Охарактеризуйте валентные возможности атомов азота кратко
Обновлено: 02.07.2024
Атомы химических элементов и их валентные возможности
Данное открытие в тандеме со знанием о электронах сместило главенствующую тогда теорию о валентности, заменив ее на теорию о химических связях.
Однако понятие о валентности не пропало из научного мира. Вклад в научное развитие этого термина внесли Э. Франкленд, Ф. А. Кекуле и А. М. Бутлеров.
Согласно проделанным открытиям, атомы химических элементов состоят из:
- атомного ядра, включающего протоны p и нейтроны n;
- электронов e, находящихся на электронных уровнях.
Свойства атомов химических элементов определяет количество электронов на их последнем (внешнем) электронном слое. Именно они участвуют в образовании химических связей разных типов. Такие электроны называются валентными.
Валентность — количество связей образованных атомом при участии его валентных электронов.
Для определения валентных возможностей атома необходимо рассмотреть распределение электронов на его энергетических уровнях.
Только атомы образовавшие химические связи могут характеризоваться понятием валентности.
Валентность обозначают римскими цифрами от I до VIII.
Число валентных электронов или число общих электронных пар определяет валентность.
Понятие валентности сопряжено со степенью окисления и часто совпадает с его значением.
Молекула аммиака имеет формулу N H 3 . Атом азота связан химическими связями с тремя атомами водорода, эти связи одинарные, следовательно, валентность азота равна трем.
Чем определяются, какие факторы влияют
Валентность атома определяется количеством валентных электронов:
- атомы главных подгрупп содержат валентные электроны, расположенные на орбиталях s- и p-типов;
- атомы побочных подгрупп (помимо атомов лантаноидов и актиноидов), имеют валентные электроны на s-орбиталях внешнего и d-орбиталях предпоследнего слоев.
Атомы могут иметь основное и возбужденное состояние, из-за чего большинство химических элементов имеют переменную валентность.
В основном состоянии валентность зависит от неспаренных электронов последнего (иногда и предпоследнего) энергетических уровней. Обычное состояние фиксируется в Периодической таблице Менделеева.
Например, валентность углерода в основном состоянии равна II из-за двух неспаренных электронов на 2p-орбитали.
Дополнительная энергия, которую может получать атом, приводит его в возбужденное состояние. В таком случае уже соединенные электроны могут распариваться и участвовать в образовании новых связей. Валентность повышается.
Валентность углерода в возбужденном состоянии может повышаться до четырех, так как в таком состоянии у него распариваются 2s-электроны.
В формуле возбужденное состояние атома обозначается звездочкой.
Определение валентности элемента по электронно-графическим формулам
Для определения количества электронов на энергетических уровнях необходимо полагаться на номер и место химического элемента в Периодической системе Д. И. Менделеева.
Определив количество электронов, необходимо распределить их по свободным орбиталям в порядке заполнения по шкале энергии:
В одной ячейке или на одной орбитали могут располагаться либо 1 электрон, либо 2 электрона с противоположными спинами — разными направлениями вращения.
Орбитали разных уровней могу размещать в своих свободных ячейках разное количество электронов:
- s- орбиталь — 2 электрона;
- p- орбиталь — 6 электронов;
- d- орбиталь — 10 электронов;
- f- орбиталь — 14 электронов.
По количеству электронов, оставшихся неспаренными в ячейках, можно узнать валентность атомов химических элементов. Электронные формулы обычно записываются не полностью, а в кратком варианте, указывая только крайние электронные уровни каждого слоя.
Можно сформулировать следующие закономерности электронного строения атома:
- высшая валентность атома элемента соответствует номеру его группы;
- номер периода указывает на количество энергетических уровней;
- порядковый номер химического элемента — на количество его электронов.
Селен, углерод, фосфор, сера, азот, хлор и другие примеры
Рассмотрим заполнение электронных уровней на примерах.
Углерод С обладает номером 6 в Периодической системе химических элементов Д. И. Менделеева, соответственно, он обладает 6 электронами.
Они полностью заполняют уровни 1s / 2s и частично уровень 2р. В обычном состоянии углерод обладает валентностью II. Свободная орбиталь 2р подуровня позволяет орбитали 2s распариваться. Тогда валентность углерода может изменяться на IV.
Азот N обладает номером 7 в ПСХЭ Менделеева и 7 электронами.
Они полностью занимают уровни 1s / 2s и частично 2р. В обычном состоянии азот обладает валентностью III. Перейти в возбужденное состояние путем распаривания 2s-электронов атом не способен, так как относится ко второму периоду, а на втором энергетическом уровне больше нет свободных подуровней и орбиталей, способных принять распарившиеся электроны. Максимальная валентность азота равна IV (за счет образования связи, не только по обменному, но и по донорно-акцепторному механизму), валентность V — не достигается.
Особенностью азота является несоответствие его валентности номеру группы ПС. Азот не обладает валентностью равной V, однако обладает соответствующей степенью окисления +5. НЕсоответствие значений валентностей и степеней окисления атомов азота в некоторых его соединениях является еще одной особенностью этого элемента.
Кислород О обладает номером 8 в ПСХЭ Менделеева и 8 электронами. Возбужденного состояния у кислорода так же нет.
Электроны полностью занимают уровни 1s / 2s и частично 2р. Валентность кислорода равна II — постоянная валентность.
Фтор F обладает номером 9 в ПСХЭ Менделеева и 9 электронами. Они полностью занимают уровни 1s / 2s и частично 2р. Фтор обладает только валентностью I, которая не меняется.
Алюминий Al обладает номером 13 в ПСХЭ Менделеева и 13 электронами. Они полностью занимают уровни 1s / 2s, 2p / 3s и частично уровень 3р. Несмотря на электронную конфигурацию основного (стационарного) состояния атома, валентность I практически не встречается. У алюминия постоянная валентность III (из этого следует что энергия перехода в возбужденное состояние для этого элемента не высока и атомы алюминия всегда пребывают именно в возбужденном состояние).
Фосфор P обладает номером 15 в ПСХЭ Менделеева и 15 электронами.
Они полностью заполняют уровни 1s / 2s, 2p / 3s и частично уровень 3р. В обычном состоянии фосфор обладает валентностью III. Распаривание 3s электронов создает возбужденное состояние, в котором пять валентных электронов занимают 5 ячеек, и валентность в таком случае поднимается до V.
Сера S занимает 16 место в ПСХЭ Менделеева и обладает 16 электронами.
Они полностью занимают 1s / 2s, 2p / 3s и частично 3р. В обычном состоянии сера обладает валентностью II. Распаренные электроны могут занимать ячейки подуровня 3d, валентность поднимается до IV и VI.
Хлор Cl обладает номером 17 в ПСХЭ Менделеева и 17 электронами.
Они полностью занимают уровни 1s / 2s, 2p / 3s и частично 3р. В обычном состоянии валентность хлора равна I. В возбужденном состоянии хлор может повышать свою валентность до III, V или VII. Формально данный ХЭ может обладать валентностью IV и VI.
Селен Se обладает номер 34 в ПСХЭ Менделеева, соответственно, он обладает 34 электронами.
Они полностью заполняют уровни 1s / 2s, 2p / 3s, 3p / 4s, 3d, отдав 30 электронов. Еще 4 заполняют орбиталь 4р — (1 ячейка занята полностью, еще 2 содержат по одному электрону). Валентность селена в обычном состоянии равна II.
Однако селен относится к элементам с переменной валентностью, поэтому также может обладать значением валентности IV и VI.
Элементы, имеющие несколько значений валентности
Значение валентности зависит от состояния атома — обычного или возбужденного.
Не все атомы химических элементов могут переходить в возбужденное состояние. По этому признаку они делятся на химические элементы с переменной и постоянной валентностью.
Постоянная валентность наблюдается у щелочных, щелочноземельных металлов, водорода, кислорода, фтора и алюминия.
Все остальные химические элементы обладают переменной валентностью, обусловленными существованием как возбужденных, так и обычных (стационарных) состояний.
Что такое степень окисления
Степень окисления — условная величина электрического заряда атома, входящего в состав химического соединения. Расчет значений этой величины основывается на предположении, что при образовании химической связи происходит полная передача электрона от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью. В результате таких представлений каждому атому можно приписать целочисленный электрический заряд. В неорганической химии степень окисления очень часто совпадает с валентностью.
Степень окисления зачастую не совпадает с реальным значением электрического заряда атома, (совпадение наблюдается только в случае ионных соединений). Она используется лишь для систематизации и классификации химических элементов. Степень окисления широко используется при составлении формул, международных названий элементов, объяснения их окислительно-восстановительных свойств.
Степень окисления указывается как заряд рядом с символом химического элемента, как правый верхний индекс. Сначала указывается знак заряда, затем число (в обозначение реального электрического заряда ионов наоборот). Она равна количеству электронов, которые атом отдает (тогда рядом со значением ставится +), либо присоединяет (тогда ставится знак -).
СО обозначается арабскими цифрами (валентность римскими).
В чем отличие валентности и степени окисления
Валентность и степень окисления не являются равнозначными понятиями, хоть их числовое значение может совпадать.
Валентность используется для определения числа химических связей атома, причем как полярных, так и неполярных.
Степень окисления используется для выражения значения электрического заряда, сосредоточенного на атоме.
Электроотрицательность (ЭО) – свойство атомов элементов оттягивать на себя электроны от другого атома в соединении.
На ЭО влияет несколько факторов: радиус атома и расстояние между ядром и валентными электронами. Численные значения ЭО приблизительные. Часто используют шкалу определения ЭО по Полингу.
Относительная электроотрицательность атомов элементов по Полингу

Анализируя данную шкалу можно выявить ряд закономерностей, перекликающихся с периодическим законом (ПЗ).
- В периодической системе химических элементов (ПСХЭ) ЭО в периоде увеличивается слева направо и уменьшается в главной подгруппе.
- ЭО связана с окислительно-восстановительными свойствами элементов, поэтому типичные неметаллы характеризуются высокой ЭО, а металлы – низкой. Самая высокая ЭО у фтора, потому что он самый сильный окислитель.
В зависимости от значения электроотрицательности образуются вещества с различным видом химической связей: если между атомами нет разности в электроотрицательности, образуются простые вещества (состоящие из одного вида атомов), чем больше разность, тем полярность молеклы возрастает: образуются молекулы веществ с полярной связью и ионной связью.
Степень окисления химических элементов и ее вычисление
Степень окисления (СО) – условный заряд атомов химических элементов в соединении на основании того, что все связи ионные.
Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно помещается над символом элемента в верхней части.
При определении СО следует руководствоваться следующими правилами:
- Сумма СО в химическом соединении всегда равна нулю, так как молекулы электронейтральны; в сложном ионе соответствует заряду иона.
- СО всех простых веществ соответствует нулю;
- Высшая положительная СО определяется по номеру группы; низшая отрицательная равна восемь минус номер группы;
- Элементы с наибольшей ЭО имеют отрицательную СО, с наименьшей – положительную;
- Постоянную СО имеют фтор (-1), щелочные металлы (+1), щелочноземельные, а также бериллий, магний, цинк (+2), алюминий (+3). У кислорода СО равна -2, исключение пероксиды (+2). У водорода +1, исключение соединения с металлами (гидриды) -1.
Применяя эти правила можно рассчитать степени окисления элементов в сложном веществе.
К примеру, определим степени окисления элементов в фосфорной кислоте H3PO4.
Рассчитаем степени окисления у элементов в нитрате алюминия Al(NO3)3.
Валентность. Валентные возможности атомов
Валентность - это способность атома присоединять ряд других атомов для образования химической связи.
Валентность может быть определена числом химических связей, образующих атом, или числом неспаренных электронов.
Валентность обозначается римскими цифрами и указывается над химическим элементом справа вверху и не имеет знака (+ или -). Может быть постоянной или переменной.
Для определения валентности применяются определенные правила:
- У металлов главных подгрупп валентность всегда постоянная и определяется по номеру группы.
- У металлов побочных подгрупп и неметаллов валентность переменная. Высшая валентность = номеру группы, а низшая = 8 - номер группы.

Валентные возможности атомов могут определяться:
- Количеством неспаренных электронов;
- Наличием свободных орбиталей;
- Наличием неподеленных пар электронов.

Валентные возможности водорода

Валентные возможности водорода определяются одним неспаренным электроном на единственной орбитали. Водород обладает слабой способностью отдавать или принимать электроны, поэтому для него характерны в основном ковалентные химические связи. Ионные связи он может создавать с металлами, образуя гидриды. Ковалентные химические связи образуются за счет общих электронных пар. Поскольку у водорода всего один электрон, он способен образовывать только одну связь. По этой причине для него характерна валентность равная I.
Валентные возможности углерода
На внешнем энергетическом уровне у углерода 4 электрона: 2 спаренных и 2 неспаренных. Это состояние атома называется основным. По числу неспаренных электронов можно сказать, что углерод проявляет валентность равную II. Однако такая валентность проявляется только в некоторых соединениях.
В органических соединениях и некоторых органических веществах углерод проявляет валентность равную IV. Эта валентность характерна для возбужденного состояния С. Из основного в возбужденное состояние он может переходить при получении дополнительной энергии. Один электрон с s-подуровня переходит на p-подуровень, где есть свободная орбиталь.

Атом С способен присоединять и отдавать электроны с образованием ковалентных связей. Валентные возможности углерода очень широкие, он может принимать значение степени окисления от +4 до -4.
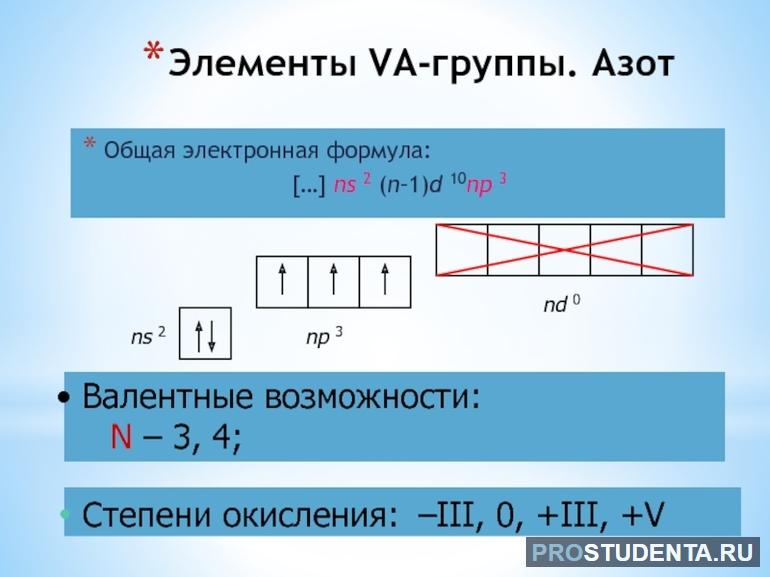
Валентные возможности азота

У азота на валентном энергетическом уровне находится 5электронов: 3 неспаренных и 2 спаренных. Исходя из этого, валентность азота может быть равна III. В возбужденное состоянии атом азота не может переходить. Однако азот может выступать в качестве донора при образовании ковалентных химических связей, обеспечивая своей электронной паре атом, имеющий свободную орбиталь. В этом случае валентность у азота будет равна IV, причем для азота, как элемента пятой группы, это максимальная валентность. Валентность V он проявлять не способен.
Валентные возможности фосфора
В отличие от азота, фосфор имеет свободные 3d-орбитали, на которые могут переходить электроны. На внешнем энергетическом уровне находятся 3 неспаренных электрона. Атом фосфора способен переходить из основного состояния в возбужденное. Электроны с p-подуровня переходят на d-подуровень. В этом случае атом Р приобретает валентность, равную V. Таким образом, строение электронной оболочки атома увеличивает валентные возможности Р, по сравнению с азотом, от I до V.

Валентные возможности кислорода

На последнем энергетическом уровне у кислорода 2 неспаренных электрона. В соединениях чаще всего проявляет валентность II. У кислорода нет d-подуровня, поэтому переход электронов невозможен. Валентные возможности очень ограничены – проявляет II и III валентности.
Валентные возможности серы
Сера, так же, как и кислород, р в VI группе главной подгруппе ПСХЭ. Поэтому на валентном энергетическом уровне у серы 2 неспаренных электрона. Напрашивается вывод, что валентность серы равна II. Однако у серы есть и d-подуровень, который расширяет ее валентные возможности. Сера способна переходить из основного состояния в возбужденное, при этом может быть либо 4 неспаренных электрона, либо 6.

Таким образом, сера способна проявлять валентности II, IV, VI.
Опираясь на этот материал, можно определить все возможные валентности для любого химического элемента.
Азот – седьмой по счету элемент Периодической таблицы. Относится к неметаллам. Расположен во втором периоде V группы A подгруппы.
Азот – типичный неметаллический элемент, по электроотрицательности (3,0) уступает лишь фтору и кислороду.
Природный азот состоит из двух устойчивых изотопов 14 N (99,635%) и 15 N (0,365%).
Молекула азота двухатомна. Между атомами азота в молекуле есть тройная связь, вследствие чего молекула N2 исключительно прочная. Молекулярный азот химически малоактивен, слабо поляризуется.
В обычных условиях молекулярный азот – газ. Температуры плавления (-210 o С) и кипения (-195,8 o С) азота очень низкие; он плоха растворяется в воде и других растворителях.
Валентность азота в соединениях
Азот — седьмой по счету элемент Периодической таблицы Д.И. Менделеева. Он находится во втором периоде во VA группе. В ядре атома азота содержится 7 протонов и 7 нейтронов (массовое число равно 14). В атоме азота есть два энергетических уровня, на которых находятся 7 электронов (рис. 1).
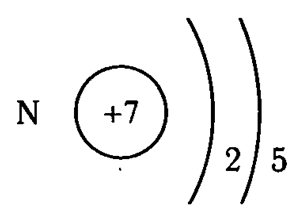
Рис. 1. Строения атома азота.
Электронная формула атома азота в основном состоянии имеет следующий вид:
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
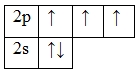
Наличие трех неспаренных электронов свидетельствует о том, что азот может проявлять валентность III в своих соединения (N III 2O3, N III H3, HN III O2).
Известно, что помимо трех ковалентных связей, образуемых по обменному типу, азот способен образовывать ещё одну (т.е. в сумме четыре) по донорно-акцепторому механизму за счет наличия неподеленной пары электронов, находящейся на 2s-подуровне. Это означает, что азот также может проявлять в своих соединениях валентность IV (N IV O2).
Так как на 2 энергетическом слое нет подуровней кроме 2s и 2p, которые уже заняты электронами, возбужденного состояния у азота нет.
Ранее считалось, что высшая валентность азота равна V – соответствует номеру группы, в которой этот элемент расположен (N V 2O5, HN V O3). Однако, квантово-механические исследования показали, что такая валентность для азота не характерна (рис. 2). Степень окисления +5 у азота есть, а валентности равной V – нет.
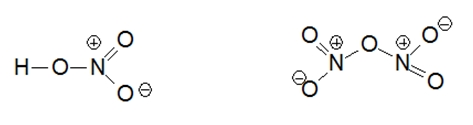
Рис. 2. Структурные формулы азотной кислоты и оксида азота (V).
Также для азота характерно проявление валентностей I (N I 2O) и II (NO).
Примеры решения задач
| Задание | Укажите, чему равны валентности элементов, входящих в состав перечисленных соединений: Mn2O7, MgO, Cl2O, CaO, Cl2O7и CrO. |
| Ответ | Определение валентностей элементов в химическом соединении стоит начинать с указания валентности известного элемента. Все перечисленные выше соединения относятся к классу оксидов. Валентность кислорода в оксидах всегда равна II. Рассмотрим на примере первого вещества. Запишем его формулу и укажем римскими цифрами валентность известного элемента: |
Находим наименьшее кратное чисел единиц валентностей. Для этого умножаем значение валентности кислорода на количество атомов данного элемента в соединении (7):
Чтобы определить валентность марганца поделим наименьшее кратное чисел единиц валентностей на количество атомов марганца в соединении (2):
Это означает, что валентность марганца равна VII:
Аналогичным образом определяем валентности элементов в других соединениях: Mg II O II , Cl I 2O II , Ca II O II , Cl VII 2O II 7и Cr II O II .
Азот (N) — химический элемент, имеет в таблице Менделеева порядковый номер 7. Расположен в V группе, главной подгруппе, во втором периоде. Относится к неметаллам. На внешнем уровне у него находятся 5 электронов, 3 из них не спарены. Именно они, а также одна неподеленная электронная пара определяют валентные возможности азота. Его максимальная степень окисления +5, а значение валентности не превышает IV.
Азот (N) — химический элемент, имеет в таблице Менделеева порядковый номер 7. Расположен в V группе, главной подгруппе, во втором периоде. Относится к неметаллам. На внешнем уровне у него находятся 5 электронов, 3 из них не спарены. Именно они, а также одна неподеленная электронная пара определяют валентные возможности азота. Его максимальная степень окисления +5, а значение валентности не превышает IV.

Электронное строение
Порядковый номер азота 7, то есть всего у него имеется 7 электронов. Второй период свидетельствует, что они находятся на двух энергетических уровнях. На внешнем расположены 5 электронов. Энергетическое строение атома азота выглядит так 1s2 2s2 2p3.
До завершения заполнения внешнего слоя азоту нужно принять недостающие 3 электрона или отдать 5 имеющихся. Таким образом, минимальная степень окисления элемента -3, а самая высокая +5. Из-за этого долгое время считалось, что N — пятивалентный элемент. Однако, более глубокое изучение показало, что низшее и высшее валентное значение для него будут I и IV.
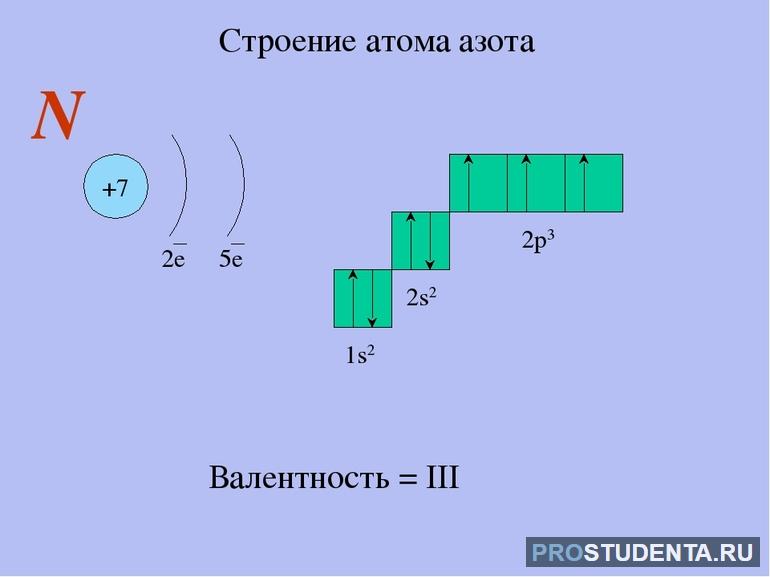
Расчет валентности
Валентность — число химических связей, которые может образовать элемент. Значение этого показателя не может превышать количество свободных орбиталей на внешнем уровне элемента. Электроны, участвующие в связывании, называются валентными.
У азота 3 неспаренных электрона на p-орбитали способны образовывать 3 ковалентные связи по обменному механизму. Такая тройная связь наблюдается, например, в простом веществе N2. Или в молекуле аммиака NH3, где азот создает по одной связи с тремя атомами водорода. То есть, благодаря незаполненной р-орбитали, азот проявляет валентность III.
Но у него на внешнем уровне есть неподеленная пара на s-орбитали. Она может создавать одну связь по донорно-акцепторному механизму. Это добавляет еще одну валентность атому. В целом элемент можно охарактеризовать как четырехвалентный. Таким образом, возможные валентные значения могут быть:
- I (N2O);
- II (NO);
- III (N2O3, N2);
- IV (HNO3, N2O5).
Степень окисления элемента и его валентные возможности не всегда совпадают. Например, в азотной кислоте (формула HNO3) содержится 3 двухвалентных кислорода. Один из трех элементов принимает по одному электрону от водорода и азота. Второй атом кислорода получает на свою р-орбиталь оставшиеся 2 неспаренных электрона с р-орбитали N. И этот же элемент связан с последним кислородом по донорно-акцепторному механизму при помощи неподеленной пары с подуровня s. Таким образом, элемент N находится в своей максимальной степени окисления +5, а его валентность равняется IV. Аналогичным образом строятся связи в оксиде азота V.
У некоторых элементов может наблюдаться возбуждение. Возбужденное состояние характеризуется перескоком электрона на свободную орбиталь. Элемент при этом нестабилен и существует недолго, но в этот краткий период валентность увеличивается. У N нет свободных орбиталей, на которые может перейти электрон, поэтому IV — это максимальное валентное значение для него.
Примеры задач
Задача: определить валентность азота в следующих соединениях: AgNO3, HNO2, N2H4.
Чтобы определить неизвестную валентность атома в молекуле, нужно знать ее значение для других составляющих атомов и рассчитать, сколько кратных единиц приходится на них. Вычислить нужно следующим образом:
- Нитрат серебра AgNO3. На внешнем уровне аргентум имеет только один неспаренный электрон, значит, может образовать только одну химическую связь. Для кислорода валентное значение всегда будет II, 3 атома должны вместе обладать валентностью VI. Один из кислородов связан с серебром. 6 — 1 = 5. Оставшиеся электроны кислород получает от N, при этом пара электронов образует одну связь. То есть у N в молекуле нитрата серебра валентность IV.
- Азотистая кислота HNO2. Валентность кислорода II, количество этого элемента в молекуле тоже два. 2*2 = 4. Водород является одновалентным. 4 — 1 = 3. Итого валентное значение N равняется III.
- Гидразин N2H4. Атом водорода имеет валентность I. 4 * 1 = 4. Атома азота в молекуле гидразина два, поэтому 4 нужно поделить пополам и получится 2. Валентность N в молекуле гидразина равна II.
Атом азота имеет 5 электронов на внешнем уровне. Два из них находятся на s-орбитали, а другие 3 расположены на р-орбитали. Благодаря трём неспаренным электронам и одной неподеленной паре, элемент имеет валентности от I до IV.
Читайте также:

