Обобществленные электроны это кратко
Обновлено: 04.07.2024
Тип урока: Изучение нового материала.
Цель урока: Сформировать представления о металлической связи.
- выяснить, как взаимодействуют между собой атомы элементов-металлов
- узнать, как влияет металлическая связь на свойства образованных ею веществ
- обобщить знания о химической связи
- Вводное слово учителя о цели и задачах урока.
- Повторение опорных знаний о ковалентной и ионной связи.
- Изучение нового материала:
- Закрепление материала.
1. Организационный этап
Приветствие учащихся. Проверка готовности к занятию. Организация внимания.
- Какие типы химической связи вы уже знаете?
- Что такое ионная связь?
- Что такое ковалентная связь?
- Какие виды ковалентной связи вы знаете? Как их можно различить?
Теперь давайте выполним следующие упражнения.
1. Между атомами каких химических элементов химическая связь будет иметь ионный характер:
2. Только ковалентная связь наблюдается в соединении с формулой:
3. Неполярная ковалентная связь наблюдается в веществе:
1) углекислом газе
4. Химическая связь наиболее прочна в молекуле:
5. В молекуле какого вещества содержится ковалентная неполярная связь:
2) поваренной соли
3. Изучение нового материала
Вы знаете, как взаимодействуют между собой атомы металлов и неметаллов, а также атомы неметаллов между собой.
Сегодня мы рассмотрим, как будут взаимодействовать атомы металлов между собой. Почему металлы существуют в виде слитка, куска или металлического изделия?
Что удерживает атомы металла в единое целое?
Какими свойствами обладают металлы и от чего они зависят – мы с вами должны ответить на этом уроке.
- Сформировать понятие о металлической связи.
- Изучить механизм образования связи.
- Показать единую природу химической связи.
- Какое место в Периодической системе занимают металлы?
В таблице Дмитрия Ивановича Менделеева более 90 химических элементов представлены металлами. Почти все эти вещества (за исключением ртути) – твердые вещества с кристаллической решеткой.
Ученые давно установили, что именно в таких соединениях связь намного прочнее.
Она получила название металлической химической связи.
Металлическая связь – это связь в металлах и сплавах между атом-ионами посредством обобществленных электронов.
Что же такое обобществленные электроны? И почему атомы в металлах были названы атом-ионами?
Чаще всего атомы элементов металлов содержат на внешнем энергетическом уровне от одного 1 до трех 3 электронов. И эти электроны легко отрываются и попадают на энергетические уровни таких же атомов металлов. Таким образом, все электроны на внешних уровнях атомов металлов обобществленные, то есть принадлежат всем атомам вещества. Электроны выполняют роль цемента, удерживая катионы (положительно заряженные ядра с электронами внутренних энергетических уровней) в узлах кристаллической решетки. В свою очередь, катионы удерживают электроны в пределах кристаллической решетки.
Разобраться в том, какой электрон принадлежал какому атому, просто невозможно, так как все оторвавшиеся электроны становятся общими, соединяясь с ионами. Эти электроны временно образуют атомы, потом снова отрываются и соединяются с другим ионом. Этот процесс продолжается бесконечно. Таким образом, в металлических соединениях атомы непрерывно превращаются в ионы и наоборот.
Этот процесс схематично можно изобразить так: постоянно отдавая и одновременно получая электроны, атом металла не является атомом и в тоже время не ион. Поэтому атомы в металлах и называются атом-ионами. Например, схематическое строение фрагмента металла алюминия. Каждый атом алюминия окружен восемью соседними атомами. Всего вокруг ядра атома алюминия располагается тринадцать электронов, но на внешнем энергетическом уровне только три. Они и будут участвовать в образовании металлической связи. Свободно отрываясь и двигаясь по внешних орбиталях всех соседних атомов, они склеивают ионный остов алюминия в твердый металлический кристалл. Металлическая связь, как и ковалентная, основана на объединении электронов соседних атомов. Но если при ковалентной связи один атом связан общими электронами только с соседним, то при металлической связи общие электроны есть со всеми соседними атомами.
Вещества с металлической связью часто сочетают прочность с пластичностью, так как при смещении атомов относительно друг друга не происходит разрыва связей. Металлы отражают световые волны, поэтому имеют металлический блеск и непрозрачны. Свободно движущиеся электроны обуславливают электропроводность и теплопроводность металлов и сплавов.
В парообразном состоянии атомы металлов связаны ковалентной связью. Металлическая связь характерна для чистых металлов и сплавов металлов в твердом и жидком состояниях.
На рисунке схематически изображено строение фрагмента металла натрия. При этом небольшое число обобществленных электронов связывает большое число ионов и атомов.
Схема металлической связи
Металлическая связь имеет некоторое сходство с ковалентной, поскольку основана на обобществлении внешних электронов. Однако при ковалентной связи обобществлены внешние непарные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической, как правило, пластичны, электропроводны и имеют металлический блеск.
Металлическая связь характерна как для чистых металлов, так и для смесей различных металлов –сплавов, находящихся в твердом и жидком состояниях.
Вывод: Все виды связей основаны на особенностях строения атомов химических элементов, и их изучение является одним из центральных вопросов в химии.
4. Закрепление материала:
Теперь давайте выполним следующие упражнения.
1. Из приведённых ниже формул веществ выпишите формулы веществ с металлической связью:
2. Из приведённых ниже формул веществ выпишите формулы металлов:
3. Верны ли следующие суждения?
А). Химический элемент кальций образует вещества, в которых наблюдаются все типы химических связей.
Б). Вещество кальций Са и нитрид кальция Ca3N2 образованы соответственно с помощью металлической и ковалентной неполярной связей.
Это поэтическое название того факта, что электронные орбитали (сиречь область, где существует вероятность нахождения электрона) двух или нескольких атомов перекрываются, и, следовательно, один и тот же электрон оказывается на орбиталях нескольких атомов. то есть "принадлежит" им всем :-))
Когда два атома сталкиваются и вступают в реакцию, они или соединяются вместе, обобществляя свои электроны, или же вновь расходятся после перераспределения электронов. Именно это обобществление или перераспределение электронов и вызывает изме-нение свойств веществ, наблюдаемое при проведении химических реакций.
Кропотливое и тщательное изучение рентгеновских лучей показало, что и обобществление, и перераспределение электронов подчиняется какому-то определенному порядку, и в результате была выдвинута следующая гипотеза. Окружающие ядро атома электроны подразделяются на определенные группы и образуют так называемые электронные оболочки. Ближайшая к ядру атома оболочка получила название К-оболочка, а последующие оболочки были названы соответственно L-оболочка, М-оболочка, N-оболочка и т. д. Согласно этой гипотезе, на ближайшей к ядру оболочке могут располагаться только два электрона, на следующей L-обо- лочке — восемь, на М-оболочке — восемнадцать и т. д., т. е. чем дальше оболочка удалена от ядра, тем больше электронов на ней может располагаться. Например, три электрона атома лития, одиннадцать электронов атома натрия и девятнадцать электронов атома калия распределяются по электронным оболочкам в следующем порядке: Li 2, 1; Na 2, 8, 1; К 2, 8, 8, 1.
У каждого атома щелочных металлов электроны распределяются таким образом, что внешнюю оболочку занимает только один электрон. Поскольку при столкновении атомов в контакт вступают именно внешние электронные оболочки, то следует ожидать, что число электронов на внешней оболочке и определяет химическую активность элемента. Элементы с аналогичными внешними электронными оболочками имеют сходные свойства, как, например, вышеупомянутые щелочные металлы.
Рассуждая таким образом, можно сказать, что щелочнозе-мельные элементы (магний, кальций, стронций и барий) похожи друг на друга также по этой причине: у каждого из них на внешней оболочке по два электрона. На внешних оболочках атомов галогенов (фтора, хлора, брома и иода) по семь электронов, а на внешних оболочках инертных газов (неона, аргона, криптона и ксенона) — по восемь.
Составляя периодическую таблицу, Менделеев, разумеется, сам того не зная, расположил элементы в соответствии со строением электронных оболочек их атомов.
В более тяжелых атомах, в которых число электронов все растет и растет, увеличивается число электронов на внутренних оболочках, но на внешней оболочке число электронов остается постоянным. Так, например, порядковые номера редкоземельных элементов лежат в пределах от 57 до 71 включительно. И хотя по мере продвижения по периодической таблице мы наблюдаем увеличение числа электронов на внешней оболочке, все редкоземельные элементы имеют по три электрона на внешней оболочке. Это тождество внешних оболочек объясняет, почему элементы этой группы так неожи-данно оказались похожи друг на друга по свойствам.
Когда Менделеев составлял периодическую таблицу, он исходил из валентности элементов, поскольку о распределении в них электронов в то время ему еще ничего не было известно. Теперь вполне разумно было предположить, что валентность элемента определяется его электронной структурой.
Немецкий химик Рихард Абегг (1869—1910) в 1904 г. указал, что электронная структура инертных газов должна быть особенно устойчивой. Атомы инертных газов не проявляют тенденции к уменьшению или увеличению числа электронов на внешних электронных оболочках и поэтому не участвуют в химических реакциях.
В твердом теле расстояния между атомами настолько малы, что каждый из них оказывается в потенциальном поле остальных атомов, которое нельзя игнорировать.
Вначале проведем качественное рассмотрение последствий объединения атомов в кристалл. Для этого сравним состояние изолированного атома, когда расстояние до другого атома r>>а – порядка кристаллической решетки (рис. 4.1, а). Для простоты возьмем атом натрия, имеющий энергетические уровни 1s, 2s, 2p, 3s. Уровни 1s, 2s, 2p заполнены, уровень 3s содержит один электрон, более высокие уровни пусты. Атомы отделены друг от друга потенциальными барьерами, и переход электрона между 3s уровнями отдельных атомов уже на расстоянии более
2 нм практически невозможен.
В верхней части рисунка показана картина распределения плотности вероятности ρ=4πτ 2 ψψ * обнаружения электрона на расстоянии r от ядра.
Теперь подвергнем атомы медленному сближению так, чтобы образовался кристалл. По мере сближения атомов взаимодействие между ними растет. На рис. 4.1, б приведены два втома натрия.
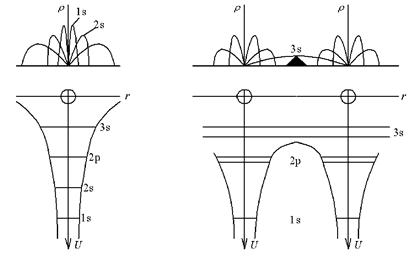
Рис. 4.1. Атомы натрия: а – удаленный атом, τ>>a; б – два атома, τ>>a
Сближение атомов вызывает уменьшение высоты и толщины потенциальных барьеров, разделяющих атомы. Так, для электронов 3s высота уровня оказывается выше потенциального барьера, и уровень оказывается общим для всех атомов. Это подтверждается и перекрытием функции ρ для 3s уровня. Иными словами происходит обобществление валентных 3s электронов.
В кристалле на этом уровне должно разместиться N одинаковых электронов. Однако, согласно принципу Паули, это запрещено, и 3s уровень расщепляется на N подуровней. В итоге формируется энергетическая зона, где могут находиться свободные электроны, называемые электронным газом.
Вследствие уменьшения толщины потенциального барьера при сближении атомов некоторую свободу перемещения по кристаллу получают и более близкие к ядру электроны. Некоторые из них могут туннелировать сквозь барьеры, и вероятность перемещения зависит от толщины барьера. Эта вероятность уменьшается для более глубоких уровней. Так, в рассматриваемом кристалле время нахождения на уровне 3s составляет для электрона 10 -15 с, а время нахождения на самом глубоком уровне 1s – 10 4 с.
Вернемся к 3s зоне и рассмотрим ее структуру. Мы уже говорили, что зона состоит из N подуровней. Такое состояние называют N – кратно вырожденным, а расщепление уровня на подуровни – снятием вырождения. Так выглядит ситуация, если мы имеем дело с S уровнем (l=0). В общем случае кратность вырождения определяется знакомым нам соотношением n=2l+1 (п. 2.7). Число электронов, которое может размещаться в зоне, определяется выражением (2l+1)n.
Расстояние между подуровнями очень мало. Если ширину зоны Е принять за несколько электрон-вольт, то расстояние между уровнями будет не более 10 -22 эВ. Поэтому обычно не учитывают тонкую структуру зоны, считая зону непрерывной.
В твердом теле расстояния между атомами настолько малы, что каждый из них оказывается в потенциальном поле остальных атомов, которое нельзя игнорировать.
Вначале проведем качественное рассмотрение последствий объединения атомов в кристалл. Для этого сравним состояние изолированного атома, когда расстояние до другого атома r>>а – порядка кристаллической решетки (рис. 4.1, а). Для простоты возьмем атом натрия, имеющий энергетические уровни 1s, 2s, 2p, 3s. Уровни 1s, 2s, 2p заполнены, уровень 3s содержит один электрон, более высокие уровни пусты. Атомы отделены друг от друга потенциальными барьерами, и переход электрона между 3s уровнями отдельных атомов уже на расстоянии более
2 нм практически невозможен.
В верхней части рисунка показана картина распределения плотности вероятности ρ=4πτ 2 ψψ * обнаружения электрона на расстоянии r от ядра.
Теперь подвергнем атомы медленному сближению так, чтобы образовался кристалл. По мере сближения атомов взаимодействие между ними растет. На рис. 4.1, б приведены два втома натрия.

Рис. 4.1. Атомы натрия: а – удаленный атом, τ>>a; б – два атома, τ>>a
Сближение атомов вызывает уменьшение высоты и толщины потенциальных барьеров, разделяющих атомы. Так, для электронов 3s высота уровня оказывается выше потенциального барьера, и уровень оказывается общим для всех атомов. Это подтверждается и перекрытием функции ρ для 3s уровня. Иными словами происходит обобществление валентных 3s электронов.

В кристалле на этом уровне должно разместиться N одинаковых электронов. Однако, согласно принципу Паули, это запрещено, и 3s уровень расщепляется на N подуровней. В итоге формируется энергетическая зона, где могут находиться свободные электроны, называемые электронным газом.
Вследствие уменьшения толщины потенциального барьера при сближении атомов некоторую свободу перемещения по кристаллу получают и более близкие к ядру электроны. Некоторые из них могут туннелировать сквозь барьеры, и вероятность перемещения зависит от толщины барьера. Эта вероятность уменьшается для более глубоких уровней. Так, в рассматриваемом кристалле время нахождения на уровне 3s составляет для электрона 10 -15 с, а время нахождения на самом глубоком уровне 1s – 10 4 с.
Вернемся к 3s зоне и рассмотрим ее структуру. Мы уже говорили, что зона состоит из N подуровней. Такое состояние называют N – кратно вырожденным, а расщепление уровня на подуровни – снятием вырождения. Так выглядит ситуация, если мы имеем дело с S уровнем (l=0). В общем случае кратность вырождения определяется знакомым нам соотношением n=2l+1 (п. 2.7). Число электронов, которое может размещаться в зоне, определяется выражением (2l+1)n.
Расстояние между подуровнями очень мало. Если ширину зоны Е принять за несколько электрон-вольт, то расстояние между уровнями будет не более 10 -22 эВ. Поэтому обычно не учитывают тонкую структуру зоны, считая зону непрерывной.
Правило октета — Связи в диоксиде углерода (CO2) все атомы окружены 8 электронами согласно правилу октета. Следовательно, CO2 является устойчивой молекулой. Правило октета (октетная теория) предложено Г. Н. Льюисом для объяснения причин… … Википедия
Октетная теория — Связи в диоксиде углерода (CO2) все атомы окружены 8 электронами согласно правилу октета. Следовательно, CO2 является устойчивой молекулой. Правило октета (октетная теория) предложено Г.Н. Льюисом для объяснения причин образования ковалентных… … Википедия
Правило октетов — Связи в диоксиде углерода (CO2) все атомы окружены 8 электронами согласно правилу октета. Следовательно, CO2 является устойчивой молекулой. Правило октета (октетная теория) предложено Г.Н. Льюисом для объяснения причин образования ковалентных… … Википедия
ХРОМА СЕМЕЙСТВО — ПОДГРУППА VIB. СЕМЕЙСТВО ХРОМА ХРОМ, МОЛИБДЕН, ВОЛЬФРАМ Все три элемента VIB подгруппы хром Cr, молибден Mo, вольфрам W играют большую роль в промышленности, особенно в металлургии и электротехнике. Каждый из этих элементов занимает среднее… … Энциклопедия Кольера
МОЛЕКУЛ СТРОЕНИЕ — (молекулярная структура), взаимное расположение атомов в молекулах. В ходе химических реакций происходит перегруппировка атомов в молекулах реагентов и образуются новые соединения. Поэтому одна из фундаментальных химических проблем состоит в… … Энциклопедия Кольера
зонная теория — квантовая теория, объясняющая поведение электронов в твердых телах. Основной результат зонной теории: разрешённые значения энергии электронов в твердом теле образуют определенные интервалы разрешённые зоны, которые могут быть отделены друг от… … Энциклопедический словарь
МИКРОЧАСТИЦЫ — (от греч. μικρός – малый) – частицы очень малой массы (в частности, нулевой), для движения и взаимодействия к рых существенна дискретность (атомизм) действия. К М. относятся элементарные частицы, атомные ядра, атомы, молекулы, квазичастицы.… … Философская энциклопедия
Ковалентная связь — Рис.1. Модель одинарной ковалентной связи (электронная плотность выделена красным цветом) Ковалентная связь (атомная связь, гомеополярная связь) химическая связь, образованная перекрытием (обобществлением) пары … Википедия
Ковалентная химическая связь — Ковалентная связь на примере молекулы метана: законченный внешний энергетический уровень у водорода (H) 2 электрона, а у углерода (C) 8 электронов. Ковалентная связь связь, образованная направленными валентными электронными облаками. Нейтральные… … Википедия
Ковалентные связи — Ковалентная связь на примере молекулы метана: законченный внешний энергетический уровень у водорода (H) 2 электрона, а у углерода (C) 8 электронов. Ковалентная связь связь, образованная направленными валентными электронными облаками. Нейтральные… … Википедия
Читайте также:

