Нахождение в природе кислорода и озона кратко
Обновлено: 08.07.2024
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 2s 2p
Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Кислород О2 — газ без цвета, вкуса и запаха, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород – голубоватая жидкость, кипящая при -183 о С.
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
- Разложение некоторых кислородосодержащих веществ:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода в присутствии оксида марганца (IV):
2HgO → 2Hg + O2
Соединения кислорода
Основные степени окисления кислород +2, +1, 0, -1 и -2.
Оксиды металлов и неметаллов Na2O, SO2 и др.
Соли кислородсодержащих кислот
Кислородсодержащие органические вещества
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) и свойства восстановителя (только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами , и с неметаллами . Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо , в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:

Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды . При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения ( сероводород, аммиак, метан, силан гидриды . При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора ( сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления ( оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например , кислород окисляет гидроксид железа (II):
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)

Исторически так сложилось, что химический элемент и одно из простых веществ, образованных атомами этого элемента, имеют общее название — кислород. Поскольку между этими понятиями существует принципиальная разница, следует четко различать, о чем идет речь — о кислороде как о химическом элементе или о простом веществе.
Кислород как химический элемент
Самым первым химическим элементом, к изучению которого мы приступаем, является кислород. Как вы уже знаете, химический знак кислорода — О. Относительная атомная масса кислорода равна 16:
Позднее вы узнаете, какое строение имеет атом кислорода и чем он отличается от атомов других химических элементов.
Кислород как простое вещество
Простое вещество кислород существует в виде молекул. Молекула кислорода состоит из двух атомов химического элемента кислорода (рис. 73), поэтому химическая формула кислорода как простого вещества — O2.
Поскольку относительная атомная масса кислорода равна 16, то относительная молекулярная масса простого вещества кислорода равна:
![]()
Следовательно, молярная масса кислорода равна:
![]()
Как у всех газов, молярный объем кислорода при нормальных условиях равен:
![]()
История открытия кислорода
Кроме кислорода, существует еще одно простое вещество, молекулы которого состоят только из атомов кислорода. Это озон, молекула которого содержит три атома кислорода (рис. 74), его формула — О3.
При нормальных условиях озон представляет собой газ с резким раздражающим запахом. Он очень токсичен для всех живых организмов и поэтому используется вместо хлора для обеззараживания воды.
Небольшие количества озона образуются в воздухе во время грозы, а также в результате взаимодействия смолы хвойных деревьев с кислородом. Озон оказывает губительное действие на бактерии, поэтому лесной воздух (особенно в хвойных лесах) обладает целебным действием.
В небольших количествах озон образуется также при работе копировальных аппаратов и лазерных принтеров. Использовать такие приборы следует только в хорошо проветриваемых помещениях.
В верхних слоях атмосферы Земли (на высоте примерно 30—40 км) существует озоновый слой. Содержащийся в нем озон образуется из кислорода под воздействием солнечного излучения. Некоторые компоненты этого излучения губительны для живых организмов и растений на нашей планете, а озоновый слой поглощает их. Если бы не было озонового слоя, то жизнь на Земле постепенно бы прекратилась.
Многие ученые считают, что вещества, образующиеся в процессе производственной деятельности человека, разрушают озоновый слой. Это прежде всего фреоны — соединения, использующиеся в холодильных установках и дезодорантах, выбросы реактивных самолетов и ракет. Попадая в озоновый слой, эти вещества приводят к уменьшению его толщины или даже разрыву этого слоя — образованию так называемых озоновых дыр. В результате образования и увеличения размеров озоновых дыр могут наступить серьезные экологические катастрофы.
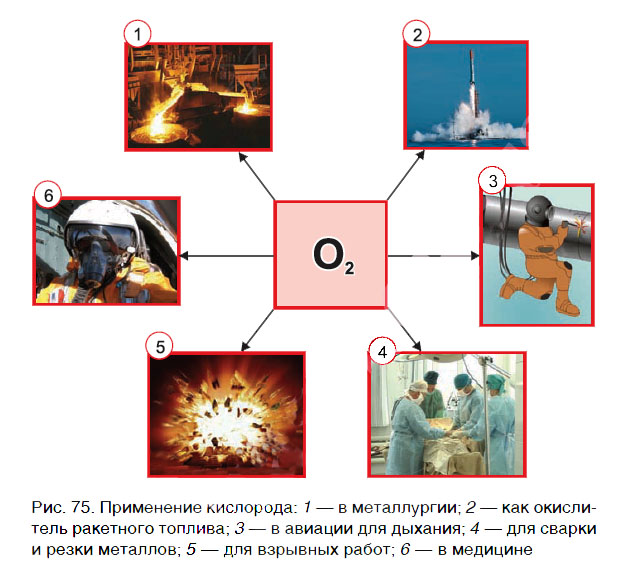
Применение кислорода
Кислород очень широко применяется в народном хозяйстве. На рисунке 75 приведены основные области применения кислорода. Главными потребителями кислорода являются металлургическая промышленность (выплавка стали), космическая техника (окислитель ракетного топлива), процессы обработки металлов (сварка и резка металлов).
Краткие выводы урока:
- Химический элемент кислород образует два простых вещества — кислород О2 и озон О3.
- Когда говорят о кислороде как о химическом элементе, подразумевают атомы кислорода О.
- Когда говорят о кислороде как о простом веществе, подразумевают вещество, состоящее из молекул и имеющее формулу О2.
Наш урок посвящен химическому элементу, который занимает особое место в жизни человека и всего живого. Речь пойдет о кислороде. Вы познакомитесь с общей характеристикой химического элемента – кислорода по его положению в ПСХЭ, рассмотрим нахождение кислорода в природе, изучим способы получения кислорода и его физические свойства.
Также данный урок посвящен изучению истории открытия одного из самых известных неорганических веществ – кислорода. Из материалов урока вы узнаете, кому принадлежит приоритет открытия кислорода и кто дал название этом веществу.
“Кислород — это вещество, вокруг которого вращается земная химия”.
I. Познавательный фильм: “Кислород”
II. Общая характеристика кислорода как химического элемента по положению его в ПСХЭ

Кислород — элемент главной подгруппы шестой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным порядковым номером 8.
Обозначается символом O (лат. Oxygenium).
Относительная атомная масса химического элемента кислорода равна 16, т.е. Ar(O)=16.
Относительная молекулярная масса равна 32, т.е. Мr(O2)=32.
III. Валентность кислорода, физические свойства
Температура кипения сжиженного кислорода -183 С, температура плавления твердого кислорода -219 С. Интересно, что кислород притягивается магнитом.
Кислород поддерживает дыхание и горение. Причем, если внести в сосуд с кислородом тлеющую лучинку, то она вспыхнет ярким пламенем.
Это интересно: “Какого цвета твердый кислород”
При температуре 90 K газ кислород превращается в бледно-голубую жидкость, а при температуре 54 K становится твёрдым. Но твёрдый кислород твёрдому кислороду рознь: в интервале давлений от 0 до приблизительно 130 гигапаскалей (1,3 млн атмосфер) кислород может существовать по крайней мере в шести модификациях (их обозначают греческими буквами γ, β, α, δ, ε и ζ). Эти модификации отличаются друг от друга кристаллической решёткой, магнитными и электрическими свойствами, а также цветом. Например, при давлении 5,4 гПа (это примерно в 52 тысячи раз выше атмосферного) твёрдый кислород имеет бледно-голубой цвет. При дальнейшем повышении давления (до 10 гПа) твёрдый кислород становится красным. Некоторые модификации твёрдого кислорода даже называют по их характерному цвету. Например, δ-O2 называют оранжевым кислородом, а ε-O2 — красным кислородом.
IV. Кислород в природе

Кислород — самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 49% массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,5% (по массе), в атмосфере содержание свободного кислорода составляет 21% по объёму и 23% по массе. Более 1500 соединений земной коры в своем составе содержат кислород.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 20 %, по массовой доле — около 65 %.
V. Открытие и получение кислорода
Открытие кислорода приходится на XVIII век. До этого времени считалось, что любой газ – это разновидность воздуха. Началом изучения газов послужило, казалось бы, незначительное изобретение. Английский ученый Гейлс предложил прибор для сбора газов. Заполненную водой колбу он опустил горлом вниз в сосуд с водой, в горло колбы поместил изогнутый ружейный ствол, по которому в колбу, вытесняя воду, поступали газы. Вот с этого прибора все и началось…
Приоритет открытия кислорода принадлежит англичанину Джозефу Пристли.В 1774 г. он обнаружил, что при разложении оксида ртути образуется газообразное вещество, в атмосфере которого тлеющая лучина вспыхивает ярким пламенем, а дышать этим газом особенно легко. Это был кислород. Уравнение реакции разложения оксида ртути:
Интересно, что еще до работ Дж. Пристли в 1771 г. опыты по разложению оксида ртути проделал шведский химик Карл Шееле. Но результаты его исследований были опубликованы только в 1775 г., поэтому Пристли о них ничего не знал.
Есть еще один интересный исторический факт. Оказывается голландский химик Корнелиус Дреббел примерно за 150 лет до Пристли и Шееле получил кислород при нагревании нитрата калия:
2KNO3 = 2KNO2 + O2
Он описал свойства полученного газообразного вещества: тлеющий уголек в нем вспыхивал, в атмосфере этого газа легко дышалось. Свое открытие ученый даже использовал на изобретенном им подводном судне. Однако в то время ученые не интересовались газами, и открытие Дреббела даже не заметили.
VI. Получение кислорода
Промышленный способ получения кислорода
В промышленных целях кислород необходимо получать в больших объёмах и максимально дешёвым способом. Такой способ получения кислорода был предложен лауреатом Нобелевской премии Петром Леонидовичем Капицей. Он изобрёл установку для сжижения воздуха. Как известно, в воздухе находится около 21% по объему кислорода. Кислород можно выделить из жидкого воздуха методом перегонки, т.к. все вещества, входящие в состав воздуха имеют разные температуры кипения. Температура кипения кислорода - -183°С, а азота - -196°С. Значит, при перегонке сжиженного воздуха первым закипит и испарится азот, а затем – кислород.
Лабораторные способы получения кислорода
В лаборатории кислород требуется не в таких больших количествах, как в промышленности. Обычно его привозят в голубых стальных баллонах, в которых он находится под давлением. В некоторых случаях всё же требуется получить кислород химическим путём. Для этого используют реакции разложения.
1. Разложение пероксида водорода
При комнатной температуре пероксид водорода разлагается медленно (признаков протекания реакции мы не видим), но этот процесс можно ускорить, если добавить в раствор несколько крупинок оксида марганца(IV). Вокруг крупинок черного оксида сразу начинают выделяться пузырьки газа. Это кислород. Как бы долго ни протекала реакция, крупинки оксида марганца(IV) в растворе не растворяются. То есть, оксид марганца(IV) участвует в реакции, ее ускоряет, но сам в ней не расходуется.
Вещества, которые ускоряют реакцию, но не расходуются в реакции, называют катализаторами.
Реакции, ускоряемые катализаторами, называют каталитическими.
Ускорение реакции катализатором называют катализом.
Таким образом, оксид марганца (IV) в реакции разложения пероксида водорода служит катализатором. В уравнении реакции формула катализатора записывается сверху над знаком равенства. Запишем уравнение проведенной реакции. При разложении пероксида водорода выделяется кислород и образуется вода. Выделение кислорода из раствора показывают стрелкой, направленной вверх:
2. Разложение перманганата калия
При нагревании перманганат калия разлагается с образованием кислорода.
В пробирку насыпают кристаллический перманганат калия. При нагревании перманганат калия разлагается, выделяющийся кислород поступает по газоотводной трубке в колбу-приемник. Кислород тяжелее воздуха, поэтому не покидает колбу и постепенно заполняет ее. Если опустить тлеющую лучину в колбу с собранным кислородом, то она ярко вспыхнет.
Уравнение проведенной реакции:
2 KMnO4 = K2MnO4 + MnO2 + O2 ↑
3. Разложение бертолетовой соли
Для получения кислорода к бертолетовой соли всегда примешивают оксид марганца МпО2 или другое вещество, каталитически ускоряющее процесс разложения. Если нагревать более или менее значительные количества чистой соли, то на поверхности расплава может образоваться корка тугоплавкого хлорида калия, под которой скопляется кислород, в результате чего происходит взрыв. В присутствии оксида марганца MnO2 бертолетова соль начинает разлагаться раньше, чем она расплавится (около 200 ºС).
2KClO3 t˚C , MnO2=2KCl + 3O2↑
Это интересно

Бертолетова соль KClO3 (хлорноватокислый калий, хлорат калия) — одна из самых известных солей. Это сильный окислитель; при подогревании, толчках, растирании бертолетовой соли со многими соединениями происходит воспламенение или взрыв. Именно поэтому бертолетову соль используют при производстве спичек, взрывчатых веществ, в пиротехнике и т. п. Обращаться с этой солью нужно осторожно: она не только взрывоопасна, но и ядовита. Она может связываться с гемоглобином крови и таким образом лишать его способности переносить кислород.
Кислород мало растворим в воде и тяжелее воздуха, поэтому его можно получать двумя способами:

Кислород О имеет атомный номер 8, расположен в главной подгруппе (подгруппе а) VI группе, во втором периоде. В атомах кислорода валентные электроны размещаются на 2-м энергетическом уровне, имеющем только s — и p -орбитали. Это исключает возможность перехода атомов О в возбуждённое состояние, поэтому кислород во всех соединениях проявляет постоянную валентность, равную II. Имея высокую электроотрицательность, атомы кислорода всегда в соединениях заряжены отрицательно (с.о. = -2 или -1). Исключение – фториды OF 2 и O 2 F 2 .
Для кислорода известны степени окисления -2, -1, +1, +2
Общая характеристика элемента
Кислород – самый распространенный элемент на Земле, на его долю приходится чуть меньше половины, 49 % от общей массы земной коры. Природный кислород состоит из 3 стабильных изотопов 16 О, 17 О и 18 О (преобладает 16 О). Кислород входит в состав атмосферы (20,9 % по объему, 23,2 по массе), в состав воды и более 1400 минералов: кремнезема, силикатов и алюмосиликатов, мраморов, базальтов, гематита и других минералов и горных пород. Кислород составляет 50-85% массы тканей растений и животных, т.к содержится в белках, жирах и углеводах, из которых состоят живые организмы. Общеизвестна роль кислорода для дыхания, для процессов окисления.
Кислород сравнительно мало растворим в воде – 5 объемов в 100 объемах воды. Однако, если бы весь растворенный в воде кислород перешел в атмосферу, то он занял бы огромный объем – 10 млн км 3 ( н.у). Это равно примерно 1% всего кислорода в атмосфере. Образование на земле кислородной атмосферы обусловлено процессами фотосинтеза.

Строение молекулы озона
3О 2 = 2О 3 – 285 кДж
Озон в стратосфере образует тонкий слой, который поглощает большую часть биологически вредного ультрафиолетового излучения.
При хранении озон самопроизвольно превращается в кислород. Химически кислород О 2 менее активен, чем озон. Электроотрицательность кислорода 3,5.
Физические свойства кислорода
O 2 – газ без цвета, запаха и вкуса, т.пл. –218,7 °С, т.кип. –182,96 °С, парамагнитен.
Жидкий O 2 голубого, твердый – синего цвета. O 2 растворим в воде (лучше, чем азот и водород).
Получение кислорода
1. Промышленный способ — перегонка жидкого воздуха и электролиз воды:

2Н 2 О → 2Н 2 + О 2
2. В лаборатории кислород получают:
1.Электролизом щелочных водных растворов или водных растворов кислородосодержащих солей (Na 2 SO 4 и др.)
2. Термическим разложением перманганата калия KMnO 4 :
2KMnO 4 = K 2 MnO4 + MnO 2 + O 2 ↑,
Бертолетовой соли KClO 3 :
2KClO 3 = 2KCl + 3O 2 ↑ (катализатор MnO 2 )
Пероксид бария BaO 2 :
2BaO 2 = 2BaO + O 2 ↑
3. Разложением пероксида водорода:
2H 2 O 2 = H 2 O + O 2 ↑ (катализатор MnO 2 )
4. Разложение нитратов:
2KNO 3 → 2KNO 2 + O 2
На космических кораблях и подводных лодках кислород получают из смеси K 2 O 2 и K 2 O 4 :
2K 2 O 4 + 2H 2 O = 4KOH +3O 2 ↑
4KOH + 2CO 2 = 2K 2 CO 3 + 2H 2 O
Когда используют K 2 O 2 , то суммарная реакция выглядит так:
2K 2 O 2 + 2CO 2 = 2K 2 CO 3 + O 2 ↑
Если смешать K 2 O 2 и K 2 O 4 в равномолярных (т.е. эквимолярных) количествах, то на 1 моль поглощенного СО 2 выделится один моль О 2.
Химические свойства кислорода
Валентная оболочка кислорода расположена на 2-м уровне – относительно близко к ядру. Поэтому ядро сильно притягивает к себе электроны. На валентной оболочке кислорода 2s 2 2p 4 находится 6 электронов. Следовательно, до октета недостает двух электронов, которые кислород стремится принять с электронных оболочек других элементов, вступая с ними в реакции в качестве окислителя.
Итак, кислород – второй по силе окислитель среди всех элементов Периодической системы. С этим связано большинство его важнейших химических свойств.
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород — окислитель.

Кислород легко реагирует с щелочными и щелочноземельными металлами:
Мелкий порошок железа ( так называемого пирофорного железа) самовоспламеняется на воздухе, образуя Fe 2 O 3 , а стальная проволока горит в кислороде, если ее заранее раскалить:
С неметаллами (серой, графитом, водородом, фосфором и др.) кислород реагирует при нагревании:
Почти все реакции с участием кислорода O 2 экзотермичны, за редким исключением, например:
N 2 + O 2 → 2NO – Q
Эта реакция протекает при температуре выше 1200 o C или в электрическом разряде.
Кислород способен окислить сложные вещества, например:
2H 2 S + 3O 2 → 2SO 2 + 2H 2 O (избыток кислорода),
2H 2 S + O 2 → 2S + 2H 2 O (недостаток кислорода),
4NH 3 + 5O 2 → 4NO + 6H 2 O (в присутствии катализатора Pt ),
Известны соединения, содержащие катион диоксигенила O 2 + , например, O 2 + [PtF 6 ] — (успешный синтез этого соединения побудил Н. Бартлетта попытаться получить соединения инертных газов).

Озон химически более активен, чем кислород O 2 . Так, озон окисляет иодид — ионы I — в растворе Kl:
Озон сильно ядовит, его ядовитые свойства сильнее, чем, например, у сероводорода. Однако в природе озон, содержащийся в высоких слоях атмосферы, выполняет роль защитника всего живого на Земле от губительного ультрафиолетового излучения солнца. Тонкий озоновый слой поглощает это излучение, и оно не достигает поверхности Земли. Наблюдаются значительные колебания в толщине и протяженности этого слоя с течением времени (так называемые озоновые дыры) причины таких колебаний пока не выяснены.
Применение кислорода O 2 : для интенсификации процессов получения чугуна и стали, при выплавке цветных металлов, как окислитель в различных химических производствах, для жизнеобеспечения на подводных кораблях, как окислитель ракетного топлива (жидкий кислород), в медицине, при сварке и резке металлов.

Применение озона О 3 : для обеззараживания питьевой воды, сточных вод, воздуха, для отбеливания тканей.
Читайте также:


