Модель атома бора кратко
Обновлено: 02.07.2024
Автор — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев.
Темы кодификатора ЕГЭ: постулаты Бора.
Планетарная модель атома, успешно истолковав результаты опытов по рассеянию -частиц, в свою очередь столкнулась с очень серьёзными трудностями.
Как мы знаем, любой заряд, движущийся с ускорением, излучает электромагнитные волны. Это - неоспоримый факт классической электродинамики Максвелла, подтверждаемый многочисленными наблюдениями.
Нам также хорошо известно, что электромагнитные волны несут энергию. Стало быть, ускоренно движущийся заряд, излучая, теряет энергию, которая этим излучением уносится.
А теперь давайте возьмём произвольный электрон в планетарной модели. Он двигается вокруг ядра по замкнутой орбите, так что направление его скорости постоянно меняется. Следовательно, электрон всё время имеет некоторое ускорение (например, при равномерном движении по окружности это будет центростремительное ускорение), и поэтому должен непрерывно излучать электромагнитные волны. Расходуя свою энергию на излучение, электрон будет постепенно приближаться к ядру; в конце концов, исчерпав запас своей энергии полностью, электрон упадёт на ядро.
Если исходить из того, что механика Ньютона и электродинамика Максвелла работают внутри атома, и провести соответствующие вычисления, то получается весьма озадачивающий результат: расход энергии электрона на излучение (с последующим падением электрона на ядро) потребует совсем малого времени - порядка секунды. За это время атом должен полностью "коллапсировать" и прекратить своё существование.
Таким образом, классическая физика предрекает неустойчивость атомов, устроенных согласно планетарной модели. Этот вывод находится в глубоком противоречии с опытом: ведь на самом деле ничего такого не наблюдается. Предметы нашего мира вполне устойчивы и не коллапсируют на глазах! Атом может сколь угодно долго пребывать в невозбуждённом состоянии, не излучая при этом электромагнитные волны.
Постулаты Бора.
Оставалось признать, что внутри атомов перестают действовать известные законы классической физики. Микромир подчиняется совсем другим законам.
Первый прорыв в познании законов микромира принадлежит великому датскому физику Нильсу Бору. Он предложил три постулата, резко расходящиеся с механикой и электродинамикой, но тем не менее позволяющих правильно описать простейший из атомов - атом водорода.
Классическая физика хорошо описывает непрерывные процессы - движение материальной точки, изменение состояния идеального газа, распространение электромагнитных волн. . . Энергия объекта, подчиняющегося механике или электродинамике, в принципе может принимать любые значения. Однако линейчатые спектры указывают на дискретность процессов, происходящих внутри атомов. Эта дискретность должна фигурировать в законах новой теории.
Первый постулат Бора. Всякий атом (и вообще, всякая атомная система) может находиться не во всех состояниях с любым, наперёд заданным значением энергии. Возможен лишь дискретный набор избранных состояний, называемых стационарными, в которых энергия атома принимает значения Находясь в стационарном состоянии, атом не излучает электромагнитные волны.
Как видим, первый постулат Бора вопиющим образом противоречит классической физике: налагается запрет на любые значения энергии, кроме избранного прерывистого набора, и признаётся, что электроны, вроде бы движущиеся ускоренно, на самом деле не излучают.
Выглядит фантастически, не правда ли? Однако в том же 1913 году, когда Бор предложил свои постулаты, существование стационарных состояний было подтверждено экспериментально - в специально поставленном опыте немецких физиков Франка и Герца. Таким образом, стационарные состояния - это не выдумка, а объективная реальность.
Значения разрешённого набора называются уровнями энергии атома. Что происходит при переходе с одного уровня энергии на другой?
Второй постулат Бора. Если атом переходит из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией , то разность этих энергий может высвободиться в виде излучения. В таком случае излучается фотон с энергией
Эта же формула работает и при поглощении света: в результате столкновения с фотоном атом переходит из состояния в состояние с большей энергией , а фотон при этом исчезает.
Для примера на рис. 1 показано излучение фотона при переходе атома с энергетического уровня на уровень . Переход заключается в том, что электрон "соскакивает" с одной орбиты на другую, расположенную ближе к ядру.

Рис. 1. Излучение фотона атомом
Формула (1) даёт качественное представление о том, почему атомные спектры испускания и поглощения являются линейчатыми.
В самом деле, атом может излучать волны лишь тех частот, которые соответствуют разностям значений энергии разрешённого дискретного набора ; соответственно, набор этих частот также получается дискретным. Вот почему спектр излучения атомов состоит из отдельно расположенных резких ярких линий.
Вместе с тем, атом может поглотить не любой фотон, а только тот, энергия которого в точности равна разности каких-то двух разрешённых значений энергии и . Переходя в состояние с более высокой энергией , атомы поглощают ровно те самые фотоны, которые способны излучить при обратном переходе в исходное состояние . Попросту говоря, атомы забирают из непрерывного спектра те линии, которые сами же и излучают; вот почему тёмные линии спектра поглощения холодного атомарного газа находятся как раз в тех местах, где расположены яркие линии спектра испускания этого же газа в нагретом состоянии.
Качественного объяснения характера атомных спектров, однако, недостаточно. Хотелось бы иметь теорию, позволяющую вычислить частоты наблюдаемых спектров. Бору удалось это сделать в самом простом случае - для атома водорода.
Атом водорода.
Атом водорода состоит из ядра с зарядом , которое называется протоном, и одного электрона с зарядом (через обозначена абсолютная величина заряда электрона). При построении своей теории атома водорода Бор сделал три дополнительных предположения.
1. Прежде всего, мы ограничиваемся рассмотрением только круговых орбит электрона. Таким образом, электрон движется вокруг протона по окружности радиуса с постоянной по модулю скоростью (рис. 2 ).

Рис. 2. Модель атома водорода
2. Величина , равная произведению импульса электрона на радиус орбиты , называется моментом импульса электрона. В каких единицах измеряется момент импульса?
Это в точности размерность постоянной Планка! Именно здесь Бор увидел появление дискретности, необходимой для квантового описания атома водорода.
Правило квантования (третий постулат Бора). Момент импульса электрона может принимать лишь дискретный набор значений, кратных "перечёркнутой" постоянной Планка:
3. Выше мы говорили, что классическая физика перестаёт работать внутри атома. Так оно в действительности и есть, но вопреки этому мы предполагаем, что электрон притягивается к протону с силой, вычисляемой по закону Кулона, а движение электрона подчиняется второму закону Ньютона:
Эти три предположения позволяют довольно просто получить формулы для уровней энергии атома водорода. Переписываем соотношение (3) в виде:
Из правила квантования (2) выражаем :
и подставляем это в (4) :
Отсюда получаем формулу для допустимых радиусов орбит электрона:
Теперь перейдём к нахождению энергии электрона. Потенциальная энергия кулоновского взаимодействия электрона с ядром равна:
(Она отрицательна, так как отсчитывается от бесконечно удалённой точки, в которой достигает максимального значения.)
Полная энергия электрона равна сумме его кинетической и потенциальной энергий:
Вместо подставим правую часть выражения (4) :
Полная энергия, как видим, отрицательна. Если на радиус орбиты никаких ограничений не накладывается, как это имеет место в классической физике, то энергия может принимать любые по модулю значения. Но согласно (5) существует лишь дискретный набор возможных значений радиуса; подставляя их в (6) , получаем соответствующий набор допустимых значений энергии атома водорода:
Основное состояние атома водорода - это состояние с наименьшей энергией . В основном состоянии атом может находиться неограниченно долго. Вычисление даёт:
Мы видим, что если атом находится в основном состоянии, то для выбивания электрона нужно сообщить атому энергию, равную как минимум 13,6 эВ. Эта величина носит название энергии ионизации атома водорода.
По формуле (5) легко вычислить радиус орбиты основного состояния:
То есть, диаметр атома оказывается равным как раз см - величине, известной из опыта. Таким образом, теория Бора впервые смогла объяснить размер атома!
Кроме того, в рамках теории Бора удаётся получить формулы для вычисления частот (или длин волн) спектра атома водорода. Так, согласно второму постулату Бора и формуле (7) имеем:
На практике чаще имеют дело с длинами волн. Учитывая, что , формулу (8) можно переписать так:
Константа м называется постоянной Ридберга. Теория Бора даёт значение этой постоянной, очень хорошо согласующееся с экспериментом.
Длины волн спектра атома водорода образуют серии, характеризующиеся фиксированным значением в формуле (9) . Все длины волн данной серии излучаются при переходах на уровень с вышележащих энергетических уровней .
Переходы в основное состояние:
образуют серию Лаймана. Длины волн этой серии описываются формулой (9) при :
Линии серии Лаймана лежат в ультрафиолетовом диапазоне.
Переходы на второй уровень:
образуют серию Бальмера. Длины волн этой серии подчиняются формуле (9) при :
Первые четыре линии серии Бальмера лежат в видимом диапазоне (рис. 3 ), остальные - в ультрафиолетовом.

Рис. 3. Видимый спектр атома водорода (серия Бальмера)
Переходы на третий уровень:
образуют серию Пашена.Длины волн этой серии описываются формулой (9) при :
Все линии серии Пашена лежат в инфракрасном диапазоне.
Имеются ещё три "именованных" серии: это серия Брэккета (переходы на уровень), серия Пфунда (переходы на уровень ) и серия Хэмпфри (переходы на уровень ). Все линии этих серий лежат в далёкой инфракрасной области.
Достоинства и недостатки теории Бора.
О достоинствах модели атома водорода, предложенной Бором, мы так или иначе уже сказали. Резюмируем их.
-Теория Бора продемонстрировала, что для описания атомных объектов принципиально недостаточно представлений классической физики. В микромире работают другие, совершенно новые законы.
Для микромира характерно квантование - дискретность изменения величин, описывающих состояние объекта. В качестве меры квантования, как показала теория Бора, может выступать постоянная Планка , которая является универсальной константой и играет фундаментальную роль во всей физике микромира (а не только в явлениях излучения и поглощения света).
-Теория Бора впервые и совершенно точно указала на факт наличия стационарных энергетических состояний атома, образующих дискретный набор. Этот факт оказался общим свойством объектов микромира.
-В рамках модели Бора удалось получить формулы для вычисления частот спектра атома водорода и объяснить размер атома. Классическая физика была не в состоянии решить эти проблемы.
Однако теория Бора, разумеется, не могла претендовать на роль общей теории, описывающей микромир. Модель Бора обладала рядом существенных недостатков.
-Теория Бора непоследовательна. С одной стороны, она отвергает описание атома на основе классической физики, так как постулирует наличие стационарных состояний и правила квантования, непонятных с точки зрения механики и электродинамики. С другой стороны, классические законы - второй закон Ньютона и закон Кулона - используются для записи уравнения движения электрона по круговой орбите.
-Теория Бора не смогла дать адекватное описание самого простого после водорода атома гелия. Подавно не могло быть и речи о распространении теории Бора на более сложные атомы.
-Даже в самом атоме водорода теория Бора смогла описать не всё. Например, дав выражения для частот спектральных линий, модель Бора не объясняла различие в их интенсивностях. Кроме того, неясен оставался механизм образования молекулы водорода из двух атомов.
Несмотря на свои недостатки, теория Бора стала важнейшим этапом развития физики микромира. Полуклассическая-полуквантовая модель Бора послужила промежуточным звеном между классической физикой и последовательной квантовой механикой , построенной десятилетием позже - в 1920-х годах.

По мере накопления знаний о материи и веществе происходило появление и уточнение теорий, объясняющих особенности строения атомов. Поговорим кратко о теории строения атома Бора.
Проблемы планетарной модели атома
В начале XXв Э. Резерфорд установил, что распределение заряда внутри атома крайне неравномерно. В центре атома находится компактное ядро, содержащее весь положительный заряд, а вокруг него на достаточно большом расстоянии (по сравнению с ядром) обращаются электроны. Была построена планетарная модель атома.
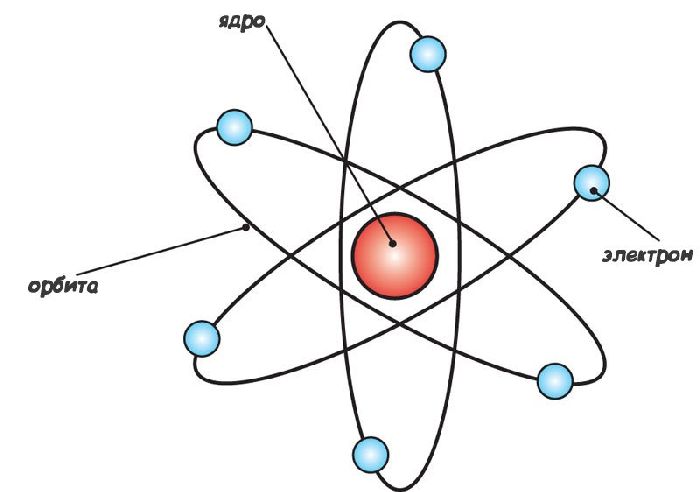
Рис. 1. Планетарная модель атома.
Эта модель хорошо объяснила результаты опытов по зондированию атомов α-частицами, однако, она противоречила достаточно хорошо обоснованной и подтвержденной к тому времени теории электродинамики Максвелла.
Согласно теории Максвелла, любой заряд, движущийся с ускорением, излучает электромагнитные волны и теряет энергию. Электрон, двигаясь по круговой орбите вокруг ядра, движется с постоянным центростремительным ускорением, и поэтому должен излучать, терять энергию, и в конце концов, упасть на ядро. Расчеты показывали, что это должно происходить в очень короткий промежуток времени, порядка десятков наносекунд. В реальности же атомы стабильны.
Вторым затруднением планетарной модели были сложности объяснения линейчатых спектров – противоречия здесь не было, но и обосновать наличие спектральных линий эта модель не могла.
Постулаты Бора
Для объяснения наблюдаемых явлений в 1913 г Н. Бор предложил свою теорию, базирующуюся на двух постулатах:
- Существуют особые стационарные состояния атома, находясь в которых электроны не излучают энергию, хотя двигаются с ускорением. В каждом стационарном состоянии электрон обладает некоторой энергией $E_n$, разной для разных состояний.
- Электроны излучают или поглощают энергию, переходя из одного стационарного состояния в другое, количество излучаемой или поглощаемой энергии равно разности энергий стационарных состояний.
Постулаты Н.Бора были допущениями, которые никак не обосновывались, исходя из классических теорий того времени. Однако, они явились первой ласточкой новой теории – квантовой механики.
Модель атома Н. Бора
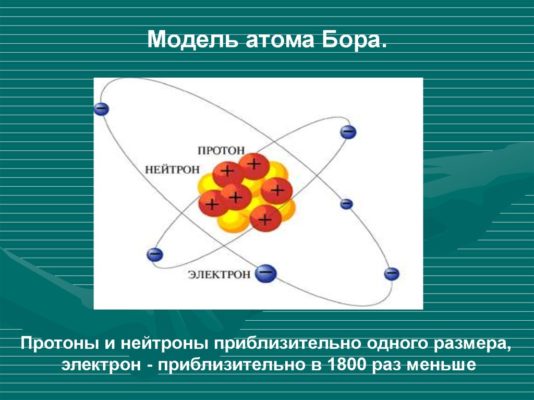
Рис. 2. Модель атома Бора.
На основе своих постулатов и законов механики И.Ньютона Н.Бор смог определить радиусы орбит электрона в атоме водорода, а также энергию, соответствующую стационарному уровню $n$:
- $n$ – номер энергетического уровня (1,2,3…);
- $E_n$ – энергия электрона на уровне $n$;
- $R_y$ – постоянная Ридберга, численно равная 13.6 эВ.
Теория Бора объяснила как стабильность атомов, так и линейчатый характер спектров. Например, серия самых ярких линий спектра водорода, открытая в 1885 г И. Бальмером (названная его именем), соответствует переходам на второй энергетический уровень с третьего, четвертого и более высоких уровней.
Атом водорода способен излучать и более мощную серию, соответствующую переходам на первый энергетический уровень с более высоких, однако, эта серия лежит в ультрафиолетовой области, и была открыта только в 1906 г. Т. Лайманом. Есть и другие серии линий, соответствующих переходам на третий и более высокие уровни.
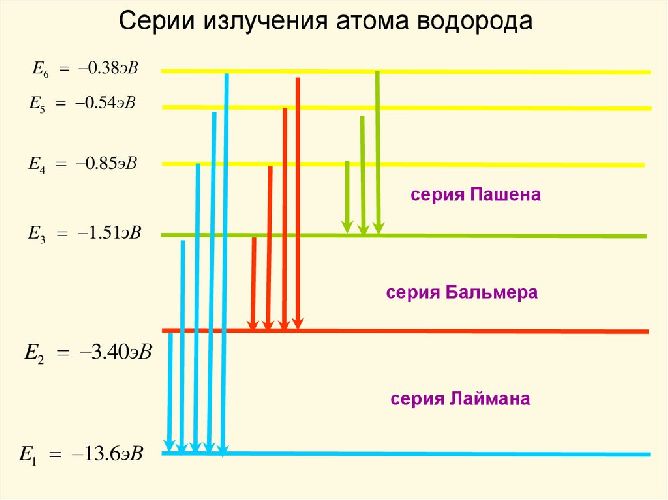
Рис. 3. Серия Бальмера серия Лаймана серия Пашена.
Что мы узнали?
Н. Бор разработал теорию строения атомов на основе своих двух допущений-постулатов. Эта теория смогла объяснить противоречие с электродинамикой Максвелла и линейчатый спектр излучения вещества.
Атомная модель Бора Это изображение атома, предложенное датским физиком Нилсом Бором (1885-1962). Модель утверждает, что электрон движется по орбите на фиксированном расстоянии вокруг атомного ядра, описывая равномерное круговое движение. Орбиты - или энергетические уровни, как он их назвал - имеют разную энергию.

Бор пронумеровал энергетические уровни электрона, считая, что чем ближе электрон к ядру, тем ниже его энергетическое состояние. Таким образом, чем дальше электрон находится от ядра, тем выше будет уровень энергетического уровня и, следовательно, энергетическое состояние будет выше..
- 1 Основные характеристики
- 1.1 Он основан на других моделях и теориях того времени
- 1.2 Экспериментальные доказательства
- 1.3 Электроны существуют на энергетических уровнях
- 1.4 Без энергии нет движения электрона
- 1.5 Количество электронов в каждом слое
- 1.6 Электроны вращаются по круговым орбитам без излучающей энергии
- 1.7 Разрешенные орбиты
- 1.8 Энергия, испускаемая или поглощаемая в прыжках
- 2.1 Первый постулат
- 2.2 Второй постулат
- 2.3 Третий постулат
Основные характеристики
![]()
Характеристики модели Бора важны, потому что они определили путь к разработке более полной атомной модели. Основными из них являются:
Он основан на других моделях и теориях того времени
Модель Бора была первой, в которой использовалась квантовая теория, поддерживаемая атомной моделью Резерфорда, и идеи, взятые из фотоэлектрического эффекта Альберта Эйнштейна. На самом деле Эйнштейн и Бор были друзьями.
Экспериментальные доказательства
Согласно этой модели, атомы поглощают или испускают излучение только тогда, когда электроны прыгают между разрешенными орбитами. Немецкие физики Джеймс Франк и Густав Герц получили экспериментальные доказательства этих состояний в 1914 году.
Электроны существуют на энергетических уровнях
Электроны окружают ядро и существуют на определенных энергетических уровнях, которые являются дискретными и которые описаны в квантовых числах.
Энергетическое значение этих уровней существует как функция от числа n, называемого основным квантовым числом, которое можно рассчитать с помощью уравнений, которые будут подробно описаны ниже..
Без энергии нет движения электрона
На рисунке выше показан электрон, который совершает квантовые скачки.
Согласно этой модели, без энергии нет движения электрона с одного уровня на другой, так же как без энергии невозможно поднять предмет, который упал, или отделить два магнита..
Количество электронов в каждом слое
Электроны, которые помещаются в каждый слой, рассчитываются с 2n 2
Химические элементы, которые являются частью периодической таблицы и находятся в одном столбце, имеют одинаковые электроны в последнем слое. Количество электронов в первых четырех слоях будет 2, 8, 18 и 32.
Электроны вращаются по круговым орбитам без излучающей энергии.
Согласно Первому Постулату Бора, электроны описывают круговые орбиты вокруг ядра атома без излучения энергии.
Разрешены орбиты
Согласно второму постулату Бора, единственными допустимыми орбитами для электрона являются те, для которых угловой момент L электрона является целым кратным постоянной Планка. Математически это выражается так:
![]()
Энергия, испускаемая или поглощаемая в прыжках
Согласно Третьему Постулату, электроны будут излучать или поглощать энергию при прыжках с одной орбиты на другую. При скачке орбиты испускается или поглощается фотон, энергия которого представлена математически:
![]()
Постулаты атомной модели Бора
Бор дал преемственность планетарной модели атома, согласно которой электроны вращались вокруг положительно заряженного ядра, а также планет вокруг Солнца..
Однако эта модель бросает вызов одному из постулатов классической физики. В соответствии с этим частица с электрическим зарядом (подобно электрону), которая движется по круговому пути, должна непрерывно терять энергию за счет излучения электромагнитного излучения. Потеряв энергию, электрон должен будет следовать по спирали, пока не упадет в ядро..
Затем Бор предположил, что законы классической физики не являются наиболее подходящими для описания устойчивости, наблюдаемой в атомах, и представил следующие три постулата:
Первый постулат
![]()
Электрон вращается вокруг ядра по круговым орбитам, не излучая энергию. На этих орбитах орбитальный момент импульса постоянен.
Для электронов атома разрешены только орбиты определенных радиусов, соответствующих определенным энергетическим уровням.
Второй постулат
![]()
Не все орбиты возможны. Но как только электрон находится на разрешенной орбите, он находится в состоянии удельной и постоянной энергии и не излучает энергию (стационарная энергетическая орбита).
Например, в атоме водорода допустимые энергии для электрона определяются следующим уравнением:
![]()
![]()
Энергии электронов атома водорода, которые генерируются из вышеприведенного уравнения, являются отрицательными для каждого из значений n. При увеличении n энергия становится менее отрицательной и, следовательно, увеличивается.
Когда n достаточно велико, например, n = ∞, энергия равна нулю и представляет, что электрон освобожден и ионизирован атом. Это состояние с нулевой энергией питает большую энергию, чем состояния с отрицательными энергиями..
Третий постулат
Электрон может переходить со стационарной энергетической орбиты на другую, излучая или поглощая энергию.
Энергия, излучаемая или поглощаемая, будет равна разности энергий между двумя состояниями. Эта энергия E находится в форме фотона и задается следующим уравнением:
В этом уравнении E - энергия (поглощенная или излучаемая), h - постоянная Планка (ее значение составляет 6,63 x 10). -34 джоул-секунды [Дж-с]) и ν - частота света, единица измерения которой равна 1 / с..
Диаграмма энергетических уровней для атомов водорода
Модель Бора смогла удовлетворительно объяснить спектр атома водорода. Например, в диапазоне длин волн видимого света спектр излучения атома водорода имеет следующий вид:
Посмотрим, как можно рассчитать частоту некоторых наблюдаемых световых полос; например, красный цвет.
Используя первое уравнение и подставив n для 2 и 3, вы получите результаты, которые отображаются на диаграмме.
![]()
Для n = 2, E2 = -5,45 х 10 -19 J
Для n = 3, E3 = -2,42 х 10 -19 J
Затем можно рассчитать разницу энергии для двух уровней:
ΔE = E3 - Е2 = (-2,42 - (- 5,45)) х 10 - 19 = 3,43 х 10 - 19 J
Согласно уравнению, объясненному в третьем постулате, ΔE = h ν. Затем вы можете рассчитать ν (частоту света):
= 3,43 х 10 -19 J / 6,63 x 10 -34 J-ы
= 4,56 х 10 14 s -1 или 4,56 х 10 14 Гц
Будучи λ = c / ν, а скорость света c = 3 x 10 8 м / с, длина волны определяется как:
λ = 6565 х 10 - 7 м (656,5 нм)
Это значение длины волны красной полосы, наблюдаемой в спектре водородных линий.
3 основных ограничения модели Бора
1- он адаптируется к спектру атома водорода, но не к спектрам других атомов.
2. Волнообразные свойства электрона не представлены в описании этого как маленькая частица, которая вращается вокруг атомного ядра..
3. Бор не может объяснить, почему классический электромагнетизм не применим к его модели. Именно поэтому электроны не испускают электромагнитное излучение, когда они находятся на стационарной орбите.
![]()
Боровская модель водородоподобного атома (Z — заряд ядра), где отрицательно заряженный электрон заключен в атомной оболочке, окружающей малое, положительно заряженное атомное ядро. Переход электрона с орбиты на орбиту сопровождается излучением или поглощением кванта электромагнитной энергии (hν).
![m_evr = n\hbar \]()
Бо́ровская моде́ль а́тома (Моде́ль Бо́ра) — полуклассическая модель атома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать непрерывно, и очень быстро, потеряв энергию, упасть на ядро. Чтобы преодолеть эту проблему Бор ввел допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определенным (стационарным) орбитам, находясь на которых они не излучают, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причем стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка [1] : .
Используя это допущение и законы классической механики, а именно равенство силы притяжения электрона со стороны ядра и центробежной силы, действующей на вращающийся электрон, он получил следующие значения для радиуса стационарной орбиты и энергии находящегося на этой орбите электрона:
![R_n = \frac<4<\pi></p>
<p>\varepsilon_0\hbar^2>n^2; \quad E_n = -\frac<32<\pi>^2\varepsilon_0^2\hbar^2>\cdot\frac]()
Здесь — масса электрона, Z — количество протонов в ядре, — диэлектрическая постоянная, e — заряд электрона.
Именно такое выражение для энергии можно получить, применяя уравнение Шрёдингера, решая задачу о движении электрона в центральном кулоновском поле.
![E_0=-13.6]()
Радиус первой орбиты в атоме водорода R0=5,2917720859(36)·10 −11 м [2] , ныне называется боровским радиусом, либо атомной единицей длины и широко используется в современной физике. Энергия первой орбиты эВ представляет собой энергию ионизации атома водорода.
Содержание
Полуклассическая теория Бора
Далее исходя из соображений классической физики о круговом движении электрона вокруг неподвижного ядра по стационарной орбите под действием кулоновской силы притяжения, Бором были получены выражения для радиусов стационарных орбит и энергии электрона на этих орбитах:
=5.3\cdot10^" width="" height="" />
м — боровский радиус. ," width="" height="" />
<2\hbar^2>" width="" height="" />
— энергетическая постоянная Ридберга (численно равна 13,6 эВ).Формула Зоммерфельда — Дирака
![\oint\mathbf<p> \cdot\,\mathbf = \frac = J]()
где — ,\mathbf" width="" height="" />
— обобщенный импульс и координаты электрона, — энергия, — частота. А квантовый постулат утверждает, что площадь замкнутой кривой в фазовой — плоскости за один период движения, равна целому числу умноженному на постоянную Планка (Дебай, 1913 г.). С точки зрения рассмотрения постоянной тонкой структуры наиболее интересным является движение релятивистского электрона в поле ядра атома, когда его масса зависит от скорости движения. В этом случае мы имеем два квантовых условия:, ,
где определяет главную полуось эллиптической орбиты электрона (), а — его фокальный параметр :
, .
В этом случае Зоммерфельд получил выражение для энергии в виде
![E = -\frac <RZ^2></p>
<p> + \epsilon(n,k)]()
.где — постоянная Ридберга, а — порядковый номер атома (для водорода ).
Дополнительный член отражает более тонкие детали расщепления спектральных термов водородоподобных атомов, а их число определяется квантовым числом . Таким образом сами спектральные линии представляют собой системы более тонких линий, которые соответствуют переходам между уровнями высшего состояния () и низшего состояния (). Это и есть т. н. тонкая структура спектральных линий. Зоммерфельд разработал теорию тонкой структуры для водородоподобных атомов (H, " width="" height="" />
, " width="" height="" />
), а Фаулер с Пашеном на примере спектра однократно ионизированного гелия " width="" height="" />
установили полное соответствие теории с экспериментом.Зоммерфельд (1916 г.) еще задолго до возникновения квантовой механики Шредингера получил феноменологичную формулу для водородных термов в виде:
![E + E_0 = E_0 \left( 1 + \frac <\alpha^2Z^2></p>
<p> <\left( n_r + \sqrt<n_\phi^2 - \alpha^2Z^2>\right)^2> \right) ^]()
,где — постоянная тонкой структуры, — порядковый номер атома, — энергия покоя, — радиальное квантовое число, а — азимутальное квантовое число. Позднее эту формулу получил Дирак используя релятивистское уравнения Шредингера. Поэтому сейчас эта формула и носит имя Зоммерфельда — Дирака.
![Z = 1]()
Появление тонкой структуры термов связана с прецессией электронов вокруг ядра атома. Поэтому появление тонкой структуры можно обнаружить по резонансному эффекту в области ультракоротких электромагнитных волн. В случае (атом водорода) величина расщепления близка к
![E/h \approx R\alpha^2/n^2]()
Поскольку длина электромагнитной волны равна
![\lambda = c/\nu = ch/E = cn^2/R\alpha^2 \approx 0,17cm]()
![n = 2]()
Поэтому для это будет почти 1 см.
Достоинства теории Бора
- Объяснила дискретность энергетических состояний водородоподобных атомов.
- Теория Бора подошла к объяснению внутриатомных процессов с принципиально новых позиций, стала первой полуквантовой теорией атома.
- Эвристическое значение теории Бора состоит в смелом предположении о существовании стационарных состояний и скачкообразных переходов между ними. Эти положения позднее были распространены и на другие микросистемы.
Недостатки теории Бора
- Не смогла объяснить интенсивность спектральных линий.
- Справедлива только для водородоподобных атомов и не работает для атомов, следующих за ним в таблице Менделеева.
- Теория Бора логически противоречива: не является ни классической, ни квантовой. В системе двух уравнений, лежащих в её основе, одно — уравнение движения электрона — классическое, другое — уравнение квантования орбит — квантовое.
Теория Бора являлась недостаточно последовательной и общей. Поэтому она в дальнейшем была заменена современной квантовой механикой, основанной на более общих и непротиворечивых исходных положениях. Сейчас известно, что постулаты Бора являются следствиями более общих квантовых законов. Но правила квантования типа широко используются и в наши дни как приближенные соотношения: их точность часто бывает очень высокой.
Читайте также:















