Металлические кристаллы это кратко
Обновлено: 02.07.2024
МЕТАЛЛИЧЕСКИЕ КРИСТАЛЛЫ
МЕТАЛЛИЧЕСКИЕ КРИСТАЛЛЫ, кристаллич. в-ва, все атомы к-рых объединены металлическими связями - валентные электроны металла делокализованы по всему пространству кристаллич. решетки, образуемой его положит. ионами. Структуры металлических кристаллов характеризуются плотной и плот-нейшей упаковкой (см. Плотная упаковка)положит. ионов. Сферич. симметрия частиц, составляющих металлические кристаллы, объясняется ненаправленностью металлич. связи. Изменение электронной концентрации (число электронов, приходящихся на один атом или на единицу объема) при изменении номера группы в периодич. системе определяет закономерную смену структур. Так, Na и др. щелочные металлы кристаллизуются в объемноцентрир. кубич. решетке (ОЦК), Be, Mg и др. щел.-зем. металлы, кроме Ва,-в гексагон. компактной (ГК), Аl-в гранецентрир. кубической (ГЦК). Именно эти три типа структуры характерны и для металлов групп Сu (ГЦК) и Zn (ГК), а также др. переходных металлов. Закономерности смены структуры в зависимости от положения элемента в табл. Менделеева усложняются явлением полиморфизма. Полиморфизм (в зависимости от т-ры и давления) характерен для большинства металлов. Высокотемпературной модификацией чаще всего оказывается ОЦК структура. Не обнаружены полиморфные модификации у переходных элементов V-VI гр. (V, Сг, Nb, Та, Mo, W), имеющих ОЦК структуру, у переходных элементов конца длинных периодов (Ni, Pd, Pt), а также у Ag, Au и Си, кристаллизующихся в ГЦК решетке.
Кроме названных характерных металлич. структур существуют особые структуры-Zn (гексагон. решетка с ано мально большим отношением параметров с/а и координац. числом 12), Hg (ромбоэдрич.), In (тетрагональная). Эти структуры можно рассматривать как характерные метал-лич., но искаженные из-за потери сферич. симметрии ионов, что обусловлено наложением на металлич. связь направленной (ковалентной) связи. Среди структур переходных металлов выделяют: многослойные структуры плотнейшей упаковки у нек-рых РЗЭ (Nd, Pr, Sm); кристаллич. структуры, характерные для интерметаллидов (a-Mn, имеющий решетку х-фазы, b-Mn-с решеткой одного из типов р-фаз Юм Розери, b-U-c решеткой s-фазы FeCr). Эта аналогия дает основание полагать, что в нек-рых переходных металлах атомы могут находиться в разных электронных состояниях и, соотв., вести себя как компоненты хим. соединения. Переходный металлы могут растворять значит. кол-ва не-металлич. элементов с достаточно малым атомным радиусом, таких, как Н, N, С, В, О (образуя твердые р-ры внедрения), и давать с ними металлические соединения. Образующиеся при этом кристаллич. структуры повторяют типичные металлич. или близкие к ним. Изменения кристаллич. структуры под влиянием примесей или при образовании соед. можно рассматривать как разновидность полиморфизма. Гексагoн. структура наблюдалась в электроосаж-денном Сr, видимо, в результате растворения Н 2 ; при взаимод. Ti с С, N 2 или О 2 подрешетка металлич. атомов приобретает вид ГЦК.
Практически применяемые металлич. материалы почти всегда представляют собой сплавы. В осн. металлич. материалы (сталь и чугун, бронза и латунь, сплавы на основе Ti, Al, Mg и др.)-поликристаллич. в-ва, т.е. состоят из монокристаллич. зерен всевозможной ориентации. В нек-рых материалах создают текстуру, т.е. структуру, в к-рой зерна имеют заданную кристаллографич. ориентацию. При этом возникает анизотропия св-в, сходная с анизотропией монокристаллов (напр., анизотропия магн. св-в тек-стурир. трансформаторной стали). Наряду с произ-вом по-ликристаллич. металлич. материалов имеются технологии получения деталей машин в виде металлич. монокристаллов, а также металлич. материалов с ультрамелким зерном. Микрокристаллич. материалы в виде ленты или проволоки с размером зерна ~ 1 мкм получают закалкой из жидкого состояния. Монокристаллич. и микрокристаллич. тонкопленочные металлич. материалы получают химическим осаждением из газовой фазы.
кристаллич. в-ва, все атомы к-рых объединены металлическими связями - валентные электроны металла делокализованы по всему пространству кристаллич. решетки, образуемой его положит. ионами. Структуры М. к. характеризуются плотной и плот-нейшей упаковкой (см. Плотная упаковка )положит. ионов. Сферич. симметрия частиц, составляющих М. к., объясняется ненаправленностью металлич. связи. Изменение электронной концентрации (число электронов, приходящихся на один атом или на единицу объема) при изменении номера группы в периодич. системе определяет закономерную смену структур. Так, Na и др. щелочные металлы кристаллизуются в объемноцентрир. кубич. решетке (ОЦК), Be, Mg и др. щел.-зем. металлы, кроме Ва,-в гексагон. компактной (ГК), Аl-в гранецентрир. кубической (ГЦК). Именно эти три типа структуры характерны и для металлов групп Сu (ГЦК) и Zn (ГК), а также др. переходных металлов. Закономерности смены структуры в зависимости от положения элемента в табл. Менделеева усложняются явлением полиморфизма. Полиморфизм (в зависимости от т-ры и давления) характерен для большинства металлов. Высокотемпературной модификацией чаще всего оказывается ОЦК структура. Не обнаружены полиморфные модификации у переходных элементов V-VI гр. (V, Сг, Nb, Та, Mo, W), имеющих ОЦК структуру, у переходных элементов конца длинных периодов (Ni, Pd, Pt), а также у Ag, Au и Си, кристаллизующихся в ГЦК решетке.
Кроме названных характерных металлич. структур существуют особые структуры-Zn (гексагон. решетка с аномально большим отношением параметров с/а и координац. числом 12), Hg (ромбоэдрич.), In (тетрагональная). Эти структуры можно рассматривать как характерные метал-лич., но искаженные из-за потери сферич. симметрии ионов, что обусловлено наложением на металлич. связь направленной (ковалентной) связи. Среди структур переходных металлов выделяют: многослойные структуры плотнейшей упаковки у нек-рых РЗЭ (Nd, Pr, Sm); кристаллич. структуры, характерные для интерметаллидов(a-Mn, имеющий решетку х-фазы, b-Mn-с решеткой одного из типов р-фаз Юм Розери, b-U-c решеткой s-фазы FeCr). Эта аналогия дает основание полагать, что в нек-рых переходных металлах атомы могут находиться в разных электронных состояниях и, соотв., вести себя как компоненты хим. соединения. Переходный металлы могут растворять значит. кол-ва не-металлич. элементов с достаточно малым атомным радиусом, таких, как Н, N, С, В, О (образуя твердые р-ры внедрения), и давать с ними металлические соединения. Образующиеся при этом кристаллич. структуры повторяют типичные металлич. или близкие к ним. Изменения кристаллич. структуры под влиянием примесей или при образовании соед. можно рассматривать как разновидность полиморфизма. Гексагoн. структура наблюдалась в электроосаж-денном Сr, видимо, в результате растворения Н 2 ; при взаимод. Ti с С, N 2 или О 2 подрешетка металлич. атомов приобретает вид ГЦК.
Практически применяемые металлич. материалы почти всегда представляют собой сплавы. В осн. металлич. материалы (сталь и чугун, бронза и латунь, сплавы на основе Ti, Al, Mg и др.)-поликристаллич. в-ва, т. е. состоят из монокристаллич. зерен всевозможной ориентации. В нек-рых материалах создают текстуру, т. е. структуру, в к-рой зерна имеют заданную кристаллографич. ориентацию. При этом возникает анизотропия св-в, сходная с анизотропией монокристаллов (напр., анизотропия магн. св-в тек-стурир. трансформаторной стали). Наряду с произ-вом по-ликристаллич. металлич. материалов имеются технологии получения деталей машин в виде металлич. монокристаллов, а также металлич. материалов с ультрамелким зерном. Микрокристаллич. материалы в виде ленты или проволоки с размером зерна ~ 1 мкм получают закалкой из жидкого состояния. Монокристаллич. и микрокристаллич. тонкопленочные металлич. материалы получают химическим осаждением из газовой фазы.
Лит.: Уманский Я. С., Скаков Ю. А., Физика металлов. Атомное строение металлов и сплавов, М., 1978; Годовиков А. А., Кристаллохимия простых веществ, Новосиб., 1979; Григорович В. К., Металлическая связь и структура металлов, М., 1988. Ю. А. Скаков.
Химическая энциклопедия. — М.: Советская энциклопедия . Под ред. И. Л. Кнунянца . 1988 .
Полезное
Смотреть что такое "МЕТАЛЛИЧЕСКИЕ КРИСТАЛЛЫ" в других словарях:
КРИСТАЛЛЫ — (от греч. krystallos кристалл; первоначально лед), твердые тела, обладающие трехмерной периодич. атомной (или молекулярной) структурой и, при определенных условиях образования, имеющие естеств. форму правильных симметричных многогранников (рис.… … Химическая энциклопедия
Кристаллы (физич.) — Кристаллы (от греч. krýstallos, первоначально лёд, в дальнейшем горный хрусталь, кристалл), твёрдые тела, имеющие естественную форму правильных многогранников (рис. 1). Эта форма следствие упорядоченного расположения в К. атомов, образующих… … Большая советская энциклопедия
Кристаллы — I Кристаллы (от греч. krýstallos, первоначально лёд, в дальнейшем горный хрусталь, кристалл) твёрдые тела, имеющие естественную форму правильных многогранников (рис. 1). Эта форма следствие упорядоченного расположения в К. атомов,… … Большая советская энциклопедия
КРИСТАЛЛЫ — (от греч. krystallos, букв. лёд; горный хрусталь) твёрдые тела, имеющие упорядоченное взаимное расположение образующих их частиц атомов, ионов, молекул. В идеальном К. частицы располагаются строго периодически в трёх измерениях, образуя т. н.… … Большой энциклопедический политехнический словарь
МЕТАЛЛИЧЕСКИЕ ВОЛОКНА — получают из металлов (напр., Аl, Сu, Аu, Ag, Mo, W) и сплавов (латуни, стали, тугоплавких, напр. нихрома). Имеют поликристаллич. структуру (о М. в. монокристаллич. структуры см. Нитевидные кристаллы).Выпускают волокна, мононити (тонкие проволоки) … Химическая энциклопедия
КОВАЛЕНТНЫЕ КРИСТАЛЛЫ — кристаллы с ко валентными хим. межатомными связями. К. к. образуются чаще всего из элементов IV и близких к ней групп периодической системы элементов с тетраэдрич. гибридизацией валентных орбиталей, так что химическая связь осуществляется парами… … Физическая энциклопедия
нитевидные кристаллы — Металлические нитевидные наросты, образующиеся самопроизвольно при хранении, эксплуатации или во время электроосаждения. [ГОСТ 9.008 82] Тематики покрытия металл. и неметалл … Справочник технического переводчика
ФИЗИКА ТВЕРДОГО ТЕЛА — раздел физики, изучающий структуру и свойства твердых тел. Научные данные о микроструктуре твердых веществ и о физических и химических свойствах составляющих их атомов необходимы для разработки новых материалов и технических устройств. Физика… … Энциклопедия Кольера
КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА — расположение атомов кристаллич. в ва в пространстве. наиб. характерное св во К. с. трехмерная периодичность (см. Кристаллическое состояние). Обычно, говоря о К. с., подразумевают среднее во времени расположение атомных ядер (т. наз. статич.… … Химическая энциклопедия
КРИСТАЛЛОХИМИЯ — раздел химии, изучающий пространств. расположение и хим. связи атомов в кристаллах, а также зависимость физ. и хим. св в кристаллич. в в от их строения. Изучая влияние хим. состава в ва на его структуру, К. тесно связана с кристаллографией. центр … Химическая энциклопедия

Металлы – особая группа элементов в периодической таблице Менделеева. В отличие от неметаллов элементы этой группы являются исключительно восстановителями с положительной степенью окисления, а также обладают пластичностью, твёрдостью, упругостью, что обусловлено кристаллическим строением металлов.
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Отрицательно заряженные электроны держат на равном расстоянии положительно заряженные электроны, предавая кристаллической решётке правильную геометрическую форму.
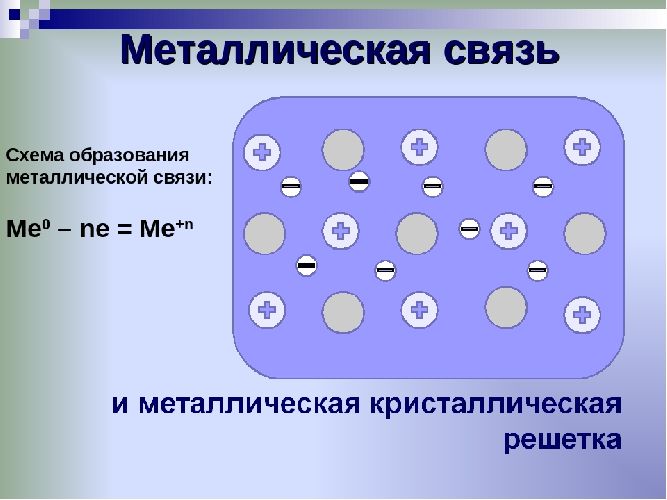
Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Виды решёток
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.
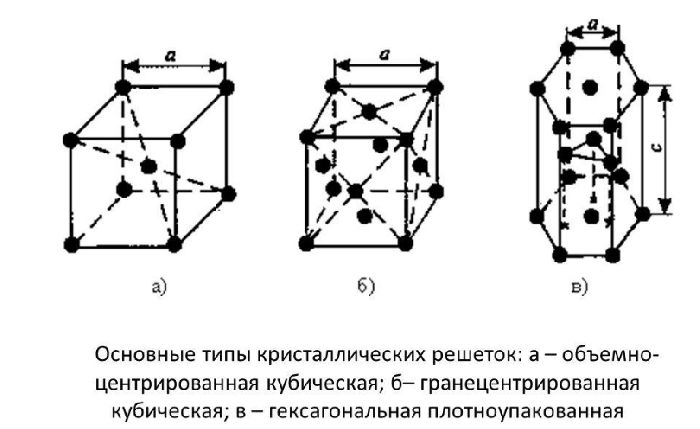
Рис. 2. Типы решёток.
Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
Характеристика решётки
Кристаллические решётки характеризуются компактностью или степенью наполненности. Компактность определяют показатели:
- параметр решётки – расстояние между атомами;
- число атомов;
- координационное число – количество соседних ячеек;
- плотность упаковки – отношение объёма, занимаемого атомами, к полному объёму решётки.
При подсчёте количества атомов следует помнить, что атомы в узлах и на гранях входят в состав соседних ячеек.
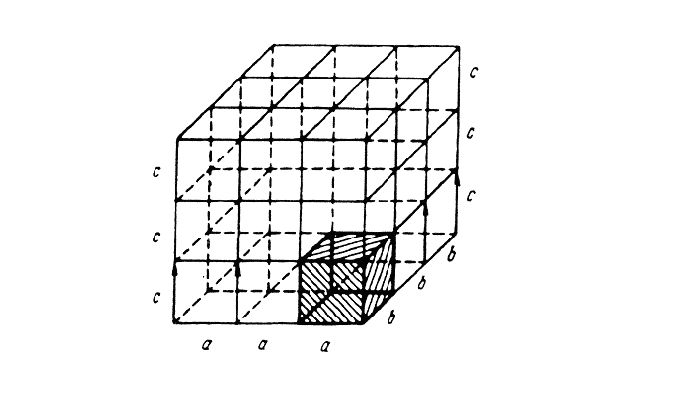
Рис. 3. Кристаллические ячейки составляют решётку.
Что мы узнали?
Узнали кратко об атомно-кристаллическом строении металлов. Металлы – твёрдые кристаллические вещества. Единицей решётки является элементарная кристаллическая ячейка. Благодаря металлическим связям ионы в узлах ячеек удерживаются на одинаковом расстоянии. Различают три типа кристаллических решёток – ОЦК, ГЦК и ГПУ, отличающихся количеством атомов и геометрической формой.
МЕТАЛЛИ́ЧЕСКИЕ КРИСТА́ЛЛЫ, кристаллы, в которых атомы объединены металлич. химич. связями. При образовании кристаллич. решётки М. к. атомы сближаются до касания, валентные орбитали соседних атомов перекрываются, вследствие чего электроны свободно перемещаются с орбитали одного атома на свободные и близкие по энергии орбитали соседних атомов. В результате этого в кристаллич. решётке М. к. возникают обобществлённые свободные электроны, которые непрерывно перемещаются между положительно заряженными ионами узлов решётки, электростатически связывая их в единое целое (см. в ст. Химическая связь ).
Это кристаллы, в которых преобладает металлический тип связи. Их образуют элементы всех подгрупп А и I - III подгрупп В. Они электроположительны, так как имеют малый потенциал ионизации. В металлическом кристалле при взаимодействии с элементами других групп атомы легко отдают свои валентные электроны и превращаются в положительный ион.
При взаимодействии друг с другом валентные энергетические зоны атомов перекрываются, образуя общую зону со свободными подуровнями. Это дает возможность валентным электронам свободно перемещаться в пределах этой зоны. Происходит обобществление валентных электронов в объеме всего кристалла.
Таким образом, валентные электроны в металле нельзя считать потерянными или приобретенными атомами. Они обобществлены атомами в объеме всего кристалла, в отличие от ковалентных кристаллов, в которых такое обобществление ограничено одной парой атомов.
Металлическая связь ненаправленная, так как каждый атом стремится притянуть к себе как можно больше соседних атомов. Следствием этого является высокое координационное число и большая компактность кристаллических структур металлов. Как указывалось, большим координационным числом, характеризующим компактность решетки, обладают кристаллические структуры ГЦК и ГПУ. Гранецентрированную кубическую решетку ГЦК имеют металлы и Гексагональную плотноупакованную решетку ГПУ имеют многие металлы, но отношение соответствующее сферической симметрии атомов, имеют лишь и Со.
Отклонение с от значения 1,633 объясняют наличием доли ковалентной связи и возникшей в результате этого несферической симметрии атомов. В этом случае, помимо металлического взаимодействия, в направлении, в котором вытянут атом, возникает ковалентное взаимодействие. При расположении несферических атомов в кристалле своей большой осью вдоль оси отношение больше При расположении атомов малой осью вдоль оси отношение меньше
Возникновением доли ковалентных связей и несферической симметрией атомов объясняют также образование кристаллических структур ОЦК. Такая структура не обладает большой плотностью упаковки. Кристаллическую структуру ОЦК имеют Fe, Cr, Mo, W, V, Та, Tip, Nb, Zr и др.
Среди металлов и некоторых неметаллов распространено явление полиморфизма - способность в твердом состоянии при различных температурах (или давлении) иметь различные типы кристаллических структур. Эти кристаллические структуры называют аллотропическими формами или модификациями. Низкотемпературную модификацию называют а, а высокотемпературные Р, у, 6 и т. д.
Стабильность модификаций при определенной температуре и давлении определяется значением термодинамического потенциала (свободной энергией)
Более стабильной при данной температуре будет модификация, имеющая
Рис. 1.13. Изменение термодинамического потенциала двух модификаций металла при нагреве
меньшее алгебраическое значение термодинамического потенциала, что может быть достигнуто либо за счет малой энтальпии Н, либо большой энтропии
Стабильность модификаций может меняться в связи с изменением типа связи. При низких температурах благодаря большой энергии ковалентной связи, а следовательно, и малой энтальпии стабильна модификация олова с решеткой алмаза которая при нагреве сменяется модификацией с более слабой металлической связью.
Температурным полиморфизмом обладают около тридцати металлов (табл. 1.4). Быстрое охлаждение может сохранить высокотемпературную модификацию в течение длительного времени при температурах так как низкая диффузионная подвижность атомов при таких температурах не способна вызвать перестройку решетки.
Кроме того, известен полиморфизм под влиянием температуры и давления.
ТАБЛИЦА 1.4. Кристаллическая структура полиморфных металлов
При нагреве до и давлении углерод в форме графита перекристаллизуется в алмаз. При очень больших давлениях в железе обнаружена низкотемпературная модификация с гексагональной решеткой ГПУ.
Рост давления может приводить к превращению при низких температурах менее плотноупакованных модификаций в плотноупакованные структуры. В при больших давлениях обнаружено превращение ковалентных кристаллов с решеткой алмаза в металлические кристаллы с тетрагональной объемно-центрированной решеткой .
Энергия металлической связи несколько меньше, чем энергия ковалентной связи, поэтому металлы в большинстве случаев, по сравнению с ковалентными кристаллами, имеют более низкие температуры плавления, испарения, модуль упругости, но более высокий температурный коэффициент линейного расширения.
Для большинства случаев с увеличением энергии связи растут температура плавления модуль упругости , энергия активации самодиффузии ; коэффициент линейного расширения а, наоборот, уменьшается (табл. 1.5).
ТАБЛИЦА 1.5. Энергии межатомной связи и свойства металлов
Закономерность обнаружена экспериментально и имеет ряд исключений. В их числе: аномально завышен модуль упругости что позволяет использовать его сплавы как материалы повышенной жесткости (см. гл. 13). Металлы имеют заниженные значения не только модуля упругости, но и энергии активации самодиффузии. Последнее объясняет их пониженную жаропрочность.
Приведенные в табл. 1.5 значения определены по теплоте испарения; даны для поликристаллов, причем для температуры для низкотемпературных модификаций полиморфных металлов.
Вследствие ненаправленности металлической связи и образования плотно-упакованных структур металлические кристаллы более пластичны и менее тверды, чем ковалентные кристаллы. Хорошая электрическая проводимость обеспечивается наличием свободных подуровней в валентной энергетической зоне.
Температурный коэффициент электрического сопротивления у металлических кристаллов имеет положительное значение, т. е. электрическое сопротивление при нагреве растет.
Читайте также:

