Мегалобластная анемия патогенез кратко
Обновлено: 02.07.2024
Длинный, но не полный список диагнозов-синонимов, послуживший заголовком статьи, нуждается в комментарии; попутно прояснится и содержание этих терминов.
В12 – это витамин (понятно, какой группы), иначе называемый фактором Касла и представленный четырьмя различными кобальтсодержащими веществами с одинаковыми биологическими свойствами, что и позволило выделить их в единую подгруппу витамина В.
Таким образом, получаем: опасная, злокачественно протекающая В-витаминодефицитная незрело-эритроцитная анемия. Раньше ее так и называли: злокачественная анемия или злокачественное малокровие. Но еще ее называют болезнью Аддисона-Бирмера или бирмеровой анемией, и вот почему.
В 1822 году симптомы некоего тяжелого заболевания крови впервые упомянул английский врач Дж.С.Комб. В 1849 году его соотечественник, выдающийся врач и ученый Томас Аддисон дал более развернутое описание и толкование. Существенно позже, – в 1871 году, но независимо от Аддисона, – немецкий исследователь Микаэль Антон Бирмер в деталях изучил и охарактеризовал это заболевание, которому дал название прогрессирующая пернициозная анемия.
Позже лечение от анемии напряженно искал американец Уильям Мерфи (от анемии вообще, без нозологического деления), производя эксперименты на искусственно обескровленных собаках. Мерфи кормил их различными продуктами и сравнивал темпы восстановления; его внимание обратила на себя сырая печень. С 1920-х годов усилиями У.Мерфи, Дж.Уиппла и Дж.Майнота пернициозная анемия перестала быть однозначно и стопроцентно летальной болезнью: спасительное лекарство крылось именно в печени. А закончилось все тем, что Мерфи, Уиппл и Майнот в 1934 году получили Нобелевскую премию, – за то, что выделили вещество (группу соединений, как выяснилось), известное сегодня под названием витамин В12.
В серии статей о витаминах Лахта Клиника неоднократно обращала внимание на то, что история открытия и изучения этих удивительных веществ оказалась очень непростой, извилистой, порой драматичной. Но человечество вообще и медицина в частности отличаются невероятным самосохранительным упрямством, когда что-то угрожает нам по-настоящему. Сегодня на очереди сердечнососудистая патология, злокачественные опухоли, вирусные гепатиты, аутоиммунные и наследственные болезни. И никуда, образно говоря, эти убийцы от нас не спрячутся, – как не спрятались чума и лепра, авитаминозы и анемии: истинные причины будут изобличены, патогенез досконально изучен, лекарства найдены. Поскорее бы только, господа ученые. Поскорее бы. Мы знаем, что делается все мыслимое и немыслимое; знаем, что где-то в лабораториях, клиниках, университетских центрах морщат высокие лбы и трут воспаленные от бессонницы глаза современные Каслы, Аддисоны, Бирмеры, Дженнеры, Мечниковы, Флемминги. И все-таки – поторопитесь, пожалуйста…
Возвращаясь к запутанной проблеме В12-дефицитной анемии: анемия пернициозная – это не синоним, это частный случай. Как уже ясно из сказанного, недостаток кобальтсодержащих витаминов и фолиевой кислоты в организме может быть обусловлен двумя принципиально разными причинами.
Причины
Вторая группа причин значительно обширней: она охватывает множество заболеваний и состояний, снижающих концентрацию внутреннего фактора Касла, – желудочного мукопротеида, без которого даже при достаточном поступлении витаминов В9 и В12 невозможно их усвоение. К таким состояниям относится ряд желудочно-кишечных заболеваний, особенно тех, что поражают тонкий кишечник (в т.ч. инфекционные энтериты, болезнь Крона и мн.др.); постоперационные синдромы, связанные с частичной резекций желудка и/или кишечника; патология печени (в печени содержится депо данной группы витаминов, которого хватает на несколько лет). Недостаток транскобаламина (белка, осуществляющего транспорт витаминов В12) в редких случаях может быть наследственным. К нарушениям метаболизма внешнего фактора Касла приводит также избыточный и слишком продолжительный прием антибиотиков, антацидов, пероральных контрацептивов; гельминтозы; гиперактивность некоторых бактериальных культур; аутоиммунные расстройства; онкопроцессы; химические ожоги слизистой желудка; алкоголизм.
Потребность в фолатах и В12 возрастает при беременности.
Распространенность данной разновидности анемии в общей популяции оценивается на уровне 1%, с преобладанием женщин. В выборках пожилого и старческого возраста доля лиц с В12-дефицитной анемией возрастает до 10% и более, – за счет инволюционных изменений в тканях, секреторных процессах и общем метаболизме.
Симптоматика
Диагностика
Быстрое и доказательное установление точного диагноза требует от врача высокой квалификации, большого опыта, а также постоянной настороженности в отношении гиповитаминозов. Подозрение на анемию, вызванную дефицитом внутреннего фактора Касла (пернициозная форма) или алиментарным, пищевым фактором, вызывается сочетанием неспецифических и характерных симптомов на фоне сниженного гемоглобина в общеклиническом анализе крови. При наличии такого подозрения назначается батарея лабораторных анализов, производится инструментальное обследование органов ЖКТ (рентгенография, ФГДС, ирригография, УЗИ и др.); по мере необходимости к лечебно-диагностическому процессу привлекаются кардиолог, невролог и другие специалисты.
Лечение
Терапевтическая стратегия определяется установленной этиологией анемии. Обязательными являются нормализация рациона, специальная диета, интенсивное лечение основного заболевания (если оно есть). Заместительная терапия цианкобаламином должна тщательно рассчитываться с учетом всех индивидуальных особенностей случая. Иногда имеются показания к назначению гормональных средств. При развитии жизнеугрожающего состояния прибегают к гемотрансфузиям. Паллиативные меры принимаются в зависимости от конкретного симптомокомплекса. Категорически исключен алкоголь – безжалостный антагонист витаминов группы В.
При поздней диагностике, длительном течении и запоздалом начале терапии изменения со стороны нервной системы могут оказаться глубокими и необратимыми.
Некоторые больные получают поддерживающее лечение пожизненно. Необходим также регулярный онкоконтроль.

3. Коровина Н.А., Заплатников А.Л., Захарова И.Н. Железодефицитные анемии у детей. – Руководство для врачей. – Владимир, 1998.
5. Наглядная гематология / Перевод с англ. Под редакцией проф. В.И. Ершова. – 2-е изд. – М.: ГЭОТАР-Медиа, 2008. – 116 с.: ил.
6. Папаян А.В., Жукова Л.Ю. Анемии у детей: руководство для врачей. – СПб.: ПИТЕР. – 2001 год – 384 с.
7. Патофизиология: учебник: в 2 т./под ред. В.В. Новицкого, Е.Д. Гольдберга, О.И. Уразовой. – 4-е изд. – ГЭОТАР-Медиа, 2010. – Т.2. – 848 с.: ил.
9. Патофизиология: курс лекций/ [Порядин Г. В. и др.]; под ред. Г. В. Порядина. – М. : ГЭОТАР-Медиа, 2012. – 592 с.
Мегалобластные анемии – большая группа анемий врожденного и приобретенного характера, характеризующаяся изменением морфологии эритроцитов, нарушением синтеза ДНК и РНК в эритрокариоцитах, а также процессов их созревания. Характерной особенностью указанных анемий является возникновение мегалобластического типа кроветворения, при котором в костном мозге появляются мегалобласты с необычным расположением хроматина в ядре, асинхронной дифференцировкой ядра и цитоплазмы.
Наиболее частыми причинами развития мегалобластных анемий являются нарушения метаболизма витамина В12, фолиевой кислоты, дефицит указанных соединений в организме. Комбинированный дефицит витамина В12 и фолиевой кислоты встречается редко.
Прежде всего, необходимо остановиться на метаболической значимости витамина В12. Витамин В12, относится к группе кобаламинов, содержится в пище животного происхождения: мясе, яйцах, сыре, молоке, печени, почках в комплексной связи с белком. Продукты растительного происхождения не содержат витамин В12. Витамин В12, содержащийся в пище, получил название внешнего фактора, впервые в чистом виде одновременно был выделен в 1948 г. в Великобритании и в США. для обеспечения всасывания витамина В12, необходим так называемый внутренний фактор – термолабильный гликопротеин с молекулярной массой порядка 50000– 60000 Да, секретируемый париетальными клетками тела и дна желудка.
В процессе всасывания витамина В12 выделяют несколько стадий. В желудке под действием соляной кислоты витамин В12 высвобождается из пищи и соединяется с R-белком слюны (транскобаламином I). После расщепления в 12-перстной кишке R-белка панкреатическими протеазами витамин В12 связывается с внутренним фактором (ВФ), вырабатываемым париетальными клетками желудка. Связь витамина В12 с ВФ стабилизируется в щелочной среде кишечника и становится устойчивой к действию протеолитических ферментов. Молекулы ВФ-В12 абсорбируются в подвздошной кишке с помощью специальных рецепторов в присутствии ионов кальция. на следующем этапе включается механизм активного транспорта через кишечные клетки. В плазме крови витамин В12, связывается с транспортными белками– транскобаламинами I, II, III, причем транскобаламин I – белок с электрофоретической подвижностью, свойственной α-глобулинам, имеет полупериод жизни 9–10 дней и нелегко обменивается с тканями. Между тем связанный с транскобаламином II витамин В12 имеет короткий полупериод жизни, причем транскобаламин II усиливает поглощение витамина В12 клетками различных органов и тканей, в частности эритроцитами. Транскобаламин II является основным транспортным белком для витамина В12, обеспечивая его доставку к костному мозгу.
Дефицит витамина В12, в организме приводит к развитию В12-дефицитной анемии, описанной впервые в 1849 г. Аддисоном, а затем в 1872 г. – Бирмером, назвавшим ее пернициозной прогрессирующей анемией.
Касаясь этиологических факторов развития В12-дефицитной анемии, необходимо отметить возможность или недостаточного поступления его в организм, или нарушения процесса его усвоения. Как известно, суточная потребность витамина В12, для новорожденных составляет 0,5 мкг, для детей в возрасте до 1 года – 1,5 мкг, для мужчин и женщин –3 мкг, для беременных и кормящих женщин – около 4 мкг (А. Ленинджер, 1985).
В связи с тем, что витамин В12 содержится в разнообразных продуктах, алиментарная недостаточность его встречается редко, при крайнем ограничении диеты, в которой отсутствуют молоко, яйца, масло, мясо и другие продукты животного происхождения. В12-дефицитные анемии алиментарного происхождения возникают у грудных детей, находящихся на грудном вскармливании, матери которых страдали пернициозной анемией.
Таким образом, в большинстве случаев В12-дефицитные анемии обусловлены нарушением его всасывания. Принимая во внимание важную роль слизистой желудка в секреции внутреннего фактора, необходимо отметить важную роль в развитии В12-дефицитной анемии нарушений секреторной активности желудка врожденного или приобретенного характера. Наиболее частой причиной нарушения всасывания витамина В12 является атрофия слизистой желудка, при которой отсутствует секреция соляной кислоты, пепсина, внутреннего фактора. Причины развития атрофических процессов в слизистой желудка различны: они могут носить наследственный или приобретенный характер. Описана анемия у детей старше 10 лет, характеризующаяся дефицитом внутреннего фактора, гистамин устойчивой ахлоргидрией, атрофией слизистой желудка и наличием антител к внутреннему фактору. Однако в отличие от анемии взрослых у данного контингента детей старше 10 лет отмечается большая частота эндокринных расстройств, проявляющихся идиопатичеоким гипопаратиреозом, гипотиреозом, болезнью Аддисона, недостаточностью яичников. По-видимому, эти сопутствующие нарушения обусловлены генетически детерминированной тенденцией к развитию аутоиммунных заболеваний.
Во многих случаях развития В12-дефицитной анемии не удается установить ее наследственный характер. У многих больных так называемой пернициозной анемией в сыворотке крови обнаруживают антитела или против цитоплазмы париетальных клеток желудка, или против внутреннего фактора. Нарушение секреции внутреннего фактора может быть следствием воздействия на слизистую желудка различных токсических факторов экзогенной природы, а также субтотальной или тотальной резекции желудка. Нередко нарушения всасывания витамина В12 обусловлены заболеваниями кишечника также врожденного и приобретенного характера. Недостаточность всасывания витамина В12 в кишечнике отмечается после резекции терминального отдела подвздошной кишки, при тяжелом хроническом энтерите у лиц, перенесших резекцию тощей кишки, при целиакии, при тропической спру. Нарушение всасывания витамина В12, может быть связано с наличием слепой петли, анастомозов и свищей, появляющихся после оперативных вмешательств, что приводит к изменению бактериальной кишечной флоры, и, по-видимому, усилению конкурентного потребления витамина бактериями или интенсивному расщеплению в кишечнике комплекса витамин В12–внутренний фактор. Конкурентный расход витамина В12 отмечен при инвазии широким лентецом.
Таким образом, вышеизложенное позволяет выделить следующие основные этиологические и патогенетические факторы развития В12-дефицитных анемий:
1. Алиментарный фактор (при резком ограничении диеты, включающей длительное использование лишь продуктов растительного происхождения; у детей, находящихся на грудном вскармливании, матери которых страдают В12-дефицитной анемией).
2. Гастрогенный фактор (наследственная и приобретенная недостаточность внутреннего фактора – гастромукопротеина, обусловленная нарушением секреторной активности париетальных клеток желудка).
3. Энтерогенный фактор (недостаточность процессов всасывания в дистальном отделе подвздошной кишки врожденного и приобретенного характера).
4. Фактор недостаточности гематогенного транспорта врожденного и приобретенного характера.
Патогенез основных клинических проявлений В12-дефицитной анемии, гематологическая характеристика
Характерной особенностью В12-дефицитной анемии является возникновение мегалобластного типа кроветворения, когда нарушается синтез нуклеиновых кислот; созревание и дифференцировка ядра эритрокариоцитов отстают от созревания цитоплазматических структур, в частности гемоглобина. Одновременно нарушается дифференцировка и других клеток миелоидного ряда: мегакариобластов, миелобластов,cодержание эритроцитов в периферической крови резко снижено, иногда до 0,7·1012 /л, что обусловлено, с одной стороны, снижением осмотической резистентности мегалоцитов, укорочением их сроков циркуляции в периферической крови, а с другой стороны, возрастанием сроков дифференцировки клеток красной крови в костном мозге.
Количественные изменения эритроцитов периферической крови при В12-дефицитной анемии сочетаются с выраженными качественными сдвигами: анизоцитозом и пойкилоцитозом. Эритроциты имеют большие размеры– до 10–12 мкм, нередко овальную форму без центрального просветления, в цитоплазме эритроцитов обнаруживаются остатки ядерного вещества (тельца Жолли) и нуклеолеммы (кольца Кебота), базофильная пунктация. Мегалоциты избыточно насыщены гемоглобином, в связи с чем, анемия носит гиперхромный характер. Цветовой показатель может превышать 1,1–1,2. Несмотря на высокий цветовой показатель, общее содержание гемоглобина в крови резко падает в связи с эритропенией. Анемия носит гипорегенераторный характер, содержание ретикулоцитов в крови, как правило, снижено.
Нейтрофилы отличаются крупными размерами, нередко возникают гиперсегментоз, нейтропения, сдвиг лейкоцитарной формулы вправо, что свидетельствует о нарушении регенераторной активности костного мозга и в отношении элементов белой крови. Лейкопения в далеко зашедших случаях сочетается и с тромбоцитопенией. В связи с усилением гемолиза эритроцитов нередко увеличивается содержание непрямого билирубина в крови.
Клинические признаки В12-дефицитной анемии обусловлены нарушением функций кроветворного аппарата, пищеварительной и нервной системы. Помимо комплекса неспецифических симптомов, обусловленных развитием анемии и гемической гипоксии (слабости, быстрой утомляемости, сердцебиения, одышки), у больных появляются признаки глоссита, стоматита, гастрита, желтушность склер, нередко увеличение селезенки, иногда печени. Развитие воспалительного процесса в желудочно-кишечном тракте может быть не только причиной, но и следствием В12-дефицитной анемии, в частности: при недостаточности одной из коферментных форм витамина В12 – метилкобаламина, нарушается синтез тетрагидрофолиевой кислоты, тимидинмонофосфата, ДНК, а, следовательно, подавляется митотическая активность не только клеток костного мозга, но и слизисто желудочно-кишечного тракта.
Поражение нервной системы у больных с В12-дефицитной анемией связано с недостаточностью другой коферментной формы витамина –5-дезоксиаденозилкобаламина, что приводит к нарушению трансформации метилмалоновой кислоты в янтарную и избыточному ее накоплению. Метилмалоновая кислота в повышенных концентрациях обладает выраженным цитотоксическим, в частности нейротропным, действием. Поражения нервной системы при В12-дефицитной анемии характеризуются как фуникулярный миелоз, наиболее ранними признаками которого являются парестезии, атаксия, гипорефлексия, появление патологических рефлексов, развитие клонуса и комы. Иногда у больных появляются психические нарушения, бред, галлюцинации.
Всасывание фолатов в основном происходит в проксимальном отделе тощей кишки, где .всасывается до 90 % моноглутаматов и около 30 % полиглутаматов. В результате метаболических процессов в кишечном эпителии в портальную кровь поступают 5-метилтетрагидрофолаты, которые затем транспортируются к печени, костному мозгу, вступая в метаболические реакции.
Фолиевая кислота может выполнять свою метаболическую функцию, т. е. быть акцептором или донатором метиловых, формиловых и других монокарбоновых фрагментов только в восстановленном виде, занимая ключевое положение в синтезе аминокислот, нуклеиновых кислот, что особенно важно для пролиферирующих тканей и растущего детского организма.
Дефицит фолата в педиатрической практике наблюдается главным образом у недоношенных детей, при инфекциях, мальабсорбции и гемолизе.
Причинами дефицита фолата у детей могут быть респираторные инфекции, кишечные инфекции, а также алиментарный дефицит. Возникновение синдрома мальабсорбции фолата у детей и взрослых имеет место при целиакии, тропической спру, после резекции тонкой кишки, при синдроме слепой петли. Всасывание фолиевой кислоты нарушается при алкоголизме, длительном применении противосудорожных препаратов.
Таким образом, основными патогенетическими факторами фолиеводефицитной анемии являются или алиментарная недостаточность, или нарушения процессов всасывания в тонком кишечнике.
При дефиците фолиевой кислоты возникает мегалобластная анемия. В периферической крови отмечаются макроцитоз, гиперхромная анемия, ретикулоцитопения, тромбоцитопения, лейкопения. В костном мозге обнаруживаются мегалобласты. Отсутствует неврологическая симптоматика, свойственная В12-дефицитной анемии.

Мегалобластные анемии чаще всего являются следствием дефицита витамина B12 и фолата. Неэффективный гемопоэз оказывает влияние на все клеточные ростки, но в особенности на эритроидный. Диагностика, как правило, основана на данных общего анализа крови и мазка периферической крови, в которых обычно выявляют макроцитарную анемию с анизоцитозом и пойкилоцитозом, крупные эритроциты овальной формы (макроовалоциты), тельца Хауэлла-Жолли (остаточные фрагменты ядра), гиперсегментированные нейтрофилы и ретикулоцитопению. Лечение ориентировано на устранение первичного заболевания.
Мегалобласты представляют собой крупные ядерные предшественники эритроцитов с неконденсированным хроматином, вследствие нарушения синтеза ДНК. Макроцитами называют эритроциты увеличенных размеров ( т.е. величина объема эритроцитов [MCV] > 100 фл/кл). Макроцитоз может наблюдаться в ряде клинических ситуаций, не связанных с созреванием мегалобластов.
Немегалобластный макроцитоз

Макроцитоз, связанный с избыточностью мембраны эритроцитов, встречается у пациентов с хроническим заболеванием печени, когда нарушена этерификация холестерина. Макроцитоз со средним объемом эритроцитов (MCV) от 100 до 105 фл/ячейку может встречатьсяпри хроническом употреблении алкоголя при отсутствии дефицита солей фолиевойкислоты. Слабо выраженный макроцитоз может встречаться при гипопластической анемии Апластическая анемия Апластическая анемия является патологией гемопоэтических стволовых клеток, которая приводит к потере предшественников гемопоэза, гипоплазии или аплазии костного мозга и цитопениям 2 или более. Прочитайте дополнительные сведения , особенно на стадии восстановления. Макроцитоз также часто распространен при миелодисплазии Миелодиспластический синдром (МДС) Миелодиспластический синдром (МДС) представляет собой группу заболеваний, характеризующихся цитопенией в периферической крови, дисплазией гемопоэтических клеток-предшественников, гиперклеточностью. Прочитайте дополнительные сведения . Поскольку формирование мембраны эритроцитов происходит в селезенке после того как клетки высвобождаются из костного мозга, эритроциты могут быть слегка макроцитарными после спленэктомии, хотя эти изменения не связаны с анемией. Ретикулоцитоз (например, при гемолитической анемии) может быть причиной макроцитоза.

Немегалобластный макроцитоз подозревается у пациентов с макроцитарной анемией, когда при тестировании исключается дефицит витамина B12 или дефицит фолиевой кислоты. Эритроциты большого размера (макро-овалоциты) в мазке периферической крови и увеличенный показатель ширины распределения эритроцитов, типичные для классической мегабластной анемии, могут отсутствовать. Если немегалобластный макроцитоз не объясняется клиническими проявлениями (например, наличием апластической анемии Апластическая анемия Апластическая анемия является патологией гемопоэтических стволовых клеток, которая приводит к потере предшественников гемопоэза, гипоплазии или аплазии костного мозга и цитопениям 2 или более. Прочитайте дополнительные сведения , хроническим заболеванием печени или употреблением алкоголя) или при подозрении на миелодисплазию Миелодисплазия и анемия, обусловленная нарушением транспорта железа При миелодиспластическом синдроме анемия, как правило, резко выражена. Анемия обычно нормоцитарная или макроцитарная, также могут присутствовать диморфические (крупные и мелкие) популяции циркулирующих. Прочитайте дополнительные сведения , можно провести исследование костного мозга и цитогенетический анализ. При немегабластном макроцитозе, костный мозг не является мегалобластным, однако при миелодисплазии и развившемся заболевании печени присутствуют мегалобластные предшественники эритроцитов с плотным ядерным хроматином, который отличается от обычных тонких фибриллярных структур при мегалобластной анемии.
Мегалобастическая анемия - морфология, причины
Мегалобластическая анемия - это патологическое состояние, заключающееся в общем клеточном расстройстве, в основе которого лежит нарушение клеточного деления за счет заниженного синтеза нуклеиновых кислот, что, в большинстве случаев, является результатом недостаточности витамина В12 или фолиевой кислоты. В гематологическом плане это заболевание характеризуется мегалобластическим преобразованием и неэффективностью миелопоэза.
Мегалобластоз — патофизиологические рамки, морфология
Основным нарушением, обусловливающим мегалобластическую морфологию является недостаточное синтезирование ДНК (биохимическими механизмами, описанными далее). Результаты этого дефицита следующие:
а) Увеличивается межмитотическая фаза, во время которой продолжается синтез РНК и белков. Это объясняет утрату количественного равновесия между ДНК и РНК, что, в морфологическом плане проявляется изменением отношения ядро-цитоплазма в пользу последней.
г) Последствием неполноценного кроветворения является анемия, которая (под стимулирующим влиянием эритропоэтина) способствует развитию эритробластической гиперплазии (при изменении отношения Э:Г, росте клеточной костаномозговой массы и гематопоэтической преобразовании жирного костного мозга), что усиливает дефицит фолиевой кислоты или витамина В12 (за счет увеличенного расхода) и замыкает порочный круг усугублением мегалобластоза и анемии.
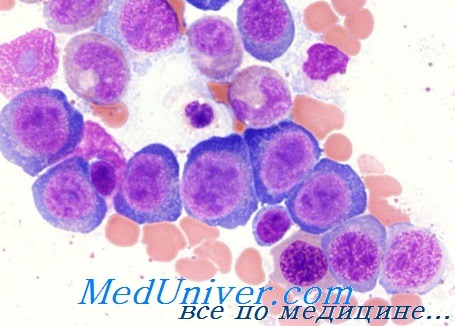
В основе количественных и качественных изменений остальных двух костномозговых рядов находятся те же нарушения, которые поражают и эритробластный ряд. Неэффективный грапулоцитопоэз поддерживается не только морфологическими альтерационными изменениями, но также повышением уровня мурамидазы в сыворотке (Perillie).
Неэффективность мегакариопоэза, отмечаемая при мегалобластной анемии, которую подсказывал контраст между ростом общей массы мегакариоцитов костного мозга и периферической тромбоцитопзнией, была подтверждена работами Harker и Finch, установивших среднюю выработку, на ядерную единицу, шести тромбоцитов вместо сорока (норма). Рост разрушения гранулоцитов и тромбоцитов на периферии — возможно путем увеличенной секвестрации селезенкой — может способствовать, в различной степени, развивающейся при этом цитопении.
Подобные клеточные альтерационные изменения наблюдаются и в других клеточных системах, в основном у тех, характерной чертой которых составляет коэффициент быстрого деления, в том числе эпителий пищеварительного тракта (в отдельных случаях и клетки зародыша, плодных придатков). В этом следует искать объяснение некоторых клинических признаков или осложнений (глоссит, затруднения пищеварения, расстройство поглощения, перинатальные осложнения и пр.).
Общим диагностическим элементом мегалобластных анемий является определение мегалобластной морфологии всех кровяных клеток костного мозга и периферической крови.
Термином мегалобласт определяются предшественники эритроцитов. В принципе мегалобласт крупнее соответствующего нормального эритробласта с измененным отношением ядро-цитоплазма в пользу последней. Ядро промегалобласта (диаметром 20—30 u) объемистое, нередко расположено эксцентрично, хроматинная структура в виде жемчужин, содержит несколько крупных ядрышек синеватой окраски; цитоплазма синего цвета, наиболее ясная зона расположена вокруг ядра, причем может сохраниться и на последующих стадиях.
На стадии базофильного мегалобласта ядро уменьшается, отсутствуют ядрышка, хроматинная структура более плотная, однако не наблюдаются характерные для базофильного нормобласта скопления, базофильность цитоплазмы станитовся более резкой. На стадии полихроматофильного мегалобласта отражен наиболее ярко асинхронизм созревания между ядром (еще крупным, с едва начинающим организоваться в виде блоков хроматинном) и цитоплазмой (растянутой, полихроматофильной, нередко с наличием телец Жолли). Диаметр оксифильного мегалобласта колеблется от 10 до 18 u, его цитоплазма полностью оксифильная и хроматинная структура ядра еще выявима.
Мегалоцит характеризуется более крупными размерами (от 12 до 14 u), отсутствием ясной центральной зоны (большей толщиной) и часто чуть овальной формой.
Происходящие в гранулоцитном ряде мегалобластические изменения отражаются в увеличенном, в принципе, размере клетки и обильности цитоплазмы. Эти признаки проявляются более четко в гигантских метамиелоцитах, имеющих крупное ядро, весьма скудную хроматинную структуру, не соответствующей форме ядра, при этом цитоплазма продолжает оставаться базофильной. Наблюдается тенденция к гиперсегментированию в результате чего образуется форма гиперсегментированных гранулоцитов (6, 8, 10 и более сегментов), хроматинная структура которых, однако, менее плотная (в отдельных случаях сегментирование частичное, в виде надреза).
Что касается этиопатогенеза мегалобластической анемии отмечаем, что значительные достижения последних двух десятилетий в изучении этого заболевания привели к выделению следующих трех основных категорий, из них первые две включают случаи, обусловливаемые недостатком витамина В12 и фолиевой кислоты (с возможным их сочетанием при определенных обстоятельствах), а третья — более редкие случаи этого заболевания, независимые от первых двух недостатков, вызываемые известными или еще неизвестными причинами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

