Макроскопические параметры это кратко
Обновлено: 05.07.2024
По современным представлениям любое макроскопическое тело или система состоят из колоссального числа микрочастиц (атомов, молекул или ионов), находящихся в непрерывном движении. Например, в 1 см 3 газа при нормальных условиях содержится около 3×10 19 молекул, а в жидких и твердых телах - порядка 10 22 молекул. Для описания состояния физических свойств таких макросистем потребуется записать очень большое число уравнений классической или квантовой физики, решить и проанализировать их, что технически представляет неосуществимую задачу. Кроме того, существуют физические причины нерациональности данного подхода. Даже если бы нам удалось описать движение каждой частицы, это не позволило бы получить информацию о поведении тела. Подход к решению таких задач должен быть иным.
Физические свойства макроскопических систем изучаются двумя взаимно дополняющими друг друга методами: статистическим и термодинамическим.
Статистический метод основан на вероятностном подходе к изучению закономерностей, возникающих в макроскопических системах микрочастиц. При достаточно большом числе частиц в системе начинают проявляться новые закономерности, называемые статистическими. Свойства системы в этом случае обусловлены не столько индивидуальными свойствами микрочастиц, сколько характером взаимодействий и средними значениями их динамических характеристик (микропараметров): средней скоростью, средней энергией и т.д. В стационарных условиях такие микропараметры, усредненные по большому числу частиц, не изменяются и могут служить объективными характеристиками состояния системы. Раздел физики, в котором с помощью статистического метода изучаются свойства макроскопических систем, называется статистической физикой. Основной задачей статистической физики является установление законов поведения вещества на основе знаний законов поведения микрочастиц (молекул, атомов, ионов, квантов и т.д.), из которых оно состоит. Статистическая физика основана на вероятностных представлениях о свойствах микрочастиц и использовании различного рода статистических распределений, важнейшими из которых являются распределения Гиббса и Больцмана.
Термодинамический метод, в котором не рассматривается внутреннее строение изучаемых тел и характер движения микрочастиц, основан на изучении различных физических явлений с помощью макропараметров и функций состояния и является по своей сути феноменологическим методом. Раздел физики, в котором макросистемы изучаются с помощью термодинамического метода, называется термодинамикой. Основная задача термодинамики, таким образом, заключается в установлении связей между физическими величинами, характеризующими состояние и изменения состояния термодинамической системы. Термодинамика основывается на двух опытных законах, а также на тепловой теореме Нернста или третьем законе термодинамики. Наряду с простотой и наглядностью термодинамический метод обладает существенным недостатком, заключающимся в том, что остается нераскрытым внутренний механизм явлений. В термодинамике, как правило, бессмысленны вопросы “почему”? Например, если мы устанавливаем термодинамическим методом, что при растяжении медный стержень охлаждается, а резиновый - нагревается, то физические механизмы этого остаются неизвестными. В то же время, статистический метод позволяет решать эту и многие другие неразрешимые в рамках термодинамического метода задачи: вывод уравнений состояния макроскопических систем, описание явлений переноса, некоторые вопросы излучения. Наконец, статистический метод дает строгое обоснование законов термодинамики и позволяет установить границы их применимости. Таким образом, термодинамический и статистический методы тесно взаимосвязаны, и поэтому имеет смысл говорить о единой статистической термодинамике. Следует отметить, однако, что сделанные в дальнейшем выводы будут справедливы только для систем, содержащих достаточно большое количество частиц.
МАКРОСКОПИЧЕСКИЕ СОСТОЯНИЯ
Макроскопические параметры.
Термодинамическая система - это макроскопическая совокупность тел (полей, частиц) способных обмениваться энергией, как между собой, так и с внешней средой. Открытой термодинамической системой называется система, обменивающаяся веществом с внешней средой. Типичным примером таких систем являются живые организмы. Закрытая термодинамическая система не может обмениваться веществом с внешней средой. Термодинамическая система называется изолированной, если она не обменивается с внешней средой ни веществом, ни энергией. Замкнутой термодинамической системой будем называть систему, не обменивающуюся энергией с внешней средой механическим путем (путем совершения механической работы). Термодинамическая система будет называться адиабатной, если она не обменивается энергией с внешней средой путем теплообмена.
Термодинамическими параметрами (макроскопическими параметрами состояния) системы называются физические величины, характеризующие состояние термодинамической системы в целом (давление, температура, объем, намагниченность, упругие напряжения, энергия и др.). Внешнимипараметрами системы называются физические величины, зависящие от положения в пространстве и различных свойств тел (например, электрических зарядов), которые являются внешними по отношению к данной системе. Например, для газа таким параметром является объем V, ибо он зависит от расположения внешних тел (стенок сосуда, внешнего давления). Внутренними параметрами системы называются физические величины, зависящие как от положения и свойств внешних тел, так и от координат и скоростей тел системы. Например, внутренними параметрами газа являются его давление и энергия.
Количество вещества можно характеризовать несколькими способами, которые тесно связаны между собой. Молекулярной массой (M) вещества называется отношение массы молекулы этого вещества к 1/12 массы атома 12 С . 1/12 массы атома 12 С называется атомной единицей массы (а.е.м.), 1а.е.м. = mед = 1,66·10 -27 кг.
Количество вещества, содержащего столько же частиц, сколько содержится атомов в 0,012 кг изотопа углерода 12 С, называется молем. Число частиц, содержащихся в одном моле вещества, называется числом Авогадро (NА ). Опытным путем найдено, что NА = 6,023·10 23 1/моль. Массу моля называютмолярной массой (m). Очевидно, что масса одной молекулы m1 = Mmед , тогда молярная масса вещества: m = Mmед NА = m1NА. Если масса произвольного количества вещества (например, газа) равна m, то количество вещества можно выразить числом молей данного вещества n = m/m.
Другим важным параметром термодинамической системы, определяющим количество вещества, является объем (V) - объем пространства, занятого термодинамической системой. Единицей измерения объема в системе СИ является кубический метр (м 3) . Молярным объемом называется величина равная Vm = V/n.
Закон Авогадро: при одинаковых условиях молярные объемы различных газов одинаковы.
Давлением называется физическая величина:
где dF^ - модуль силы, действующей перпендикулярно малому участку поверхности площадью dS, по которой она распределена.
Единицей измерения давления в системе СИ Паскаль (Па).
Под макросостоянием системы понимают любое состояние, которое задано указанием плотности, давления, температуры, энергии или других параметров, характеризующих состояние всей системы или малых частей ее, но содержащих достаточно большое число частиц. Равновесное состояние термодинамической системы - это такое состояние, при котором термодинамические параметры системы одинаковы во всех точках системы, во все моменты времени при неизменных внешних условиях. Равновесное состояние характеризуется отсутствием каких-либо потоков (энергии, вещества и т.п.). В равновесном состоянии система может пробыть сколь угодно долго. Если систему путем каких-либо внешних воздействий вывести из равновесного состояния, то она самопроизвольно переходит в равновесное состояние. Эта тенденция является важнейшей особенностью термодинамических систем.
Термодинамический метод изучает свойства тел, не вдаваясь в их микроскопическую структуру, а опираясь на фундаментальные законы ( начала термодинамики), установленные обобщением экспериментальных фактов. Состояние термодинамической системы будет равновесным, если все параметры cостояния имеют определенные значения, не изменяющиеся с течением времени.
Макроскопическое Состояние (Макросостояние) Системы
Макроскопическое Состояние (Макросостояние) Системы определяется значениями ее термодинамических параметров: давления p, температуры Т, удельного объема v, внутренней энергии U и т. п. Для определения макроскопического состояния однокомпонентной системы достаточно знать значения любых 2 независимых параметров (напр., Т и p или Т и v).
Макроскопические параметры: масса системы, объем системы, температура системы, количества вещества в системе, давление системы на внешние тела, внутренняя энергия системы.
Уравнение состояния — уравнение, связывающее между собой термодинамические (макроскопические) параметры системы, такие, как температура, давление, объём, химический потенциал и др. Уравнение состояния можно написать всегда, когда можно применять термодинамическое описание явлений. При этом реальные уравнения состояний реальных веществ могут быть крайне сложными.
Состояние термодинамического равновесия системы частиц. Тепловое движение.
Согласно опыту любая замкнутая система, состоящая из большого числа взаимодействующих частиц, с течением времени самопроизвольно переходит в особое конечное состояние, которое называется термодинамическим равновесием. Состояние термодинамического равновесия является устойчивым относительно малых возмущений как начальных условий, так и самого конечного состояния. Вывод о существовании равновесного состояния термодинамической системы иногда называют нулевым началом термодинамики. Следует отметить, что переход системы в состояние термодинамического равновесия не может быть описан только на основе законов механического движения отдельной частицы. Иными словами, временная динамика такой системы частиц в целом имеет качественные отличия от динамики отдельной частицы.
В состоянии термодинамического равновесия частицы совершают особое движение, которое называется тепловым. Тепловое движение сложных составных частиц может быть поступательным, вращательным и колебательным. Интенсивность любого теплового движения характеризуется с помощью макроскопической величины, называемой температурой. В состоянии термодинамического равновесия температура T одинакова для всех макроскопических частей системы (условие теплового равновесия), что обеспечивает отсутствие теплообмена между макроскопическими частями системы. В Международной системе единиц СИ температура измеряется в кельвинах (K).
Модель идеального газа. Температура. Давление. Уравнение Клапейрона-Менделеева.
Модель идеального газа
Абстрактная модель, отражающая существенные черты явления, аналогичная материальной точке.
1. Молекулы (или атомы) газа не имеют собственного объема, то есть рассматриваются как материальные точки.
2. Силы взаимодействия между атомами и молекулами идеального газа пренебрежимо малы. Поэтому потенциальной энергией взаимодействия можно пренебречь. Отсюда, внутренняя энергия идеального газа – сумма кинетических энергий хаотического движения всех молекул. Взаимодействие же молекул сводится к упругим столкновениям.
Справедливо для газов в разреженном состоянии. Отсюда – идеальный газ: система невзаимодействующих материальных точек.
Температура
Если два тела находятся в состоянии термодинамического равновесия, то есть не обмениваются энергией путем теплопередачи, то этим телам приписывается одинаковая температура. Температура– физическая величина, характеризующая степень нагретости тел и определяет направление передачи тепла. Если между телами происходит направленный теплообмен, то телу отдающему энергию приписывают большую температурупо сравнению с телом, получающим тепловую энергию.
В физике и технике за абсолютную шкалу температур принята шкала Кельвина, названная в честь знаменитого английского физика, лорда Кельвина.
1 К - одна из основных единиц системы СИ. Кроме того, используются и другие шкалы:
- шкала Фаренгейта (немецкий физик 1724г) – точка таяния льда 32°F, точка кипения воды 212°F.
- шкала Цельсия (шведский физик 1742г) – точка таянья льда 0°С, точка кипения воды 100°С. 0°С = 273,15 К.
Давление
Давление газа – есть следствие столкновения газовых молекул со стенками сосуда. Именно давление чаще всего является единственным сигналом присутствия газа. Находящиеся под давлением газ или жидкость действуют с некоторой силой на любую поверхность, ограничивающую их объем. В этом случае сила действует по нормали к ограничивающей объем поверхности. Давление на поверхности равно:
где ΔF–сила, действующая на поверхность площадь ΔS.
Внутреннее давление является одним и тем же во всех направлениях, и, во всем объеме независимо от формы сосуда. Этот результат называется законом Паскаля: если к некоторой части поверхности, ограничивающей газ или жидкость, приложено давление P0 , то оно одинаково передается любой части этой поверхности.
Уравнение Клапейрона-Менделеева:
Термодинамический метод изучает свойства тел, не вдаваясь в их микроскопическую структуру, а опираясь на фундаментальные законы ( начала термодинамики), установленные обобщением экспериментальных фактов. Состояние термодинамической системы будет равновесным, если все параметры cостояния имеют определенные значения, не изменяющиеся с течением времени.
Макроскопическое Состояние (Макросостояние) Системы
Макроскопическое Состояние (Макросостояние) Системы определяется значениями ее термодинамических параметров: давления p, температуры Т, удельного объема v, внутренней энергии U и т. п. Для определения макроскопического состояния однокомпонентной системы достаточно знать значения любых 2 независимых параметров (напр., Т и p или Т и v).
Макроскопические параметры: масса системы, объем системы, температура системы, количества вещества в системе, давление системы на внешние тела, внутренняя энергия системы.
Уравнение состояния — уравнение, связывающее между собой термодинамические (макроскопические) параметры системы, такие, как температура, давление, объём, химический потенциал и др. Уравнение состояния можно написать всегда, когда можно применять термодинамическое описание явлений. При этом реальные уравнения состояний реальных веществ могут быть крайне сложными.
Состояние термодинамического равновесия системы частиц. Тепловое движение.
Согласно опыту любая замкнутая система, состоящая из большого числа взаимодействующих частиц, с течением времени самопроизвольно переходит в особое конечное состояние, которое называется термодинамическим равновесием. Состояние термодинамического равновесия является устойчивым относительно малых возмущений как начальных условий, так и самого конечного состояния. Вывод о существовании равновесного состояния термодинамической системы иногда называют нулевым началом термодинамики. Следует отметить, что переход системы в состояние термодинамического равновесия не может быть описан только на основе законов механического движения отдельной частицы. Иными словами, временная динамика такой системы частиц в целом имеет качественные отличия от динамики отдельной частицы.
В состоянии термодинамического равновесия частицы совершают особое движение, которое называется тепловым. Тепловое движение сложных составных частиц может быть поступательным, вращательным и колебательным. Интенсивность любого теплового движения характеризуется с помощью макроскопической величины, называемой температурой. В состоянии термодинамического равновесия температура T одинакова для всех макроскопических частей системы (условие теплового равновесия), что обеспечивает отсутствие теплообмена между макроскопическими частями системы. В Международной системе единиц СИ температура измеряется в кельвинах (K).
Модель идеального газа. Температура. Давление. Уравнение Клапейрона-Менделеева.
Модель идеального газа
Абстрактная модель, отражающая существенные черты явления, аналогичная материальной точке.
1. Молекулы (или атомы) газа не имеют собственного объема, то есть рассматриваются как материальные точки.
2. Силы взаимодействия между атомами и молекулами идеального газа пренебрежимо малы. Поэтому потенциальной энергией взаимодействия можно пренебречь. Отсюда, внутренняя энергия идеального газа – сумма кинетических энергий хаотического движения всех молекул. Взаимодействие же молекул сводится к упругим столкновениям.
Справедливо для газов в разреженном состоянии. Отсюда – идеальный газ: система невзаимодействующих материальных точек.
Температура
Если два тела находятся в состоянии термодинамического равновесия, то есть не обмениваются энергией путем теплопередачи, то этим телам приписывается одинаковая температура. Температура– физическая величина, характеризующая степень нагретости тел и определяет направление передачи тепла. Если между телами происходит направленный теплообмен, то телу отдающему энергию приписывают большую температурупо сравнению с телом, получающим тепловую энергию.
В физике и технике за абсолютную шкалу температур принята шкала Кельвина, названная в честь знаменитого английского физика, лорда Кельвина.
1 К - одна из основных единиц системы СИ. Кроме того, используются и другие шкалы:
- шкала Фаренгейта (немецкий физик 1724г) – точка таяния льда 32°F, точка кипения воды 212°F.
- шкала Цельсия (шведский физик 1742г) – точка таянья льда 0°С, точка кипения воды 100°С. 0°С = 273,15 К.
Давление
Давление газа – есть следствие столкновения газовых молекул со стенками сосуда. Именно давление чаще всего является единственным сигналом присутствия газа. Находящиеся под давлением газ или жидкость действуют с некоторой силой на любую поверхность, ограничивающую их объем. В этом случае сила действует по нормали к ограничивающей объем поверхности. Давление на поверхности равно:
где ΔF–сила, действующая на поверхность площадь ΔS.
Внутреннее давление является одним и тем же во всех направлениях, и, во всем объеме независимо от формы сосуда. Этот результат называется законом Паскаля: если к некоторой части поверхности, ограничивающей газ или жидкость, приложено давление P0 , то оно одинаково передается любой части этой поверхности.
Уравнение Клапейрона-Менделеева:

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Макроскопические параметры F и / или р и и, а также ф и е или Я и б и аналогичные им величины, влияющие на энергию системы, а также производные от них составляют систему термодинамических переменных, с помощью которых записываются уравнения термодинамики. [4]
Макроскопические параметры F и / или р и v, а также ф и е или Н и В и аналогичные им величины, влияющие на энергию системы, а также производные от них составляют систему термодинамических переменных, с помощью которых записываются уравнения термодинамики. [5]
Макроскопические параметры растворов электролитов являются сложной функцией электрических характеристик его компонентов - растворителя и растворенного вещества. Вместе с тем для растворов электролитов характерно присутствие частиц с зарядами противоположного знака, создающих локальные электрические поля колоссальной напряженности порядка 106 в / см. Это дало основание многим исследователям при описании свойств растворов электролитов учитывать в основном свойства отдельных ионов и образуемых ими ионных атмосфер. Такой способ описания растворов электролитов получил название электростатического и наиболее ярко отражен в классической теории Дебая - Хюккеля [ 17, стр. [6]
Макроскопические параметры термодинамической системы по большей части определяются средними значениями параметров микроскопических подсистем - атомов, молекул. Температура тела определяется средней кинетической энергией составляющих его молекул, давление газа связано еще и с концентрацией молекул. [7]
Вообще макроскопическими параметрами могут быть не только функции канонических переменных, но и параметры, характеризующие распределения вероятностей микроскопических параметров. [8]
Поэтому известные макроскопические параметры газа ( давление и температуру) приходится связывать со средними значениями кинетической энергии его молекул. Так, давление Р является усредненным результатом многочисленных ударов молекул о стенки сосуда. [9]
Зависимость макроскопического параметра е от среднего макроскопического поля Е означает, что микроскопическая поляризуемость а тех или иных механизмов поляризации зависит от действующего на молекулы, атомы или ионы микроскопического поля F. F) сложно, так как зависимость F ( E) определяется конкретной структурой тех или иных диэлектриков и может быть весьма различной. [10]
Значения макроскопического параметра Грюнайзена , определенные с помощью соотношений ( III. Как указывалось в разд. [11]
Для макроскопических параметров системы можно ввести характерное время - время, за которое в системе происходят заметные изменения. Изменения функций Fs определяются характерным микроскопическим временем, которое много меньше характерного времени макроскопических процессов. [12]
Из многочисленных макроскопических параметров термодинамической системы можно выбрать несколько, которыми однозначно определяется ее состояние. Сколько параметров однозначно определяет состояние системы и какие именно-это зависит от рода системы и внешних воздействий. [13]
Не все макроскопические параметры системы независимы. Говорят, что / есть число степеней свободы макроскопической системы, если она описывается / независимыми параметрами. Среди разнообразных связей между характеристиками системы важное место занимают уравнения состояния. Так называется любая зависимость равновесного внутреннего параметра от внешних параметров и температуры. Различают термические уравнения состояния, если задана обобщенная сила Л как функция от X и Т, и калорическое уравнение состояния, если внутренним параметром является энергия. [14]
Однако неизменность макроскопических параметров может сохраняться на интервалах времени, много больших, чем времена релаксации макроскопических приборов. Это значит, что не очень отличаются друг от друга и усредненные характеристики разных множеств микросостояний, проходимых системой за то же время релаксации, но в разные моменты. [15]
Любое макроскопическое тело или группа макроскопических тел называется термодинамической системой (от греч. systema — целое, составленное из частей).
Величины, характеризующие состояние термодинамической системы без учета молекулярного строения тел, называют макроскопическими (или термодинамическими) параметрами. Макроскопические параметры не исчерпываются объемом, давлением и температурой. Например, для смеси газов нужно знать концентрации отдельных компонентов смеси. Если вещество находится в электрическом или магнитном поле, то необходимо задать характеристики этих полей в веществе.
В то же время форма сосуда, в котором находится газ, не является существенной для определения его состояния. Например, кислород в сосуде, изображенном на рисунке 3.1, а, будет находиться точно в таком же состоянии, в каком и кислород в сосуде другой формы (рис. 3.1, б), если объемы сосудов, массы и температуры газов одинаковы. В частности, давления газов в обоих сосудах равны. Не зависит от формы сосуда сжимаемость газа и его другие свойства.
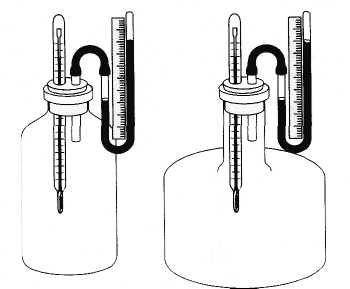
Давление газа в молекулярно-кинетической теории
На примере давления газа выясним, какой смысл имеют макроскопические параметры с молекулярно-кинетической точки зрения.
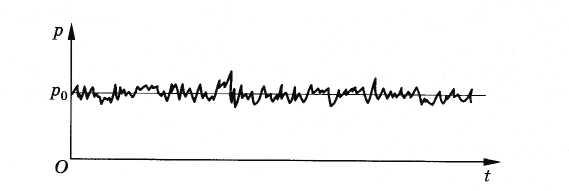
Пусть газ находится в закрытом сосуде. Манометр показывает давление газа р0. Как возникает это давление? Каждая молекула газа, ударяясь о стенку, в течение малого промежутка времени действует на нее с определенной силой. В результате беспорядочных ударов о стенку сила, действующая со стороны всех молекул на поверхность стенки единичной площади, т. е. давление, будет быстро меняться со временем примерно так, как показано на рисунке 3.2. Однако действия, вызванные ударами отдельных молекул, настолько слабы, что манометром они не регистрируются. Манометр фиксирует среднюю по времени силу, действующую на каждую единицу площади поверхности его чувствительного элемента — мембраны. Несмотря на небольшие изменения давления, среднее значение давления р0 практически оказывается вполне определенным, так как ударов о стенку очень много, а массы молекул очень малы.
Состояние термодинамической системы характеризуется макроскопическими параметрами — объемом, давлением и температурой.
§ 3.2. Температура. Тепловое равновесие
Субъективные представления о температуре
В геометрии вводят одну основную величину — длину. Остальные величины: площадь и объем — производные. В кинематике добавляют еще одну величину — время. Скорость, ускорение являются производными. В динамике еще одной основной величиной становится масса. В теории тепловых явлений единственная новая основная величина, которую надо ввести, — это температура.
В коже нашего тела, кроме чувствительных приемников, реагирующих на прикосновение, давление и болевые раздражения, есть приемники, реагирующие на раздражение ощущением тепла и холода. Руководствуясь этим, можно все тела расположить в ряд по их способности вызывать ощущения тепла и холода. Причину способности тел по-разному воздействовать на органы чувств можно связать с различной степенью нагретости тел — температурой. Это только качественное, субъективное определение температуры, не содержащее указаний на способ ее измерения. В отличие от измерения длины, времени, массы и т. д. прошло длительное время, прежде чем на смену субъективным впечатлениям о температуре пришли точные и единые методы ее измерения. Развитие методов измерения температуры стало возможным лишь тогда, когда была установлена зависимость от температуры таких величин, как длина, объем и т. д., которые можно измерять непосредственно.
Читайте также:

