Крекинг алканов кратко и понятно
Обновлено: 02.07.2024
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения.
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование.
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:

Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:

| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан: |
Бромирование протекает более медленно и избирательно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:

Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:

Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:

1.2. Нитрование алканов.
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
2. Реакции разложения.
2.1. Дегидрирование и дегидроциклизация.
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, п ри дегидрировании этана образуются этилен или ацетилен:  |
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:

Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:

Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:

Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:


Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:

2.2. Пиролиз (дегидрирование) метана .
При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ:


Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг.
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов.
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение.
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
Уравнение сгорания алканов в общем виде:
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
Эта реакция используется для получения сажи.
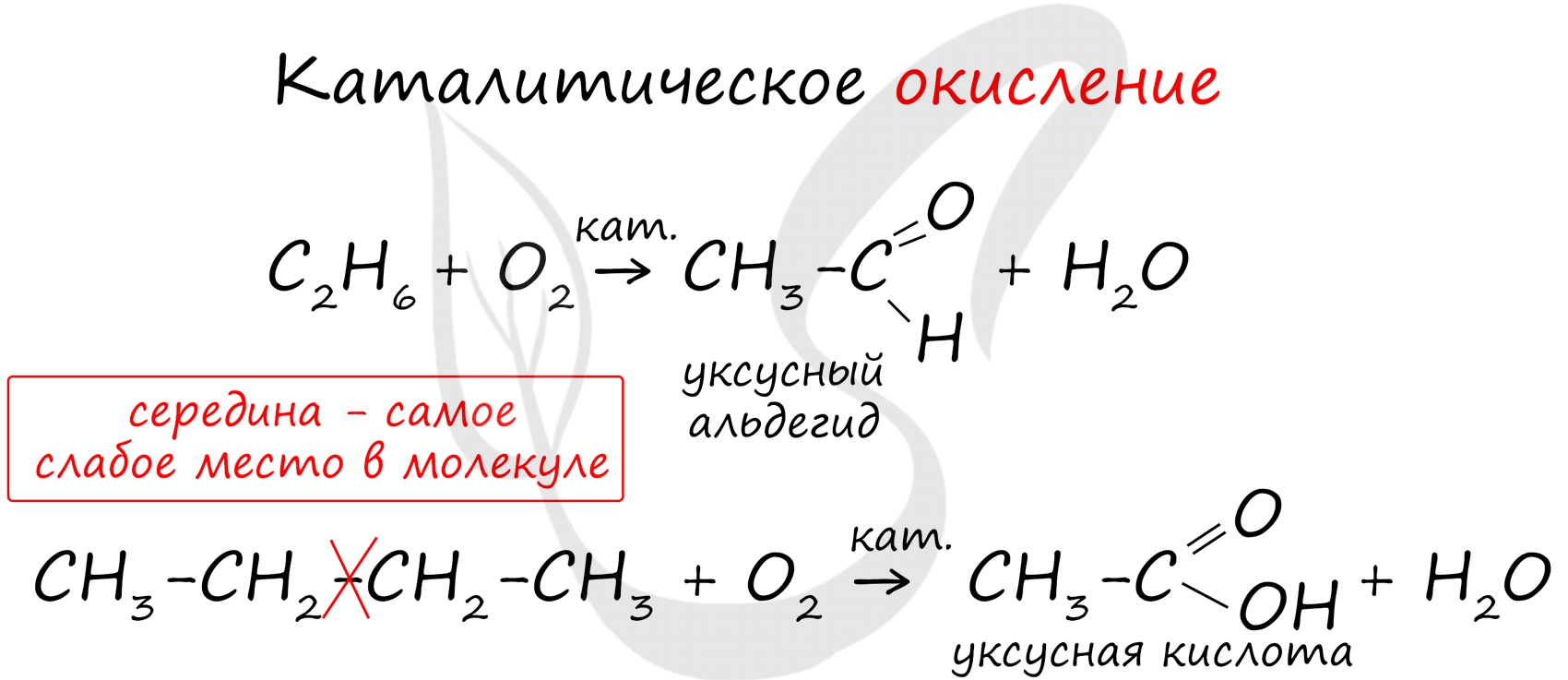
3.2. Каталитическое окисление.
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:

- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:

- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.

4. Изомеризация алканов.
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
Мы приступаем к новому разделу - органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций ;)
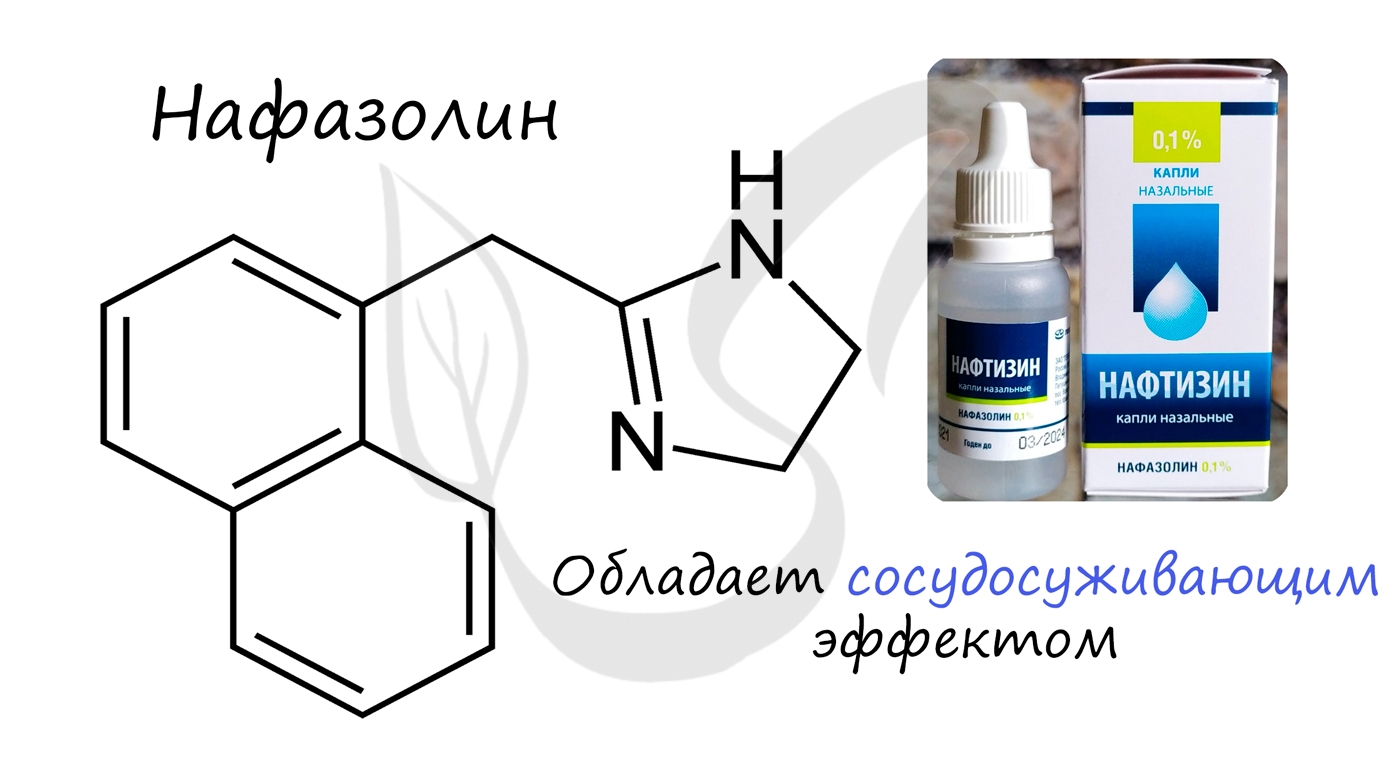
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает химическое строение.
- Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его свойствах.
- Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

Алканы (парафины) - насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями - содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда - CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen - имя + calare - созывать) - совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса "ан": метан, этан, пропан, бутан и т.д.
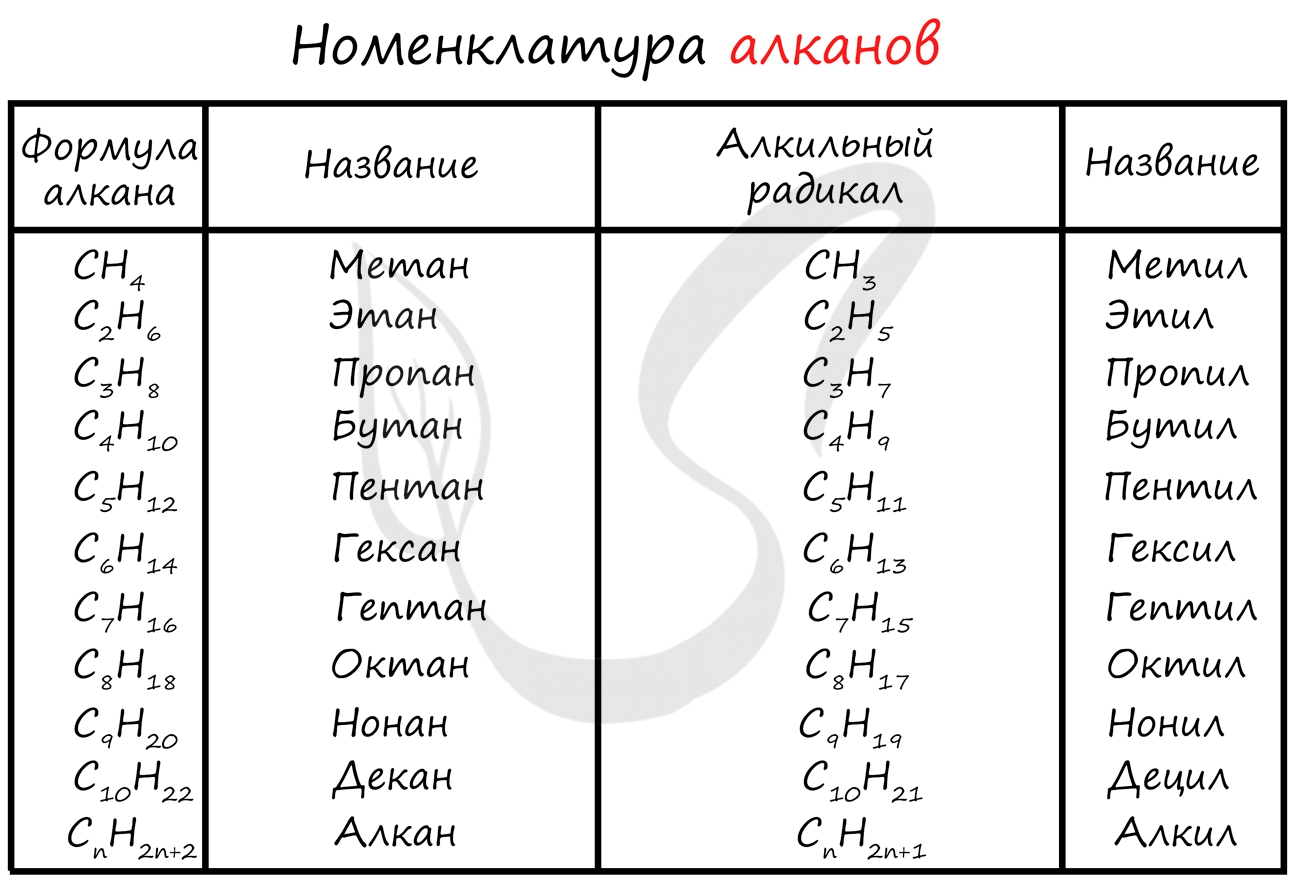
Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos - соответственный).
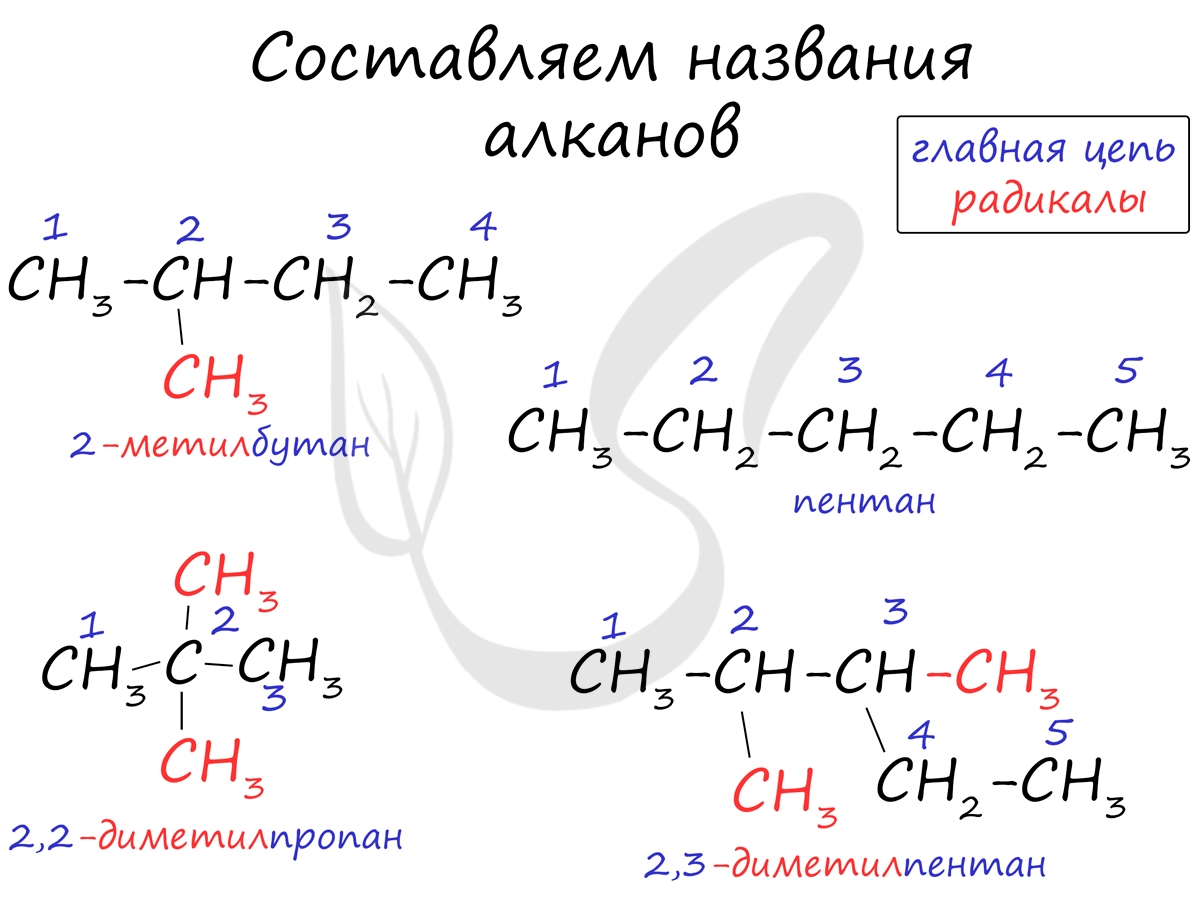
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
- Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.

Изомерами (греч. isomeros - составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
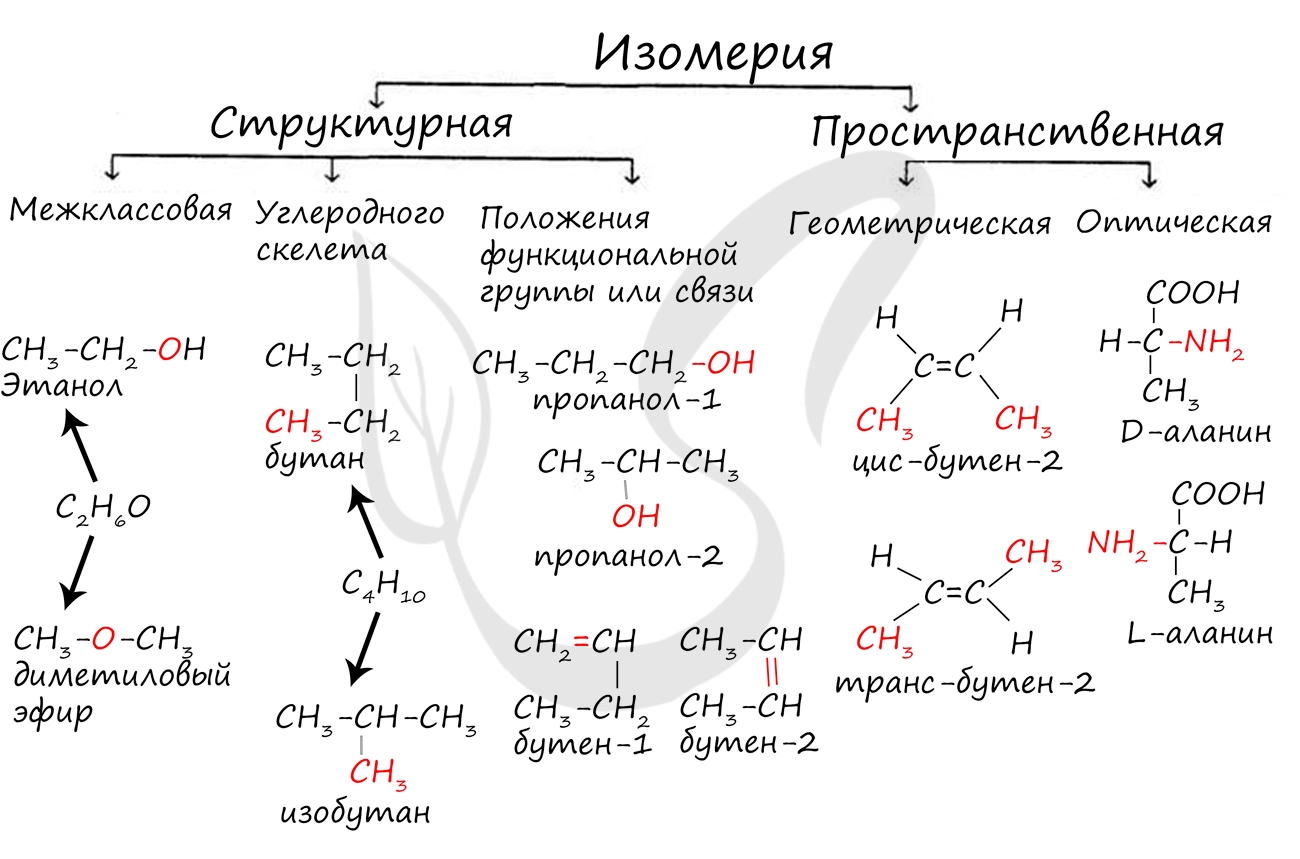
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.

- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода - sp 3
- Валентный угол (между химическими связями) составляет 109°28'

Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.

Получение алканов
В ходе крекинга нефти получается один алкан и один алкен.
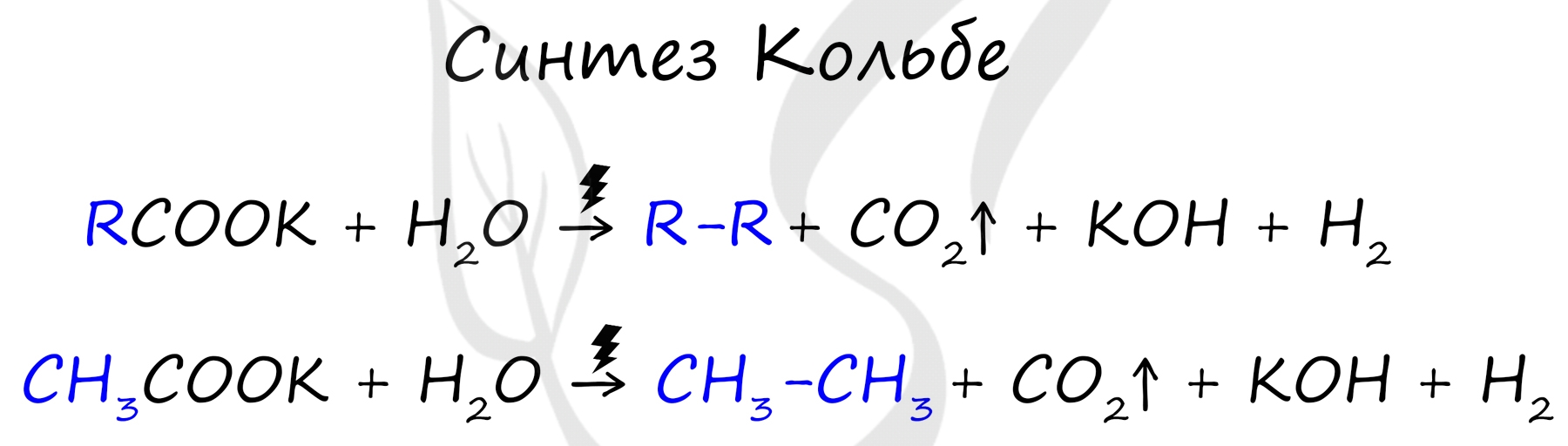
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.

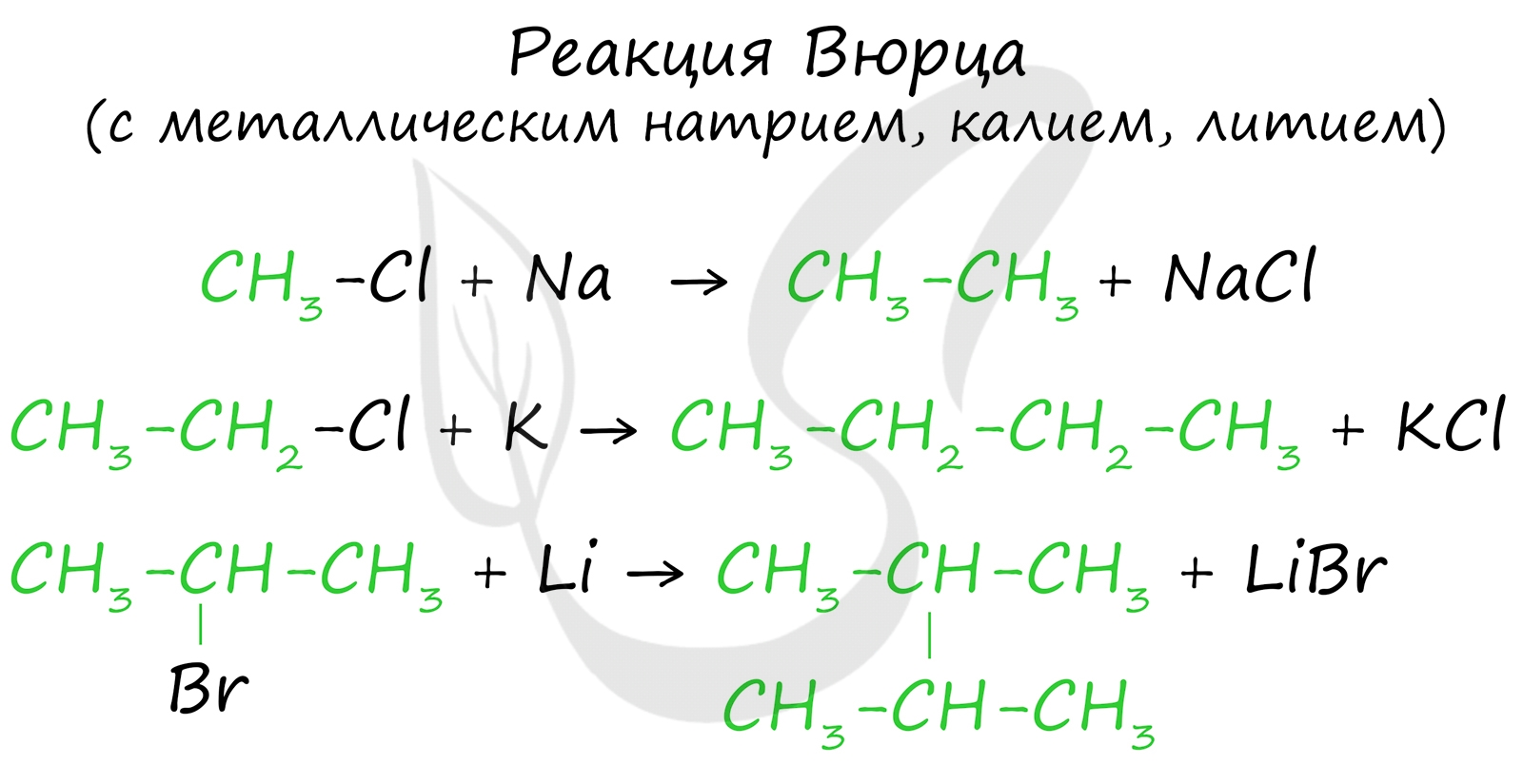
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
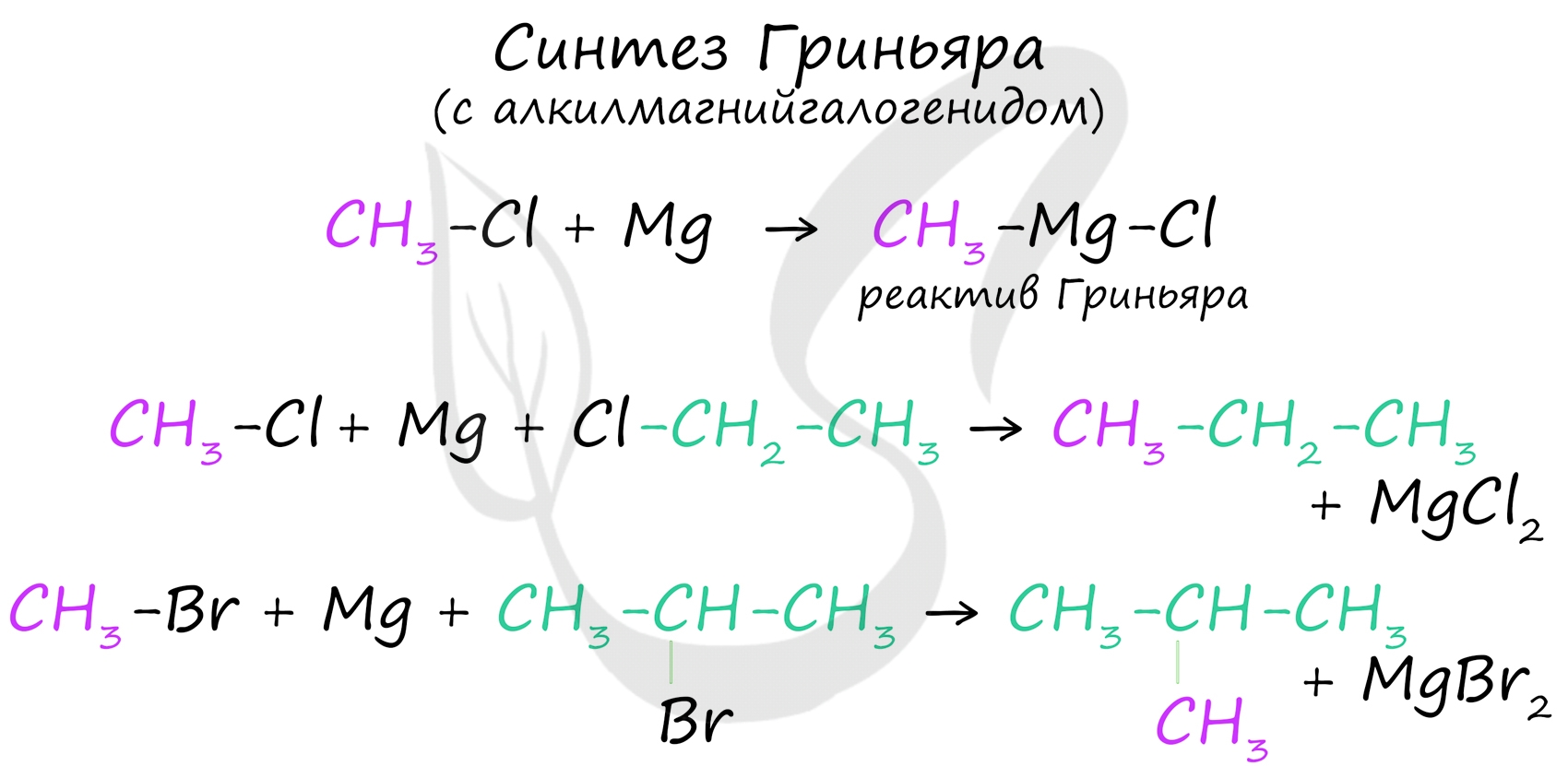
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.

В результате электролиза солей карбоновых кислот может происходить образование алканов.
В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Химические свойства алканов
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее - у вторичного и значительно труднее - у первичного.

Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.

Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Для удобства и более глубокого понимания, азотную кислоту - HNO3 - можно представить как HO-NO2.

Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
Пиролиз (греч. πῦρ - огонь + λύσις - разложение) - термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения - в отсутствии кислорода.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.

Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Крекингом называется термическое превращение алканов при температурах 470-540 $<>^\circ$С.
При более высоких температурах (700-1000 $<>^\circ$ С) алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов. Энергия углерод-углеродных связей в алканах близки по величине для первичных, вторичный, третичных и четвертичных атомов углерода (табл. 1) и в жестких условиях пиролиза расщепление любой связи $CH_2 - CH_2$ в нормальных алканах равновероятно.

Для разветвленных углеводородов преимущественно происходит разрыв связи у третичного или четвертичного атома углерода.
Виды и особенности крекинга
Различают термическое и каталитический крекинг. Главным объектом при крекинге является расщепление (деструкция) углеродной цепи по связям С-С с одновременным дегидрированием, изомеризацией и циклизацией. При этом образуются главным образом ненасыщенные углеводороды. Строение продуктов крекинга определяется:
- природой исходного алкана
- условиями проведения процесса (температурой, давлением, природой катализатора).
Начальная температура крекинга алканов зависит от их моле кулярный массы. Чем больше молекулярная масса, тем легче расщепляются алканы. В зависимости от длины углеродной цепи относительная скорость крекинга, например по отношению к пентана, равна:
- Количество атомов углерода 5, 6, 7, 8, 10, 20
- Относительная скорость крекинга 1, 4, 9, 10, 32, 120
Существуют такие тенденции разрыва связи С-С: с повышением температуры наблюдается смещение места разрыва к краю молекулы, с повышением давления углеродная цепь расщепляется ближе к середине. Так, из бутана при различных условиях могут образовываться следующие соединения:
Готовые работы на аналогичную тему

Рисунок 2. Виды и особенности крекинга. Автор24 — интернет-биржа студенческих работ
Термический крекинг
Термический крекинг - свободнорадикальное процесс, в результате которого образуются главным образом ненасыщенные углеводороды (мономеры). При температурах 450-550 $<>^\circ$С алканы расщепляются на свободные радикалы, способны дальше распадаться на более простые метильные и этильные радикалы, например:

Рисунок 3. Термический крекинг. Автор24 — интернет-биржа студенческих работ
Активные метильные радикалы отщепляют атомы водорода от молекул других алканов с образованием новых свободных радикалов:

Рисунок 4. Термический крекинг. Автор24 — интернет-биржа студенческих работ
Для таких свободных радикалов при крекинге наиболее характерные реакции, которые в целом формируют природу конечных продуктов, а именно:
Реакции $\beta $-распада:


Реакции обрыва (рекомбинации):

$\beta $-Распад и диспропорционирование свободных радикалов практически всегда проходят по $\beta $-связям относительно неспаренного электрона. Это происходит потому, что $\beta $-связь в известной степени разрыхлена вследствие уменьшения степени перекрывания соответствующих атомных орбиталей. Электронные облака таких $\sigma $-связей С-Н взаимодействуют с неспаренным электроном благодаря эффекту гиперконьюгации ($\sigma $-р-сопряжению).
В условиях пиролиза (высокие температуры) наблюдается глубокий распад алканов с образованием ацетиленовых углеводородов, сажи или кокса, водорода и др.
Каталитический крекинг
Каталитический крекинг применяют главным образом с целью получения разветвленных алканов (моторного топлива) и ненасыщенных углеводородов. В промышленных условиях процесс проходит в присутствии алюмосиликатных катализаторов или кислот Льюиса при 450-530 $<>^\circ$С и примерно атмосферном давлении. Реакция начинается с отщепления гидрид-иона от алкана с образованием карбокатионов, которые благодаря $\beta $-распаду притерпевают дальнейшие изменения:

Рисунок 8. Каталитический крекинг. Автор24 — интернет-биржа студенческих работ
Параллельно процессу образования олефинов происходит реакция изомеризации, которая чрезвычайно важна для получения разветвленных алканов, особенно изобутана и изопентана.
Изомеризация алканов в присутствии сильных кислот Льюиса или суперкислот проходит с образованием карбокатионов. Сильная кислота необходима потому, что алканы проявляют малое родство с протоном, поскольку не содержат $\pi $- или n-электронов.
Сначала образуется протонированный алкан с трицентровой двуэлектронной связью у атома углерода, по месту условного присоединения протона, поскольку конкретное место присоединения, как правило, неизвестно. Протонованый алкан быстро превращается в карбокатион, которые путем гидридного и метиланионного перемещений изомеризуются в третичные карбокатионы, то есть в разветвленные алканы:

Рисунок 9. Каталитический крекинг. Автор24 — интернет-биржа студенческих работ
Образованные с помощью каталитического крекинга разветвленные алканы - ценные высокооктановые бензины и сырье для получения каучуков.
Алканы в топливе
В двигателе внутреннего сгорания при сжатии бензиновой паров с воздухом алканы нормального строения образуют перекиси, которые вызывают преждевременное возгорание углеводородной смеси. Это явление называется детонацией и наносит вред двигателю.
Разветвленные алканы лишены этого недостатка. Ценные углеводороды с неоструктурой или структурой, подобной структуре изооктана (последнему условно присвоено октановое число 100, а для н-гептана октановое число составляет 0):

Рисунок 10. Алканы в топливе. Автор24 — интернет-биржа студенческих работ
Итак, если бензин имеет марку, например, 76, то это означает, что ему соответствует октановое число 76 и он проявляет такую же детонационную стойкость, как смесь 76\% изооктана и 24\% н-гептана. Выше октановое число (130> имеет 2,2,3-триметилбутан (триптан).
Топливо для дизельных двигателей характеризуется другим показателем - цетановым числом. Ценные топлива при этом, наоборот, состоят из алканов нормального, неразветвленного строения. Стандартом для дизельного топлива принят цетан $C_H_$ (цетановое число 100).
Дегидрирование алканов служит основным источником алкенов в промышленности. Процесс проводят при высокой температуре (до 450 °С). В качестве катализатора применяют специальным образом приготовленный триоксид хрома. Из этана так получают этилен, из н-бутана – бутилены, а из изобутана – изобутилены.
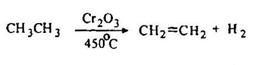
Крекинг алканов проводят при более высокой температуре. Этот процесс протекает менее однозначно с образованием целой гаммы продуктов.
Дегалогенирование вицинальных дигалогеналканов цинковой пылью в водно-спиртовом или уксуснокислом растворе
Дегидратация спиртов (реакция элиминирования)
Наиболее обычным способом получения олефинов в лабораторных условиях является дегидратация (отщепление воды) спиртов. Отщепление воды от спиртов проводят нагреванием спирта при высокой температуре в присутствии сильных минеральных кислот (H2SO4, H3PO4). При этом сначала образуется сложный эфир, который распадаясь наряду с этиленом дает молекулу кислоты. Дегидратацию этанола ведут при 180 °С.
Дегидратацию гомологов этанола ведут при более низкой температуре. Если возможно получение нескольких изомеров, то преимущественно образуется более замещенный алкен.
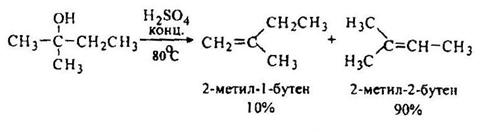
В процессе гидратации часто происходит перемещение двойной связи и строение полученного углеводорода не отвечает строению исходного спирта. Так, например, при дегидратации изоамилового спирта обычно получаются три углеводорода
Легкость дегидратации спиртов:
третичные > вторичные > первичные.
По другому способу пары спирта пропускают над твердым катализатором (Al2O3, оксиды тория или вольфрама). Температура реакции составляет 300-350 °С, а выход алкена приближается к теоретическому.
Дегидратацией спиртов получают также и циклоалкены: например, из циклогексанола получают циклогексен.
Дегидрирование алканов служит основным источником алкенов в промышленности. Процесс проводят при высокой температуре (до 450 °С). В качестве катализатора применяют специальным образом приготовленный триоксид хрома. Из этана так получают этилен, из н-бутана – бутилены, а из изобутана – изобутилены.
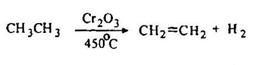
Крекинг алканов проводят при более высокой температуре. Этот процесс протекает менее однозначно с образованием целой гаммы продуктов.
Дегалогенирование вицинальных дигалогеналканов цинковой пылью в водно-спиртовом или уксуснокислом растворе
Дегидратация спиртов (реакция элиминирования)
Наиболее обычным способом получения олефинов в лабораторных условиях является дегидратация (отщепление воды) спиртов. Отщепление воды от спиртов проводят нагреванием спирта при высокой температуре в присутствии сильных минеральных кислот (H2SO4, H3PO4). При этом сначала образуется сложный эфир, который распадаясь наряду с этиленом дает молекулу кислоты. Дегидратацию этанола ведут при 180 °С.
Дегидратацию гомологов этанола ведут при более низкой температуре. Если возможно получение нескольких изомеров, то преимущественно образуется более замещенный алкен.

В процессе гидратации часто происходит перемещение двойной связи и строение полученного углеводорода не отвечает строению исходного спирта. Так, например, при дегидратации изоамилового спирта обычно получаются три углеводорода
Легкость дегидратации спиртов:
третичные > вторичные > первичные.
По другому способу пары спирта пропускают над твердым катализатором (Al2O3, оксиды тория или вольфрама). Температура реакции составляет 300-350 °С, а выход алкена приближается к теоретическому.
Дегидратацией спиртов получают также и циклоалкены: например, из циклогексанола получают циклогексен.
Читайте также:

