Комплексонометрическое титрование это кратко
Обновлено: 30.06.2024
Одним из методов комплексообразования, получившим большое распространение в титриметрии, является комплексонометрия. В ее основе лежит образование прочных растворимых комплексов (хелатов) при взаимодействии ионов металлов с производными аминополикарбоновых кислот (комплексонами).
Из большого числа комплексонов в титриметрическом анализе особенно широко используется этилендиаминтетрауксусная кислота (H4Y). Сама кислота малорастворима в воде, поэтому применяют ее двунатриевую соль (ЭДТА), растворимость которой достаточно велика. ЭДТА количественно и стехиометрично реагирует с ионами металлов. Сухой препарат ЭДТА просто получить в чистом виде, а его раствор устойчив в течение длительного времени. ЭДТА обычно приготавливается как раствор вторичного стандарта из дигидрата двунатриевой соли этилендиаминтетрауксусной кислоты, который может содержать 0,3 %-й избыток влаги по отношению к указанной стехиометрии.
Молекула Н4Y содержит четыре способных к диссоциации атома водорода – два относительно сильнокислотных и два слабокислотных (рК1а = 2,00; рК2а = 2,67; рК3а = 6,16; рК4а = 10,26). В результате, рН среды оказывает сильное влияние на состоя
ние H4Y в растворе, а, следовательно, и на полноту комплексообразования ЭДТА с металлами.
Будучи полидентатным лигандом, этилендиаминтетраацетат-ион с ионами практически всех металлов дает прочные комплексы состава 1 : 1 независимо от заряда катиона. ЭДТА может действовать как четырех-, пяти- и шестидентатный лиганд, так как кроме четырех карбоксильных групп –СОО - содержит два атома азота, каждый из которых имеет неподеленную пару электронов. Например, строение комплекса М(II)Y 2- с координационным числом четыре (КЧ = 4) можно схематично изобразить следующим образом:
Образование комплексов ЭДТА с металлами в зависимости от рН среды описывается уравнениями:
Константы устойчивости (КМY) комплексов металлов с ЭДТА, приведенные в справочниках, относятся к равновесию:
Вследствие того, что полнота комплексообразования сильно зависит от кислотности среды, комплексонометрические титрования проводят обычно при постоянном рН. Часто процесс титрования осложняется осаждением части определяемого иона в виде основных оксидов и гидроксидов при рН, необходимом для проведения титрования. Чтобы этого избежать, необходимо ввести вспомогательный комплексообразующий реагент. Определения, которые необходимо вести в слабощелочной среде, обычно проводят в аммиачных буферах с подходящим значением рН и необходимой концентрацией комплексообразователя – аммиака.
При расчетах в комплексонометрии нужно пользоваться условными константами устойчивости (K”MY), учитывающими протекание в растворе конкурирующих реакций: комплексообразования иона металла с компонентами буфера и протонизации этилендиаминтетраацетат-иона:
где aм – доля металла, незакомплексованного с компонентами буфера и другими лигандами; aY – доля депротонированного реагента Y 4- ; [M’] – суммарная равновесная концентрация всех присутствующих в растворе форм металла за исключением комплексов металла с ЭДТА; [Y’]- суммарная равновесная концентрация всех присутствующих в растворе форм ЭДТА за исключением комплексов ЭДТА с металлом.
Доля металла, незакомплексованного с компонентами буфера и другими лигандами определяется по формуле:
а доля депротонированного реагента Y 4- - по формуле:
Доля депротонированного реагента aY (табл. 8.1) зависит от значения рН и констант диссоциации H4Y:
Величины aY для H4Y в растворах с различными значениями рН
Доля металла aM является обратной величиной функции Ледена (Фм).

Функция Ледена учитывает образование комплексов металла с компонентами буфера (например, в аммиачном буфере с аммиаком и гидроксид-ионами) и другими лигандами, которые могут присутствовать в растворе (например, маскирующие реагенты):
где bi, bj – общие константы устойчивости комплексов с лигандами L и ОН - .
Если в условиях титрования aМ=1, то условная константа образования комплекса металла с ЭДТА обозначается K’MY и равна
Кривые комплексонометрического титрования строят в координатах рМ – D. Размер интервала, внутри которого происходит резкое изменение рМ, и положение точки эквивалентности определяются значением условной константы устойчивости комплекса металла с ЭДТА, концентрациями титруемого вещества и титранта.
Все дальнейшие расчеты будем рассматривать для случая равных аналитических концентраций титруемого вещества и титранта (с0), с учетом разбавления растворов.
На ход кривой комплексонометрического титрования до точки эквивалентности (D 1). Чем кислее среда, тем меньше aY и К"MY, соответственно, меньше скачок титрования:
Оба фактора определяют положение точки эквивалентности. Для точки эквивалентности можно записать следующие равенства:
Подставляя концентрации в условную константу, получаем
Рассмотрим, каково должно быть значение К"MY в условиях титрования, чтобы погрешность за счет неполноты связывания металла в комплекс с ЭДТА в точке эквивалентности была меньше 0,1 %. Пусть 99,9 % от исходного количества металла перешло в комплексонат в точке эквивалентности. Тогда имеем:
Подставляя концентрации в выражение для условной константы, получим, что она должна удовлетворять условию:
Таким образом, при титровании 0,010 М растворов ошибка титрования за счет неполного протекания реакции не превышает 0,1 %, если значения условных констант устойчивости комплексов металлов с ЭДТА больше 2 · 10 8 .
Конечную точку титрования в комплексонометрии устанавливают с помощью металлохромных индикаторов. Металлохромные индикаторы – это вещества, которые образуют с ионами титруемых металлов достаточно прочные растворимые комплексные соединения, отличающиеся по окраске от цвета свободного индикатора и менее устойчивые, чем комплексы металлов с ЭДТА.
Большинство металлоиндикаторов обладает способностью присоединять протоны и образовывать соединения, окрашенные почти так же, как и комплексы металлов. Поэтому они являются кислотно-основными индикаторами и пригодны в качестве металлоиндикаторов только в той области рН, где конкурирующая реакция с участием протонов отсутствует.
Таким образом, в конечной точке титрования происходит разрушение окрашенных комплексов металла с индикатором с образованием бесцветных комплексов металла с ЭДТА и высвобождением имеющего другую окраску свободного индикатора.
Процесс комплексообразования иона металла с индикатором характеризуется константой устойчивости (КМInd). При расчетах в комплексонометрии в случае присутствия посторонних комплексообразователей или лигандов следует пользоваться условными константами устойчивости. По определению, условная константа устойчивости комплекса металла с индикатором равна:
где aInd – доля депротонированного индикатора Ind m - , [Ind’] – суммарная равновесная концентрация всех присутствующих в растворе форм индикатора за исключением комплексов индикатора с металлом.
Если в условиях титрования aM = 1, то пользуются условной константой устойчивости комплекса металла с индикатором:
Для того чтобы правильно фиксировать точку эквивалентности, нужно брать такой индикатор, у которого интервал изменения окраски попадает в интервал резкого изменения рМ титруемого раствора. Подобрать индикатор и рассчитать индикаторную ошибку титрования в каждом конкретном случае можно, только построив теоретическую кривую титрования.
При правильно выбранном индикаторе, когда конец титрования практически совпадает с точкой эквивалентности, даже при относительно невысоких значениях условных констант образования комплексов металла с ЭДТА (lgК"MY ³ 6) можно получить вполне приемлемые результаты. И, наоборот, при неудачно выбранном индикаторе даже при образовании очень прочных комплексов металлов с ЭДТА результаты могут оказаться неудовлетворительными.
Рассмотрим, как правильно выбрать индикатор. Пусть изменение цвета титруемого раствора происходит, когда 50 % исходного количества комплексов металла с индикатором разрушилось, т.е. [МInd]к.т = [Ind’]к.т. В этом случае концентрация металла в конечной точке титрования равна:
Пусть конечная точка титрования совпадает с точкой эквивалентности, т.е. [М n+ ]к.т = [М n+ ]т.экв. Подставляя в формулу (8.2) вместо концентраций металла выражения для их расчета, получим:
Конечная точка титрования будет совпадать с точкой эквивалентности, если взять индикатор, для которого в условиях титрования К”Мind удовлетворяет равенству
Например, если с0 = 0,010М и K”MY = 2 · 10 8 (что соответствует 99,9 % связыванию металла в комплекс с ЭДТА в точке эквивалентности), то индикатор будет менять окраску в точке эквивалентности, если K”MInd=2 · 10 3 .

Титратор для комплексонометрического титрования. GT-200
Чтобы унифицировать получаемые результаты анализа и избежать индикаторной ошибки рекомендуется применять автоматизированные установки. Они позволят выполнять анализ в строго контролируемых одинаковых условиях, фотометрически детектируя смену окраса раствора.
Основной блок – потенциометрический титратор GT-200 – управляется либо встроенным программным обеспечением, либо с помощью WINDOWS-совместимого ПО. Он производит все расчетные операции и сохраняет необходимые данные (концентрации, объемы, статистику и пр.) в памяти.
Бюретка для титрования GT-200BRT – предназначена для дозирования и титрования растворов. Можно задавать шаг, скорость, последовательность дозирования.
Фотометрический датчик GT-LDII – имеет встроенный детектор, вырабатывающий фототок при определенной длине волны. При смене окраса раствора длина волны меняется, изменяя фототок. В процессе подачи титранта объем поданного раствора можно зафиксировать до смены окраса индикатора и после.
Мешалка GT-200STR – позволяет производить контролируемое и повторяемое перемешивание пробы.
Это основные элементы автоматической системы для фотометрического титрования на базе потенциометрического титратора GT-200. Дополнительно к ним можно добавить устройства для автоматической подачи образцов, принтер для распечатки результатов, весы с возможностью передачи веса образца сразу в прибор и другие полезные модули.
Сущность комплексонометрического титрования
Комплексонометрическое титрование – это титриметрический метод анализа, основанный на взаимодействии определяемых ионов металла с комплексонами. Чаще всего в роли комплексообразователя выступает динатриевая соль этилендиаминтетрауксусной кислоты (другие названия: Трилон Б, ЭДТА), которая в большинстве случаев образует комплексы с катионами металлов в молярном соотношении 1:1, что упрощает расчет концентраций определяемых элементов.
Устойчивые комплексы с ЭДТА большинство металлов образуют в щелочной среде, для этого к раствору с анализируемым образцом добавляют аммиачный буфер, но некоторые элементы, например, железо (Fe III), можно титровать и в кислой среде.
Основные требования к комплексообразующему реагенту:
Образования устойчивых комплексов с катионами металлов в известном молярном соотношении.
Хорошая растворимость образуемых комплексов в воде.
Образующиеся комплексы не должны быть окрашены.
Взаимодействие комплексона с противоионом должно происходить быстро и количественно
Всем этим требованиям, в большинстве случаев, удовлетворяет Трилон Б.
Индикатор подбирают в зависимости от титруемого элемента и исходя из типа титрования.
Как уже упоминалось ранее, pH среды существенно влияет на устойчивость образующихся комплексов, что видно при построении кривой комплексонометрического титрования ионов кальция, представленной ниже:
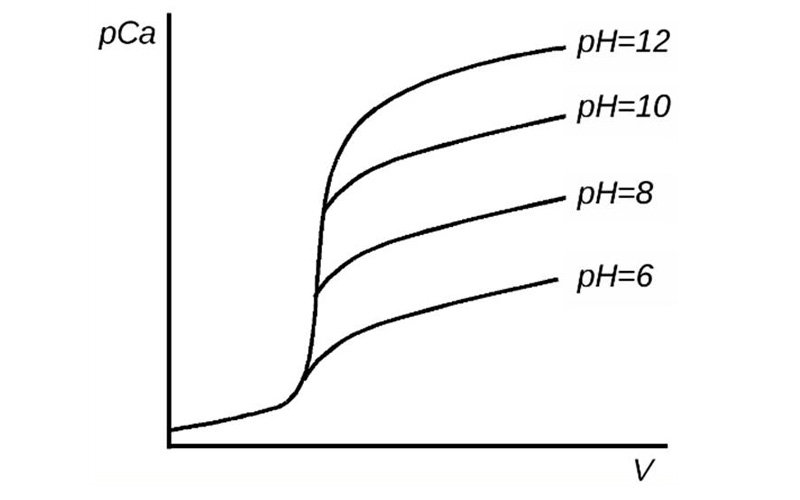
Рис.1 Кривая титрования [Ca 2+ ] трилоном Б при различных значениях pH.
Из кривых титрования видно, что при более высоком pH величина ΔpCa больше (высокий скачок), что позволяет точней идентифицировать точку эквивалентности.
Классификация методов комплексонометрического титрования
Как и большинство титриметрических методов, комплексонометрию можно проводить прямым, обратным или заместительным титрованием.
В случае прямого титрования первоначальное окрашивание раствора вызвано взаимодействием индикатора с металлом. В дальнейшем сильный комплексообразователь трилон Б вытесняет индикатор, образуя с металлом более устойчивый комплекс. В ходе этого взаимодействия наблюдается смена цветности раствора. Титрант добавляется до получения устойчивого окраса, что говорит о присутствии в растворе свободного Трилона Б.
Обратный метод титрования подразумевает добавление избытка комплексона к раствору. Непрореагировавшую часть ЭДТА оттитровывают солью цинка или магния. Зная первоначально добавленный объем ЭДТА и вычтя из него количество оттитрованного избытка, можно вычислить содержание металла, вступившего во взаимодействие с комплексоном. Этот способ предпочтителен для элементов, которые медленно взаимодействуют с Трилоном Б, для которых сложно подобрать индикатор. Металлы в нерастворимых в воде солях тоже определяют обратным титрованием. Кроме того, если индикатор образует более прочный комплекс с металлом, чем титрант, то обратное комплексонометрическое титрование поможет определить его содержание.
При заместительном титровании к образцу добавляют комплексы металлов, которые легко вытесняются определяемыми металлами в образце. Избыток добавленного раствора оттитровывается стандартным раствором ЭДТА.
Комбинированные методы комплексонометрического титрования
Комбинацией упомянутых методов можно определять не только катионы, но и анионы, такие как SO4 2- ; PO4 3- ; CrO4 2- . Для этого их сначала осаждают, фильтруют, растворяют в известном количестве ЭДТА. Избыток ЭДТА оттитровывают сульфатом цинка.
Виды комплексонометрического титрования
Различают комплексонометрические методы в зависимости от используемого хелата:
Трилон Б – трилонометрия. Обычно применяется для определения катионов металлов.
Соединения ртути – меркуриметрия. Применяется для анализа анионов (галогенов, цианидов и пр.).
Фосфорорганические комплексоны. Применяются относительно недавно и позволяют специфично определять катионы металлов даже в смесях.
Можно классифицировать методы комплексонометрического титрования в зависимости от используемого индикатора.
Индикаторы для комплексонометрического титрования
Выбор индикатора в первую очередь зависит от условий титрования. Для анализа катионов металлов наиболее универсален индикатор Эриохром черный Т, который применяется для определения Mg + ; Са 2+ ; Zn 2+ ; Cd 2+ ; Pb 2+ ; Мn 2+ .
Широкий спектр элементов можно определять с помощью Ксиленолового оранжевого, в том числе редкоземельные элементы, висмут и Fe 3+ .
Также в комплексонометрическом титровании используют такие индикаторы, как: Пирокатехиновый фиолетовый, Мурексид, кальцес, Хромовый темно¬синий, Бериллон II, Кальцион, Кальцеин и пр.
При индикаторном титровании необходимо четко фиксировать смену окраса индикатора для определения конечной точки титрования. Учитывая особенности индивидуального цветовосприятия, момент перехода окраса у разных лаборантов может отличаться, что влияет на точность получаемых результатов, повторяемость.
Применение комплексонометрического титрования
Одним из методов комплексообразования, получившим большое распространение в титриметрии, является комплексонометрия. В ее основе лежит образование прочных растворимых комплексов (хелатов) при взаимодействии ионов металлов с производными аминополикарбоновых кислот (комплексонами).
Из большого числа комплексонов в титриметрическом анализе особенно широко используется этилендиаминтетрауксусная кислота (H4Y). Сама кислота малорастворима в воде, поэтому применяют ее двунатриевую соль (ЭДТА), растворимость которой достаточно велика. ЭДТА количественно и стехиометрично реагирует с ионами металлов. Сухой препарат ЭДТА просто получить в чистом виде, а его раствор устойчив в течение длительного времени. ЭДТА обычно приготавливается как раствор вторичного стандарта из дигидрата двунатриевой соли этилендиаминтетрауксусной кислоты, который может содержать 0,3 %-й избыток влаги по отношению к указанной стехиометрии.
Молекула Н4Y содержит четыре способных к диссоциации атома водорода – два относительно сильнокислотных и два слабокислотных (рК1а = 2,00; рК2а = 2,67; рК3а = 6,16; рК4а = 10,26). В результате, рН среды оказывает сильное влияние на состоя
ние H4Y в растворе, а, следовательно, и на полноту комплексообразования ЭДТА с металлами.
Будучи полидентатным лигандом, этилендиаминтетраацетат-ион с ионами практически всех металлов дает прочные комплексы состава 1 : 1 независимо от заряда катиона. ЭДТА может действовать как четырех-, пяти- и шестидентатный лиганд, так как кроме четырех карбоксильных групп –СОО - содержит два атома азота, каждый из которых имеет неподеленную пару электронов. Например, строение комплекса М(II)Y 2- с координационным числом четыре (КЧ = 4) можно схематично изобразить следующим образом:
Образование комплексов ЭДТА с металлами в зависимости от рН среды описывается уравнениями:
Константы устойчивости (КМY) комплексов металлов с ЭДТА, приведенные в справочниках, относятся к равновесию:
Вследствие того, что полнота комплексообразования сильно зависит от кислотности среды, комплексонометрические титрования проводят обычно при постоянном рН. Часто процесс титрования осложняется осаждением части определяемого иона в виде основных оксидов и гидроксидов при рН, необходимом для проведения титрования. Чтобы этого избежать, необходимо ввести вспомогательный комплексообразующий реагент. Определения, которые необходимо вести в слабощелочной среде, обычно проводят в аммиачных буферах с подходящим значением рН и необходимой концентрацией комплексообразователя – аммиака.
При расчетах в комплексонометрии нужно пользоваться условными константами устойчивости (K”MY), учитывающими протекание в растворе конкурирующих реакций: комплексообразования иона металла с компонентами буфера и протонизации этилендиаминтетраацетат-иона:
где aм – доля металла, незакомплексованного с компонентами буфера и другими лигандами; aY – доля депротонированного реагента Y 4- ; [M’] – суммарная равновесная концентрация всех присутствующих в растворе форм металла за исключением комплексов металла с ЭДТА; [Y’]- суммарная равновесная концентрация всех присутствующих в растворе форм ЭДТА за исключением комплексов ЭДТА с металлом.
Доля металла, незакомплексованного с компонентами буфера и другими лигандами определяется по формуле:
а доля депротонированного реагента Y 4- - по формуле:
Доля депротонированного реагента aY (табл. 8.1) зависит от значения рН и констант диссоциации H4Y:
Величины aY для H4Y в растворах с различными значениями рН
Доля металла aM является обратной величиной функции Ледена (Фм).

Функция Ледена учитывает образование комплексов металла с компонентами буфера (например, в аммиачном буфере с аммиаком и гидроксид-ионами) и другими лигандами, которые могут присутствовать в растворе (например, маскирующие реагенты):
где bi, bj – общие константы устойчивости комплексов с лигандами L и ОН - .
Если в условиях титрования aМ=1, то условная константа образования комплекса металла с ЭДТА обозначается K’MY и равна
Кривые комплексонометрического титрования строят в координатах рМ – D. Размер интервала, внутри которого происходит резкое изменение рМ, и положение точки эквивалентности определяются значением условной константы устойчивости комплекса металла с ЭДТА, концентрациями титруемого вещества и титранта.
Все дальнейшие расчеты будем рассматривать для случая равных аналитических концентраций титруемого вещества и титранта (с0), с учетом разбавления растворов.
На ход кривой комплексонометрического титрования до точки эквивалентности (D 1). Чем кислее среда, тем меньше aY и К"MY, соответственно, меньше скачок титрования:
Оба фактора определяют положение точки эквивалентности. Для точки эквивалентности можно записать следующие равенства:
Подставляя концентрации в условную константу, получаем
Рассмотрим, каково должно быть значение К"MY в условиях титрования, чтобы погрешность за счет неполноты связывания металла в комплекс с ЭДТА в точке эквивалентности была меньше 0,1 %. Пусть 99,9 % от исходного количества металла перешло в комплексонат в точке эквивалентности. Тогда имеем:
Подставляя концентрации в выражение для условной константы, получим, что она должна удовлетворять условию:
Таким образом, при титровании 0,010 М растворов ошибка титрования за счет неполного протекания реакции не превышает 0,1 %, если значения условных констант устойчивости комплексов металлов с ЭДТА больше 2 · 10 8 .
Конечную точку титрования в комплексонометрии устанавливают с помощью металлохромных индикаторов. Металлохромные индикаторы – это вещества, которые образуют с ионами титруемых металлов достаточно прочные растворимые комплексные соединения, отличающиеся по окраске от цвета свободного индикатора и менее устойчивые, чем комплексы металлов с ЭДТА.
Большинство металлоиндикаторов обладает способностью присоединять протоны и образовывать соединения, окрашенные почти так же, как и комплексы металлов. Поэтому они являются кислотно-основными индикаторами и пригодны в качестве металлоиндикаторов только в той области рН, где конкурирующая реакция с участием протонов отсутствует.
Таким образом, в конечной точке титрования происходит разрушение окрашенных комплексов металла с индикатором с образованием бесцветных комплексов металла с ЭДТА и высвобождением имеющего другую окраску свободного индикатора.
Процесс комплексообразования иона металла с индикатором характеризуется константой устойчивости (КМInd). При расчетах в комплексонометрии в случае присутствия посторонних комплексообразователей или лигандов следует пользоваться условными константами устойчивости. По определению, условная константа устойчивости комплекса металла с индикатором равна:
где aInd – доля депротонированного индикатора Ind m - , [Ind’] – суммарная равновесная концентрация всех присутствующих в растворе форм индикатора за исключением комплексов индикатора с металлом.
Если в условиях титрования aM = 1, то пользуются условной константой устойчивости комплекса металла с индикатором:
Для того чтобы правильно фиксировать точку эквивалентности, нужно брать такой индикатор, у которого интервал изменения окраски попадает в интервал резкого изменения рМ титруемого раствора. Подобрать индикатор и рассчитать индикаторную ошибку титрования в каждом конкретном случае можно, только построив теоретическую кривую титрования.
При правильно выбранном индикаторе, когда конец титрования практически совпадает с точкой эквивалентности, даже при относительно невысоких значениях условных констант образования комплексов металла с ЭДТА (lgК"MY ³ 6) можно получить вполне приемлемые результаты. И, наоборот, при неудачно выбранном индикаторе даже при образовании очень прочных комплексов металлов с ЭДТА результаты могут оказаться неудовлетворительными.
Рассмотрим, как правильно выбрать индикатор. Пусть изменение цвета титруемого раствора происходит, когда 50 % исходного количества комплексов металла с индикатором разрушилось, т.е. [МInd]к.т = [Ind’]к.т. В этом случае концентрация металла в конечной точке титрования равна:
Пусть конечная точка титрования совпадает с точкой эквивалентности, т.е. [М n+ ]к.т = [М n+ ]т.экв. Подставляя в формулу (8.2) вместо концентраций металла выражения для их расчета, получим:
Конечная точка титрования будет совпадать с точкой эквивалентности, если взять индикатор, для которого в условиях титрования К”Мind удовлетворяет равенству
Например, если с0 = 0,010М и K”MY = 2 · 10 8 (что соответствует 99,9 % связыванию металла в комплекс с ЭДТА в точке эквивалентности), то индикатор будет менять окраску в точке эквивалентности, если K”MInd=2 · 10 3 .
Комплексонометрическое титрование – метод титриметрического анализа, основанный на реакции комплексообразования катионов металлов с комплексонами – аминополикарбоновыми кислотами и их солями.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Комплексонометрическое ОФС.1.2.3.0015.15
титрование Взамен ст. ГФ XI, вып.1
Комплексонометрическое титрование – метод титриметрического анализа, основанный на реакции комплексообразования катионов металлов с комплексонами – аминополикарбоновыми кислотами и их солями.
В настоящее время среди известных комплексонов наибольшее применение для комплексонометрического титрования получила динатриевая соль этилендиаминтетрауксусной кислоты, известная под названиями: натрия эдетат, трилон Б, комплексон III, хелатон III и др.
Натрия эдетат образует с катионами различных металлов в стехиометрическом отношении (1:1) устойчивые и хорошо растворимые в воде комплексонаты, что позволяет использовать его для количественного определения алюминия, висмута, кальция, магния, свинца, цинка и других ионов металлов в лекарственных препаратах.
Индикаторы, применяемые для визуального определения конечной точки титрования, называются металлоиндикаторами. В химическом отношении они, как правило, являются органическими кислотами и обладают способностью изменять окраску при образовании комплексных соединений с катионами металлов. Взаимодействие металлоиндикаторов с катионами определяемых металлов должно быть обратимым и константа устойчивости металлоиндикаторного комплекса должна быть на 10 4 меньше константы устойчивости комплекса катиона металла с титрантом.
Прямое титрование раствором натрия эдетата проводят следующим образом: к раствору анализируемого катиона прибавляют буферный раствор, имеющий необходимое значение рН, и указанное количество металлоиндикатора. В точке эквивалентности окраска раствора изменяется от окраски комплекса катиона с металлоиндикатором до окраски свободного металлоиндикатора.
При обратном титровании избыток натрия эдетата оттитровывают при определенном значении рН в присутствии соответствующего металлоиндикатора растворами солей магния, свинца, цинка и др. до перехода окраски свободного индикатора до окраски комплекса металлоиндикатора с катионом титранта.
Методики определения катионов
Алюминий
Определение проводят одним из приведенных ниже способов.
- Точную навеску препарата (соответствующую 0,02 – 0,03 г алюминия) растворяют в смеси 2 мл хлористоводородной кислоты раствора 1 М и 50 мл воды. Прибавляют 50,0 мл натрия эдетата раствора 0,05 М и нейтрализуют натрия гидроксида раствором 1 М по метиловому красному. Нагревают раствор до кипения и выдерживают на кипящей водяной бане в течение 10 мин, охлаждают, прибавляют 0,05 г индикаторной смеси ксиленолового оранжевого, 5 г гексаметилентетрамина и титруют избыток натрия эдетата цинка сульфата раствором 0,1 М до красно-фиолетового окрашивания.
1 мл натрия эдетата раствора 0,05 М соответствует 1,349 мг алюминия.
- К 20,0 мл раствора препарата, приготовленного, как описано в фармакопейной статье, прибавляют 25,0 мл натрия эдетата раствора 0,1 М и 10 мл смеси равных объемов аммония ацетата раствора 15,5 % и уксусной кислоты разведенной 12 %. Кипятят в течение 2 мин, охлаждают до комнатной температуры, прибавляют 50 мл этанола и 3 мл свежеприготовленного дитизона раствора 0,025 % в этаноле. Избыток натрия эдетата оттитровывают цинка сульфата раствором 0,1 М до перехода окраски от зеленовато-голубой до красно-фиолетовой.
1 мл натрия эдетата раствора 0,1 М соответствует 2,698 мг алюминия.
Висмут
Точную навеску препарата (соответствующую 0,1 – 0,2 г висмута) растворяют, как указано в фармакопейной статье. Прибавляют 50 мл воды и доводят рН до 1,0 – 2,0, добавляя по каплям азотную кислоту разведенную 16 % или 10 % раствор аммиака. Прибавляют 0,05 г индикаторной смеси ксиленолового оранжевого и медленно титруют натрия эдетата раствором 0,05 М до желтого окрашивания.
1 мл натрия эдетата раствора 0,05 М соответствует 10,45 мг висмута.
Кальций
Точную навеску препарата (соответствующую 0,04 – 0,05 г кальция) растворяют, как указано в фармакопейной статье, в воде или хлористоводородной кислоте разведенной 8,3 % и далее проводят определение по одному из приведенных способов:
- Доводят объем раствора водой до 100 мл и титруют натрия эдетата раствором 0,05 М. В конце титрования прибавляют 4 мл натрия гидроксида раствора 30 % и 3 мл раствора хальконкарбоновой кислоты – появляется розовое окрашивание. Продолжают титрование до перехода окраски в интенсивно синий цвет.
- Доводят объем раствора водой до 50 мл, прибавляют 10 мл буферного раствора аммония хлорида рН 10,0; 0,1 г индикаторной смеси или 7 капель раствора индикатора хромового темно-синего и титруют натрия эдетата раствором 0,05 М до сине-фиолетового окрашивания.
1 мл натрия эдетата раствора 0,05 М соответствует 2,004 мг кальция.
Магний
Точную навеску препарата (соответствующую 0,02 – 0,03 г магния) растворяют, как указано в фармакопейной статье. Прибавляют 50 мл воды, 10 мл буферного раствора аммония хлорида рН 10,0; 0,1 г индикаторной смеси или 7 капель раствора индикатора кислотного хром черного специального и титруют натрия эдетата 0,05 М раствором до синего окрашивания.
1 мл натрия эдетата раствора 0,05 М соответствует 1,215 мг магния.
Свинец
Точную навеску препарата (соответствующую 0,1 – 0,2 г свинца) растворяют, как указано в фармакопейной статье. Прибавляют 50 мл воды, 0,05 г индикаторной смеси ксиленолового оранжевого, 5,0 г гексаметилентетрамина и титруют натрия эдетата раствором 0,05 М до желтого окрашивания.
1 мл натрия эдетата 0,05 М раствора соответствует 10,36 мг свинца.
Цинк
Точную навеску препарата (соответствующую 0,06 – 0,08 г цинка) растворяют, как указано в фармакопейной статье. Прибавляют 50 мл воды, 0,05 г индикаторной смеси ксиленолового оранжевого, 5,0 г гексаметилентетрамина и титруют натрия эдетата раствором 0,05 М до желтого окрашивания.
Читайте также:

