Кислоты органические и неорганические кратко
Обновлено: 04.07.2024
С точки зрения состава, кислоты — сложные вещества, образованные кислотным остатком и атомами водорода, способными замещаться на атомы металла.
С точки зрения теории электролитической диссоциации, кислоты — соединения, которые диссоциируют в водном растворе на отрицательные ионы кислотного остатка и положительные ионы H+, что обуславливает изменение цвета индикатора (например, фиолетовый лакмус в кислой среде становится красным).
Все кислоты едкие и имеют кислый вкус. При нормальных условиях находятся в газообразном или жидком виде, кроме некоторых твtрдых: кремниевой кислоты H 2 S i O 3 , ортоборной кислоты H 3 B O 3 и органических кислот с большим количеством атомов углерода.
Классификация кислот
Кислоты делятся на две группы:
Неорганические кислоты имеют общую формулу HnK, где K - кислотный остаток. Классифицируют их по нескольким показателям:
- Наличие кислорода в кислотном остатке: кислородсодержащие ( H 3 P O 4 , H N O 3 ) и бескислородные ( H 2 S , H C l ).
- Основность (количество атомов водорода, способных заместиться на металл): одноосновные ( H B r , H N O 3 ), двухосновные ( H 2 S O 4 , H 2 C O 3 ), трехосновные ( H 3 P O 4 ).
- Летучесть: летучие ( H 2 S , H N O 3 ), нелетучие ( H 2 S O 4 , H 3 P O 4 ).
- Степень диссоциации: сильные ( H N O 3 , H C l ) и слабые ( H 2 C O 3 , H C l O ).
- Устойчивость: стабильные ( H 2 S O 4 , H 3 P O 4 ) и нестабильные (распадаются, H 2 S O 3 , H 2 C O 3 ).
- Растворимость в воде: нерастворимые ( H 2 S i O 3 и H 3 B O 3 ) и растворимые — все остальные.
- Агрегатное состояние, в котором могут быть: газообразные ( H 2 S , H C l ) , жидкие ( H 2 S O 4 , H N O 3 ) и твердые ( H 3 P O 4 , H 3 B O 3 , H 2 S i O 3 ).
Органические кислоты: наиболее широко распространены карбоновые кислоты — соединения, в состав которых входит карбоксильная группа -COOH. Общая формула: R-COOH, где R — углеводородный радикал. Они играют важную роль в биохимии живых организмов, участвуют в процессах обмена веществ.
1. Карбоновые кислоты классифицируют по следующим признакам:
- число карбоксильных групп:
- одноосновные: муравьиная H - C O O H и уксусная C H 3 - C O O H ;
- двухосновные: щавелевая H O O C - C O O H , малоновая; H O O C - C H 2 - C O O H
- многоосновные: лимонная кислота ( H O O C - C H 2 ) 2 - C ( O H ) - C O O H .
- тип углеводородного радикала:
- предельные: C H 3 C H 2 C H 2 C O O H масляная кислота;
- непредельные: C H 2 = C H - C H 2 C O O H акриловая кислота;
- ароматические: C 6 H 5 C O O H бензойная кислота;
- алициклические: C 4 H 6 O 2 циклопропанкарбоновая кислота;
- гетероциклические: C 6 H 5 N O 2 никотиновая кислота:
- замещенные карбоновые кислоты, в состав которых входит карбоксильная группа - C O O H , углеводородный радикал R и различные функциональные группы. Некоторые из них:
- галогены → галогенкарбоновые кислоты, H a l - R - C O O H (хлоруксусная кислота С l С Н 2 С О О Н , трифторуксусная кислота C F 3 C O O H );
- - O H → гидроксикислоты, O H - R - C O O H (гликолиевая кислота H O C H 2 C O O H , молочная кислота С H 3 C H ( O H ) C O O H ) ;
- - N H 2 → аминокислоты, H 2 N - R - C O O H (аминоуксусная кислота C H 2 N H 2 - C O O H глицин; 1,2- амино-3-метилпентановая кислота H O 2 C C H ( N H 2 ) C H ( C H 3 ) C H 2 C H 3 изолейцин). Аминокислоты — главная составная часть белков.
2. Серосодержащие органические кислоты (сульфокислоты) содержат сульфогруппы и имеют общие формулы кислот: R S O 3 H → сульфоновые; R S O 2 H → сульфиновые; R S O H → сульфеновые. Наиболее известны: 2-аминоэтансульфоновая кислота C 2 H 7 N O 3 S таурин и 2-амино-3-меркаптопропановая кислота H O 2 C C H ( N H 2 ) C H 2 S H цистеин.
3. Нуклеиновые кислоты — высокомолекулярные соединения, состоящие из нуклеотидов. Играют важную роль в биологии: находятся в клетках всех организмов, являются носителями генов, участвуют в передаче и реализации наследственной информации через синтез белка. Типы нуклеиновых кислот в зависимости от моносахарида-основы:
- дезоксирибонуклеиновая кислота (ДНК) — дезоксирибоза ( C 5 H 10 O 4 );
- рибонуклеиновая кислота (РНК) — рибоза ( C 5 H 10 O 5 ).
Номенклатура кислот
Часто используемые (распространенные) кислоты:
| Формула и название кислоты | Название кислотного остатка, переходящего в соль |
| H A l O 2 метаалюминиевая | метаалюминат |
| H 3 A l O 3 ортоалюминиевая | ортоалюминат |
| H A s O 3 метамышьяковая | метаарсенат |
| H 3 A s O 4 ортомышьяковая | ортоарсенат |
| H 3 B O 3 ортоборная | ортоборат |
| H B r бромоводородная | бромид |
| H B r O бромноватистая | гипобромит |
| H B r O 3 бромноватая | бромат |
| H C N циановодородная (синильная*) | цианид |
| H 2 C O 3 угольная | карбонат |
| H C l хлороводородная (соляная*) | хлорид |
| H C l O хлорноватистая | гипохлорит |
| H C l O 2 хлористая | хлорит |
| H C l O 3 хлорноватая | хлорат |
| H C l O 4 хлорная | перхлорат |
| H F фтороводородная (плавиковая*) | фторид |
| H J йодоводородная | йодид |
| H M n O 4 марганцовая | перманганат |
| H N O 2 азотистая | нитрит |
| H N O 3 азотная | нитрат |
| H P O 3 метафосфорная | метафосфат |
| H 3 P O 4 ортофосфорная (фосфорная*) | ортофосфат |
| H 2 S сероводородная | сульфид |
| H 2 S O 3 сернистая | сульфит |
| H 2 S O 4 серная | сульфат |
| H 2 S i O 3 метакремниевая | метасиликат |
| H 3 S i O 4 ортокремниевая | ортосиликат |
| *В скобках приведены тривиальные названия кислот | |
Номенклатура органических кислот
Для органических кислот чаще используют тривиальные названия (приведены в таблице 2), которые определяются по источнику, откуда впервые была получена кислота.
| Формула | Общепринятое название кислоты | Тривиальное название кислоты | Название соли |
| H C O O H | Метановая | Муравьиная | формиат |
| C H 3 C O O H | Этановая | Уксусная | ацетат |
| C 2 H 5 C O O H | Пропановая | Пропионовая | пропионат |
| C 3 H 7 C O O H | Бутановая | Масляная | бутират |
| C 4 H 9 C O O H | Пентановая | Валериановая | валерат |
| C 5 H 11 C O O H | Гексановая | Капроновая | капронат |
| Н О О С С Н 2 С Н ( О Н ) С О О Н | Гидроксибутандиовая | Яблочная | малат |
| С H 3 C H ( O H ) C O O H | 2-гидроксипропановая | Молочная | лактат |
| C H 2 N H 2 - C O O H | Аминоуксусная | Глицин | глицинат |
| HOOC-COOH | Этандиовая | Щавелевая | оксалат |
| ( H O O C - C H 2 ) 2 - C ( O H ) - C O O H | 2-гидроксипропан-1,2,3-трикарбоновая кислота | Лимонная | цитрат |
- C 2 H 5 C O O H — пропановая кислота;
- C H 3 - C ( C H 3 ) 2 - C O O H — 2,2-диметилпропановая кислота;
- C H 3 - C H 2 - C H ( N H 2 ) - C O O H 2 -аминобутановая (как вариант альфа-аминомасляная) кислота;
- C H 3 - C H ( N H 2 ) - C H 2 - C O O H 3 -аминбутановая (как вариант бета-аминомасляная) кислота.
Названия серосодержащих органических кислот: название самой длинной цепочки + окончание — сульфоновая, сульфиновая или сульфеновая кислота: 2-аминоэтансульфоновая кислота C 2 H 7 N O 3 S :
Общие химические свойства кислот (в уравнениях реакций для органических кислот используется стандартная формула R - C O O H ):
- Меняют окраску индикатора за счет образования катионов Н+ при диссоциации (фиолетовый лакмус → красный).
- + основания (реакция нейтрализации) → соль:
- 2 F e O H 3 + 3 H 2 S O 4 → F e 2 S O 4 3 + 6 H 2 O
- R C O O H + N a O H → R C O O N a + H 2 O
3. + металлы, стоящие левее водорода в ряду активности → соль и водород:
- F e + 2 H C I → F e C I 2 + H 2 ↑
- 2 R C O O H + M g → R C O O 2 M g + H 2 ↑ .
4. + оксиды оснóвные и амфотерные → соль и вода:
- C a O + H 2 S O 4 → C a S O 4 + H 2 O
- 2 R C O O H + C a O → R C O O 2 C a + H 2 O
- Z n O + N 2 S O 4 → Z n S O 4 + H 2 O
- 2 R C O O H + N a 2 O → 2 R C O O N a + H 2 O
5. + соли более слабых кислот → новая соль + кислота (угольная кислота распадается на H 2 O и C O 2 ↑ ):
- H 2 S O 4 + N a 2 C O 3 → N a 2 S O 4 + H 2 O + C O 2 ↑
- R C O O H + N a H C O 3 → R C O O N a + H 2 O + C O 2 ↑
Реакции, характерные для:
Неорганических кислот:
Окислительно-восстановительные: H 2 S O 3 + C I 2 + H 2 O → H 2 S O 4 + 2 C H I
P b + 4 H N O 3 (конц) → P b N O 3 2 + 2 N O 2 ↑ + 2 H 2 O
Органических кислот:
1. Образование функциональных производных путем замещения гидроксильной группы:
- R - C O - O H + P C I 5 → R - C O - C I (хлорангидрид) + P O C I 3 + H C I ;
- R – C ( O ) - O H + H - O - C ( O ) - R → R – C ( O ) – O – C ( O ) – R (ангидрид);
- C H 3 C O O H + C H 3 - C H 2 - O H → C H 3 - C O - O - C 2 H 5 (этилацетат (сложный эфир)) + H 2 O ;
- C H 3 C O O H + C H 3 - N H 2 → C H 3 - C O - N H - C H 3 (амид) + H 2 O (при нагревании).
C H 3 - C H 2 - C O O H + B r → C H 3 - C H B r - C O O H + H B r (катализатор – Pкр).
P - C O O H + L i A I H 4 (водный раствор, подкисленный H C I ) → R - C H 2 - O H - A I C I 3 + L i C I
Кислоты прежде всего классифицируют на неорганические и органические (карбоновые). Слабые кислотные свойства проявляют такие органические соединения как спирты и фенолы. Неорганические и карбоновые кислоты, в свою очередь, имеют свои собственные классификации. Так, все неорганические кислоты можно классифицировать:
- по числу атомов водорода, способных к отщеплению в водном растворе (одноосновные –HCl, HNO2, двухосновные –H2SO4, H2SiO3, трехосновные –H3PO4)
- по составу кислоты (бескислородсодержащие – HI, HF, H2S и кислородсодержащие – HNO3, H2CO3)
Карбоновые кислоты классифицируют:
- по числу карбоксильных групп (одноосновные – HCOOH, CH3COOH и двухосновные –H2C2O4)
Физические свойства кислот
При н.у. большинство неорганических кислот существуют в жидком состоянии, некоторые – в твёрдом состоянии (H3PO4, H3BO3).
Органические кислоты с числом атомов углерода до 3 представляют собой легкоподвижные бесцветные жидкости с характерным резким запахом; кислоты с 4-9 атомами углерода — маслянистые жидкости с неприятным запахом, а кислоты с большим количеством атомов углерода— твёрдые вещества, нерастворимые в воде.
Строение карбоксильной группы
Карбоксильная группа — -COOH состоит из карбонильной группы — > С=O и гидроксильной группы –OH, которые оказывают взаимное влияние друг на друга. Неподеленная пара электронов атома кислорода в гидроксид-ионе смещена в сторону атома углерода карбонильной группы, что ослабляет связь –ОН и обусловливает наличие кислотных свойств (рис 1).

Рис. 1 Строение карбоксильной группы
Получение кислот
Неорганические и органические кислоты получают разными способами. Так, неорганические кислоты можно получить:
-
по реакции кислотных оксидов с водой
Органические кислоты получают путем:
-
окисления альдегидов и первичных спиртов (в качестве окислителей выступают KMnO4 и K2Cr2O7)
R – CH2 –OH → R –C(O)H → R-COOH,
где R – углеводородный радикал.
Химические свойства кислот
К общим химическим свойствам и органических и неорганических кислот относят:
— способность изменять окраску индикаторов, например, лакмус при попадании в раствор кислоты приобретает красную окраску (это обусловлено диссоциацией кислот);
— взаимодействие с активными металлами
— взаимодействие с основными и амфотерными оксидами
— взаимодействие с основаниями
RCOOH + NaOH = RCOONa + H2O
— взаимодействие с солями слабых кислот
CH3COONa + HCl = CH3COOH + NaCl
Специфические свойства неорганических кислот
К специфическим свойствам неорганических кислот относят окислительно-восстановительные реакции, связанные со свойствами анионов кислот:
Специфические свойства органических кислот
К специфическим свойствам органических кислот относят образование функциональных производных путем замещения гидроксильной группы (1, 2, 3, 4), а также галогенирование (5), восстановление (6) и декарбоксилирование (7).
R –C(O)-OH + PCl5 = R –C(O)-Cl (хлорангидрид) + POCl3 + HCl (1)
R –C(O)-OH + H-O-C(O)-R = R – C(O) – O – C(O) – R (ангидрид) (2)
R-COOH + LiAlH4 (водный раствор, подкисленный HCl) = R-CH2-OH +AlCl3 + LiCl (6)
Примеры решения задач

5) CH3COONa + HCl = СН3СООН + NaCl
6) СН3СООН + С2Н5ОН СН3СООС2Н5 + Н2О (Воздействие H2SO4)
| Задание | Определите массу пирита (FeS2), необходимую для получения такого количества SO3, чтобы при растворении последнего в растворе серной кислоты с массовой долей 91 % массой 500 г получить олеум с массовой долей 12,5 %. |
| Решение | Запишем уравнения реакций: |
Найдем молярные массы веществ, необходимых для дальнейших расчетов:
Масса воды в 100 г раствора серной кислоты (ω = 91 %) составит:
Из уравнения реакции (3) следует, что
0,5 моль H2O прореагирует с 0,5 моль SO3 и образуется 0,5 моль H2SO4
Рассчитаем массу SO3
Тогда общая масса H2SO4 составит
Для получения олеума (ω = = 12,5 %) на 140 г H2SO4 потребуется SO3:
m(SO3) = 12,5•140/87,5 = 20 г
Таким образом, всего SO3 расходуется
Из уравнений реакций (2, 3) следует, что на образование 0,75 моль SO3 расходуется

В видеоуроке акцент делается на общность химических свойств органических и неорганических кислот. Особое внимание уделяется их химическим, физическим свойствам и способам получения.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Органические и неорганические кислоты"
У органических кислот своя классификация. По типу углеводородного радикала различают предельные карбоновые кислоты, у которых све связи сигма-типа, например, пропановая кислота, или масляная; непредельные, у которых есть кратные связи, например, акриловая, или пропэновая кислота; и ароматические карбоновые кислоты, у которых есть ароматическое кольцо: например, бензойная кислота.
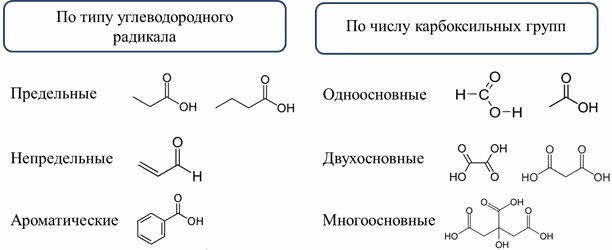
По числу карбоксильных групп различают одноосновные карбоновые кислоты, у которых одна карбоксильная группа, например, муравьиная, уксусная кислота; двухосновные, у которых две карбоксильные группы, например, щавелевая, малоновая кислота; и многоосновные кислоты, у которых несколько карбоксильных групп, например, лимонная кислота.
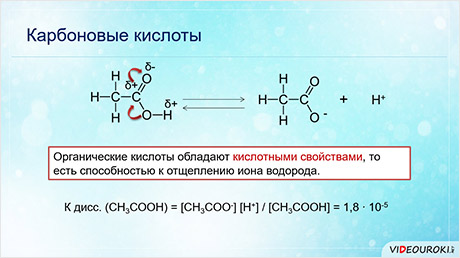
Органические кислоты, как и неорганические, обладают кислотными свойствами, то есть способностью к отщеплению иона водорода.
Карбоновые кислоты – слабые электролиты. Так, константа диссоциации уксусной кислоты: одна целая восемь десятых на десять в минус пятой степени.


От чего же зависит сила карбоновой кислоты?
Во-первых, от строения. То есть чем больше положительный заряд на атоме водорода в молекуле кислоты, тем более сильным электролитом она будет. Наличие углеводородных радикалов с карбоксильной группой уменьшает способность кислоты диссоциировать, поэтому и сила кислоты будет уменьшаться.
Так, в ряду от муравьиной до два-два-диметил-пропановой кислоты сила кислот будет уменьшаться.

То есть самой сильной кислотой будет муравьиная, или метановая кислота, у которой и самая высокая константа диссоциации.
Введение электроноакцэпторных заместителей увеличивает положительный заряд на томе водорода, а значит, и силу кислоты.
Например, в ряду от уксусной до трихлор-уксусной кислоты сила кислот будет увеличиваться, так как увеличивается число электроноакцэпторного заместителя – хлора.

Карбоновые кислоты обладают свойствами, характерными для минеральных кислот. Из-за смещения электронной плотности от гидроксильной группы к сильно поляризованной карбонильной группе молекулы карбоновых кислот способны к электролитической диссоциации.
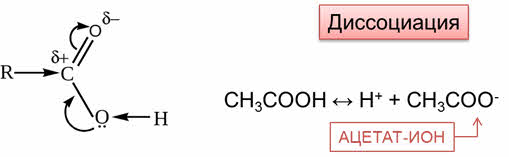
Так, при диссоциации уксусной кисоты образуется ион водорода и ацэтат-ион.
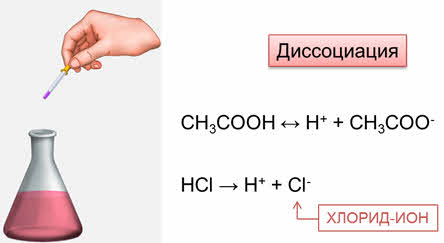
Неорганические кислоты в растворе также диссоциируют с образованием ионов водорода и изменяют окраску индикаторов. При диссоциации соляной кислоты образуются ионы водорода и хлорид-ионы.
Органические и неорганические кислоты реагируют с металлами, стоящими в электрохимическом ряду напряжений металлов до водорода.
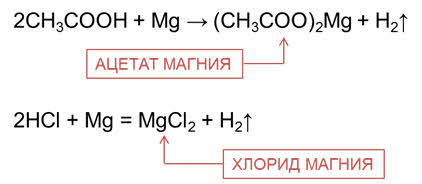
Например, в реакции уксусной кислоты с магнием образуется соль – ацэтат магния и выделяется газ – водород, в реакции соляной кислоты с магнием образуется соль – хлорид магния и газ водород.

Органические и неорганические кислоты реагируют с основными и амфотэрными оксидами.
В реакции уксусной кислоты с основным оксидом – оксидом меди два, образуется соль – ацэтат меди два и вода; в реакции соляной кислоты с оксидом меди два образуется соль – хлорид меди два и вода.


В реакции уксусной кислоты с амфотэрным оксидом – оксидом алюминия образуется соль – ацэтат алюминия и вода; в реакции соляной кислоты с оксидом алюминия образуется хлорид алюминия и вода.


Органические и неорганические кислоты взаимодействуют с основаниями. Эти реакции являются реакциями нейтрализации.
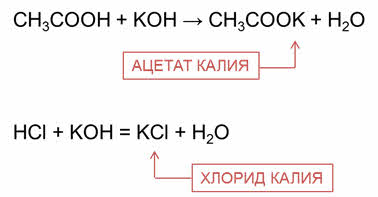
Так, в реакции уксусной кислоты с гидроксидом калия образуется соль – ацэтат калия и вода, в реакции соляной кислоты с гидроксидом калия образуется соль – хлорид калия и вода.
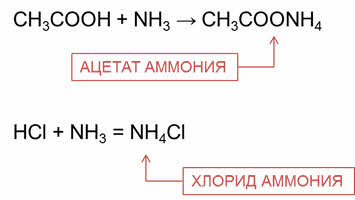
Органические и неорганические кислоты реагируют с аммиаком с образованием солей аммония.
Например, в реакции уксусной кислоты с аммиаком образуется соль – ацэтат аммония; в реакции соляной кислоты с аммиаком образуется соль – хлорид аммония.
Органические и неорганические кислоты реагируют с солями слабых кислот.
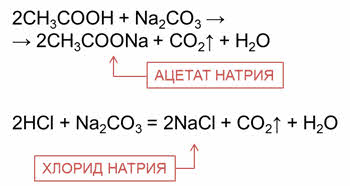
Так, в реакции уксусной кислоты с карбонатом натрия образуется соль – ацэтат натрия, углекислый газ и вода; в реакции соляной кислоты с карбонатом натрия образуется соль – хлорид натрия, углекислый газ и вода.
Таким образом, химические свойства органических кислот обусловлены в основном наличием в молекуле карбоксильной группы. Общие свойства органических и неорганических кислот проявляются в реакциях с основаниями, некоторыми активными металлами, основными и амфотэрными оксидами, солями более слабых кислот.
Вы уже знаете немало определений кислот как класса сложных веществ.
Кислотами называют сложные вещества, которые состоят из атомов водорода, способных замещаться на металл, и кислотного остатка.
В свете теории электролитической диссоциации к кислотам относят электролиты, которые при диссоциации образуют катионы только одного типа — гидратированные ионы водорода.
Теория электролитической диссоциации объясняет кислотно-основные свойства водных растворов электролитов присутствием в них избытка ионов Н + (точнее, Н3O + ) или ОН - :


В 1923 г. появилась протолитическая теория кислот и оснований Брёнстеда—Лоури, которая расширила представления о кислотах и основаниях, объяснила поведение веществ в водных и неводных (спиртовых, эфирных, аммиачных) растворах. Согласно этой теории,
| кислоты — это молекулы или ионы, которые являются в данной реакции донорами катионов водорода Н + , т. е. отдают их. |
| основания — это молекулы или ионы, которые принимают катионы Н + , т. е. являются акцепторами Н + . |
В реакции получения хлорида аммония хлороводород отдает катион водорода Носнования — это молекулы или ионы, которые принимают катионы Н + , т. е. являются акцепторами Н + . аммиаку, следовательно, хлороводород НСl ведет себя как кислота, a NH3 — как основание.
Так как атом водорода состоит только из протона и электрона, то катион водорода Н + представляет собой протон, поэтому кислоту иногда называют донором протонов, а основание — акцептором протонов.
С точки зрения теории кислот и оснований Брёнстеда—Лоури распад электролита на ионы (1) и гидролиз по аниону (2) рассматривают как кислотно-основное взаимодействие электролитов и воды:

В реакции (1) Н2O ведет себя как основание — присоединяет протон (Н + ) и образует ион оксония по донор-но-акцепторному механизму:

Ион оксония Н30 + и сам может играть роль кислоты — отдавать Н + и превращаться в молекулу воды.
Теперь, когда вы познакомились с более широким взглядом на природу кислотно-основных свойств химических соединений, сделаем обобщение сведений о классе кислот, рассмотрев классификацию и свойства неорганических и органических кислот (табл. 18).
Читайте также:

