Катализ в биологии кратко
Обновлено: 05.07.2024
Зачастую говоря о витаминах, минералах и других полезных для человеческого организма элементах упоминаются вещества, которые называются ферментами. Что такое ферментативный катализ и как он происходит в организме человека вы узнаете, дочитав эту статью до конца.
Строение атома и химические связи
Взаимодействие молекул
Чтобы молекулы вступили во взаимодействие и перераспределились внешние электроны составляющих их атомов, разорвались одни связи и замкнулись другие, этим им необходимо находиться в достаточно активном состоянии. Известно, что повышение температуры ускоряет химические реакции. Это объясняется тем, что тепловая энергия увеличивает число молекул, находящихся в активированном состоянии. Количество энергии, которое вещества должны получить дополнительно для того, чтобы между ними пошел процесс, называется энергией активизации. Это количество энергии, достаточное для того, чтобы большинство молекул преодолело так называемый энергетический барьер. Когда взаимодействие заканчивается, ее продукты находятся на более низком энергетическом уровне, чем исходные вещества, то есть в более устойчивом состоянии.
Как работают катализаторы?
Сущность действия катализаторов состоит в том, что они понижают энергетический барьер реакции, направляют ее как бы в обход этого барьера.
Представьте себе лыжника, стоящего перед лестницей к трамплину, с которого ему предстоит прыгнуть. Чтобы начать спуск, ему необходимо предварительно затратить некоторое количество энергии, для попадания на площадку перед трамплином. И тогда ему хватит небольшого толчка, для полета.
Теперь допустим, что перед нашим лыжником имеется ровная тропинка, ведущая на спуск с трамплина в обход лестницы. Чтобы начать спуск, пройдя этой тропинкой, ему требуется гораздо меньшая затрата энергии, чем для подъема на площадку по лестнице; стоящий перед ним энергетический барьер окажется менее высоким. Но при этом величина свободной энергии спуска будет такой же, как при спуске с площадки.
Для чего нужны ферменты и что такое ферментативный катализ
Ферментативный катализ отличается от катализа неферментативного тремя важными особенностями.
Первая — это большая специфичность ферментов (катализаторов). Если катализатор-нефермент, так сказать, облегчает осуществление множества различных хим. реакций, убыстряя их, то фермент катализирует химические превращения веществ, имеющих строго специфическое строение и не оказывает воздействие на остальные субстраты (вещества, химические превращения которых катализируются определенным ферментом).
Вторая – заключается в том, что ферменты действуют при мягких условиях внешней среды. Они не требуют высоких температур, резко кислой или очень щелочной реакции среды, повышенного во много раз давления — условий, при которых невозможна жизнь.
Третья – чрезвычайно высокая молекулярная активность ферментов; 1 молекула фермента катализирует за 1 минуту превращения множество молекул субстрата. Под действием биологических катализаторов — ферментов реакции идут в десятки тысяч, подчас в миллионы раз быстрей, чем под влиянием неорганических-катализаторов.
Ферментативный катализ по эффективности более высок по сравнению с неорганическими. Это объясняется тем, что он сильней уменьшает энергию активации. Также эффективней облегчается преодоление энергетического барьера реакции, увеличивает число активированных, способных к реакции молекул, и потому ее ускоряет.
Ферментативный катализ на первое его стадии заключается в том, что фермент соединяется с субстратом и образуется фермент-субстратный комплекс.
Формирование и последующее превращения фермент-субстратного комплекса разделяют на несколько стадий:
- соединение молекул фермента и субстрата;
- преобразование первичного фермент-субстратного комплекса в один или несколько последовательных комплексов, находящихся в активированном состоянии — химические связи легче могут разорваться;
- отделение конечных продуктов реакции от фермента.
Освободившаяся молекула фермента способна вновь вступать в оборот — соединяться с новой порцией субстрата.
Непосредственное участие в каталитическом действии принимает не вся молекула фермента, а лишь часть ее, которая называется активным центром фермента. Важнейшая составная часть активного центра — его каталитически активный участок, непосредственно взаимодействующий с субстратом. Наряду с этим принято выделять в составе активного центра так называемый контактный, или якорный участок (площадку), который обеспечивает связывание фермента с субстратом. Для многих ферментов уже выяснено, какие аминокислоты входят в состав их активных центров.
Как происходит ферментативный катализ на химическом уровне
Как протекает ферментативный катализ изучен еще не до конца, в частности не совсем ясно, каким образом активируется субстрат, какой вид приобретает его молекула в том активированном, переходном состоянии, при котором облегчен разрыв и замыкание связей в молекуле. Одни из объяснений дает так называемая теория деформации субстрата.
Возьмем соединение А—В. Связь между A и В разорвана с присоединением к А—В молекулы воды. При этом вода присоединяется таким образом, что за счет освободившейся валентности к А присоединяется одна часть молекулы воды — группа ОН (гидроксильная группа), а к молекуле В — второй атом водорода, входивший в молекулу воды. Такой тип химических реакций называется реакциями гидролиза — распад молекулы с присоединением к продуктам распада остатков молекулы воды. Ферменты, катализирующие такой тип реакции, называют гидролитическими ферментами. К такому типу реакций относятся реакции расщепления белков, углеводов и жиров в органах пищеварения. Например, молекула обычного сахара состоит из двух простых сахаров: глюкозы и фруктозы, соединенных между собой.
Если связь между ними с присоединением воды разорвется, молекула сахарозы расщепится на молекулу глюкозы и молекулу фруктозы. Таким образом, под соединением А—В мы можем подразумевать сахарозу, под А — глюкозу и под В — фруктозу. Реакция гидролиза сахарозы катализируется ферментом сахаразой, который является каталитически активным белком.
Как происходит ферментативный катализ в организме человека
По местам освободившихся связей к молекуле субстрата или ее остатку могут присоединяться другие атомы или группа атомов — синтезируются новые соединения. Такие реакции катализируются особым классом ферментов — синтетазами. Отщепившиеся от молекулы атомы и их группы за счет действия ферментов, именуемых трансферазами, могут быть перенесены на молекулы других соединений с образованием при этом новых молекул.
За счет действия ферментов, называемых оксидоредуктазами, продукты расщепления белков, углеводов, жиров подвергаются глубокому распаду путем их окисления. В результате такого процесса углерод пищевых веществ окисляется до углекислоты, водород — до воды, азот восстанавливается до аммиака. Те продукты обмена веществ (метаболиты), которые в организме подвергаются далее тем или иным превращениям, называются промежуточными продуктами, а те что дальнейшим превращениям не подвергаются, а удаляются из организма являются конечными.
Например: крахмал пищи под действием пищеварительных ферментов подвергается гидролизу, расщепляясь при этом на большое число молекул глюкозы. Глюкоза поступает в клетки тела. В них она подвергается многочисленным превращениям, в ходе которых она преобразуется в различные необходимые организму продукты: холестерин, гормоны и многие другие. Основная же масса продуктов распада глюкозы в итоге многоэтапных превращений, на разных стадиях катализируемых различными ферментами, вступает в конце концов в окислительно-восстановительные реакции и полностью окисляются до углекислоты и воды. В ходе этого окисления глюкозы освобождается необходимая для жизнедеятельности энергия.
Вообще процессы распада пищевых веществ идут с освобождением энергии. Такие реакции называются экзэргоническими. Процессы биологического синтеза протекают с потреблением энергии и называются эндэргоническими. Наиболее эффективный способ освобождения энергии пищевых веществ — глубокий их распад путем окисления. Энергия для этих процессов используется организмом как для производства различных видов работы (сокращение мышц и др.), так и для процессов биосинтеза.
Вывод
На это мы закончим. В этой статье по подробно разобрали что такое ферментативный катализ и как он происходит. Если вам статья понравилась и стала полезной, поделитесь ей со своими знакомыми и друзьями в соц сетях.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Биологические катализаторы"
Начнём с цитаты известного советского химика и инженера, академика Георгия Константиновича Борескова:
Неуютная картина, не правда ли? Поэтому сегодняшняя наша цель – разобраться, почему же Земля всё-таки выглядит более привычно для нашего глаза.

Для протекания многих химических реакций необходимы специальные условия. Чаще всего на скорость реакций влияют температура и давление. Чем они выше, тем быстрее протекает химическая реакция. Но её скорость можно увеличить, не изменяя внешних условий, а просто добавив к реагирующей смеси определённые вещества. Так, металлический родий почти в 10000 раз ускоряет разложение муравьиной кислоты на углекислый газ и водород. Такие вещества, увеличивающие скорость реакции, но не входящие в состав продуктов реакции, называются катализаторами.
В клетках живых организмов каждую секунду происходят тысячи химических реакций.
И это несмотря на то, что в живой клетке умеренная температура и нормальное давление. Например, бактерии из рода Азотобактер могут при обычных условиях разрывать прочнейшую молекулу азота, где атомы соединены тремя ковалентными связями и присоединять их к водороду. А для того, чтобы проделать то же самое человеку в промышленности, необходимо создать давление в 350 раз большее, чем на поверхности Земли и поднять температуру до 500 градусов Цельсия.
Естественно, бактерии не обходятся при этом без катализаторов. Кстати, люди также пытались применить их при получении аммиака. Перепробовав при этом более 20000 различных веществ.
Что же за всесильные вещества – эти катализаторы?
Катализаторами химических реакций в неживой природе могут быть самые различные вещества. Это и уже упомянутый нами экзотический родий, который используется для изготовления зеркал супермощных лазеров и обычный оксид марганца, применяемый для получения кислорода даже в школьной лаборатории.
Кроме того, неорганические катализаторы могут ускорять реакции с разными веществами. Например, родий не только эффективно разлагает муравьиную кислоту, но и борется с выбросами вредных оксидов азота в автомобильных катализаторах.
Другое дело – биологические, а значит, органические катализаторы. На них мы остановимся более подробно.
Многочисленные исследования прошлого нашей планеты говорят о том, что на начальном этапе зарождения жизни каталитической способностью обладали некоторые молекулы рибонуклеиновых кислот.

И тогда это свойство РНК имело очень важное значение. Сегодня же роль молекул РНК как катализаторов крайне мала. А основными биокатализаторами в клетке являются ферменты. Которых уже к 2013 году было описано более пяти тысяч видов.
Абсолютно все процессы в живом организме прямо или косвенно осуществляются с участием ферментов или энзимов, как их ещё называют. Это и фиксация углерода в процессе фотосинтеза, и расщепление питательных веществ в пищеварительном тракте, и синтез источника энергии для всех живых организмов – АТФ, и многое –многое другое.
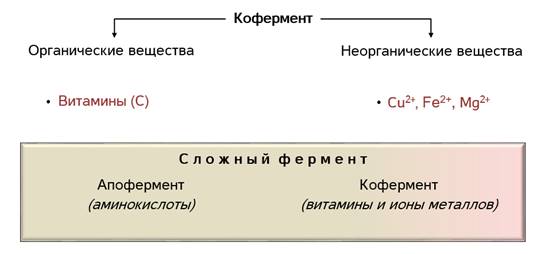
Как вы помните, по химической природе биологические катализаторы относятся к белкам. Они могут быть как простыми, состоящими только из аминокислот, так и сложными, включающими белок и небелковую часть – простетическую группу. Простетическая группа фермента называется кофермент, а белковая часть – апофермент.
В роли коферментов выступают органические и неорганические вещества. Среди органических это могут быть витамины, например, аскорбиновая кислота. А из неорганических – ионы различных металлов. Например, ионы меди, железа, магния.
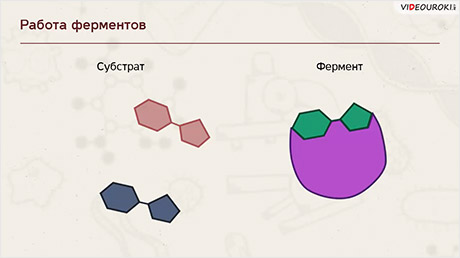
Ферменты ускоряют химические реакции за счёт тесного взаимодействия с молекулами исходных реагирующих веществ – так называемых субстратов. Зачастую размеры молекул субстратов значительно меньше размеров молекул самих ферментов, хотя, казалось бы, должно быть наоборот. Поэтому с субстратом или субстратами, потому что их может быть несколько, взаимодействует не вся молекула фермента, а лишь небольшой её участок – активный центр фермента. Построен он чаще всего из нескольких аминокислотных остатков, которые образуют его уникальную структуру. Почему уникальную? Дело в том, что форма и химическое строение активного центра таковы, что с ним могут связываться только те субстраты, структура которых подходит к структуре активного центра.
Магия этого процесса неизвестна до сих пор. Несмотря на то, что человечество в ближайшее время планирует полёты на Марс, оно не в состоянии разобраться со своим организмом. Но существует теория. Её выдвинул ещё в 1890 году немецкий химик Эмиль Фишер.
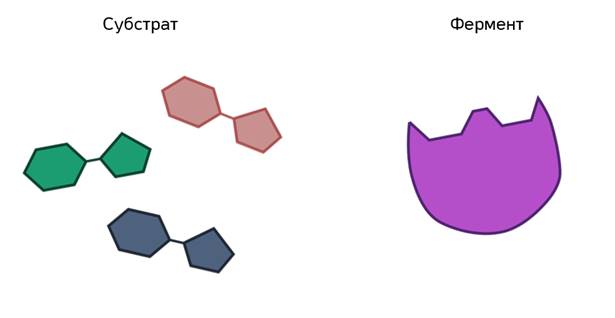
В этом комплексе молекула субстрата деформируется и в её структуре ослабляются определённые химические связи. Что приводит к облегчённому их разрыву и в конечном итоге к ускорению химической реакции.
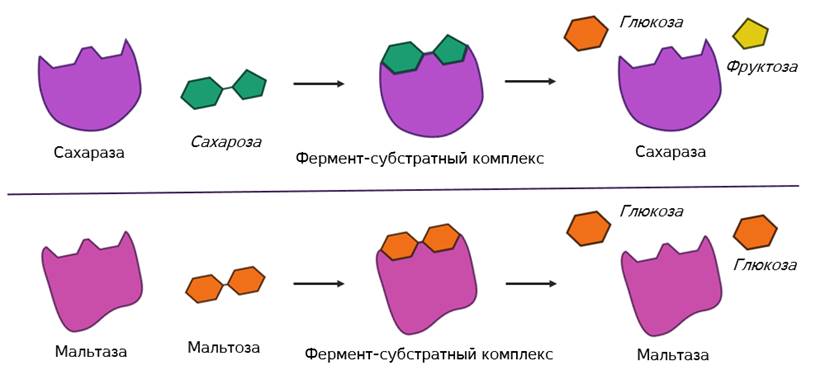
После этого фермент-субстратный комплекс распадается на конечные продукты и свободный фермент, а активный центр последнего тут же готов принимать новые молекулы субстрата. Получаем такой же итог, как и в случае работы обычных химических катализаторов – скорость реакции увеличивается, а сам катализатор при этом не расходуется и может использоваться многократно.
Но в самом механизме работы органических и неорганических катализаторов есть кардинальное отличие. Каждый фермент действует только на определённый тип связи и ускоряет только одну определённую реакцию. То есть обладает специфичностью. Как вы поняли, специфичность объясняется соответствием активного центра только определённым субстратам. Поэтому, например, фермент мальтаза, разлагающий дисахарид мальтозу до двух молекул глюкозы оказывается не способным разрушать молекулы сахарозы. Несмотря на то, что сахароза также является дисахаридом.
Активирующее влияние на скорость ферментативной реакции оказывают разнообразные вещества органической и неорганической природы. Например, в желудке человека соляная кислота активирует фермент пепсин. Максимальная активность которого лежит в пределах рН от полутора до двух.
Ингибирование ферментов может быть обратимым и необратимым. Если вещество-ингибитор вызывает стойкое изменение пространственной структуры фермента, то такое ингибирование будет необратимым.
А вот обратимое ингибирование, в свою очередь, бывает двух типов. Давайте их рассмотрим.
С активным центром фермента могут связываться вещества, сходные по структуре с субстратом. Никакой реакции при этом нет, но между ингибиторами и субстратом происходит конкуренция за активный центр. Поэтому такой тип ингибирования называется конкурентным.
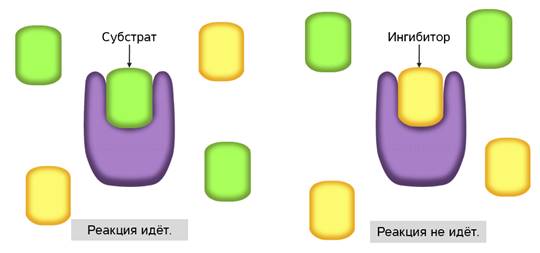
Конкурентное ингибирование широко используется в медицине. Антибиотики, противоопухолевые препараты, используемые в качестве лекарственных средств, являются конкурентными ингибиторами.
В неконкурентном ингибировании не участвуют вещества, сходные с субстратом. При таком типе ингибирования, молекулы ингибиторов присоединяются к регуляторному центру фермента. Это вызывает изменение пространственной структуры активного центра, что препятствует присоединению к нему молекул субстрата. Тем самым снижается скорость ферментативной реакции.
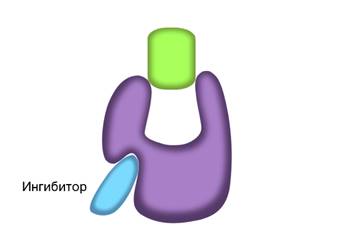
Уникальные способности ферментов уже много лет используются человеком в хозяйственной деятельности. В настоящее время развивается новая отрасль науки – промышленная энзимология. Которая, в свою очередь, является основой биотехнологии.
Мы уже упоминали об использовании ферментов в медицине. Фармацевтическая промышленность научилась производить искусственный аналог гормона надпочечников кортизола – преднизолон. Который используется при лечении ревматоидного артрита.
Широкое применение ферменты-энзимы находят также в пищевой промышленности. Их применяют в производстве сыров, соков, овощных и фруктовых пюре. Не обходится без применения ферментов хлебопечение, производство алкогольных напитков. Для улучшения вкуса, аромата и консистенции их применяют для обработки мяса.
В текстильной и кожевенной промышленности ферменты позволяют значительно увеличить выход овчины, а обработка кожи перед дублением делает её поверхность чистой, гладкой и тонкой.
Перспективным является применение ферментов, разлагающих целлюлозу. В результате этого из древесины, торфа, сельскохозяйственных и городских отходов можно получить ценные биотехнологические продукты: глюкозу, этанол, ацетон и другие. Особую актуальность это имеет в наши дни, когда проблема загрязнения окружающей среды выходит на передний план.
Катализ – явление возбуждения химических реакций специальными веществами – катализаторами. Катализатор многократно вступает в промежуточное химическое взаимодействие с веществами, участвующими в реакции и восстанавливает свой состав после каждого цикла промежуточных взаимодействий.
Гомогенный катализ – реагирующие вещества и катализатор образуют одну фазу.
Гетерогенный катализ – вещества и катализатор находятся в разных фазах.
Микрогетерогенный катализ занимает промежуточное место между гомогенным и гетерогенным катализами. Катализатор – большие полимерные молекулы. Для взаимодействующих на них небольших молекул они подобны гетерогенным частицам, но образуют с реагентами одну фазу. В эту группу входят ферментативные реакции, в которых катализатор (фермент) – крупные белковые молекулы сложного состава и строения. Поэтому его называют и ферментативным катализом.
Химическое превращение протекает через образование активного комплекса, обладающего избыточной энергией. Ее достаточно для перестройки новых веществ – продуктов реакции. Изменение энергии системы при химическом взаимодействии по реакционному пути(1).
А – активированный комплекс
К –промежуточное соединение с катализатором
Е0, Ек – энергии исходных веществ и продуктов
Е1, Е2 – энергии активации превращения прямом и обратном направлениях
∆Н – изменение энергии в результате превращения (тепловой эффект).
Но не все молекулы обладают достаточной энергией для образования активного комплекса – только те, энергия которых превышает энергию активации Е1. Если необходимая энергия Е1 велика, то реакция практически не протекает.
Катализатор открывает новый реакционный путь, благодаря тому, что вступает в химическое взаимодействие с образованием активированного комплекса с меньшей энергией, чем требуется для образования активированного комплекса без катализатора. Промежуточное соединение, в которое входит катализатор, превращается далее в продукты через другой активированный комплекс, но тоже с меньшей энергией. После второго этапа реакции катализатор восстанавливает свой химический состав и его компоненты не входят в состав продуктов. И хотя реакционный путь удлиняется, становится стадийным, уменьшение энергии активированного комплекса приводит к увеличению скорости реакции (2).
Особый интерес к катализу проявился в период развития промышленной химии, так как возможность ускорять химические реакции в нужном направлении без расхода энергии и по существу без расхода самого вещества катализатора придали катализу большую практическую значимость. С помощью катализа решаются задачи, стоящие перед технологией связанного азота, более 80% нефти перерабатывается с использованием каталитических процессов, невозможно осуществление большинства процессов органического синтеза.
Катализаторы – вещества, которые, многократно вступая в промежуточное взаимодействие с участниками реакции, изменяют ее механизм и увеличивают скорость реакции; при этом они восстанавливают свой химический состав после каждого цикла промежуточных воздействий.
Влияние катализатора на механизм химической реакции можно пояснить на условном примере. Пусть протекает одностадийная реакция с энергией активации Е0 :
Ход реакции на энергетической диаграмме каталитической и некаталитической реакций изображен кривой 1. В присутствии катализатора механизм реакции изменяется, она протекает через несколько последовательных стадий (кривая 2). Например, первой стадией может быть образование промежуточного активированного комплекса Акт:
Затем активированный комплекс реагирует со вторым реагентом с образованием комплекса катализатора и продукта:
Последней стадией является разложение комплекса RКт с образованием продукта К и высвобождением катализатора для нового каталитического цикла:

Каждая из этих последовательных стадий характеризуется своими значениями энергии активации Е1, Е2, Е3, но, как правило, высота каждого из этих потенциальных барьеров ниже энергии активации Е0. Таким образом, в присутствии катализатора реакция протекает по более энергетически выгодному пути, что позволяет проводить процесс с большей скоростью.
Исходное(I) и конечное (II) энергетические состояния реакционной системы в присутствии катализатора и без него остаются одинаковыми; следовательно: катализатор не может изменить состояние химического равновесия, которое не зависит от пути реакции.
Роль катализатора состоит лишь в изменении скорости достижения состояния равновесия. Катализатор может увеличить скорость только тех процессов, которые разрешены термодинамически, но не может инициировать термодинамически невозможные реакции.
Некоторые химические реакции без катализатора практически неосуществимы из-за слишком большой энергии активации. Казалось бы, что для преодоления высокого энергетического барьера можно повысить кинетическую энергию молекул, то есть увеличить температуру. Но для многих обратимых экзотермических реакций повышение температуры приводит к смещению равновесия в обратную сторону и делает реакцию неразрешенной термодинамически. В таких случаях применение катализаторов не только оправданно, но и необходимо. Катализатор снижает энергию активации и позволяет тем самым проводить ее при существенно более низких температурах.
Молекулы реагента адсорбируются на поверхности катализатора. Адсорбция представляет собой явление, связанное с уменьшением количества газа при соприкосновении газа (адсорбата) с твердым телом (адсорбентом), и заключается в некотором уплотнении газа на поверхности твердого тела. Различают физическую адсорбцию и хемосорбцию в зависимости от того, какова природа сил, вызывающих это концентрирование молекул адсорбата у поверхности твердого тела. Если эти силы имеют такую же природу, как и молекулярное воздействие в газах, жидкостях и твердых телах, то говорят о физической адсорбции. При хемосорбции проявляются силы взаимодействия химической природы – молекулы адсорбата теряют свою индивидуальность, образуя поверхностные соединения с адсорбентом.
При протекании каталитических процессов основная роль принадлежит хемосорбции, или активированной адсорбции, результатом которой является образование активированного комплекса адсорбции – неустойчивого промежуточного соединения между реагентом и катализатором. Стадия активированной адсорбции определяет специфичность действия катализаторов в отношении различных реакций. Если химическая связь реагента с адсорбентом слишком сильная, разрушение образования комплекса, ведущее к образованию продуктов, затрудняется. Если же связь адсорбента и адсорбата слишком слабая, близкая по своей природе к физической адсорбции, то в молекуле адсорбата не происходит разрыхления связей, приводящего к снижению энергии активации каталитического процесса по сравнению с некаталитическим.
Общая химическая технология, Кутепов А.М., Москва, Высшая школа, 1990, стр.206-207, 214, 205
Определение катализа. Виды катализа. Хемосорбция и образование промежуточного активированного комплекса. Энергия активации каталитической реакции. Катализ и равновесие. Применение катализа.
Катализ – явление возбуждения химических реакций специальными веществами – катализаторами. Катализатор многократно вступает в промежуточное химическое взаимодействие с веществами, участвующими в реакции и восстанавливает свой состав после каждого цикла промежуточных взаимодействий.
Гомогенный катализ – реагирующие вещества и катализатор образуют одну фазу.
Гетерогенный катализ – вещества и катализатор находятся в разных фазах.
Микрогетерогенный катализ занимает промежуточное место между гомогенным и гетерогенным катализами. Катализатор – большие полимерные молекулы. Для взаимодействующих на них небольших молекул они подобны гетерогенным частицам, но образуют с реагентами одну фазу. В эту группу входят ферментативные реакции, в которых катализатор (фермент) – крупные белковые молекулы сложного состава и строения. Поэтому его называют и ферментативным катализом.
Химическое превращение протекает через образование активного комплекса, обладающего избыточной энергией. Ее достаточно для перестройки новых веществ – продуктов реакции. Изменение энергии системы при химическом взаимодействии по реакционному пути(1).
А – активированный комплекс
К –промежуточное соединение с катализатором
Е0, Ек – энергии исходных веществ и продуктов
Е1, Е2 – энергии активации превращения прямом и обратном направлениях
∆Н – изменение энергии в результате превращения (тепловой эффект).
Но не все молекулы обладают достаточной энергией для образования активного комплекса – только те, энергия которых превышает энергию активации Е1. Если необходимая энергия Е1 велика, то реакция практически не протекает.
Катализатор открывает новый реакционный путь, благодаря тому, что вступает в химическое взаимодействие с образованием активированного комплекса с меньшей энергией, чем требуется для образования активированного комплекса без катализатора. Промежуточное соединение, в которое входит катализатор, превращается далее в продукты через другой активированный комплекс, но тоже с меньшей энергией. После второго этапа реакции катализатор восстанавливает свой химический состав и его компоненты не входят в состав продуктов. И хотя реакционный путь удлиняется, становится стадийным, уменьшение энергии активированного комплекса приводит к увеличению скорости реакции (2).
Особый интерес к катализу проявился в период развития промышленной химии, так как возможность ускорять химические реакции в нужном направлении без расхода энергии и по существу без расхода самого вещества катализатора придали катализу большую практическую значимость. С помощью катализа решаются задачи, стоящие перед технологией связанного азота, более 80% нефти перерабатывается с использованием каталитических процессов, невозможно осуществление большинства процессов органического синтеза.
Катализаторы – вещества, которые, многократно вступая в промежуточное взаимодействие с участниками реакции, изменяют ее механизм и увеличивают скорость реакции; при этом они восстанавливают свой химический состав после каждого цикла промежуточных воздействий.
Влияние катализатора на механизм химической реакции можно пояснить на условном примере. Пусть протекает одностадийная реакция с энергией активации Е0 :
Ход реакции на энергетической диаграмме каталитической и некаталитической реакций изображен кривой 1. В присутствии катализатора механизм реакции изменяется, она протекает через несколько последовательных стадий (кривая 2). Например, первой стадией может быть образование промежуточного активированного комплекса Акт:
Затем активированный комплекс реагирует со вторым реагентом с образованием комплекса катализатора и продукта:
Последней стадией является разложение комплекса RКт с образованием продукта К и высвобождением катализатора для нового каталитического цикла:
Каждая из этих последовательных стадий характеризуется своими значениями энергии активации Е1, Е2, Е3, но, как правило, высота каждого из этих потенциальных барьеров ниже энергии активации Е0. Таким образом, в присутствии катализатора реакция протекает по более энергетически выгодному пути, что позволяет проводить процесс с большей скоростью.
Исходное(I) и конечное (II) энергетические состояния реакционной системы в присутствии катализатора и без него остаются одинаковыми; следовательно: катализатор не может изменить состояние химического равновесия, которое не зависит от пути реакции.
Роль катализатора состоит лишь в изменении скорости достижения состояния равновесия. Катализатор может увеличить скорость только тех процессов, которые разрешены термодинамически, но не может инициировать термодинамически невозможные реакции.
Некоторые химические реакции без катализатора практически неосуществимы из-за слишком большой энергии активации. Казалось бы, что для преодоления высокого энергетического барьера можно повысить кинетическую энергию молекул, то есть увеличить температуру. Но для многих обратимых экзотермических реакций повышение температуры приводит к смещению равновесия в обратную сторону и делает реакцию неразрешенной термодинамически. В таких случаях применение катализаторов не только оправданно, но и необходимо. Катализатор снижает энергию активации и позволяет тем самым проводить ее при существенно более низких температурах.
Молекулы реагента адсорбируются на поверхности катализатора. Адсорбция представляет собой явление, связанное с уменьшением количества газа при соприкосновении газа (адсорбата) с твердым телом (адсорбентом), и заключается в некотором уплотнении газа на поверхности твердого тела. Различают физическую адсорбцию и хемосорбцию в зависимости от того, какова природа сил, вызывающих это концентрирование молекул адсорбата у поверхности твердого тела. Если эти силы имеют такую же природу, как и молекулярное воздействие в газах, жидкостях и твердых телах, то говорят о физической адсорбции. При хемосорбции проявляются силы взаимодействия химической природы – молекулы адсорбата теряют свою индивидуальность, образуя поверхностные соединения с адсорбентом.
При протекании каталитических процессов основная роль принадлежит хемосорбции, или активированной адсорбции, результатом которой является образование активированного комплекса адсорбции – неустойчивого промежуточного соединения между реагентом и катализатором. Стадия активированной адсорбции определяет специфичность действия катализаторов в отношении различных реакций. Если химическая связь реагента с адсорбентом слишком сильная, разрушение образования комплекса, ведущее к образованию продуктов, затрудняется. Если же связь адсорбента и адсорбата слишком слабая, близкая по своей природе к физической адсорбции, то в молекуле адсорбата не происходит разрыхления связей, приводящего к снижению энергии активации каталитического процесса по сравнению с некаталитическим.
Общая химическая технология, Кутепов А.М., Москва, Высшая школа, 1990, стр.206-207, 214, 205
КАТАЛИЗ (от греческого katalysis - разрушение), ускорение химической реакции в присутствии вещества - катализатора, который взаимодействует с реагентами, но в реакции не расходуется и не входит в состав конечных продуктов.
Использование катализаторов позволяет проводить химические процессы при небольших температурах с предпочтительным образованием одного продукта из нескольких возможных.
Каталитическими процессами являются производство аммиака, серной кислоты, многих полимеров и др. Многие процессы в живых организмах ускоряются катализаторами - ферментами.
Являясь катализаторами, ферменты имеют ряд общих с небиологическими катализаторами свойств:
1. Ферменты не входят в состав конечных продуктов реакции и выходят из нее, как правило, в первоначальном виде, т.е. они не расходуются в процессе катализа.
2. Ферменты не могут возбудить те реакции, протекание которых противоречит законам термодинамики, они ускоряют только те реакции,которые могут протекать и без них.
3. Ферменты не смещают положения равновесия, а лишь ускоряют его достижение.
Биологический катализ имеет некоторые специфические свойства:
1. По своему химическому строению все ферменты являются белками.
2. Эффективность ферментов намного выше, чем небиологических катализаторов (скорость протекания реакции при участии фермента выше на несколько порядков).
3. Ферменты обладают узкой специфичностью, избирательностью действия на субстраты, т.е. на вещества, превращение которых они катализируют. 4. Регулируемость ферментов как биокатализаторов.
5. Термолабильность ферментов. Скорость химических реакций зависит от температуры, поэтому катализируемые ферментами реакции также чувствительны к изменениям температуры. Однако вследствие белковой природы фермента тепловая денатурация при повышении температуры будет снижать эффективную концентрацию фермента с соответствующим снижением скорости реакции
32. Классификация гормонов Роль гормонов в регуляции метаболизма
По химическому строению известные гормоны позвоночных делят на основные классы:
-Производные полиеновых (полиненасыщенных) жирных кислот
Структура гормонов позвоночных животных, точнее её основы, встречается у беспозвоночных, растений и одноклеточных организмов. По-видимому, структура гормонов возникла 3,5 млрд лет назад, но приобрела гормональные функции лишь в последние 500 млн лет в филогенезе животного мира. При этом в процессе эволюции изменилась не только структура, но и функции гормональных соединений. Наибольшему изменению подверглось химическое строение белково-пептидных гормонов. В большинстве случаев, гомологичный гормон высших позвоночных обладает способностью воспроизводить физиологические эффекты у низших позвоночных, однако обратная картина наблюдается значительно реже.
Гормоны этого класса — полициклические химические соединения липидной природы, в основе структуры которых находится стерановое ядро (циклопентанпергидрофенантрен), конденсированное из трёх насыщенных шестичленных колец и одного насыщенного пятичленного кольца (D). Стерановое ядро обусловливает общность (единство) полиморфного класса стероидных гормонов, а сочетание относительно небольших модификаций стеранового скелета определяет расхождение свойств гормонов этого класса.
Стероидные гормоны, проникнув в клетку, связываются с цитоплазматич. рецепторами, образовавшийся комплекс транспортируется в ядро, где он связывается с белками хроматина и регулирует транскрипцию определенных генов. Гормоны щитовидной железы также действуют непосредственно на ядро, но, в отличие от стероидных, после проникания в клетку сразу связываются с ядерными рецепторами. Все остальные гормоны взаимод. с рецепторами, находящимися на клеточной поверхности. Действие подавляющего большинства этих гормонов опосредовано изменением в клетке концентрации циклич. 3',5'-аденозинмонофосфата (ц-АМФ).
Связывание гормонов с-рецептором, находящимся на клеточной пов-сти, вызывает активацию фермента аденилатциклазы, катализирующего превращение АТФ в ц-АМФ; последний взаимод. с регуляторной субъединицей фермента протеинкиназы и вызывает ее отщепление от каталитич. субъединицы. Освободившаяся субъединица протеинкиназы катализирует фосфорилирование ряда белков, в результате чего изменяются конформация нёк-рых структурных белков и активность мн. ферментов.
Для некоторыхрых пептидных гормонов (инсулина, пролактина, соматотропина) механизм действия еще не расшифрован, но, повидимому, они также взаимод. с рецепторами, находящимися на клеточной пов-сти, вызывая образование посредников.
Читайте также:

