Изотопы их получение и применение кратко
Обновлено: 02.07.2024
В 1932 был открыт нейтрон – частица, не имеющая заряда, с массой, близкой к массе ядра атома водорода – протона, и создана протонно-нейтронная модель ядра. В результате в науке установилось окончательное современное определение понятия изотопов: изотопы – это вещества, ядра атомов которых состоят из одинакового числа протонов и отличаются лишь числом нейтронов в ядре. Каждый изотоп принято обозначать набором символов, где X – символ химического элемента, Z – заряд ядра атома (число протонов) , А – массовое число изотопа (общее число нуклонов – протонов и нейтронов в ядре, A = Z + N). Поскольку заряд ядра оказывается однозначно связанным с символом химического элемента, часто для сокращения используется просто обозначение AX.
Из всех известных нам изотопов только изотопы водорода имеют собственные названия. Так, изотопы 2H и 3H носят названия дейтерия и трития и получили обозначения соответственно D и T (изотоп 1H называют иногда протием) .
В природе встречаются как стабильные изотопы, так и нестабильные – радиоактивные, ядра атомов которых подвержены самопроизвольному превращению в другие ядра с испусканием различных частиц (или процессам так называемого радиоактивного распада) . Сейчас известно около 270 стабильных изотопов, причем стабильные изотопы встречаются только у элементов с атомным номером Z Ј 83. Число нестабильных изотопов превышает 2000, подавляющее большинство их получено искусственным путем в результате осуществления различных ядерных реакций. Число радиоактивных изотопов у многих элементов очень велико и может превышать два десятка. Число стабильных изотопов существенно меньше, Некоторые химические элементы состоят лишь из одного стабильного изотопа (бериллий, фтор, натрий, алюминий, фосфор, марганец, золото и ряд других элементов) . Наибольшее число стабильных изотопов – 10 обнаружено у олова, у железа, например, их – 4, у ртути – 7.
С помощью ядерных реакций можно получить рад. изотопы всех хим. элементов. Получают их на ускорителях эл. частиц и атомных реакторах. Их еще наз. "меченые атомы".Применяют: биологии, медицине, промышленности, сельском хозяйстве, археологии.
В атомной индустрии всевозрастающую ценность для человечества представляют радиоактивные изотопы.
Элементы, не существующие в природе
С помощью ядерных реакций можно получить радиоактивные изотопы всех химических элементов, встречающихся в природе только в стабильном состоянии.
Элементы под номерами 43, 61, 85 и 87 вообще не имеют стабильных изотопов и впервые получены искусственно.
Так, например, элемент с порядковым номером Z = 43, названный технецием, имеет самый долгоживущий изотоп с периодом полураспада около миллиона лет.
С помощью ядерных реакций получены также трансурановые элементы.
О нептунии и плутонии вы уже знаете.
Кроме них, получены еще следующие элементы: америций (Z = 95), кюрий (Z = 96), берклий (Z = 97), калифорний (Z = 98), эйнштейний (Z = 99), фермий (Z = 100), менделевий (Z = 101), нобелий (Z = 102), лоуренсий (Z = 103), резерфордий (Z = 104), дубний (Z = 105), сиборгий (Z = 106), борий (Z = 107), хассий (Z = 108), мейтнерий (Z = 109), а также элементы под номерами 110, 111 и 112, не имеющие пока общепризнанных названий.
Элементы, начиная с номера 104, впервые синтезированы либо в подмосковной Дубне, либо в Германии.
Меченые атомы
В настоящее время как в науке, так и в производстве все более широко используются радиоактивные изотопы различных химических элементов.
Наибольшее применение имеет метод меченых атомов.
Метод основан на том, что химические свойства радиоактивных изотопов не отличаются от свойств нерадиоактивных изотопов тех же элементов.
Обнаружить радиоактивные изотопы можно очень просто — по их излучению.
Радиоактивность является своеобразной меткой, с помощью которой можно проследить за поведением элемента при различных химических реакциях и физических превращениях веществ.
Метод меченых атомов стал одним из наиболее действенных методов при решении многочисленных проблем биологии, физиологии, медицины и т. д.
Радиоактивные изотопы — источники излучений

Радиоактивные изотопы широко применяются в науке, медицине и технике как компактные источники γ-лучей.
Главным образом используется радиоактивный кобальт
Получение радиоактивных изотопов
Получают радиоактивные изотопы в атомных реакторах и на ускорителях элементарных частиц.
В настоящее время производством изотопов занята большая отрасль промышленности.
Радиоактивные изотопы в биологии и медицине
Одним из наиболее выдающихся исследований, проведенных с помощью меченых атомов, явилось исследование обмена веществ в организмах.
Было доказано, что за сравнительно небольшое время организм подвергается почти полному обновлению.
Слагающие его атомы заменяются новыми.

Лишь железо, как показали опыты по изотопному исследованию крови, является исключением из этого правила.
Железо входит в состав гемоглобина красных кровяных шариков.
При введении в пищу радиоактивных атомов железа было обнаружено, что они почти не поступают в кровь.
Только в том случае, когда запасы железа в организме иссякают, железо начинает усваиваться организмом.

Если не существует достаточно долго живущих радиоактивных изотопов, как, например, у кислорода и азота, меняют изотопный состав стабильных элементов.
Так, добавлением к кислороду избытка изотопа было установлено, что свободный кислород, выделяющийся при фотосинтезе, первоначально входил в состав воды, а не углекислого газа.
Радиоактивные изотопы применяются в медицине как для постановки диагноза, так и для терапевтических целей.
Радиоактивный натрий, вводимый в небольших количествах в кровь, используется для исследования кровообращения.
Иод интенсивно отлагается в щитовидной железе, особенно при базедовой болезни.
Наблюдая с помощью счетчика за отложением радиоактивного иода, можно быстро поставить диагноз.
Большие дозы радиоактивного иода вызывают частичное разрушение аномально развивающихся тканей, и поэтому радиоактивный иод используют для лечения базедовой болезни.
Интенсивное γ-излучение кобальта используется при лечении раковых заболеваний (кобальтовая пушка).
Радиоактивные изотопы в промышленности
Не менее обширна область применения радиоактивных изотопов в промышленности.
Одним из примеров может служить способ контроля износа поршневых колец в двигателях внутреннего сгорания.
Облучая поршневое кольцо нейтронами, вызывают в нем ядерные реакции и делают его радиоактивным.
При работе двигателя частички материала кольца попадают в смазочное масло.
Исследуя уровень радиоактивности масла после определенного времени работы двигателя, определяют износ кольца.
Радиоактивные изотопы позволяют судить о диффузии металлов, процессах в доменных печах и т. д.
Мощное γ-излучение радиоактивных препаратов используют для исследования внутренней структуры металлических отливок с целью обнаружения в них дефектов.
Радиоактивные изотопы в сельском хозяйстве
Все более широкое применение получают радиоактивные изотопы в сельском хозяйстве.
Облучение семян растений (хлопчатника, капусты, редиса и др.) небольшими дозами γ-лучей от радиоактивных препаратов приводит к заметному повышению урожайности.
Большие дозы радиации вызывают мутации у растений и микроорганизмов, что в отдельных случаях приводит к появлению мутантов с новыми ценными свойствами (радиоселекция).
Так выведены ценные сорта пшеницы, фасоли и других культур, а также получены высокопродуктивные микроорганизмы, применяемые в производстве антибиотиков.
Гамма-излучение радиоактивных изотопов используется также для борьбы с вредными насекомыми и для консервации пищевых продуктов.

Широкое применение получили меченые атомы в агротехнике.
Например, чтобы выяснить, какое из фосфорных удобрений лучше усваивается растением, помечают различные удобрения радиоактивным фосфором
Исследуя затем растения на радиоактивность, можно определить количество усвоенного ими фосфора из разных сортов удобрения.
Радиоактивные изотопы в археологии

Интересное применение для определения возраста древних предметов органического происхождения (дерева, древесного угля, тканей и т. д.) получил метод радиоактивного углерода.
В растениях всегда имеется β-радиоактивный изотоп углерода с периодом полураспада Т = 5700 лет.
Он образуется в атмосфере Земли в небольшом количестве из азота под действием нейтронов.
Последние же возникают за счет ядерных реакций, вызванных быстрыми частицами, которые поступают в атмосферу из космоса (космические лучи).
Соединяясь с кислородом, этот изотоп углерода образует углекислый газ, поглощаемый растениями, а через них и животными.
Один грамм углерода из образцов молодого леса испускает около пятнадцати β-частиц в секунду.
После гибели организма пополнение его радиоактивным углеродом прекращается.
Имеющееся же количество этого изотопа убывает за счет радиоактивности.
Определяя процентное содержание радиоактивного углерода в органических остатках, можно определить их возраст, если он лежит в пределах от 1000 до 50 000 и даже до 100 000 лет.
Таким методом узнают возраст египетских мумий, остатков доисторических костров и т. д.
Радиоактивные изотопы широко применяются в биологии, медицине, промышленности, сельском хозяйстве и даже в археологии.
Физика атомного ядра. Физика, учебник для 11 класса - Класс!ная физика
Радиоактивные изотопы, встречающие в природе, называются естественными. Но многие химические элементы встречаются в природе только в стабильном (т.е. радиоактивном) состоянии.
В 1934 году французские ученые Ирен и Фредерик Жолио – Кюри обнаружили, что радиоактивные изотопы могут быть созданы искусственным путем в результате ядерных реакций. Такие изотопы назвали искусственными.
Для получения искусственных радиоактивных изотопов обычно используют ядерные реакторы и ускорители элементарных частиц. Существует отрасль промышленности, специализирующаяся на производстве таких элементов.
Впоследствии был получены искусственные изотопы всех химических элементов. Всего в настоящее время известно примерно 2000 радиоактивных изотопов, причем 300 из них – естественные.
В настоящее время радиоактивные изотопы широко применяют в различных сферах научной и практической деятельности: техника, медицина, сельское хозяйство, средства связи, военной области и в некоторых других. При этом часто используют так называемый метод меченых атомов.
В постиндустриальную эпоху развития человечества все больше стало отдавать предпочтение новым технология получения энергии. Изотопы являются субстратом в энергетическом производстве (топливный компонент ядерного реактора). Также данные видоизменные химические атомы используются и других областях человеческой деятельности: медицина, патологическая физиология, отрасль изготовление ядерного оружия.
- Что такое изотоп?
- Обозначения изотопов
- Изотопы водорода
- Изотопы урана
- Нуклиды
- Изотопы галлия
- Превращения изотопов
- Применение радиоактивных изотопов
Что такое изотоп?
Изотопами называют видоизменные элементы периодической таблицы Менделеева, которые имеют один и тот же порядковый номер, но различную атомную массу. Название характеризует нахождение подобных структур в одной клеточке периодической таблицы с нормальными элементами (изо – равное, топ – положение, место – в переводе с английского). Состав изотопов представляет собой совокупность протонов, электронов и нейтронов (количество нейтронов обычно больше, чем в обычных элементах периодической таблицы).
Обозначения изотопов
Видоизмененные элементы периодической таблицы Менделеева обозначаются следующим образом: к символу химического элемента, к которому принадлежит изотоп, подписывается верхний левый индекс с обозначением массового числа. Так, например, изотоп кислорода, обладающий массовым числом равным восемнадцати атомных единиц, будет обозначаться следующим образом: 18 O. Имеется также другое обозначение подобных атомов (например, кислород – 18).
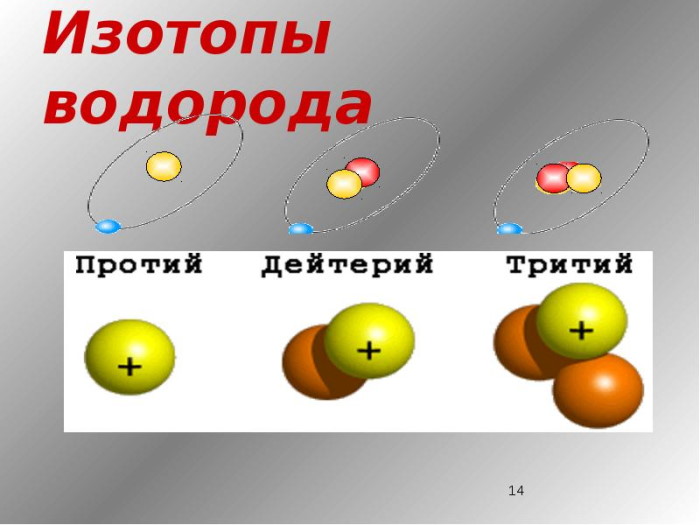
Изотопы водорода
Выделяют три видоизменённых атома водорода, обладающих разными массовыми числами:
протий (Н) – одна атомная единица массы;
дейтерий (D) – две атомные единицы массы;
тритий (Т) – три атомные единицы массы.
В природе чаще всего встречается протий (в 99,98 процентах случаев), именно поэтому среднее массовое число водорода будет равняться приблизительно 1 а.е.м. Стоит, отметить, что бета-распад трития составляет порядка 12 лет, после чего он переходит в форму Гелий - 3.
Отдельно необходимо выделить, видоизменённые атомы водорода, массовое число которого может колебаться в районе 4 – 7 а.е.м.
Изотопы урана
Изотопный ряд урана включает в себя изотопы, имеющие массу от 219 а.е.м. до 243 а.е.м. Элементы, обладающие наибольшей изотопной распространенностью – это уран – 235 и уран – 238.
Изотопные атомные урана с массовыми числами 235 и 238 представляют собой основной компонент для производства плутония – 239 (основного компонента ядерного оружия и ядерного топлива для реакторов нового поколения).
Нуклиды
Нуклиды подразделяются на две больших категории:
Химический элемент периодической таблицы ртуть (гидраргирум) обладает наибольшей изотопной распространенностью стабильных нуклидов. Так, стабильные нуклиды ртути – это вещества изотопного ряда гидраргиума, обладающие атомной массой от 170 а.е.м. до 219 а.е.м.
Термин нуклид (в понятии радионуклид) был предложен в двадцатом веке американцем Трумэном Команом. Радионуклиды отличаются длительным периодом полураспада, который в большинстве случаев имеет значение порядка 5*10 8 лет. Таким образом, радионуклиды населяют Землю с момента ее зарождения как планеты. В зависимости от массового числа нуклиды могут подвергать различным видам превращения, обозначим некоторые из них:
альфа-распад (для большинства радионуклидов подобный вид распада не наблюдается и из-за большого периода полураспада);
нейтронный и двухнейтронный распады.
Изотопы галлия
Изотопный ряд галлия представлен элементами, обладающими промежутком массовых числен от 49 а.е.м. до 71 а.е.м. Наиболее часто в природе встречаются следующие изотопные атомы: галлий – 69, галлий -71. Природный галлий обычно представлен смесью двух данных видоизмененных атомов, имеющих малый период полураспада (порядка 68 минут). Для представителей изотопного ряда галлия характерные следующие виды ядерных превращений:
электронный захват (наблюдается в 13% случаев);
позитронный распад (наблюдается в 87% случаев).
Превращения изотопов
Превращения изотопов могут протекать двумя способами:
при участии технологий, созданных человеком (используется в промышленности);
самопроизвольно (протекает в природе).
Выделяют следующие виды ядерных превращений, связанных со изменением атомной массы химических элементов: распад (альфа, бета, двойной бета, нейтронный, позитронный), электронный захват (происходит присоединение электрона, вследствие чего изменяется заряд и состав нуклида).
Применение радиоактивных изотопов
Изотопы химических элементов представляют собой элементы периодической таблицы Менделеева, обладающие нестабильными ядрами и свойством подвергаться различного ядерному распаду. В научной терминологии подобные атомы называют также радионуклидами. Радиоактивные изотопы применяются в различных сферах человеческой деятельности.
В сельском хозяйстве использования радиоизотопов необходимо для изучения особенностей роста, развития и функционирования корневых систем растений (такой способ изучения получил название – метод меченных атомов).
В авиастроительстве радионуклиды применяют для испытания авиационных конструкций на предмет износостойкости.
В сфере градостроительстве радиоактивные изотопы нашли свое применение как универсальные измерители плотности почвы.
В области коммунального хозяйства видоизмененные химические элементы, обладающие радиоактивной способностью, применяют в целях стерилизации постельного белья.
В текстильной промышленности радионуклиды используются для удаления электрических зарядов с поверхности одежды.
В машиностроительной отрасли радионуклиды используются для определения толщины металлического покрытия.
Особое место в этом списке занимает использование радиоактивных изотопов в химической промышленности и в сфере медицинских услуг. Так, получение различных полимерных соединений, которые составляют основу большинства современных предметов обихода, письменных принадлежностей, резиновых изделий того или иногда вида использования происходит при помощи взаимодействия y-излучения с различными химическими соединениями органической природы. В медицине радиоизотопы применяются в лечебных целях в рамках радиационной терапии (процедура, при которой под воздействием радионуклидов происходит разрушение любого типа живой ткани). Радиотерапия нашла свое применения в области лечения онкологических заболеваний (на данный момент, по эффективности радиотерапия уступает только химиотерапии, но зачастую данные способы лечения составляют две стадии одного процесса).
В заключении, стоит отметить, что научный прогресс в области получения новых видов изотопов тех или иных химических элементов не стоит на месте, поэтому возможно в будущем при помощи грамотного и целесообразного использования видоизмененных атомов можно будет лечить неизлечимые на данный момент заболеваний и строить космические корабли для покорения других планет и галактик.
Читайте также:

