Изобразите зависимость потенциальной энергии взаимодействия молекул от расстояния между ними кратко
Обновлено: 30.06.2024
Можно ли объяснить свойства вещества во всех его агрегатных состояниях строением вещества, движением и взаимодействием его частиц?
Силы взаимодействия молекул.
Молекулы взаимодействуют друг с другом. Без этого взаимодействия не было бы ни твёрдых, ни жидких тел.
Доказать существование значительных сил взаимодействия между атомами или молекулами несложно. Попробуйте-ка сломать толстую палку! А ведь она состоит из молекул. Но одни силы притяжения не могут обеспечить существования устойчивых образований из атомов и молекул. На очень малых расстояниях между молекулами обязательно действуют силы отталкивания. Благодаря этому молекулы не проникают друг в друга и куски вещества никогда не сжимаются до размеров порядка размеров одной молекулы.
Молекула — это сложная система, состоящая из отдельных заряженных частиц: электронов и атомных ядер.
В целом молекулы электрически нейтральны, тем не менее между ними на малых расстояниях действуют значительные электрические силы: происходит взаимодействие электронов и атомных ядер соседних молекул.
Если молекулы находятся на расстояниях, превышающих их размеры в несколько раз, то силы взаимодействия практически не сказываются.
На расстояниях, превышающих 2—3 диаметра молекул, действуют силы притяжения. По мере уменьшения расстояния между молекулами сила их взаимного притяжения сначала увеличивается, но одновременно увеличивается и сила отталкивания. При определённом расстоянии r0 сила притяжения становится равной силе отталкивания. Это расстояние считается равным диаметру молекулы.


При дальнейшем уменьшении расстояния электронные оболочки атомов начинают перекрываться и быстро увеличивается сила отталкивания. На рисунке 8.5 показаны графики зависимости потенциальной энергии взаимодействия молекул (рис. 8.5, а) и сил притяжения (1) и отталкивания (2) (рис. 8.5, б) от расстояния между молекулами. При r = r0 потенциальная энергия минимальна, сила притяжения равна силе отталкивания. При r > r0 сила притяжения больше силы отталкивания; при r
Молекулы жидкости находятся непосредственно друг возле друга. При уменьшении объёма силы отталкивания становятся очень велики. Этим и объясняется малая сжимаемость жидкостей.
Жидкости: 1) малосжимаемы;
2) текучи, т. е. не сохраняют своей формы.
Объяснить текучесть жидкостей можно так. Внешняя сила заметно не меняет числа перескоков молекул в секунду. Но перескоки молекул из одного оседлого положения в другое происходят преимущественно в направлении действия внешней силы. Вот почему жидкость течёт и принимает форму сосуда.
В жидкостях средняя кинетическая энергия теплового движения молекул сравнима со средней потенциальной энергией их взаимодействия. Наличие поверхностного натяжения доказывает, что силы взаимодействия молекул жидкостей существенны, и ими пренебрегать нельзя.
Твёрдые тела.
Атомы или молекулы твёрдых тел, в отличие от атомов и молекул жидкостей, колеблются около определённых положений равновесия. По этой причине твёрдые тела сохраняют не только объём, но и форму.
В твёрдых телах средняя потенциальная энергия взаимодействия молекул много больше средней кинетической энергии их теплового движения.
Если соединить центры положений равновесия атомов или ионов твёрдого тела, то получится правильная пространственная решётка, называемая кристаллической.

На рисунках 8.6 и 8.7 изображены кристаллические решётки поваренной соли и алмаза. Внутренний порядок в расположении атомов кристаллов приводит к правильным внешним геометрическим формам.
Основные положения МКТ. Тепловые явления - Физика, учебник для 10 класса - Класс!ная физика
Между молекулами вещества одновременно действуют силы притяжения и силы отталкивания. На расстоянии r = r0 сила F = 0, т. е. силы притяжения и отталкивания уравновешивают друг друга (см. рис.1). Таким образом, расстояние r0 соответствует равновесному состоянию между молекулами, на котором бы они находились в отсутствие теплового движения. При r 0), при г> г0 — силы притяжения (Fn 10 -9 м межмолекулярные силы взаимодействия практически отсутствуют (F → 0).
Зависимость потенциальной энергии межмолекулярного взаимодействия от расстояния между молекулами
Элементарная работа δА силы F при увеличении расстояния между молекулами на dr совершается за счет уменьшения взаимной потенциальной энергии молекул, т. е. δA = F dr = - dП. Согласно рисунку б, если молекулы находятся друг от друга на расстоянии, на котором межмолекулярные силы взаимодействия не действуют (r →∞), то П = 0. При постепенном сближении молекул между ними появляются силы притяжения (F 0). Тогда потенциальная энергия взаимодействия уменьшается, достигая минимума при r = r0. При r 0) резко возрастают и совершаемая против них работа отрицательна (δА = F dr
Проанализируем изотермы уравнения Ван–дер–Ваальса – зависимости Р от V для реального газа при постоянной температуре. Умножив уравнение Ван-дер-Ваальса на V 2 и раскрыв скобки, получаем
Поскольку данное уравнение имеет третью степень относительно V, а коэффициенты при V действительны, то оно имеет либо один, либо три вещественных корня, т.е. изобара Р = const пересекает кривую Р = Р(V) в одной или трех точках, как это изображено на рисунке 7.4. Причем с повышением температуры мы перейдем от немонотонной зависимости Р = Р(V) к монотонной однозначной функции. Изотерма при Ткр, которая разделяет немонотонные T Ткр изотермы, соответствует изотерме при критической температуре. При температуре выше критической зависимость Р = Р(V) является однозначной монотонной функцией объема. Это означает, что при T > Ткр вещество находится только в одном, газообразном состоянии, как это имело место у идеального газа. При температуре газа ниже критической такая однозначность исчезает, а это означает возможность перехода вещества из газообразного в жидкое и наоборот. На участке АСВ изотермыТ1 давление растет с увеличением объема (dP/dV) > 0. Данное состояние неустойчиво, поскольку здесь должны усиливаться малейшие флуктуации плотности. Поэтому область ВСА не может устойчиво существовать. В областях DLBи AGEдавление падает с увеличением объема (dP/dV)Т
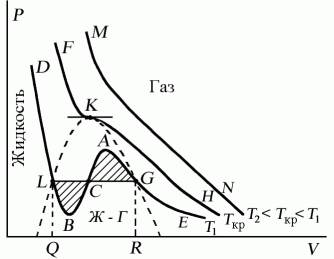
Рис. 7.4
Наличие критической точки на изотерме Ван–дер–Ваальса означает, что для каждой жидкости существует такая температура, выше которой вещество может существовать только в газообразном состоянии. К этому заключению пришел и Д.И. Менделеев в 1861 г. Он заметил, что при определенной температуре прекращалось поднятие жидкости в капиллярах, т.е. поверхностное натяжение обращалось в нуль. При той же температуре обращалась в нуль скрытая теплота парообразования. Такую температуру Менделеев назвал температурой абсолютного кипения. Выше этой температуры, согласно Менделееву, газ не может быть сконденсирован в жидкость никаким увеличением давления.
Критическую точку K мы определили как точку перегиба критической изотермы, в которой касательная к изотерме горизонтальна (рис. 7.5). Ее можно определить также как точку, в которую в пределе переходят горизонтальные участки изотерм при повышении температуры до критической. На этом основан способ определения критических параметров Pk, Vk, Тk, принадлежащий Эндрюсу. Строится система изотерм при различных температурах. Предельная изотерма, у которой горизонтальный участок LG (рис. 7.4) переходит в точку, будет критической изотермой, а указанная точка – критической точкой (рис. 7.5).
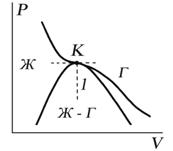
Рис. 7.5
Характер взаимодействия между молекулами лучше всего показать с помощью приведенной на рис. 6 кривой, изображающей взаимную потенциальную энергию двух молекул как функцию расстояния r между их центрами. При построении этой кривой потенциальная энергия молекул, находящихся на бесконечно большом расcтоянии друг от друга (т. е. когда они не взаимодействуют), положена равной нулю. Следовательно, кривая идет так, что при r, стремящемся к бесконечности, асимптотически приближается к оси r.

Рис.6. Зависимость потенциальной энергии взаимодействия молекул от расстояния между молекулами
Зная потенциальную энергию как функцию r, можно определить силу, с которой взаимодействуют молекулы на разных расстояниях друг от друга. Для этого нужно воспользоваться известным из механики соотношением

Рассмотрим с помощью кривой εР процесс сближения (соударения) молекул. Поместим мысленно центр одной из молекул в начало координат, а центр второй молекулы представим перемещающимся по оси r. Пусть вторая молекула летит по направлению к первой из бесконечности, имея начальный запас кинетической энергии εk = ε1. Приближаясь к первой молекуле, вторая под действием силы притяжения движется со все возрастающей скоростью. В результате кинетическая энергия молекулы ей также растет. Однако полная энергия системы, равная ε = εk + εр, остается неизменной (система двух молекул замкнута) и равной ε1 так как одновременно уменьшается потенциальная энергия εр. При прохождении молекулой точки с координатой r0 силы притяжения сменяются силами отталкивания, вследствие чего молекула начинает быстро терять скорость (в области отталкивания кривая εр идет очень круто). В момент, когда потенциальная энергия εр становится равной полной энергии системы ε1, скорость молекулы обращается в нуль. В этот момент имеет место наибольшее сближение молекул друг с другом. Минимальное расстояние d1, на которое могут сблизиться центры молекул, представляет собой эффективный диаметр молекулы. После остановки молекулы все явления протекают в обратной последовательности: сначала молекула движется со все возрастающей скоростью под действием силы отталкивания; миновав расстояние r0, молекула попадает под действие замедляющей ее движение силы притяжения и, наконец, удаляется на бесконечность, имея первоначальный запас кинетической энергии ε1.
Из рис. 6 видно, что в случае, когда молекула начинает свое движение из бесконечности с большим запасом энергии ε2, минимальное расстояние d2,на которое сближаются центры молекул, оказывается меньшим. Таким образом, эффективный диаметр молекул зависит от их средней энергии, а следовательно, и от температуры. С повышением температуры эффективный диаметр молекул d уменьшается, вследствие чего средняя длина свободного пробега λ растет.

Рис.7. Зависимость потенциальной энергии взаимодействия молекул от расстояния между молекулами в модели идеального газа

Характер взаимодействия между молекулами, предполагавшийся при выводе уравнения состояния идеального газа, соответствует потенциальной кривой, изображенной на рис. 7. На расстояниях, превышающих r0, εр постоянна, вследствие чего сила равна нулю. При r = r0 εр обращается в бесконечность, образуя потенциальный барьер, препятствующий сближению центров молекул на расстояния, меньшие r0. Такое упрощенное рассмотрение допустимо, если средние расстояния между молекулами в газе достаточно велики: при больших r кривая εр на рис. 6 идет очень полого, вследствие чего . По мере же уменьшения среднего расстояния между молекулами, т. е. при увеличении плотности газа, роль сил притяжения между молекулами все больше растет. Одновременно, как мы видели выше, сокращается та часть занимаемого газом объема, в пределах которой может происходить движение молекул.

Характер взаимодействия между молекулами лучше всего показать с помощью приведенной на рис. 6 кривой, изображающей взаимную потенциальную энергию двух молекул как функцию расстояния r между их центрами. При построении этой кривой потенциальная энергия молекул, находящихся на бесконечно большом расcтоянии друг от друга (т. е. когда они не взаимодействуют), положена равной нулю. Следовательно, кривая идет так, что при r, стремящемся к бесконечности, асимптотически приближается к оси r.

Рис.6. Зависимость потенциальной энергии взаимодействия молекул от расстояния между молекулами
Зная потенциальную энергию как функцию r, можно определить силу, с которой взаимодействуют молекулы на разных расстояниях друг от друга. Для этого нужно воспользоваться известным из механики соотношением

Рассмотрим с помощью кривой εР процесс сближения (соударения) молекул. Поместим мысленно центр одной из молекул в начало координат, а центр второй молекулы представим перемещающимся по оси r. Пусть вторая молекула летит по направлению к первой из бесконечности, имея начальный запас кинетической энергии εk = ε1. Приближаясь к первой молекуле, вторая под действием силы притяжения движется со все возрастающей скоростью. В результате кинетическая энергия молекулы ей также растет. Однако полная энергия системы, равная ε = εk + εр, остается неизменной (система двух молекул замкнута) и равной ε1 так как одновременно уменьшается потенциальная энергия εр. При прохождении молекулой точки с координатой r0 силы притяжения сменяются силами отталкивания, вследствие чего молекула начинает быстро терять скорость (в области отталкивания кривая εр идет очень круто). В момент, когда потенциальная энергия εр становится равной полной энергии системы ε1, скорость молекулы обращается в нуль. В этот момент имеет место наибольшее сближение молекул друг с другом. Минимальное расстояние d1, на которое могут сблизиться центры молекул, представляет собой эффективный диаметр молекулы. После остановки молекулы все явления протекают в обратной последовательности: сначала молекула движется со все возрастающей скоростью под действием силы отталкивания; миновав расстояние r0, молекула попадает под действие замедляющей ее движение силы притяжения и, наконец, удаляется на бесконечность, имея первоначальный запас кинетической энергии ε1.
Из рис. 6 видно, что в случае, когда молекула начинает свое движение из бесконечности с большим запасом энергии ε2, минимальное расстояние d2,на которое сближаются центры молекул, оказывается меньшим. Таким образом, эффективный диаметр молекул зависит от их средней энергии, а следовательно, и от температуры. С повышением температуры эффективный диаметр молекул d уменьшается, вследствие чего средняя длина свободного пробега λ растет.

Рис.7. Зависимость потенциальной энергии взаимодействия молекул от расстояния между молекулами в модели идеального газа

Характер взаимодействия между молекулами, предполагавшийся при выводе уравнения состояния идеального газа, соответствует потенциальной кривой, изображенной на рис. 7. На расстояниях, превышающих r0, εр постоянна, вследствие чего сила равна нулю. При r = r0 εр обращается в бесконечность, образуя потенциальный барьер, препятствующий сближению центров молекул на расстояния, меньшие r0. Такое упрощенное рассмотрение допустимо, если средние расстояния между молекулами в газе достаточно велики: при больших r кривая εр на рис. 6 идет очень полого, вследствие чего . По мере же уменьшения среднего расстояния между молекулами, т. е. при увеличении плотности газа, роль сил притяжения между молекулами все больше растет. Одновременно, как мы видели выше, сокращается та часть занимаемого газом объема, в пределах которой может происходить движение молекул.
Характер и величина силы взаимодействия между молекулами зависят от расстояния между ними. Установлено, что на малых расстояниях молекулы отталкиваются друг от друга, а на больших — притягиваются. На рис. 11.2 показано изменение сил взаимодействия двух изолированных молекул в зависимости от расстояния между ними (для простоты рассуждений молекулы предполагаются одинаковыми).
Такой характер зависимости от можно объяснить, если предположить, что между молекулами одновременно существуют силы отталкивания, быстро убывающие с расстоянием, и силы притяжения, также ослабляющиеся с расстоянием, но медленнее. На расстоянии эти силы равны, т. е. их равнодействующая равна нулю. При преобладают силы отталкивания, при силы притяжения.
Легко показать, что при таком характере сил взаимодействия молекулы будут совершать колебательные движения. Действительно, допустим, что при когда силы взаимодействия между молекулами равны нулю, молекулы движутся навстречу друг другу со скоростями, равными Тогда по мере уменьшения расстояния между молекулами силы отталкивания будут совершать отрицательную работу, уменьшая кинетическую энергию их, и на некотором расстоянии
молекулы, потеряв своюэнергию, остановятся. Можно утверждать, что при этом кинетическая энергия обеих молекул перешла в потенциальную энергию их взаимодействия.
В масштабе чертежа, приведенного на рис. 11.2, эта энергия, равная работе сил отталкивания на участке от до изобразится заштрихованными площадками В дальнейшем силы отталкивания отбрасывают молекулы друг от друга и потенциальная энергия этой системы переходит обратно в кинетическую энергию. На расстоянии потенциальная энергия системы становится равной нулю (так как равны нулю силы взаимодействия), т. е. целиком переходит в кинетическую энергию удаляющихся друг от друга молекул. При увеличении расстояния между ними начнут действовать силы притяжения, которые остановят эти молекулы на некотором расстоянии В этом состоянии опять-таки кинетическая энергия молекул целиком превращена в потенциальную; на рис. 11.2 эти энергии изобразятся заштрихованными площадками (очевидно, В последующем начнется обратное движение молекул и процесс повторяется: расстояние между молекулами периодически изменяется от до
Описанное выше колебательное движение молекул не является, вообще говоря, гармоническим, так как действующие на молекулы силы не удовлетворяют условию линейности коэффициент упругой силы, смещение молекул от положения равновесия). Лишь при малых амплитудах колебаний, когда достаточно малы и отрезок кривой на участке может быть заменен отрезком прямой, колебания будут близки к гармоническим.
Мы рассматривали колебательное движение двух изолированных молекул, находящихся достаточно далеко от других молекул. Действительная картина колебательных движений в веществе гораздо сложнее, так как каждая молекула одновременно взаимодействует со многими другими молекулами. При этом в конечном счете движение молекул является беспорядочным, т. е. направления колебательных движений изменяются с течением времени совершенно беспорядочно.
Работа, необходимая для отрыва молекул друг от друга, может быть сообщена им различными способами; в частности, связь между данной парой взаимодействующих молекул может быть разрушена
тепловым столкновением с другими молекулами. Вероятность такого события особенно велика, если средняя кинетическая энергия теплового движения молекул превосходит по величине работу отрыва молекул друг от друга. Так как средняя кинетическая энергия теплового движения пропорциональна температуре, то при очень высоких температурах тепловые столкновения разрушают всякую связь между молекулами; это означает, что при достаточно высоких температурах вещество будет находиться в газообразном состоянии. При низких температурах, когда работа отрыва молекул друг от друга значительно больше средней энергии их теплового движения, вероятность разрушения связи между молекулами очень мала и эта связь может сохраняться долго: вещество находится в твердом состоянии. Жидкое же состояние является промежуточным.
На расстоянии r0 , примерно равном сумме радиусов молекул, F=0, т.к. = . При r r0 - притяжение. Утолщенный участок - выполнение закона Гука (малые деформации).
На рисунке - график зависимости потенциальной энергии от расстояния.
При Eполн=E1: если частица движется справа налево из бесконечности, то в точке r0потенциальная энергия минимальна. В точке r1 полная энергия равна потенциальной энергии отталкивания, а кинетическая энергия равна нулю - точка поворота. Дальше молекула движется в положительном направлении оси r и уходит в бесконечность
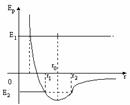
При Eполн=E2 СВОЙСТВА ТВЕРДЫХ, ЖИДКИХ И ГАЗООБРАЗНЫХ ТЕЛ.
Состояние
вещества.
Расположение частиц.
Характер движения частиц.
Соотношение между кинетической энергией молекул и потенциальной энергией межмолекулярного взаимодействия.
Некоторые свойства.
Твердое.
Расстояния сравнимы с размерами частиц. Истинно твердые тела имеют кристаллическую структуру (дальний порядок упорядоченности).
Колебания около положения равновесия.
Потенциальная много больше кинетической. Силы взаимодействия большие.
Сохраняют форму и объем. Упругость. Прочность. Твердость. Имеют определенную точку плавления и кристаллизации.
Жидкое
Расположены почти вплотную друг к другу. Наблюдается ближний порядок упорядоченности.
В основном колеблются около положения равновесия, изредка перескакивая в другое. С повышением температуры время оседлой жизни уменьшается.
Кинетическая энергия лишь незначительно меньше по модулю потенциальной энергии.
Сохраняют объем, но не сохраняют форму. Мало сжимаемы. Текучи.
Газообраз-ное.
Расстояния много больше размеров частиц. Расположение совершенно хаотическое.
Хаотическое движение с многочисленными столкновениями. Скорости сравнительно большие.
Кинетическая энергия много большепотенциальной по модулю.
Не сохраняют ни форму, ни объем. Легко сжимаемы. Заполняют весь предоставленный им объем.
Читайте также:

