История создания вакцины от коронавируса кратко
Обновлено: 02.07.2024
Вторая волна коронавируса набирает силу как в России, так и во многих других странах. К счастью, большая часть людей болеет бессимптомно или легко. Однако так везет не всем: вирус, получивший научное название SARS-CoV-2, способен не только провоцировать иммунную систему заболевшего убивать или серьезно повреждать его организм в острой фазе заболевания, но также может вызывать долго длящиеся осложнения — так называемый долгий ковид.
Не исключено, что долгий ковид может быть вызван аутоиммунными реакциями, спровоцированными вирусом, и/или связан с тем, что вирус способен не только выживать, но и активно воспроизводиться в кишечном тракте у некоторых уже выздоровевших пациентов, выписанных из больницы с отрицательными тестами ПЦР [4].
Еще одна крайне неприятная характеристика вируса — его высокая заражающая способность, начинающая проявляться за два дня до возникновения симптомов у тех, кто уже заразился [5]. Таким образом, коронавирус может распространяться невидимо и незаметно, как угарный газ. Те люди, которые еще не знают, что заразились, уже способны заражать других при коммуникациях на близком расстоянии.
Нет сомнений, что для борьбы с эпидемией, вызванной таким непредсказуемым и опасным вирусом, нужна вакцина. Поэтому в настоящее время ее разработка и успешное внедрение становятся особенно актуальной и важной задачей. По технологии производства все вакцины можно разделить на следующие категории: 1) основанные на убитом вирусе; 2) основанные на аттенуированном вирусе; 3) векторные; 4) белковые субъединичные; 5) пептидные и 6) генетические. К последним можно отнести вакцины, основанные на ДНК или РНК, которые кодируют вирусный белок-антиген [6].
В первой части статьи речь пойдет только о двух категориях вакцин, а именно генетических и векторных. Начнем с генетических. Недавно бизнес-объединение двух компаний — BioNTech и Pfizer — объявило о том, что по предварительным результатам анализа провакцинированных людей вакцина эффективно предотвращает заболевание в 90% случаев [7].
Пожалуй, одно из достоинств вакцин, которые разрабатывают компании, перечисленные выше, — то, что они не содержат последовательностей векторного вируса. (О векторных вакцинах и их сравнительных достоинствах по отношению к другим вакцинам речь пойдет ниже.) Соответственно, при применении генетических, а не векторных вакцин в организме вакцинируемого не образуется белков-антигенов, кодируемых векторными вирусами. На эти белки-антигены векторного вируса может вырабатываться иммунитет параллельно с выработкой защитной иммунной реакции на антиген вируса SARS-CoV-2.
Такой иммунитет, если он уже предсуществует, ограничивает эффективность первичного вакцинирования векторными вакцинами. Также иммунитет на векторные антигены, выработанный после вакцинирования именно векторными вакцинами, может свести на нет эффективность вторичного вакцинирования, которое, возможно, будет необходимо в случае кратковременности иммунитета, выработанного на вирусный антиген. Не исключено, что иммунитет от вакцины ослабнет — и через год или два после первой вакцинации потребуется вторая.
В то же время недостатком мРНКовых вакцин является необходимость их хранения в глубокой заморозке — −80°C и ниже, а также обязательность их транспортировки в сухом льду. Хотя если верить недавним пресс-релизам компании CureVac [11], эта проблема может быть решена. Так, сообщается, что вакцина производства CureVac может храниться около суток при комнатной температуре и долгое время — в обычном холодильнике.
У векторных вакцин есть некоторые достоинства по сравнению с вакцинами на основе мРНК. В лиофилизированной (высушенной) форме они не требуют постоянного хранения в глубокой заморозке (−80°C). Кроме того, теоретически за счет дополнительного присутствия векторных последовательностей они могут вызывать более длительный иммунитет по сравнению с мРНК вакцинами. Хотя пока что более длительный иммунитет векторных вакцин по сравнению с генетическими — это только предположение, которое требует экспериментального подтверждения.
При необходимости вторичного применения вакцины для поддержания активного иммунитета будет, вероятно, более эффективна вакцина, сделанная на основе другой векторной последовательности. В этом случае удастся избежать мешающей роли иммунитета на сам вектор от первой вакцинации. То есть для создателей вакцин оптимально иметь набор векторных последовательностей, которые происходят из разных апатогенных вирусов человека или животных вирусов, не способных заражать человека. О наборе таких вирусов, используемых современными исследователями в качестве векторов, будет рассказано во второй части статьи.
Вакцины на аденовирусной основе разрабатываются и находятся в последней фазе клинических испытаний не только в России. Речь идет о компании Johnson and Johnson, объединении University of Oxford / AstraZeneca и нескольких китайских фармацевтических компаниях [14, 15].
В то же время Россия совместно с объединением University of Oxford / AstraZeneca собирается производить векторную вакцину в Новосибирске; основу этого вектора составляет аденовирус шимпанзе. О сотрудничестве и о планах совместного производства недавно сообщил посол России в Лондоне [17]. Не совсем понятно, почему возможности масштабирования производства в Новосибирске существуют для производства импортной аденовирусной вакцины, но отсутствуют для собственной. Какая-то нестыковка!
Предварительные испытания вакцины в Китае, проведенные на нескольких сотнях добровольцев, показали, что она провоцирует высокий уровень нейтрализующих антител у большинства провакцинированных и при этом не вызывает слишком серьезных побочных эффектов. Редкими нежелательными эффектами бывали высокая температура и боль в месте укола [20].
Насколько быстро вирус может изменить свое обличье так, что вакцина ослабнет или перестанет работать? Этот вопрос чрезвычайно волнует создателей вакцин, и его активно изучают. Недавно международный коллектив из более чем 60 авторов опубликовал препринт, затрагивающий эту тему. В работе идет речь о новой мутации, вызывающей аминокислотную замену N439K. Аминокислота расположена в рецептор-связывающем мотиве рецептор-связывающего домена шиповидного белка коронавируса. Согласно авторам препринта, вирус с этой заменой имеет тенденцию к распространению и преобладанию над другими вариантами. Авторы сообщают, что вариант вируса с аминокислотной заменой N439K возник независимо дважды, в обоих случаях образуя множественные потомственные варианты из более чем 500 геномных последовательностей. По состоянию на октябрь 2020 года мутация обнаруживается в 12 странах, и вариант вируса с этой заменой является уже вторым по частоте встречаемости.
Самое неприятное в этой мутации то, что 15% моноклональных антител из коллекции исследователей и поликлональные антитела из сывороток выздоровевших людей связываются с новым вариантом вируса хуже, чем с исходным вариантом. Связывающая способность некоторых моноклональных антител падает больше чем в два раза. Естественно, падает и способность ряда антител нейтрализовать вирус.
Кроме перечисленных выше вакцинных разработок, конечно же, есть много других — как в России, так и в мире. Об их достоинствах, недостатках, препятствиях к широкомасштабному применению, а также о перспективах совершенствования я расскажу в следующей части статьи.
P.S. Пока верстался номер, пришла новость о том, что компания Модерна (Moderna, Inc.) объявила о промежуточных результатах своих клинических исследований. Согласно пресс-релизу компании, эффективность мРНК вакцины, которую она разрабатывает против COVID-19, составляет более 94%.
Всего в клиническом испытании Модерны было задействовано более 30 000 участников, которые были разделены поровну между контрольной и опытной группами. В группе плацебо заболело 90 участников, а в группе вакцинированных всего 5. Был также проведен анализ 11 особенно тяжелых случаев заболевания. Все тяжело заболевшие оказались в группе плацебо. Побочные эффекты вакцинации включали боль в месте инъекции (2,7%), усталость (9,7%), боль в мышцах (8,9%), боль в суставах (5,2%). Вакцину Модерны можно хранить при −20°C, что ее выгодно отличает от мРНК-вакцины Пфайзера, которая требует хранения при температуре −80°C [22].

Об эксперте: Павел Волчков — кандидат биологических наук, вирусолог, генетик, заведующий Лабораторией геномной инженерии Московского физико-технического института (МФТИ).
Существует много разных подходов к созданию вакцины от COVID-19. Она может быть вирусной, инактивированной, векторной, на основе нуклеиновых кислот. Какая из них окажется самой эффективной — пока никто точно не знает. Если вы разработчик, то можете выбрать любую и принять участие в большой мировой гонке по созданию долгожданной прививки. А можете, как ученые из МФТИ, сознательно отказаться от возможных бенефитов и неспешно заняться разработкой экспериментальной вакцины нового типа.
Павел Волчков:
Аденовирусы — ДНК-вирусы. Относятся к группе острых респираторных вирусных инфекций (ОРВИ) и характеризуются поражением слизистых оболочек верхних дыхательных путей, конъюнктив, лимфоидной ткани. Большинство аденовирусных инфекций представляют собой легкую форму инфицирования. Существует семь видов аденовирусов человека (от А до G) и 57 серотипов. Подразделение на серотипы связано с различными способами заражения.
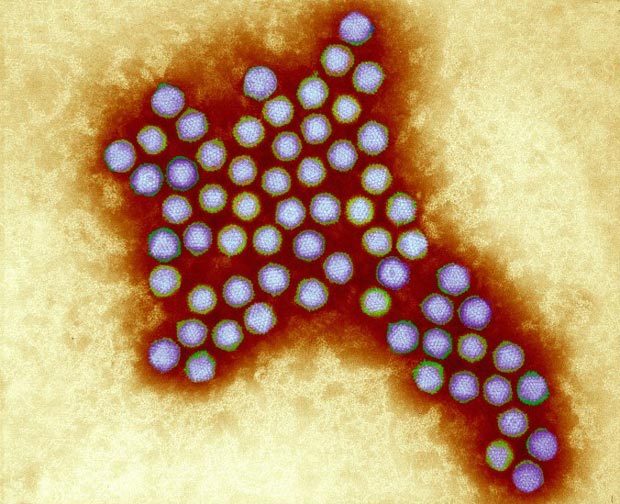
В качестве векторов для вакцин, аденовирусы применяются довольно давно. Эти вирусы хорошо изучены. Согласно данным сайта
Антигены — это любые вещества, содержащиеся в микроорганизмах и других клетках (или выделяемые ими), которые несут в себе признаки генетически чужеродной информации, и которые потенциально могут быть распознаны иммунной системой организма.
Павел Волчков:
Вакцина МФТИ: в чем инновация?
Поскольку у аденовирусных векторов есть существенные недостатки, ученые из МФТИ выбрали другие вирусы в качестве вектора — аденоассоциированные вирусы. Что любопытно, раньше никто в мире не использовал их в таком качестве.
Аденоассоциированные вирусы — мелкие ДНК-содержащие вирусы. Размер частиц 22-24 нм. Размножаются только в присутствии аденовирусов. Способны инфицировать клетки человека и некоторых других приматов. Аденоассоциированный вирус, по-видимому, не вызывает заболеваний у человека, поэтому провоцирует слабый иммунный ответ.
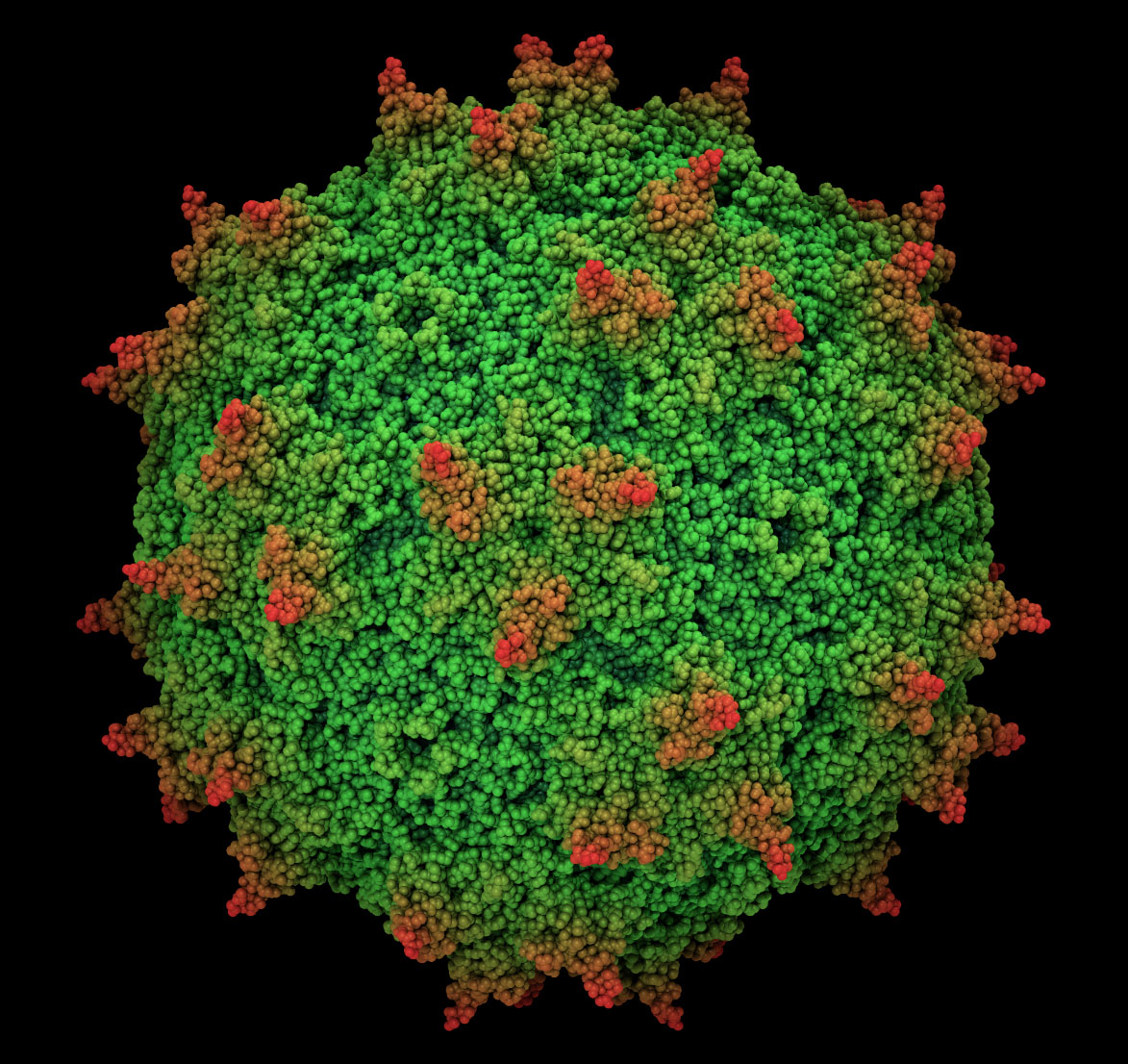
По аденоассоциированным вирусам также накоплена внушительная клиническая база. На сайте
«Мы с самого начала понимали, что сможем не только разработать вакцину, но и масштабировать ее производство. То есть произвести столько доз, сколько потребуется или столько, сколько захотим. В мире существует огромное количество аутсорсинговых компаний, которые по GMP сделают вам любое количество доз препарата.
Good Manufacturing Practice (GMP) — правила, которые устанавливают требования к организации производства и контроля качества лекарственных средств для медицинского и ветеринарного применения.
Вакцина МФТИ будет эффективна против разных штаммов SARS-CoV-2
Изначально ученые хотели разработать вакцину, которая бы вырабатывала иммунитет практически ко всем поверхностным белкам вируса SARS-CoV-2. А не только к S-белку, как это делают большинство разработчиков вакцин по всему миру (включая НИИ им. Гамалеи). Но в итоге разработчики остановились на конечном числе компонентов. Ими стали S-белок, Е-белок и М-белок.
Павел Волчков:
Если текущая разработка покажет свою эффективность и безопасность, ученые планируют пойти еще дальше и разработать вакцину, которая будет содержать не только различные компоненты SARS-CoV-2, но еще и вируса гриппа или других сезонных респираторных вирусов. То есть объединить в одной вакцине генетический материал от самых разных сезонных патогенов. По мнению ученых из МФТИ, такие ассемблированные, поливалентные вакцины могли бы готовить людей каждый сезон к новому остро-респираторному вирусному нашествию.
Павел Волчков:
Массовая вакцинация от COVID-19 может не понадобиться?
Павел Волчков уверен, что сама по себе гонка по созданию вакцин от короновируса уже не имеет смысла. Он уверен, что к тому моменту, когда российские вакцины будут испытаны и наработаны для массовой вакцинации населения, потребность в них может отпасть. Ученый считает, что уже к осени мы все, так или иначе, переболеем COVID-19 и получим естественный иммунитет.
Исследование показало, что лишь у небольшой части шведов в крови присутствовали антитела, но примерно треть граждан имела ту самую клеточную память. Это говорит о том, что существенная часть популяции шведов в той или иной форме переболела COVID-19 или имела непродолжительный контакт с вирусом. В последнем случае большой продукции антител не происходит, но благодаря Т-лимфоцитам формируется иммунологическая память к COVID-19.
Павел Волчков:
Вечно первая


Директор Центра им. Н.Ф. Гамалеи Александр Гинцбург — об эффективности вакцины, ее испытаниях на подростках и назальной прививке
Помимо России препарат производят в Узбекистане, Белоруссии, Аргентине, Вьетнаме. РФПИ объявил о партнерствах для производства вакцины с 20 компаниями в 14 государствах.

Качество и количество
По словам профессора Александра Бутенко, разработка вакцин такого типа — крайне перспективное направление на многие годы вперед.

Эксперты рынка дают ту же оценку.



— Нам подтвердили, что благодаря препарату в организме вырабатывается достаточно качественных антител, — добавил министр.
— В Европе поддерживают свою фармпромышленность, и пускать чужаков на свой рынок им ни к чему, — предположил Николай Беспалов.
ДУШАНБЕ, 19 авг — Sputnik. О процедуре регистрации новой российской вакцины от COVID-19, результатах испытаний и планах вакцинации населения агентству Sputnik рассказал замдиректора Центра имени Н. Ф. Гамалеи по научной работе Денис Логунов.
- В прошлое воскресенье вы передали результаты клинических исследований в Минздрав. Сами результаты пока не опубликованы. Расскажете об основных выводах этих исследований?
- Мы провели полный комплекс доклинических исследований безопасности и эффективности вакцины, а затем два клинических исследования, в которых вакцина изучалась с привлечением здоровых добровольцев по показателям безопасности и иммуногенности. Вакцина по результатам этих исследований показала хороший профиль безопасности и высокую иммуногенность.
У всех добровольцев, проиммунизированных нашей вакциной, были обнаружены вируснейтрализующие антитела - и в случае применения сухой, и в случае применения жидкой форм вакцины. Также были проанализированы различные показатели клеточного иммунного ответа, в частности цитотоксические лимфоциты, - очень важный параметр противовирусного иммунитета.
Цитотоксические лимфоциты, которые удаляют из организма зараженные вирусом клетки, были обнаружены у всех вакцинированных добровольцев. Таким образом, по иммуногенности мы получили очень хорошие результаты.
По безопасности: ожидаемые нежелательные явления, которые выражались в виде температуры и боли в месте введения, наблюдались не у всех добровольцев. Но эти конкретные цифры будут опубликованы в ближайшее время.
- Какое количество людей приняло участие в испытаниях в первой и второй фазе?
- В первой и второй фазе принимали участие 38 и 38 человек, то есть всего 76. Отличались два протокола тем, что вакцина по действующему веществу была одинаковая, но агрегатная форма была разная.
- А по возрасту насколько отличались участвовавшие?
- В прессе часто повторяется утверждение, что на создание надежной безопасной вакцины нужно не меньше полутора лет. Могли бы Вы объяснить, как ученым Центра имени Н. Ф. Гамалеи удалось создать вакцину в столь короткие сроки, буквально за 5-6 месяцев?
- Неправильно говорить, что нам удалось создать вакцину "с нуля" за короткие сроки. Начиная с момента разработки технологии аденовирусных векторов до ее внедрения в практику - прошло уже четыре десятка лет.
С 2015 года вакцинами на основе аденовирусных векторов, разработанными в Центре им. Н. Ф. Гамалеи, было провакцинировано более 3 000 человек. Поэтому это был не труд пяти месяцев, никоим образом.
Вакцины на основе аденовирусных векторов были созданы не только в России. Китай, компания CanSino, и Johnson & Johnson также работают с аденовирусными векторами. В первую очередь, это разработки вакцин против лихорадки Эбола. Эти платформы известны и хорошо изучены в рамках клинических испытаний.
Помимо результатов клинических испытаний в пользу безопасности данных платформ на основе аденовирусных векторов, можно добавить то, что мы все болеем аденовирусами и ни у кого никаких последствий в виде соматических заболеваний никогда не бывает.
У нас идет работа не с живыми аденовирусами, а с аденовирусными векторами, это вирусы, у которых удалены части геномов, и они не способны размножаться в клетках человека. Получается, что и с аденовирусами-то не страшно жить вместе, а с векторами, которые не способны размножаться, совсем безопасно. И мои слова подтверждаются десятками тысяч исследований этих векторов, в том числе множеством клинических исследований.
- Другие вакцины используют либо 26-й аденовирус, либо 5-й. А российская вакцина использует и тот и другой. Вы можете более подробно объяснить, как это работает?
- Посмотрите на национальный календарь прививок, вы увидите, что очень многие вакцины бустируются. То есть вы колете вакцину один раз, потом второй, третий и так далее. Для чего это делается? Для того, чтобы сформировать не только высокий иммунный ответ, но и чтобы этот ответ был пролонгированный, чтобы сформировать надежную иммуннологическую память.
Если не считать экономику, а заботиться о здравом смысле, длительности и уровне иммунного ответа, то стратегия прайм-буст иммунизации, то есть использование двух и более вакцинаций, всегда лучше. А делать прайм-буст вакцинацию разными векторами необходимо по простой причине: иммунный ответ после первого введения препарата будет формироваться в том числе и на вектор. Если вы будете вводить тот же самый вектор при второй иммунизации, то уже сформированный анти-векторный иммунитет будет снижать эффективность вакцинации. Поэтому вы просто меняете вектор-носитель на тот, который иммунный ответ не распознает. Таким образом, вам удается незаметно для иммунной системы пронести нужный ген и сформировать иммунный ответ к целевому антигену.
- Ваша вакцина получила временную регистрацию. Что это значит?
- Для чего временная регистрация существует? Мы же не здоровых добровольцев хотим с вами защищать последующие 1,5 года.
Если мы работаем с обычным населением, среди которого есть группы риска, то есть люди, которые в результате перенесенной инфекции или станут инвалидами или погибнут, то нужен был механизм, который позволит на очень жестких условиях и ограничениях вывести вакцину в оборот в разумные сроки.
Что значит жесткие условия? Это значит, что каждая пробирка кодируется QR-кодом. Будет приложение для строго учета применения вакцины по всем стационарам и для учета всех нежелательных явлений у добровольцев. Каждый доброволец, который проходит вакцинацию, сможет сделать отчет о своем самочувствии в приложении.
Еще хочу подчеркнуть, что речь не идет о принудительной массовой вакцинации, решение о вакцинации каждый принимает для себя сам.
- Сейчас речь идет о каком примерно количестве людей, которые будут участвовать в третьей фазе?
- Окончательные цифры согласовываются, но я могу сказать, что исследования будут включать примерно 30-40 тысяч человек.
Один из рабочих вариантов подразумевает, что 2 тысячи человек участвуют в клинических испытаниях по оценке параметров иммуногенности, а 28 тысяч добровольцев участвуют в наблюдательном исследовании для оценки эпидемиологической эффективности.
В настоящий момент мы еще дорабатываем протокол, чтобы он соответствовал всем нормам, в том числе международным.
- Чем отличаются друг от друга разные фазы клинических исследований?
В условиях, когда исследуются вакцины, это довольно-таки глупая идея исследовать добровольцев только на безопасность и при этом не взять кровь и посмотреть тут же иммуногенность. Поэтому очень часто для вакцин классическую первую фазу делают совместно со 2-й фазой, на которой проходит оценка не только безопасности, но и эффективности. На этом этапе для вакцин эффективность оценивают по их иммуногенности. То есть на совмещенной 1-2 фазе вы определяете безопасность и иммуногенность по самым разным параметрам.
В ходе третьей фазы оценивается эпидемиологическая эффективность. Вы должны оценить, насколько провакцинированная когорта более защищена, чем невакцинированная когорта.
Хочу еще добавить, что к клиническим испытаниям нельзя приступать без успешного прохождения обязательной программы доклинических исследований. Это обширные исследования безопасности и иммуногенности на животных, без которых на людей переходить нельзя. И все параметры обязательно исследуются на большом количестве видов – грызуны, зайцеобразные, обезьяны. Все то, что, собственно, мы сделали перед тем, как было принято решение приступать к клиническим исследованиям.
- Почему третья фаза исследований будет проводиться уже после временной регистрации?
- Идея и смысл временной регистрации в том, чтобы предоставить возможность доступа к вакцине группам риска и защитить тем самым людей от тяжелых последствий инфекции или гибели. При этом гражданский оборот вакцины будет осуществляться под жестким контролем, и эта временная регистрация может быть приостановлена в любой момент.
Целью третьей фазы является масштабная оценка безопасности и эффективности на большом количестве добровольцев в рамках контролируемого рандомизированного исследования. Это необходимо для получения большого объема статистических данных по всем параметрам испытаний. Кроме этого, этот этап необходим для принятия решения о постоянной регистрации вакцины.
- В ваш адрес звучала критика от представителей Всемирной организации здравоохранений (ВОЗ), которые говорили, что они не видели никаких научных исследований. Есть ли у вас какое-то взаимодействие с представителями ВОЗ?
- В принципе практика такова, что мы сначала предоставляем результаты экспертам Минздрава. Цель была получить безопасную и эффективную вакцину максимально быстро и это сделано, а потом уже переводить данные на английский язык и писать научные труды.
С одной стороны, это не отвлекает людей от поставленной задачи, с другой - это также не оказывает давления на экспертов, которые анализируют полученные нами данные. Когда мы публикуем что-то, то как-бы показываем, видите нас, мы опубликовали, нас цитруют и обсуждают - давайте нас регистрируйте. То есть решение публиковать данные после их рассмотрения Минздравом, позволяет провести непредвзятую экспертизу. Сейчас, когда мы зарегистрировали препарат, в ближайшие дни статья на английском языке будет подана в авторитетный международный журнал, она пройдет через экспертную оценку редакторов и рецензентов. Это не один-два дня, этот процесс должен занять какое-то время, но в любом случае весь материал собран, и мы подаем на публикацию. Надеюсь, что в ближайшее время у критиков не будет почвы.
- Как вы планируете увеличить производственные мощности?
- Ожидается, что массовое производство вакцины начнется в сентябре 2020 года. К концу 2020 года планируется довести производство вакцины до 200 миллионов доз, если задействовать все производственные площадки, включая международные.
Для этого РФПИ финансирует запуск производства вакцины на базе производственных мощностей своих портфельных компаний Р-Фарм и Биннофарм, входящей в группу компаний Алиум.
Кроме этого РФПИ, сейчас видит огромный интерес к вакцине в мире и планирует провести независимую от российской 3-ю фазу клинических испытаний в разных странах, в том числе в Саудовской Аравии, ОАЭ, Бразилии и Филиппинах, а также начать массовое производство в ряде стран в партнерстве с локальными суверенными фондами, в том числе в Индии, Южной Корее и Бразилии. Дополнительно прорабатываются возможности производства вакцины в Саудовской Аравии, Турции и на Кубе.
Уже более 20 стран выразили заинтересованность в приобретении Спутник V, в том числе Таджикистан, ОАЭ, Саудовская Аравия, Индонезия, Филиппины, Бразилия, Мексика и Индия.
- Ассоциация организаций по клиническим исследованиям (АОКИ) критиковала ученых Центра им. Н. Ф. Гамалеи за то, что они якобы вводили себе прототип своей же вакцины. По их словам, согласно международным стандартам, это является грубым нарушением. Как вы реагируете на эту критику?
- Ученые центра не пошли ни на какое нарушение. Они пошли бы на нарушение, если бы стали ловить добровольцев на улице и без подписания информированного согласия и страховки вводить им вакцину. Вот это было бы как раз то, о чем говорили АОКИ, если бы мы так делали.
Поскольку разработчик имеет право ввести себе то, что он делает, и это не регулируется никак, вводили мы не потому, что мы – герои, хотим прославиться, а потому что люди просто работали в красной зоне, то есть с вирусом. Вся плазма больных коронавирусом в Москве проходила через нас, мы должны были контролировать активность этих плазм в отношении живого вируса, то есть наши сотрудники постоянно были под угрозой.
Более того, часть людей – немолодые, часть – с сопутствующими заболеваниями.
В общем, история простая - есть возможность защитить ближний круг, существует вакцина, которая создана на всесторонне изученной платформе, и каждый из нас уверен в честности лично своих результатов и результатах коллег.
Хельсинская декларация также абсолютно не это регламентирует, она регламентирует порядок проведения клинических исследований. Мы не проводили клинические исследования в тот момент. То есть все их претензии были бы обоснованы, если бы мы проводили клиническое исследование, собрали бы своих людей, вакцинировали и стали бы вносить это в досье о клинических исследованиях. Вот это, конечно, было бы нарушением. На самом деле ничего этого не было, поэтому это просто дешевая подмена понятий.
- Как соотносится уровень антител у тех, кто получил вакцину, и у тех, кто переболел коронавирусом, и что означает это соотношение?
- Во всем мире сейчас сравнивают уровни активности сыворотки у переболевших людей с уровнем активности у иммунизированных добровольцев.
Здесь довольно существенная разница в пользу вакцинированных потому, что при иммунизации нет интоксикации организма, нет тяжелого заболевания, поэтому ничего удивительного, что уровень антител выше у вакцинированных, чем у переболевших.
Мы уже знаем, что у очень многих переболевших людей антитела появляются, но потом держатся недолго, а с вакцинацией это гораздо более надежная история.
- Могут ли вашу вакцину получать люди, переболевшие коронавирусом? Возможны ли здесь какие-то нежелательные эффекты?
- Для меня в этом смысле нет абсолютно никаких проблем. Мы же ревакцинируемся каждый год от гриппа, при этом мы им болеем, никто не спрашивает, есть ли здесь проблема, можно на следующий год иммунизироваться, если в этом году болел гриппом.
Читайте также:

