История создания искусственного сердца кратко
Обновлено: 02.07.2024
В марте 1952 года врачам одной из американских клиник удалось поддерживать жизнь пациента при помощи искусственного сердца в течение почти полутора часов. С тех пор этот случай считается первым успешным применением подобного устройства для сохранения кровообращения у человека. Как учёные десятки лет пытались заменить человеческое сердце механизмом и с какими трудностями им пришлось столкнуться — в материале RT.
Гонка за кровотоком
В марте 1952 года в США врачи смогли поддерживать жизнь пациента при помощи искусственного сердца в течение почти полутора часов. В те времена в разных странах мира полным ходом шла работа над созданием аппарата, который позволил бы заменить человеческое сердце. Разные конструкции такого устройства испытывали едва ли не ежемесячно. Опыты над животными проходили успешно, и учёные всё чаще пытались задействовать аппараты при оперировании людей.
Одним из первых успехов в этой области можно считать работу российского экспериментатора Владимира Демихова. В 1937 году он заменил сердце собаки искусственным агрегатом. Ему удалось доказать, что по крайней мере несколько часов кровь по сосудам можно гонять таким образом. Позднее он и вовсе провёл успешную операцию по трансплантации донорского сердца псу, допустив возможность пересадки органа в организм человека.
Другой учёный, американский исследователь Джон Гиббон, из года в год проводил многочисленные эксперименты на животных, а затем при поддержке компании IBM начал испытывать свои аппараты на людях. Также над устройствами, которые работали по принципу насоса для перекачки жидкостей, трудились Клэренс Деннис, Чарльз Линдберг, Алексис Каррель и другие.
Необходимо было также научиться снабжать организм пациента кислородом, но объединить два устройства в одно было меньшей проблемой. Пациенты, возраст которых зачастую не превышал пяти лет, погибали во время операций. Джон Гиббон списывал это на человеческий фактор. Он был уверен, что техника работает исправно. Стоит отметить, что причиной летального исхода, как правило, становился неправильный диагноз.
Сенсация
8 марта 1952 года 41-летнему сталевару Питеру Дьюрингу из городка Бетхелем понадобилась операция на сердце. В распоряжении врачей из трёх больниц, которые поспешили ему на помощь, был прибор на основе перистальтического насоса, принцип которого разработал ещё в 1931 году американский кардиохирург Майкл Дебейки. Сам учёный к тому времени преподавал в Бэйлорском университете в Техасе, а аппарат местные врачи доработали сами.
Подключив пациента к насосу, девять врачей, пять медсестёр и два технических специалиста пытались найти причину ухудшения состояния мужчины. Аппарат установили так, чтобы он перегонял только часть крови — три литра в минуту вместо пяти. Медики надеялись обнаружить кровяной сгусток или другую преграду, мешавшую нормальной работе органа. Несмотря на то, что спасти Дьюринга не удалось, благодаря насосу он смог прожить ещё 80 минут.
Наука пропитывает жизнь
В Российской Федерации 7 % взрослых людей страдают хронической сердечной недостаточностью (ХСН). Ежегодно, даже в условиях лечения в специализированном стационаре, умирает до 12 % больных с клинически выраженной ХСН. Единственное, что может помочь пациенту в терминальной стадии этого заболевания, — трансплантация сердца.
Не все нуждающиеся в операции доживают до ее проведения, но с тех пор как 46 лет назад бригада доктора Кристиана Барнарда провела первую в мире пересадку сердца от человека к человеку, у них по крайней мере появилась надежда на выздоровление.
История вопроса
Успехи трансплантологии связаны с развитием двух независимых сфер медицины: совершенствованием хирургической техники и методов анестезии с одной стороны, и достижениями иммунологии и фармакологии — с другой. Первое обеспечило удачное проведение операций, а второе — благополучное протекание послеоперационного периода.
Первые шаги
Однако широкий интерес идея трансплантации органов вызвала лишь спустя 300 лет, когда хирурги массово приступили к практическим опытам. Вновь столкнувшись с проблемой отторжения, они обогатили медицину тремя важными выводами: межвидовые пересадки органов (ксенотрансплантации) всегда неуспешны; пересадки между представителями одного вида (аллогенетические трансплантации) в большинстве случаев тоже, причем повторные пересадки органов между одними и теми же донорами и реципиентами ускоряли отторжение; если между донором и реципиентом было кровное родство, вероятность благоприятного исхода операции значительно увеличивалась, причем пересадка собственных органов (аутотрансплантация) почти всегда были удачна.
Первая описанная в литературе успешная трансплантация датируется II веком нашей эры: индийский хирург Шушрата произвел пересадку кожи в ходе ринопластики.
А в III веке, если верить хроникам римской католической церкви, святые Дамиан и Косма пересадили потерявшему ногу от гангрены римскому дьякону Юстиниану конечность недавно умершего эфиопа.
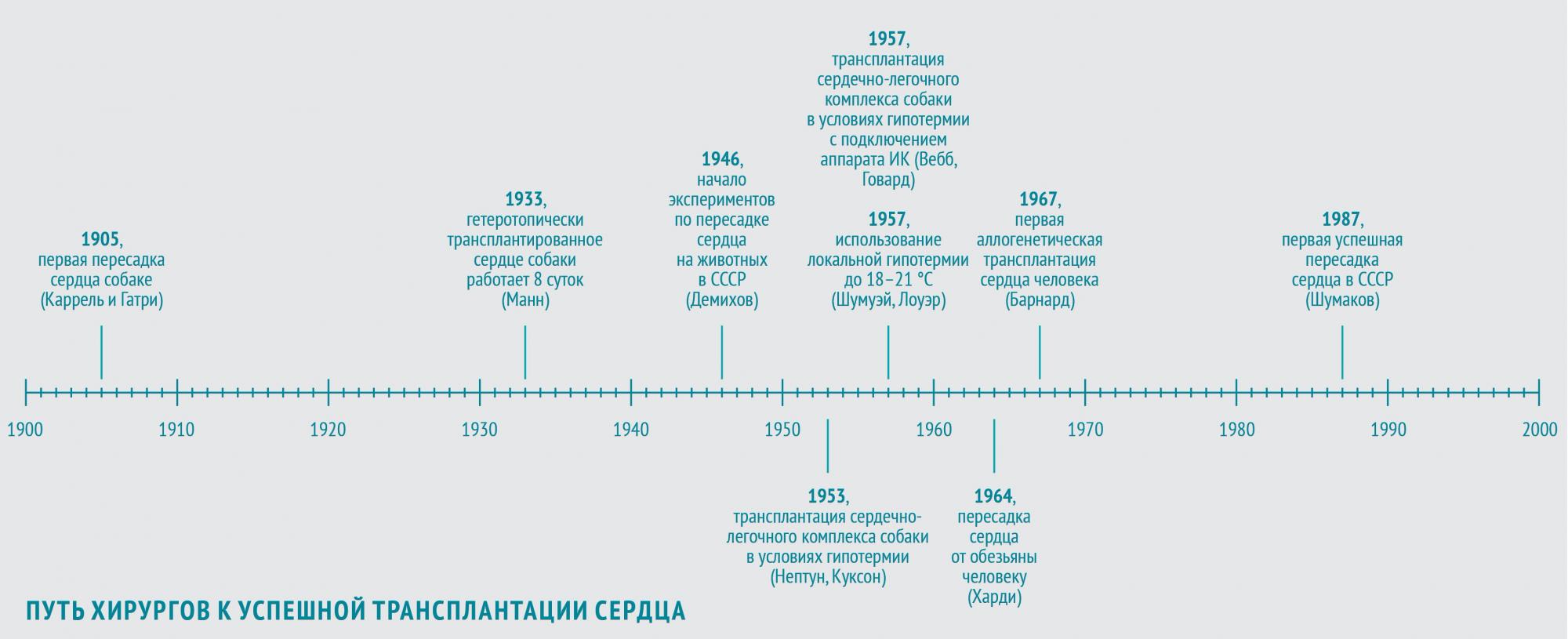
Собачье сердце
В 1905 году в череде опытов по пересадке органов очередь дошла и до сердца. Первую трансплантацию сердца собаки-донора на сосуды шеи собаки-реципиента осуществили хирург, биолог и патофизиолог Алексис Каррель и физиолог Шарль Гатри, американцы французского происхождения. Донорское сердце проработало 2 часа.
В 1933 году американский физиолог Фрэнк Манн с коллегами повторил опыт Карреля и показал возможность функционирования гетеротопически (то есть размещенного в нетипичном месте) трансплантированного сердца собаки вплоть до 8 суток (собственное сердце собаки оставалось на месте и продолжало работать).
В ногу со временем шли и советские хирурги. Наиболее весомый вклад в экспериментальные основы трансплантации сердца в СССР внес Владимир Петрович Демихов. С 1946 по 1955 год он в нескольких сотнях экспериментов разработал 24 (!) варианта хирургической техники гетеротопической трансплантации сердца в грудную клетку. В некоторых опытах донорское сердце эффективно обеспечивало кровообращение собаки-реципиента в течение более чем 15 часов.
Борьба с ишемией
Самой явной проблемой, вставшей на пути хирургов, стала ишемия: в условиях недостаточного кровотока повреждались и ткани реципиента, и донорские сердца. Трансплантацию невозможно провести в сжатые сроки, поэтому хирурги и анестезиологи стали искать способы, позволяющие продлить время операции. Так были разработаны методы управляемой гипотермии и спроектированы аппараты искусственного кровообращения (ИК).
Управляемая гипотермия позволяет снизить кровопотерю, а также продлить время операции без повышения риска ишемизации тканей.
В 1953 году американские хирурги Уилфорд Нептун и Брайан Куксон с коллегами выполнили первую трансплантацию сердечно-легочного комплекса собаки в условиях глубокой гипотермии (во время операции в комнате поддерживалась температура порядка минус 4 °С).
В 1957 году американцы Уильям Вебб и Хизер Говард повторили этот эксперимент, подключив собаку-реципиента к аппарату ИК. Позднее они сообщили о пересадке в тех же условиях изолированного сердца. Они накладывали девять анастомозов между аортой, легочной артерией, легочной и полой венами. Правда, этот трансплантат профункционировал всего 7 часов.
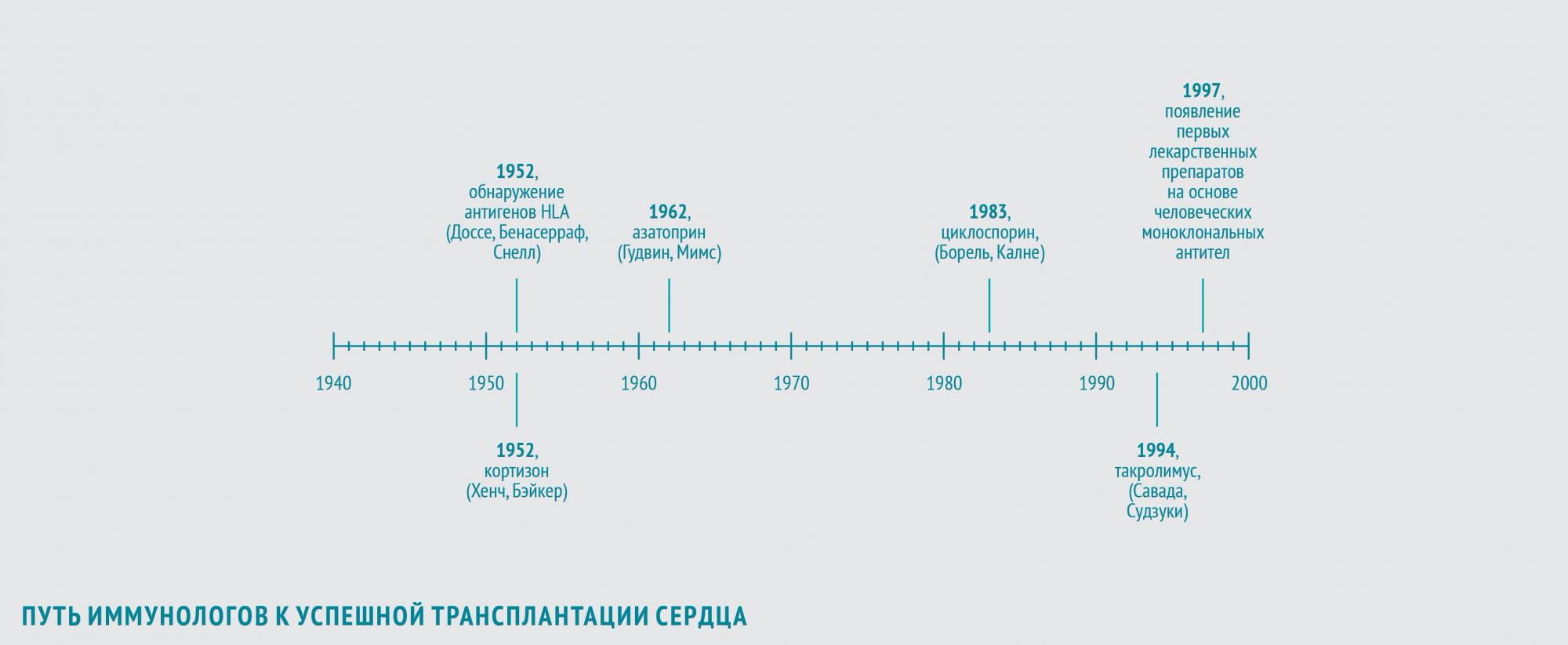
Причины отторжения
В 1952 году иммунологи Жан Доссе (Франция) и Барух Бенасерраф (США) вместе с генетиком Джорджем Снеллом (США) обнаружили, что важнейшие антигены, участвующие в отторжении трансплантата, – антигены главного комплекса гистосовместимости (HLA). За это открытие в 1980 году они были удостоены Нобелевской премии.
Существует порядка 150 вариантов антигенов HLA, и у каждого человека на мембранах клеток присутствует по шесть вариантов таких антигенов. Следовательно, возможно более триллиона их комбинаций – вероятность существования двух людей с одинаковыми комплексами HLA-антигенов близка к нулю, конечно, если они не однояйцевые близнецы. Идеально, если у донора и реципиента наблюдается несовпадение лишь одного антигена из шести. Операции проводят и в том случае, если не совпадают два, однако при этом увеличивается риск развития иммунологического отторжения.
На практике определение совместимости тканей — гистотипирование — осуществляется по лимфоцитам крови.
Немалую роль в отторжении трансплантата могут сыграть и антитела в организме реципиента (например, появившиеся из-за предшествующего переливания цельной крови). Взаимодействуя с антигенами эндотелия сосудов, пронизывающих трансплантат, они инициируют систему комплемента и каскад реакций, приводящий к закупорке сосудов.
Иммуносупрессия
Первыми веществами, которые начали использовать для подавления иммунного ответа, стали кортикостероиды.
В 1948 году американский врач Филип Хенч, применив кортизон в лечении ревматоидного артрита, показал, что препарат обладает выраженным противовоспалительным действием. В 1952 году американский хирург Роджер Бэйкер с коллегами продемонстрировал, что кортизон может использоваться и для иммуносупрессии после трансплантации.
В 1962 году американцы Уиллард Гудвин и Мэтт Мимс впервые использовали азатиоприн — иммуносупрессивный препарат, обладающий наибольшей активностью в отношении Т-лимфоцитов, для предотвращения острого отторжения трансплантированной почки. Пациентам с пересаженным сердцем также планировалось назначать азатиоприн в сочетании с кортикостероидами.
Очередь человека
Человеку сердце было впервые пересажено в 1964 году. Джеймс Харди с коллегами трансплантировали сердце крупного шимпанзе, весившего более 43 кг, больному 68 лет с тяжелой формой ИБС в терминальной стадии прогрессирующей сердечной недостаточности. Вначале трансплантат работал удовлетворительно, однако через час после отключения аппарата ИК развилась острая сердечная недостаточность, обусловленная объемной перегрузкой трансплантата, и больной погиб.
В СССР первая успешная трансплантация сердца была осуществлена в 1987 году знаменитым врачом-трансплантологом академиком АМН СССР Валерием Ивановичем Шумаковым (1931–2008).
Успех первого клинического опыта увлек медицинское сообщество, и к решению задачи трансплантации сердца обратились хирурги всего мира. Однако большинство пациентов умирало вскоре после проведения операции, и интерес исследователей начал угасать: если в 1968 году было проведено 100 трансплантаций сердца, то в 1970 — всего 18. Главной причиной смерти оставалось отторжение пересаженных органов.
Лишь четверо из прооперированных в период с 1967 по 1973 год прожили с новым сердцем дольше года; с 1974 по 1983 год годичная выживаемость увеличилась до 60 %, а вот пятилетняя составила лишь 21 %.
Иммунологи и фармакологи берутся за дело
В 1983 году увенчались успехом клинические исследования нового иммуносупрессора — циклоспорина, нерибосомного полипептида, получаемого из почвенных грибов вида Beauveria nivea. Его выделили в 1970 году в рамках программы по скринингу новых антибиотиков. В 1972 году бельгийский иммунолог Жан-Франсуа Борель открыл способность циклоспорина ингибировать культуру лимфоцитов при отсутствии общего цитостатического эффекта. В конце 70-х британский хирург Рой Калне провел первые испытания эффективности циклоспорина после трансплантации сердца и почек на экспериментальных животных. Его внедрение в широкую практику открыло новую эру в трансплантации сердца, поскольку позволило значительно продлить жизнь пациентов после трансплантации. В 1994 году было одобрено использование для послеоперационной терапии еще одного нового иммуносупрессора — такролимуса (FK-506) из группы макролидов, продуцируемого актиномицетом Streptomyces tsukubaensis. В 1987 году японские иммунологи Шиничи Савада и Джен Судзуки в экспериментах in vitro обнаружили, что такролимус в 100 раз активнее циклоспорина подавляет пролиферацию Т-лимфоцитов. В исследованиях на крысах, собаках и приматах, проводившихся с 1988 по 1993 год, такролимус обеспечивал профилактику отторжения трансплантата в дозах в 10–100 раз более низких, чем циклоспорин, и с меньшим количеством побочных эффектов. Впрочем, модификации циклоспорина, разработанные в то же время, обладали аналогичными преимуществами.
В настоящее время используется трехкомпонентная схема иммуносупрессивной терапии: циклоспорин А или такролимус в сочетании с метилпреднизолоном и микофенолата мофетилом (цитостатиком, который наиболее эффективен в отношении лимфоцитов). Препараты антилимфоцитарных антител (ALG, ATG, ОКТ-3) применяются в качестве вводной терапии, а также при выраженных признаках отторжения или стероид-резистентном отторжении.
Современная статистика
На сегодняшний день в мире проведено уже более 15000 трансплантаций сердца. 10-летняя выживаемость пациентов составляет около 50 %. Самая большая летальность — в первый год после операции (в разных клиниках – от 15 до 25 %). Основные причины смерти — инфекционные заболевания и саркома Капоши, развивающиеся на фоне иммуносупрессивной терапии.
Описаны и счастливые случаи, когда пациенты с трансплантированным сердцем прожили более 25 лет. Мировым рекордсменом стал Тони Хьюзман — пациент клиники при Стэнфордском университете. Его прооперировали в 1978 году, показанием послужила дилатационная кардиомиопатия. После трансплантации он прожил 30 лет и умер в 51 год от рака кожи.
В мире ежегодно выполняется от 2,7 до 4,5 тысяч трансплантаций сердца. Из них в России — всего около 100 операций. Лидер по количеству трансплантаций — США: там проводится до двух тысяч пересадок сердца ежегодно.
Показания для проведения операции по пересадке сердца
Диагноз:
- кардиомиопатии различного генеза;
- доброкачественные опухоли сердца;
- неоперабельные врожденные пороки сердца (например, гипоплазия левого желудочка).
Клинико-функциональная характеристика пациентов:
- хроническая сердечная недостаточность III-IV ФК по NYHA, резистентная к медикаментозной терапии;
- фракция выброса ЛЖС 7 см;
- конечно-диастолическое давление ЛЖС > 20 мм рт. ст.
- сердечный индекс (CI) 2 );
- рефрактерность желудочковых тахиаритмий;
- ожидаемая выживаемость потенциального реципиента без трансплантации сердца 15 мм рт. ст., общее легочное сопротивление (ОЛС) > 5 ед. Вуда, систолическое давление в легочной артерии более 60 мм рт. ст.);
- острые инфекционные заболевания и/или обострение хронических;
- необратимая полиорганная недостаточность;
- злокачественные новообразования в анамнезе;
- тромбофлебит;
- системные заболевания;
- ожирение (> 30 % должной массы тела);
- психические заболевания, алкоголизм, наркомания;
- недисциплинированность в приеме медикаментов, несоблюдение больничного режима.
Относительные противопоказания
- активный диффузный миокардит;
- инсулинозависимый сахарный диабет;
- язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения;
- нарушение мозгового кровообращения в анамнезе;
- инфицирование вирусами гепатита С и гепатита В;
- атеросклероз сосудов нижних конечностей;
- ограниченная поддержка семьи.
Задачи на будущее
Интересная методика, позволяющая продлить жизнь ожидающим пересадку сердца пациентам с дилатационной кардиомиопатией, разработана в 2002 году специалистами Научного центра хирургии РАМН во главе с доктором медицинских наук Алексеем Коротеевым. Его команда успешно опробовала на практике следующую методику: после курса интенсивной кардиотерапии больному делают спиральную томографию, чтобы создать точную трехмерную компьютерную модель сердца. Затем по индивидуальному муляжу шьется сетка из специального полиэфирного материала – дакрона. В ходе последующей операции сетку надевают на живое сердце, что препятствует дальнейшей дилатации.
До сих пор актуален поиск эффективной терапии послеоперационных осложнений. Большинство из них (инфекции, саркома Капоши, поражение почек и печени, а также быстрое развитие атеросклероза коронарных сосудов трансплантата) развиваются из-за постоянного использования иммуносупрессоров.
Гонка за кровотоком
В марте 1952 года в США врачи смогли поддерживать жизнь пациента при помощи искусственного сердца в течение почти полутора часов. В те времена в разных странах мира полным ходом шла работа над аппаратом, который позволил бы заменить человеческое сердце. Разные конструкции такого устройства испытывали едва ли не ежемесячно. Опыты над животными плавно подходили к концу, и учёные всё чаще пытались задействовать аппараты при оперировании людей.
Одним из первых успехов можно считать работу российского экспериментатора Владимира Демихова. В 1937 году он заменил сердце собаки на искусственный агрегат. Ему удалось доказать, что по крайней мере несколько часов кровь по сосудам можно гонять таким образом. Позднее он и вовсе провёл успешную операцию по трансплантации донорского сердца псу, допустив возможность пересадки органа в организм человека.
Другой учёный, американский исследователь Джон Гиббон, из года в год проводил многочисленные эксперименты сначала на животных, а затем при поддержке компании IBM начал испытывать свои аппараты на людях. Также над устройствами, в основе которых лежал насос для перекачки жидкостей, работали Клэренс Деннис, Чарльз Линдберг, Алексис Каррель и другие.
Помимо перекачки крови нужно было снабжать организм пациента кислородом, но объединить два устройства в одно было меньшей проблемой. Пациенты, возраст которых зачастую не превышал пять лет, погибали во время операций. Джон Гиббон списывал это на человеческий фактор. Он был уверен, что техника работает исправно. Стоит отметить, что к фатальным последствиям для пациентов в ходе недолгих операций как правило приводил неправильный диагноз.
8 марта 1952 41-летнему сталевару Питеру Дьюрингу из городка Бетхелем понадобилась операция на сердце. В распоряжении врачей из трёх больниц, которые поспешили ему на помощь, был прибор на основе перистальтического насоса, принцип которого разработал ещё в 1931 году американский кардиохирург Майкл Дебейки. Сам учёный к тому времени преподавал в Бэйлорском университете в Техасе, а аппарат местные врачи доработали сами.
Подключив пациента к насосу, девять врачей, пять медсестёр и два технических специалиста пытались найти причины ухудшения состояния мужчины. Аппарат установили так, чтобы он перегонял только часть крови — три литра в минуту вместо пяти. Медики надеялись обнаружить кровяной сгусток или другую преграду, мешавшую нормальной работе органа. Несмотря на то, что спасти Дьюринга не удалось, благодаря насосу он смог прожить ещё 80 минут.
Наука пропитывает жизнь
Искусственное сердце, разработанное Додриллом.
Кто придумал искусственное сердце
Проект по имплантации сердца разрабатывали более 300 специалистов. Сама идея принадлежит голландскому терапевту Виллему Колфу, который ещё в 1943 году создал первую в миру искусственную почку.
Первую операцию по вживлению импланта Колф и его соратники провели на корове, которая хоть и прожила с ним 2 дня, могла лишь лежать и жевать. Следующей разработкой Колфа стало сердце, позволявшее двигаться. У телят, которым вживляли такой аппарат, из груди торчали воздуховоды, но в остальном они выглядели здоровыми. Отработав технику на 200 животных, команда стала готовиться к операции на человеке. Провести её должен был Уильям Девриз — молодой кардиохирург, с которым Колф встретился на одной из своих лекций. Но на пути учёных встали чиновники.
Слева: Виллем Колф (в очках) и кардиохирург Клиффорд Кван-Гетт Справа вверху: Уильям Девриз с искусственным сердцем Справа внизу: Роберт Джаврик, главный конструктор первого искусственного сердца
Слева: Виллем Колф (в очках) и кардиохирург Клиффорд Кван-Гетт Справа вверху: Уильям Девриз с искусственным сердцем Справа внизу: Роберт Джаврик, главный конструктор первого искусственного сердца
Параллельно свою конструкцию искусственного сердца разрабатывал хирург Майкл Дебейки. С его аппаратом пациент мог прожить несколько дней, дожидаясь донорского органа. Однако в 1969 году другой врач Дентон Кули выкрал экспериментальный образец из лаборатории Дебейки и имплантировал его 47-летнему больному.
Мужчина пролежал с работающим искусственным сердцем 64 часа, дождался операции и перенес трансплантацию донорского органа. Через 36 часов он скончался от пневмонии. За всеми не слишком удачными экспериментами внимательно следили власти и долгое время запрещали проведение операций по трансплантации искусственного сердца.
Как прошла первая операция
Когда официальное разрешение наконец было получено, медики начали поиск подходящего больного: нужен был пациент с таким диагнозом, чтобы трансплантация живого сердца была невозможна.
Летом 1982 года такой человек нашелся в клинической больнице университета. Дантист Барни Кларк с диагнозом кардиомиопатия едва передвигался. Четыре года он безуспешно лечился новейшими препаратами, поэтому услышав об искусственном сердце, Кларк сразу согласился на операцию.
Хирургическое вмешательство в организм слабого Кларка оказалось труднее, чем проводимые ранее операции со здоровыми животными. Желудочки сердца рвались в руках, как обёрточная бумага. Но оперирующий хирург Девриз был уверен в себе: через девять часов он объявил, что искусственное сердце успешно подсоединено и бьётся, перекачивая кровь.
Оно билось 112 суток, точнее 2688 часов, сделав около 12 912 400 ударов. Следующий больной прожил с искусственным сердцем той же конструкции вчетверо дольше. В XXI в. появились сердца на батареях без воздуховодов. Счёт операциям пошел на сотни.

либо дополняющий сердце, который способен поддерживать нормальное кровообращение в естественных условиях жизни.
Содержание
Модели [ ]
Искусственные сердца, которые пациенты в настоящее время носят, требуют таскать тяжёлый аккумулятор, без которого не будет работать насос. Например, мужчина, носивший искусственное сердце в течение года был с тяжелыми батареями в в рюкзаке. Но ученые из Университета Райза предложили подавать энергию на искусственное сердце без батарей - носить на ноге аккумулятор. Разумеется, есть и дополнительные батареии для того, чтобы их можно было носить, когда вы лежите [1]
Ранний этап развития [ ]
Первое искусственное сердце сделал советский ученый Владимир Демихов в 1937 году. Сердце было пересажен собаке.
2 июля 1952 года 41-летний Генри Опитек, страдающий одышкой, сделал медицинскую историю в больнице Харперского университета в государственном университете Уэйна в Мичигане. Сердечная машина Dodrill-GMR , считающаяся первым операционным механическим сердцем, успешно использовалась при выполнении операции на сердце. [2] [3]
Abiocor [ ]
Имплантируемое искусственное сердце AbioCor компании Abiomed получило одобрение от американского управления по контролю над пищевыми продуктами и медикаментами (FDA).

Искусственное сердце abiocor
Это первое в мире полностью вживляемое постоянное искусственное сердце(на момент 2006 года) проходило испытания на пациентах-добровольцах в течение нескольких лет. Теперь его имплантация должна принять более массовый характер. Потенциально речь идёт о сотнях, а, быть может, тысячах человек. [5]
В августе 2012 года ключевой исследователь и разработчик AbioCor Дэвид Ледерман умер от рака поджелудочной железы. [6]
Компания также планирует улучшить AbioCor во второй версией. Ожидается, что он продлится пять лет, что более чем в три раза превышает ожидаемую продолжительность жизни AbioCor. Компания заявила, что она будет на 30 процентов меньше оригинальной модели, и ее можно было бы внедрить в мужчин и женщин более низкого роста. Были запланированы дополнительные модификации, чтобы снизить риск развития инсульта у пациента, что было связано с FDA [7]
Carmat bioprosthetic heart [ ]
Согласно пресс-релизу Carmat от 20 декабря 2013 года, первая имплантация его искусственного сердца у 75-летнего пациента была проведена 18 декабря 2013 года группой европейских больниц Жоржа Помпиду в Париже (Франция). Пациент умер через 75 дней после операции. [10]
В конструкции Carmat каждая из двух камер разделена мембраной, которая удерживает гидравлическую жидкость с одной стороны.Моторизованный насос перемещает гидравлическую жидкость в камеры и из нее, и эта жидкость заставляет мембрану двигаться; кровь течет через другую сторону каждой мембраны. Обращенная к крови сторона мембраны сделана из ткани, полученной из мешка, который окружает сердце коровы, чтобы сделать устройство более биосовместимым. Устройство Carmat также использует клапаны из ткани сердца коровы и имеет датчики для обнаружения повышенного давления внутри устройства. Эта информация отправляется во внутреннюю систему управления, которая может регулировать скорость потока в ответ на повышенный спрос, например, когда пациент тренируется. [11]
Перспективы [ ]
Раньше, когда только разрабатывалась эта технология, была проблема с травмированием кровью. Разные элементы крови повреждали материал. В будущем может быть создано такое искусственное сердце, которое можно будет подшить, и оно будет работать как биологическое.
Легче будет сделать искусственную печень или почку. Так как, искусственное сердце труднее создать. А вот полоски печени легко выживают и прирастают к организму. [12]
Читайте также:

