Исследование биологических тканей в поляризованном свете кратко
Обновлено: 07.07.2024
Поляризационная микроскопия – эффективный метод исследования структуры и свойств цитологических и гистологических препаратов. Известно, что многие биологические объекты являются анизотропными. Поэтому поляризационные методы позволяют оперативно и просто обнаружить оптически неоднородные объекты и диагностировать заболевание.
Поляризационный метод применяется в диагностике биологических объектов очень давно. Одним из первых его применил в биологии немецкий исследователь В.Шмидт в 1924 году [1]. Большой вклад в применение поляризационной микроскопии в гистологии внесли Ю.Целлариус и Л.Кактурский. Поляризационная микроскопия позволяет изучать свойства гистологических структур, обладающих способностью двойного лучепреломления [2]. При желании для реализации метода любой оптический микроскоп можно превратить в поляризационный микроскоп. Для этого оптический микроскоп снабжают дополнительно двумя поляризационными фильтрами. Первый фильтр помещают непосредственно между осветителем и объектом (поляризатор). Он преобразует обычный свет в линейно-поляризованный. Второй поляризационный фильтр помещают между объективом и глазом исследователя (анализатор). Он служит для анализа поляризованного света, прошедшего через объект исследования.
Большинство биологических структур обладает свойством положительного двойного лучепреломления, и их показатель преломления вдоль выделенного направления больше показателя преломления в поперечном направлении. Встречаются также объекты с отрицательным двойным лучепреломлением: у них показатель преломления вдоль выделенного направления меньше, чем в поперечном направлении. С помощью поляризационного метода можно наблюдать и диагностировать любые цитологические и гистологические препараты: как окрашенные, так и неокрашенные, как фиксированные, так и нефиксированные (нативные). Практически в каждом биологическом препарате имеются светящиеся объекты [3]. Перед поляризационным анализом желательно удалить парафин из срезов, потому что остатки парафина обладают собственным двойным лучепреломлением.
Первую группу объектов, распознаваемых с помощью поляризационной микроскопии, составляют круглые объекты, капли, липоиды, которые в скрещенных поляроидах выглядят как Мальтийский крест. Появление данных объектов связано с нарушением липидного обмена, с болезнями почек. Ориентировочный диаметр этих капель – 2,4 микрометра.
Эффектом анизотропии обладают холестерин и его эфиры, фосфатиды, цереброзиды, миелины. Но нейтральные жиры и жирные кислоты свойством двойного лучепреломления не обладают. Можно выделить два типа объектов: вещества, анизотропия которых исчезает при нагревании и вновь появляется при охлаждении (холестерин и его эфиры), и вещества, анизотропия которых при нагревании не исчезает (цереброзиды, фосфатиды, миелины). Для эфиров холестерина наблюдается эффект: если после быстрого охлаждения провести быстрый нагрев, то свойство анизотропности резко пропадает, так как разрушается жидкокристаллическая фаза.
Липопротеины (липопротеиды) – это комплексы, состоящие из белков и липидов. Форма липопротеинов сферическая, их размеры лежат в диапазоне 4–1200 нм. Оболочка сферы состоит из мономолекулярного слоя фосфолипидов с включенными в его состав молекулами холестерина и белков. Внешняя сторона оболочки – гидрофильная, а внутренняя сторона – гидрофобная. Внутри оболочки содержатся молекулы эфиров холестерина, триглицерида и небольшое количество свободного холестерина.
Хиломикроны (chylomicron) – это самые большие липопротеины. Хиломикроны образуются в энтероцитах после переваривания и всасывания жиров из тонкой кишки. Энтероциты – адсорбирующие клетки эпителия желудочно-кишечного тракта, в частности толстого и тонкого кишечника. Затем хиломикроны попадают в лимфатические сосуды и через грудной лимфатический проток поступают в кровь. Из-за большого размера, хиломикроны вызывают сильное рассеивание света. В результате этого после приема пищи плазма крови всегда выглядит опалесцирующей или даже мутной, в зависимости от количества потребляемой с пищей жиров. Концентрация хиломикрон в плазме крови обычно достигает максимума через 3–6 часов после приема пищи, а затем в течение часа постепенно снижается. Хиломикроны и липопротеины локализованы в плазме крови.
Липосомы (liposomes) – частицы, которые образованы одним или несколькими концентрическими замкнутыми липидными бислоями. Свойством двойного лучепреломления обладают многослойные липосомы LMV.
Основные области в диагностике
Многие заболевания, как известно [4], диагностируются по анализу осадка мочи. Среди них – липоидурия (липурия). При этом заболевании в моче иногда можно наблюдать липидные капли, которые в скрещенных поляроидах наблюдаются в виде так называемого Мальтийского креста. Липоидурия сопровождается выделением с мочой анизотропных, двоякопреломляющих жировых структур (anisotropic fat crystals). (Липурия – выделение холестерина с мочой) Капельки в поляризованном свете выглядят в виде темного креста со светящимися сегментами – Мальтийскими крестами. Их присутствие обусловлено появлением эфиров холестерина, находящегося в жидкокристаллической фазе. Если в каплях нет эфиров холестерина, – то они не светятся. Их образование связывают с жировой дегенерацией клеток эпителия почечных канальцев. Липоидурия весьма характерна для нефротического синдрома независимо от его генеза. Эти структуры появляются при жировой дистрофии.
Другое заболевание – цилиндрурия. В почечных канальцах образуются жировые цилиндры и овальные жировые тельца (oval fat bodies, fat globules) из жироперерожденного почечного эпителия. Они состоят из капель жира (липоидов) различного размера. В отличие от нейтральных жиров липоиды обладают двойным лучепреломлением. В скрещенных поляроидах появляется изображение в виде Мальтийского креста. При наблюдении без поляризаторов при малом увеличении цилиндры будут темными из-за сильного преломления света каплями жира. Жировые цилиндры обнаруживаются в осадке мочи больных липоидным нефрозом, липоидно-амилоидным нефрозом, диабетической нефропатией, гломерулонефритом и пиелонефритом с нефротическим компонентом.
Липидоз – нарушение внутриклеточного липидного обмена в организме – тоже диагностируется поляриметрическими методами. Только здесь в качестве объекта анализа рассматриваются капли жира в различных тканях, которые в поляризационном микроскопе светятся в виде Мальтийского креста. Однако область наблюдения этих объектов ограничена, так как одно и то же вещество в зависимости от его физического состояния (жидкое, кристаллическое) то дает, то не дает двойного лучепреломления. Типично двойное лучепреломление с изображением Мальтийского креста имеют сферокристаллы (сферолиты, которые образуются в присутствии эфиров холестерина). С помощью поляризационного микроскопа можно дифференцировать изотропные и анизотропные липиды. Анизотропные липиды дают характерное двойное лучепреломление. Отличительная особенность – при нагревании свойство двойного лучепреломления пропадает, а при охлаждении – появляется снова. Любой жир, находящийся в тканях, растворяется в растворителях, которые используются при окраске образцов ткани для микроскопического исследования. Поэтому исследование лучше производить в замороженных срезах, в которых жир остается в цитоплазме.
При таком заболевании, как атеросклероз (atherosclerosis), объектом исследования становятся стенки сосудов. Холестерин при микроскопическом исследовании в поляризованном свете дает характерную картину Мальтийского креста. При артритах объект исследования – синовиальная жидкость (sinovial fluid). Артрит – это заболевание, связанное с поражением суставов. В синовиальной жидкости наблюдаются сферолиты липидов, которые в скрещенных поляроидах дают ту же характерную картину. При остром бактериальном простатите исследуют поляризационное изображение секрета предстательной железы, а при желчекаменной болезни – секрета желчи.
Отличительной особенностью поляризационного свечения липидных капель является тот факт, что при вращении предметного стекла яркость свечения объекта и ориентация Мальтийского креста остается постоянной. При свечении других кристаллов и волокон проявляются другие особенности: попеременное изменение яркости изображения за период полного поворота объекта вокруг оси наблюдения. Для исследования рекомендуется использовать замороженные срезы из нефиксированного или фиксированного в формалине материала. Нельзя применять фиксирующие растворы, содержащие растворители липидов. Срезы заключают в глицерин.
Другую группу объектов составляют различные кристаллы. При подагре (gout) в синовиальной жидкости наблюдаются кристаллы моноурата натрия, которые имеют игольчатую форму и обладают отрицательным двойным лучепреломлением. При подагре в синовиальной жидкости с помощью поляризационной микроскопии можно наблюдать свечение игольчатых кристаллов мочевой кислоты. При псевдоподагре в синовиальной жидкости наблюдаются кристаллы пирофосфата кальция дегидрата, которые имеют ромбовидную или прямоугольную форму в виде коротких прямых прутьев и обладают положительным двойным лучепреломлением. Существует мнение, что кристаллы пирофосфата кальция не образуются в синовиальной жидкости, а попадают из суставного хряща в полость сустава, где и вызывают воспалительную реакцию.
Мочекаменная болезнь связана с образованием кристаллов различных веществ (уролитов – поликристаллических образований, состоящих из минералов) в естественных полостях органов мочевой системы. Поляризационными методами возможно наблюдение особых типов кристаллов. Так, оксалат кальция встречается в моче больных сахарным диабетом. Кристаллы дегидрата мочевой кислоты, обладающие двойным лучепреломлением, наблюдаются при камнеобразовании, при обширных поражениях легких, отравлении свинцом, у больных острым ревматизмом, при нарушении кровообращения. Иногда в моче можно обнаружить кристаллы крахмала, которые в скрещенных поляроидах дают изображение Мальтийского креста.
При селикозе (silicosis) в поляризованном свете гистологического препарата легкого наблюдается свечение кристаллов двуокиси кремния (SiO2). При асбестозе (asbastosis) можно определить размеры волокон асбеста, они обладают свойством двойного лучепреломления. Канцерогенность асбеста зависит не от вида асбеста, а от длины волокон. Волокна размером менее 3 микрон обладают выраженным канцерогенным эффектом. Риск возникновения рака легкого у больных асбестозом увеличивается примерно в 10 раз. Доказано, что асбест потенцирует действие других канцерогенов. Волокна размерами более 5 микрон не обладают канцерогенными свойствами. Профессиональное заболевание – талькоз (talcosis), болезнь легких, вызванная вдыханием пыли талька, также диагностируется поляризационными методами.
Новым и интенсивно развивающимся направлением поляризационной микроскопии стало изучение состава и структуры биожидкостей: сыворотки или плазмы крови, мочи, синовиальной жидкости, лимфы, слеза и т.д. На предметное стекло наносят каплю исследуемой биожидкости и сверху на нее накладывают покровное стекло. Исследуемая капля оказывается между предметным и покровным стеклами. За счет испарения воды через боковую поверхность капля высушивается, и образуются кристаллы. Эти кристаллы исследуются с помощью поляризационного микроскопа. Количество кристаллов, их форма и размеры позволяют производить раннюю диагностику различных заболеваний. Преимущество поляризационного метода состоит в том, что при обычном методе наблюдения в проходящем свете кристаллов не видно.
Третья группа объектов – различные волокна. В 1927 году П.Диври открыл с помощью поляризационной микроскопии амилоидную природу ряда патологических структур мозга стариков. При выявлении амилоида в стенках сосудов диагностируют так называемое заболевание белковой стромально-сосудистой дистрофией. Коллагеновые волокна в различных тканях обладают ярким свечением в скрещенных поляроидах. Собственная анизотропия коллагена при использовании топооптических красителей или импрегнации препаратов металлами – золотом, медью, серебром – усиливается и сопровождается появлением дихроизма.
Очень важным вопросом для судебно-медицинской экспертизы при скоропостижной кончине человека является диагностика причины его смерти на наличие инфаркта миокарда [5–7]. Эту диагностику можно оперативно провести с помощью поляризационной микроскопии. Миофибриллы в поляризованном свете обнаруживают характерную поперечную исчерченность, связанную с чередованием анизотропных (А) и изотропных (I) дисков. А-диски обладают ярко выраженным положительным двойным лучепреломлением и кажутся светлыми в поляризованном свете (при обычном свете они темные), тогда как I-диски почти полностью лишены способности к двойному лучепреломлению и в поляризованном свете выглядят темными (при обычном свете – светлые). Имеются данные о том, что при диагностике инфаркта миокарда при скоропостижной смерти без применения поляризационного метода наблюдаются частые случаи неправильных диагнозов.
Даже нервные ткани, а не то что волосы, способны поведать о многих секретах своих обладателей. Поляризационные методы используются при диагностике заболеваний кожи. Различные компоненты кожи по-разному взаимодействуют с поляризованным светом. Созданы приборы, в которых кожа освещается поляризованным светом. Наблюдение и регистрация также осуществляются через поляризатор. При таком методе наблюдения более контрастно выражены различные новообразования и повреждения на коже.
Поляризационный флуоресцентный иммуноанализ
В основе поляризационного флуоресцентного иммуноанализа (ПФИА) лежит свойство увеличения поляризации при флуоресценции небольших флуоресцентно меченых гаптенов (меток) при связывании со специфичным антителом. Если образец содержит непомеченное определяемое вещество, метка связывается с антителом конкурентно, и поляризационный сигнал уменьшается. ПФИА не требует фракционирования образцов. В настоящее время разработано большое количество методик ПФИА для малых гаптенов, таких как лекарственные препараты, гормоны, антибиотики, токсины, детергенты, пестициды и т.д. Изучаемые клетки возбуждают светом, поляризованным в вертикальной плоскости. Регистрируется флуоресценция через поляризатор, ориентированный в горизонтальной плоскости.
В дополнение к стандартной методике поляризационной микроскопии предлагается новая, более информативная, методика. Обычно для поляризационной микроскопии используются поляризационные фильтры с линейной поляризацией. В новой методике предлагается диагностика препаратов с использованием поляризационных фильтров с циркулярной поляризацией. Оказалось, что изображения, полученные с помощью циркулярных фильтров, несут, по сравнению со стандартной методикой, гораздо больше информации и позволяют выявлять более тонкую структуру тканей и клеток.
Литература
Шмидт В. Ткани животных организмов в поляризованном свете. – F. Cohen, Bonn, 1924.
Кактурский Л.В. Поляризационная микроскопия. Микроскопическая техника. – М.:Медицина, 1996.
Шабалин В.Н., Шатохина С.Н. Морфология биологических жидкостей человека. – М.: Хризостом, 2001.
Шаповальянц С.Г., Цкаев А.Ю., Иванова Т.В. Поляризационная микроскопия желчи в диагностике микрохоледохолитиаза. – Хирургия, №5, 1999, с. 15.
Целлариус Ю.Г., Семенова Л.А., Непомнящих Л.М. Патологоанатомическая диагностика преднекротичских изменений и инфаркта миокарда методом поляризационной микроскопии. Методические рекомендации. – М.: Минздрав СССР, 1979.
Габинский Я.Л., Яковлев Ю.Р., Яковлева С.Б. Текстурный атлас: инфаркт миокарда и информационно-аналитические возможности поляризационной микроскопии. – Екатеринбург: Изд. Екатеринбургский инфарктный центр, 1994.
Гринберг Л.М. Поляризационная микроскопия в патологоанатомической практике. – Екатеринбург, 1995.
Соотношение (2) лежит в основе весьма чувствительного метода измерения концентрации растворенных веществ, в частности сахара. Этот метод (поляриметрия или сахариметрия) широко используют в медицине для определения концентрации сахара в моче, в биофизических исследованиях, а также в пищевой промышленности. Соответствующие измерительные приборы называют поляриметрами или сахариметрами. Поляриметр позволяет измерять не только концентрацию, но и удельное вращение. Используя различные светофильтры, можно найти зависимость удельного вращения от длины волны (дисперсию оптической активности), в настоящее время для этих целей применяют специальные приборы - спектрополяриметры.
Для исследования прозрачных биологических объектов используют поляризационный микроскоп. Он аналогичен обычному, но снабжен двумя призмами Николя: одна расположена перед конденсором и служит поляризатором, вторая - в тубусе между объективом и окуляром и служит анализатором. Предметный столик вращается вокруг продольной оси микроскопа на 360 0 .Если поляризационный микроскоп, установленный на полное затемнение поля зрения (скрещенные николи), поместить препарат с изотропной структурой, то поле зрения останется темным. В случае, когда между поляризатором и анализатором помещен препарат с анизотропными структурами, свет, прошедший поляризатор, будет в них вновь двояко преломляться. В связи с этим, он не гасится полностью анализатором, и соответствующие структуры выступают просветленными на общем темном фоне поля зрения.
Ряд тканей (мышечная, костная, нервная) обладают оптической анизотропией, поэтому возможна поляризационная микроскопия биологических объектов. В качестве примера на рис.5.1 приведена микрофотография тонкого среза кости, полученная с помощью поляризационного микроскопа. На срезе видны только те остеоны, коллагеновые волокна которых лежат в плоскости среза. Волокна, расположенные перпендикулярно плоскости среза, через которые свет проходит вдоль оптической оси (т. е. без двойного лучепреломления), остаются затемненными.
Соотношение (2) лежит в основе весьма чувствительного метода измерения концентрации растворенных веществ, в частности сахара. Этот метод (поляриметрия или сахариметрия) широко используют в медицине для определения концентрации сахара в моче, в биофизических исследованиях, а также в пищевой промышленности. Соответствующие измерительные приборы называют поляриметрами или сахариметрами. Поляриметр позволяет измерять не только концентрацию, но и удельное вращение. Используя различные светофильтры, можно найти зависимость удельного вращения от длины волны (дисперсию оптической активности), в настоящее время для этих целей применяют специальные приборы - спектрополяриметры.
Для исследования прозрачных биологических объектов используют поляризационный микроскоп. Он аналогичен обычному, но снабжен двумя призмами Николя: одна расположена перед конденсором и служит поляризатором, вторая - в тубусе между объективом и окуляром и служит анализатором. Предметный столик вращается вокруг продольной оси микроскопа на 360 0 .Если поляризационный микроскоп, установленный на полное затемнение поля зрения (скрещенные николи), поместить препарат с изотропной структурой, то поле зрения останется темным. В случае, когда между поляризатором и анализатором помещен препарат с анизотропными структурами, свет, прошедший поляризатор, будет в них вновь двояко преломляться. В связи с этим, он не гасится полностью анализатором, и соответствующие структуры выступают просветленными на общем темном фоне поля зрения.
Ряд тканей (мышечная, костная, нервная) обладают оптической анизотропией, поэтому возможна поляризационная микроскопия биологических объектов. В качестве примера на рис.5.1 приведена микрофотография тонкого среза кости, полученная с помощью поляризационного микроскопа. На срезе видны только те остеоны, коллагеновые волокна которых лежат в плоскости среза. Волокна, расположенные перпендикулярно плоскости среза, через которые свет проходит вдоль оптической оси (т. е. без двойного лучепреломления), остаются затемненными.
Рассматривая прозрачные биологические объекты в микроскопе, трудно выявить различные структуры, поэтому приходится применять некоторые специальные методики; в их числе поляризационная микроскопия.
Поляризационный микроскоп аналогичен обычному, но имеет поляризатор перед конденсатором и анализатор в тубусе между объективом и окуляром. Предметный столик вращается вокруг оптической оси микроскопа. Таким образом, объект освещают поляризованными лучами и рассматривают через анализатор.
Если скрестить поляризатор и анализатор, то поле зрения остается темным, таким же оно останется при помещении на предметный столик изотропных прозрачных тел. Анизотропные предметы изменяют поле зрения в соответствии с тем, что они оказывают влияние на плоскость поляризации.
Так как некоторые ткани (мышечная, костная, нервная) обладают оптической анизотропией, то возможна поляризационная микроскопия биологических объектов. При скрещенных поляризаторе и анализаторе будут видны только те волокна, анизотропия которых изменяет поляризованный свет.
Поляризованный свет можно использовать в модельных условиях, для оценки механических напряжений возникающих в костных тканях. Этот метод основан на явлении фотоупругости, которое заключается в возникновении оптической анизотропии в первоначально изотропных твердых телах под действием механических нагрузок.

Из прозрачного изотропного материала, например плексигласа, создают плоскую модель кости. В скрещенных поляроидах эта модель незаметна. Прикладывая нагрузку, вызывают анизотропию плексигласа, что становится заметным по характерной картине полос и пятен (рис. 27). По этой картине, а также по ее изменению при увеличении и уменьшении нагрузки можно делать выводы о механических напряжениях, возникающих в модели, а следовательно, и в натуре.
5.6. Оптическая система глаза

Глаз является сложной оптической системой находящейся в белковой оболочке 1 (рис.28).
С ней соприкасается сосудистая оболочка 2, к которой прилегает сетчатая оболочка 3 (сетчатка), состоящая из мельчайших светочувствительный элементов (размеры порядка 10 мкм) являющихся окончаниями нервных волокон зрительного нерва 4 идущего к головному мозгу. В передней части белковая оболочка переходит в роговую (роговица) 5, а сосудистая – в радужную 6 со зрачком. Позади зрачка расположен хрусталик 7 – прозрачная упругая двояковыпуклая линза. Полость белковой оболочки заполнена прозрачной жидкостью с показателем преломления n=1,33 (у роговицы nр=1,38, у хрусталика в среднем n=1,44).
Изображение проецируется на сетчатку. Оно действительное, уменьшенное и перевернутое. Корректируется головным мозгом для правильного восприятия.
Зрачок играет роль диафрагмы и регулирует количество света, попадающего в глаз, а кривизна поверхностей хрусталика изменяется с помощью ресничной мышцы, обеспечивая резкое изображение на сетчатке предметов, находящихся на различных расстояниях от глаза (аккомодация).
При расслабленной ресничной мышце хорошо видны предметы, распложенные далее 8 метров, а вследствие аккомодации отчетливо видны предметы, находящиеся на расстоянии большем расстояния ясного зрения (25см).
Размер получаемого изображения зависит от угла зрения α между лучами, попадающими в глаз от крайних точек предмета, который может быть не менее 1 угловой минуты, и называется предельным углом зрения.
Поэтому невооруженным глазом нельзя четко рассмотреть как крупные, но далеко расположенные предметы, так и близко распложенные, но мелкие. Для увеличения угла зрения применяют телескопы и микроскопы.
Наиболее распространенными дефектами глаза являются близорукость (изображение перед сетчаткой) и дальнозоркость (за сетчаткой). Эти дефекты исправляются соответственно с помощью рассеивающих или собирающих линз.
Светочувствительные элементы сетчатки подразделяются на палочки и колбочки. Палочки более чувствительны, но не реагируют на цвет, а колбочки обладают спектральной чувствительностью, однако в узком интервале длины волны – 0,77-0,38 мкм (видимый свет), причем наибольшая чувствительность приходится на длину волны, соответствующую зеленому свету – 0,555 мкм.
Мерой спектральной чувствительности глаза является коэффициент видности излучения с длиной волны λ, характеризующийся отношением мощности монохроматического излучения с длиной волны λмакс=0,55 мкм к мощности монохроматического излучения, с длиной волны λ, вызывающего такое же ощущение, как и излучение с диной волны λмакс.

Так, например, для красного света Uλ=5*10 -5 .
Свет снижает чувствительность глаза, но в темноте она значительна и составляет 10 -17 Дж, что соответствует свету, испускаемому свечой, находящейся на расстоянии 100 км в прозрачной атмосфере.
У многих насекомых максимальная чувствительность зрения в области ультрафиолетовой части спектра, а зрение большинства птиц наиболее чувствительно к красному цвету.
Поляризационная микроскопия — один из высокоэффективных методов морфологического исследования, обладающий широкими возможностями идентификации биологических структур, что в сочетании с доступностью и относительной простотой обусловливает его высокую ценность. Метод позволяет изучать не только гистологическое строение препарата, но и некоторые его гистохимические параметры. В 40 —50-х годах XX в. поляризационную микроскопию причисляли к ультраструктурным методам, так как она позволяла видеть ультраструктурные способности тканей.
Поляризационная микроскопия предназначена для изучения свойств гистологических структур, обладающих способностью двоякого лучепреломления (анизотропии) — раздвоения светового луча при прохождении его через анизотропную среду. Световая волна в анизотропной среде распадается на две волны с взаимно перпендикулярными плоскостями колебаний электромагнитных волн. Эти плоскости называются плоскостями поляризации. Поляризованный свет отличается от обычного (неполяризованного) тем, что в последнем колебания световых волн происходят в различных плоскостях, а в поляризованном свете — лишь в определенной плоскости.
Для создания эффекта поляризации в поляризационном микроскопе применяются два поляроида. Первый, который называется поляризатором, помещается между осветителем микроскопа и гистологическим препаратом.Второй поляроид, находящийся между гистологическим препаратом и глазом исследователя, — анализатором. И поляризатор, и анализатор в оптическом отношении представляют собой совершенно одинаковые поляризационные фильтры, поэтому их можно менять местами (если конструкция микроскопа это позволяет). Ранее для поляризационной микроскопии применяли изготавливаемые из исландского шпата призмы Николя, Аренса или Томсона. У этих призм был ограничен угол преломления света. В настоящее время вместо них используют плоские поляризационные фильтры, продуцирующие широкопольный поляризованный свет.
В создании поляризованного света определяющую роль играет взаимное расположение поляризатора и анализатора относительно оптической оси микроскопа. Если они ориентированы таким образом, что тот и другой пропускают поляризованный свет в одной и той же плоскости, т.е. при совпадении их плоскостей поляризации, оба поляризационных фильтра способны пропускать поляризованный свет; поле зрения микроскопа при этом светлое (рис. 1,а).
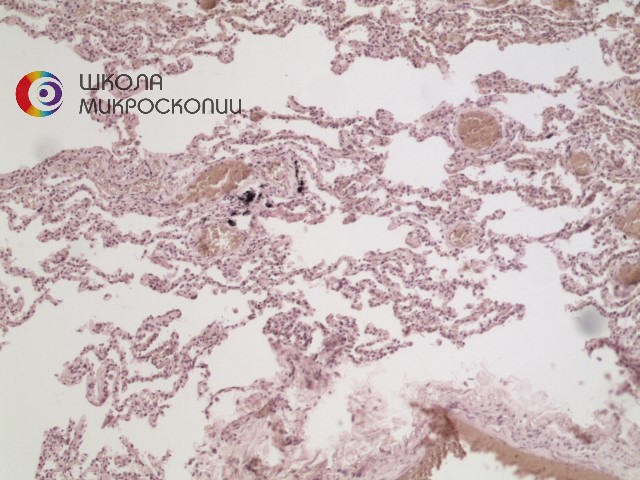
Рис. 1 Препарат легкого человека в светлом поле, OlympusCX41, объектив 10х
Если же плоскости поляризации поляризационных фильтров взаимно перпендикулярны (этого достигают путем поворота анализатора на 90° вокруг оптической оси микроскопа), то поляризованный свет не проходит и исследователь видит темное поле зрения (рис. 2).
При повороте поляризатора на 360° в процессе его вращения поле зрения дважды полностью затемнено и дважды полностью просветлено. В прошлом применяли компенсаторные фильтры Бернауэра, при использовании которых затемненное поле зрения имеет красноватый оттенок (U-TP530). При применении черных зеркальных фильтров затемненное поле зрения выглядит не полностью темным, а слабо подсвеченным.

Рис.2 Препарат легкого человека в поляризованном свете, OlympusCX41, объектив 10х
В тех случаях, когда при скрещенном положении поляризационных фильтров (т.е. в ортоскопии) на пути поляризованного света встречаются анизотропные субстанции, содержащиеся в гистологическом препарате, эти субстанции расщепляют поляризованный свет на два луча с взаимно перпендикулярными плоскостями колебаний световых волн. Световые лучи с плоскостью колебаний, совпадающей с плоскостью поляризации, проходят через анализатор, а с перпендикулярной — отсекаются, вследствие чего интенсивность светового потока, попадающего в глаз исследователя и на камеру, составляет лишь половину интенсивности исходного светового пучка. В результате описанных процессов анизотропные субстанции, находящиеся между двумя скрещенными поляризаторами, видны на темном фоне в виде светлых светящихся объектов. При этом изотропные структуры, не обладающие способностью двоякого лучепреломления, остаются темными.
Это также влияет на выбор камеры для поляризационной микроскопии. Так как задача стоит снять небольшие светлые сигналы на темном фоне, то обычно камеры для светлопольной микроскопии может быть недостаточно, из-за низкой чувствительности камеры и большого количества шумов, которые образуются при съемке. Для съемки в поляризационной микроскопии необходима камера для микроскопии с высокой чувствительностью и точной цветопередачей. Предпочтительно использовать камеры на базе CCD- матриц (OlympusDP80, DP73, DP26,VideoZavr VZ-18C28, VZ-CC50S), однако на текущем этапе можно применять и бюджетные варианты камер на базе CMOS-матриц Sonyсерии IMX (VZ-18C23).
В биологических тканях имеется достаточное количество анизотропных структур: элементы сократительного аппарата мышц, амилоид, мочевая кислота, коллагеновые образования, некоторые липиды, ряд кристаллов и др.
Расщепленные в анизотропном объекте и проходящие через анализатор световые лучи характеризуются неодинаковой скоростью распространения волн. В зависимости от величины этой разницы (ее еще называют величиной задержки светового луча) и от различий абсорбции света в анализаторе свечение анизотропных объектов может быть белым или цветным. В последнем случае речь идет о феномене дихроизма (двойная абсорбция). Цветовые эффекты при исследовании в поле поляризации дают, например, многие кристаллы.
Процесс двоякого лучепреломления может быть усилен путем применения определенных красителей, молекулы которых обладают способностью ориентированно откладываться на анизотропных структурах. Гистохимические реакции, в результате которых возникает эффект анизотропии, называются топооптическими реакциями (G. Romhanyi). Различают две разновидности таких реакций — аддитивные и инверсивные. При аддитивных реакциях задержка светового луча увеличивается, что называют положительной анизотропией, при инверсивных реакциях она уменьшается — отрицательная анизотропия.
АППАРАТУРА И ОБОРУДОВАНИЕ
Поляризационную микроскопию проводят с помощью специальных поляризационных микроскопов. В качестве примера можно назвать импортные микроскопы Olympus BX53, Olympus BX43, Olympus CX41. Большинство современных оптических микроскопов оснащаются принадлежностями для поляризационной микроскопии.
Для поляризационной микроскопии можно приспособить любой световой микроскоп лабораторного и исследовательского класса. Достаточно иметь два поляризационных фильтра, один из которых, выполняющий функцию поляризатора, помещают между источником света и препаратом, а другой, играющий роль анализатора,— между препаратом и глазом исследователя. Поляризатор может быть встроен в конденсор или же размещен под ним над полевой диафрагмой, а анализатор — в слот револьвера или же промежуточную вставку.

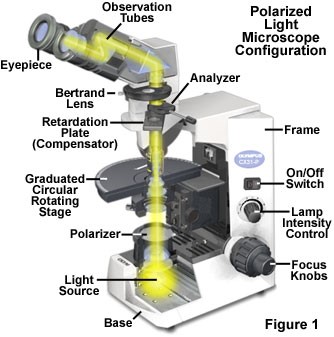
На рис. 3 представлена принципиальная схема поляризационного микроскопа. Помимо общих для всех световых микроскопов компонентов, в поляризационном микроскопе имеется два поляризационных фильтра (поляризатор, размещаемый обычно под конденсором, и анализатор, находящийся в окуляре), а также компенсатор. Анализатор должен обязательно вращаться, причем для определения степени вращения необходима соответствующая градуированная шкала.
В поляризационном микроскопе используется источник освещения, обеспечивающий высокую плотность светового пучка. В качестве такого источника рекомендуют применять лампу мощностью 100 Вт при напряжении 12 В. Для некоторых видов исследования требуется монохроматический свет. С этой целью используют металлический интерференционный фильтр, который лучше поместить над зеркалом [Scheuner G., Hutschenre-iter J., 1972]. Рассеивающее свет матовое стекло помещают перед поляризатором, т.е. между ним и источником освещения, но ни в коем случае не после поляризатора, так как при этом нарушается функция поляризационного фильтра.
Раньше для поляризационной микроскопии применялись ахроматические объективы без внутренних натяжений, однако сейчас они редкость. На сегодняшний день в поляризационном микроскопе используют только планахроматические объективы, которые не имеют внутренних натяжений. Апохроматические объективы можно применять лишь в тех случаях, когда требуется нормальная цветопередача при микрофотографировании [Appelt Н., 1955].
Поляризационные микроскопы оснащаются вращающимся предметным столиком, положение которого относительно оптической оси можно менять. Угол поворота столика измеряют с помощью градусной шкалы, нанесенной по его окружности. Одним из обязательных условий, обеспечивающих эффективное применение поляризационной микроскопии, является тщательная центровка вращающегося предметного столика с помощью центровочных винтов.
Важным элементом поляризационного микроскопа является компенсатор, помещаемый между объективом и анализатором, обычно в тубусе микроскопа. Компенсатор представляет собой пластинку, изготавливаемую из особых сортов гипса, кварца или слюды. Он позволяет измерять разницу хода расщепленных световых лучей, выражающуюся в нанометрах. Функционирование компенсатора обеспечивается его способностью изменять разницу хода световых лучей, низводя ее до нуля либо увеличивая до максимума. Это достигается вращением компенсатора вокруг оптической оси.
МЕТОДИКА МИКРОСКОПИИ В ПОЛЯРИЗОВАННОМ СВЕТЕ
Поляризационную микроскопию удобнее проводить в затемненном помещении, так как интенсивность светового потока, попадающего в глаз исследователя, уменьшается в 2 раза по сравнению с исходной. После включения осветителя микроскопа вначале добиваются максимально яркого освещения поля зрения путем вращения поляризатора или анализатора. Такое положение поляризационных фильтров соответствует совпадению их плоскостей поляризации. Препарат помещают на предметный столик и изучают его сначала в светлом поле. Затем путем вращения поляризатора (или анализатора) максимально затемняют поле зрения; эта позиция фильтра соответствует перпендикулярному расположению плоскостей поляризации. Для того чтобы выявить эффект анизотропии, нужно совместить плоскость поляризации анизотропного объекта с плоскостью поляризованного света. Эмпирически этого добиваются путем вращения предметного столика вокруг оптической оси. Если для поляризационной микроскопии используют световой микроскоп, не оборудованный вращающимся столиком, то приходится вращать гистологический препарат вручную. Это допустимо, однако в таком случае нельзя проводить отдельные виды поляризационной микроскопии, требующие количественной оценки (определение знака двоякого лучепреломления, величины разницы хода световых лучей).
Если анизотропные объекты в исследуемом препарате расположены упорядоченно (например, анизотропные диски поперечнополосатых мышечных волокон), их удобно изучать в фиксированном положении предметного столика, при котором эти объекты дают максимальное свечение на темном фоне. Если же анизотропные структуры располагаются в препарате хаотично (например, кристаллы), то при их исследовании приходится постоянно вращать предметный столик, добиваясь свечения той или иной группы объектов.
Для проведения более углубленного анализа и оценки топооптических реакций необходимо знать методику определения относительного знака двоякого лучепреломления, величины разницы хода лучей и индекса (коэффициента) лучепреломления.
Знак двоякого лучепреломления характеризует степень и направление смещения хода световых лучей, проходящих через анализатор. Это смещение вызывается топооптическими красителями, и в том случае, если оно направлено в сторону уменьшения разницы хода лучей, говорят об отрицательном знаке двоякого лучепреломления (отрицательная анизотропия), если же оно способствует увеличению разницы хода лучей, то констатируют положительный знак двоякого лучепреломления (положительная анизотропия). Если разница хода лучей исчезает, то эффект анизотропии нивелируется.
Знак двоякого лучепреломления определяют с помощью компенсатора. Процедура его применения заключается в следующем. Исследуемый объект помещают в положение, при котором в темном поле зрения достигается максимальное свечение анизотропных структур. Пластинку RI-компенсатора поворачивают вокруг оптической оси под углом +45° по отношению к плоскости поляризации анализатора. Объект в зависимости от разницы хода световых лучей, которая может колебаться от 20 до 200 нм, приобретает либо голубую, либо желтую окраску. В первом случае знак двоякого лучепреломления положительный, во втором — отрицательный. Следует иметь в виду, что в том случае, когда компенсатор расположен под углом +45°, общий фон затемненного поля зрения имеет красный оттенок.
Можно использовать также компенсатор λ/4 (U-TP137). Процедура его применения такая же, только поле зрения имеет не красный, а серый оттенок, и объект при положительном знаке лучепреломления светится, а при отрицательном — затемнен.
Количественное определение разницы хода световых лучей, выражаемой в нанометрах, осуществляют с помощью компенсатора Брака Келера. Для этого используют формулу:
где λ — константа, проставляемая на компенсаторе заводом-изготовителем, φ — угол поворота компенсатора относительно плоскости поляризации анализатора.
Индекс лучепреломления анизотропного объекта определяют путем его сопоставления (под микроскопом) с тест-объектом, помещаемым рядом. В качестве тест-объектов используют стандартные жидкости с известным индексом лучепреломления. Объект и образец помещают рядом на предметном столике. При несовпадении их коэффициентов преломления между объектом и образцом видна светлая линия, называемая линией Бека. Подъем тубуса микроскопа относительно сфокусированного положения вызывает смещение линии Бека в сторону среды, дающей более выраженный эффект лучепреломления. При совпадении коэффициентов лучепреломления объекта и образца линия Бека исчезает. Обычно коэффициент лучепреломления определяют в монохроматическом свете для натриевой линии спектра (при длине волны 589 нм и температуре 20 °С). Лучепреломление cледует определять для двух взаимно перпендикулярных плоскостей поляризации. С этой целью снимают анализатор и регистрируют лучепреломление объекта в его двух взаимно перпендикулярных положениях. Разница между обоими показателями лучепреломления (ng — nk) характеризует силу лучепреломления.
ОСОБЕННОСТИ ОБРАБОТКИ МАТЕРИАЛА И ПРИГОТОВЛЕНИЯ ПРЕПАРАТОВ
Фиксация материала для поляризационной микроскопии в кислом формалине нежелательна, так как формалиновый пигмент, образующийся при взаимодействии гемоглобина тканей с кислым формальдегидом, обладает анизотропными свойствами и затрудняет изучение препаратов в поляризованном свете. G. Scheuner и J. Hutschenreiter (1972) рекомендуют использовать с этой целью 10 % нейтральный формалин, раствор кальций-формола по Бейкеру, жидкость Карнуа.
Продолжительность фиксации в 10 % нейтральном формалине 24 — 72 ч при 4 °С, в растворе кальций-формола по Бейкеру — 16 — 24 ч при 4 °С. Фиксация в кальций-формоле особенно предпочтительна при исследовании липидно-белковых соединений. Жидкость Карнуа быстро пропитывает ткани. Кусочки толщиной 1 — 2 мм бывают профилированы уже через 1 ч при температуре 4 °С. Для исследования липидов фиксация в жидкости Карнуа непригодна. Кроме того, применяют жидкость Ценкера, особенно при импрегнации солями золота и серебра. После обработки смесью жидкости Ценкера и уксусной кислоты эритроциты приобретают способность к двоякому лучепреломлению.
При исследовании в поляризационном микроскопе плотных тканей (кости, зубы), помимо кислотной декальцинации, необходима дополнительная обработка для удаления коллагеновых волокон. С этой целью шлифы таких тканей в течение нескольких минут варят в смеси глицерина и гидроксида калия (10 мл глицерина и 2 крупинки гидроксида калия) до полного побеления, затем осторожно сливают щелочь, шлиф промывают в воде и переносят с помощью пинцета на предметный столик микроскопа.
Для поляризационной микроскопии используют парафиновые, замороженные и криостатные срезы. Неокрашенные замороженные срезы для изучения в поляризованном свете заключают в глицерин. Нефиксированные криостатные срезы пригодны для поляризационно-микроскопического анализа сразу после приготовления. В связи с их высокой чувствительностью к повреждающему действию различных факторов внешней среды эти срезы все же рекомендуют фиксировать в 10 % нейтральном формалине или растворе кальций-формола.
На результаты поляризационной микроскопии оказывает влияние толщина гистологических срезов. При исследовании толстых срезов создаются условия для наложения разных анизотропных структур друг на друга. Кроме того, при разной толщине срезов могут меняться анизотропные свойства изучаемых структур, поэтому очень важно, особенно при сравнительных исследованиях, обеспечивать постоянную толщину срезов. Рекомендуемая максимальная толщина срезов не должна превышать 10 мкм.
Еще одним обязательным условием является тщательное депарафинирование срезов, так как не удалённые остатки парафина дают выраженный эффект анизотропии, затрудняя исследование. Парафин особенно долго задерживается на эритроцитах и ядрах клеток. Для того чтобы полностью удалить парафин из срезов, рекомендуют провести их следующую обработку.
- Ксилол 30 мин
- Спирт 100% 5 мин
- Смесь метанола и хлороформа (1:1) при 50 °С 24 ч
- Спирт 100 % 5 мин
- Спирт 70 % 10 мин Вода
Следует также иметь в виду, что срезы, которые подвергают поляризационной микроскопии, не должны вступать в контакт с фенолами (например, их нельзя просветлять в карбол-ксилоле).
Если у Вас возникли вопросы по поляризационной микроскопии, обратитесь в Школу микроскопии.
Исследование биологических тканей в поляризованном свете
Рассматривая прозрачные биологические объекты в микроскопе, трудно выявить различные структуры, поэтому приходится применять некоторыеспециальные методики; в их числе поляризационная микроскопия.
Поляризационный (петрографический) микроскоп аналогичен обычному биологическому микроскопу, но имеет поляризатор перед конденсором ианализатор в тубусе между объективом и окуляром. Предметный столик может вращаться вокруг оптической оси микроскопа. Таким образом, объект освещают поляризованными лучами и рассматривают через анализатор.
Еслискрестить поляризатор и анализатор, то поле зрения будет темным, таким же оно останется при помещении на предметный столик изотропных прозрачных тел. Анизотропные предметы изменяют поле зрения в соответствиис тем влиянием, которое они окажут на направление плоскости колебаний поляризованного света.
Поляризационная микроскопия – эффективный метод исследования структуры и свойств цитологических игистологических препаратов. Известно, что многие биологические объекты являются анизотропными. Поэтому поляризационные методы позволяют оперативно и просто обнаружить оптически неоднородные объекты идиагностировать заболевание.
Поляризационный метод применяется в диагностике биологических объектов очень давно. Одним из первых его применил в биологии немецкий исследователь В.Шмидт в 1924 году. Большой вклад вприменение поляризационной микроскопии в гистологии внесли Ю.Целлариус и Л.Кактурский. Поляризационная микроскопия позволяет изучать свойства гистологических структур, обладающих способностью двойноголучепреломления [2]. При желании для реализации метода любой оптический микроскоп можно превратить в поляризационный микроскоп. Для этого оптический микроскоп снабжают дополнительно двумя поляризационными фильтрами. Первыйфильтр помещают непосредственно между осветителем и объектом (поляризатор). Он преобразует обычный свет в линейно-поляризованный. Второй.
Чтобы читать весь документ, зарегистрируйся.
Связанные рефераты
Биологические ткани
. анатомии, зрение. Здесь присутствует элемент оптики: лучи света преломляются в хрусталике.
12 Стр. 31 Просмотры
: Физические основы взаимодействия звука и биоло
. основы взаимодействия звука и биологических тканей. Применение ультразвуковых.
«Физические основы взаимодействия звука и биолог
. Показания к применению масла черного тмина | | |Заболевание верхних и нижних дыхательных путей;.
2 Стр. 118 Просмотры
Физические основы взаимодействия звука и биологи
. основы взаимодействия звука и биологических тканей. Применение ультразвуковых.
25 Стр. 12 Просмотры
Исследование поляризационного светофильтра – пол
. исследовать зависимость светопропускания и степени поляризации света поляроидом от длины.
Читайте также:

