Интересные факты о кислороде по химии кратко
Обновлено: 05.07.2024
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 2s 2p
Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Кислород О2 — газ без цвета, вкуса и запаха, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород – голубоватая жидкость, кипящая при -183 о С.
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
- Разложение некоторых кислородосодержащих веществ:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода в присутствии оксида марганца (IV):
2HgO → 2Hg + O2
Соединения кислорода
Основные степени окисления кислород +2, +1, 0, -1 и -2.
Оксиды металлов и неметаллов Na2O, SO2 и др.
Соли кислородсодержащих кислот
Кислородсодержащие органические вещества
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) и свойства восстановителя (только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами , и с неметаллами . Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо , в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:

Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды . При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения ( сероводород, аммиак, метан, силан гидриды . При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора ( сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления ( оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например , кислород окисляет гидроксид железа (II):
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)

На самом деле, не так уж и много. По этой причине мы решили подробнее рассказать вам об этом элементе. Для вас мы подобрали самые интересные факты о кислороде, которые должны понравиться не только детям и школьникам, изучающим газ на уроках химии, но и их родителям.

Когда-то было время, когда на нашей планете Земля не было О2. Тогда она была полностью покрыта океанами. Когда он впервые появился, он уничтожил около 99% всей жизни на планете. Сегодня без О2 не обходится ни одно живое существо на планете. Он находится в воздухе, которым мы дышим, и в воде, какую мы пьем. Его концентрация в воздухе находится в пределах 21%. Он также является самым распространенным элементом в земной коре (около 47%). То есть, если вы копнете грунт, то почти 50% того, что у вас будет на лопате, будет кислородом.

Официально же первооткрывателем этого элемента стал британский натуралист, священник и философ Джозеп Пристли. Он не только открыл кислород, он также открыл аммиак, монооксид углерода, хлороводород, оксид серы и оксид азота.

Только за один год вся зелень на нашей планете образует около 3 триллионов тонн кислорода. Однако его содержание в атмосфере ограничивается 21%, тогда как несколько миллионов лет назад концентрация этого элемента была выше прочти в 2 раза — 37-40%. Содержание кислорода в воздухе ниже 8% считается опасным для жизни.

Тело взрослого человека нуждается приблизительно в 500 литрах О2 в сутки. Если запереть человека в небольшой комнате без доступа к кислороду, то он задохнется от своего же собственного угарного газа, который выделяет при дыхании.

Однако мозг не единственный орган, который нуждается в больших объемах кислорода. Больше всего О2 поглощает печень (20.4%) и сердце (11.6%).
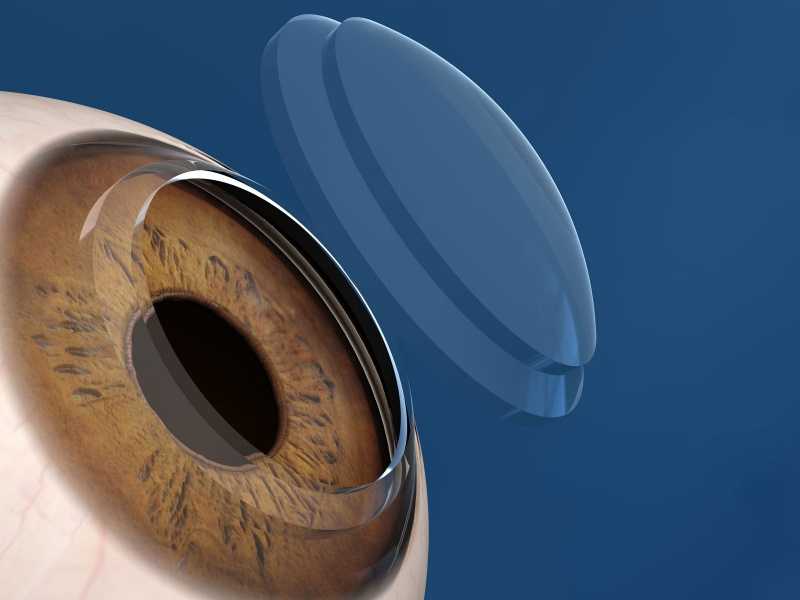
Все органы человеческого тела получают О2 благодаря кровообращению. Однако в роговице глаза нет кровообращения. Из-за этого роговице приходится самостоятельно получать этот элемент из окружающей среды.

У каждого млекопитающего есть рефлекс задержки дыхания. Он сильнее всего проявляется тогда, когда человек попадает в ледяную воду. Этот рефлекс не только задерживает дыхание, но и снижает частоту сердечных сокращений на 25%.
В человеческое легкое помещается около 6 литров О2. Однако мы не используем этот орган на полную мощность. У здорового человека задействовано только 70% легких. Легкие у разных людей могут быть разных размеров. Причем правое легкое чаще всего шине (но короче), чем левое.

Удивительно, но только 5 элементов составляют более 90% веса земной коры. Как мы говорили ранее, около 50% от веса приходится на О2. Остальные четыре элемента — это кремний, алюминий, железо и кальций.
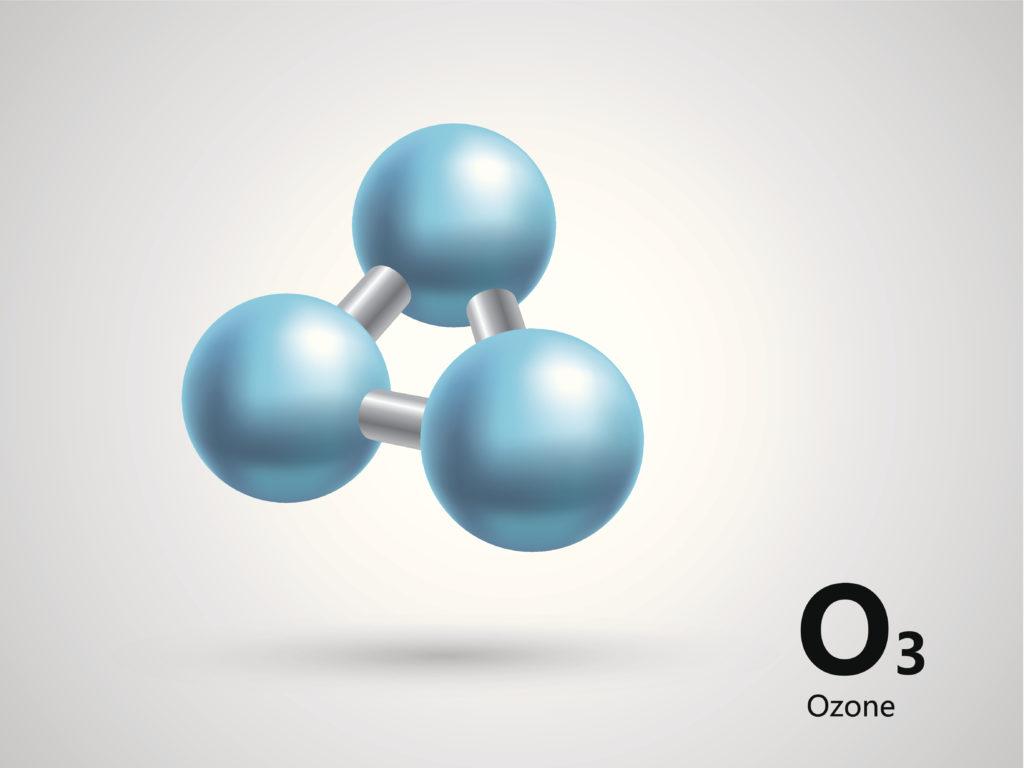
Озон (О3) является мощным окислителем, способным превращать диоксид серы в триоксид серы, сульфиды в сульфаты, йодиды а йод и многие органические соединения в кислородосодержащие производные, такие как альдегиды и кислоты.
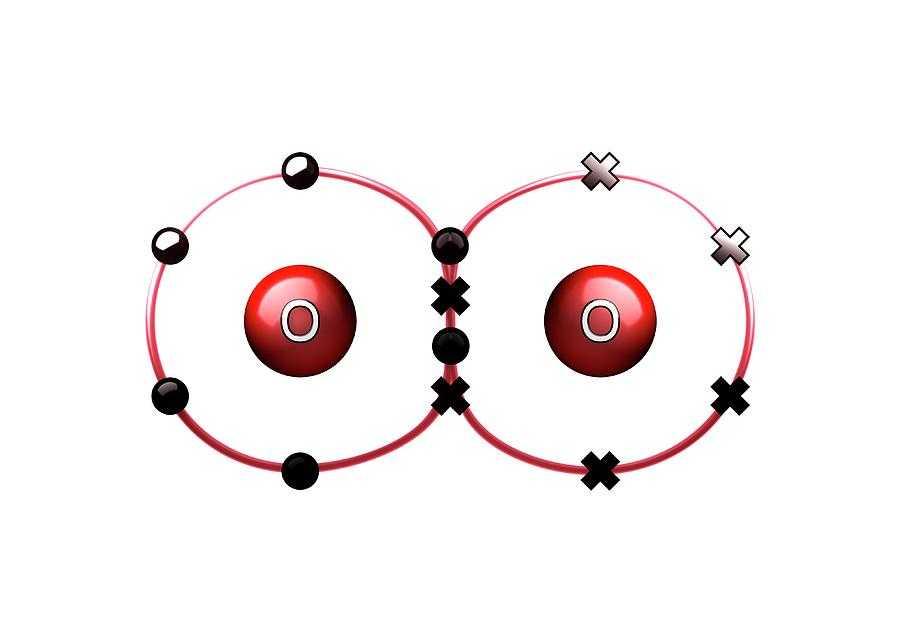
Он образует двухатомные частицы О2 при нормальных условиях и трехатомные частицы озона О3. Есть также свидетельства очень нестабильной тетатомной разновидности О4.
В молекулярной двухатомной форме есть два неспаренных электрона, которые находятся на антисвязывающих орбиталях. Парамагнитное поведение кислорода подтверждает наличие таких электронов.

Жидкий кислород (жО2) — это жидкость бледно-синего цвета. Это один из 4-х агрегатных состояний О2. Он активно используется в космической и газовой отраслях, а также при эксплуатации подводных лодок. Удивительно, но жО2 является магнитным. Его можно перемещать даже захватывая мощными магнитами.


В основном аквалангисты используют так называемый нитрокс (найтрокс). Он содержит не 21% кислорода, а 40%. Некоторые профессиональные дайверы используют найтрокс, содержащий 80% кислорода. Преимущества использования нитрокса — меньшая утомляемость во время плавания и более длительное время погружения.

Если вы думаете, что кислород есть только на планет Земля, то вы ошибаетесь. Он также есть и на Марсе, однако там его очень мало. Атмосфера Марса состоит из 94.9% углекислого газа, 2.6% азота, 1.9% аргона и только 0.174% кислорода.
Есть О2 также и на Солнце, однако его концентрация еще ниже, всего 0.078%.

Из-за человеческой деятельности плотность кислорода в атмосфере Земли ежегодно падает. В основном это вызвано массовой вырубкой лесов. Всего 300 лет тому назад в атмосфере Земли было около 30% кислорода. Сегодня этот показатель варьируется в районах 21%. Однако ученые сообщают о том, что в скором времени он может упасть до 19%.

Наверняка вы знаете, что кислород — это газ, который нужен людям и всем животным для дыхания. А что ещё можно рассказать о кислороде? Разные интересные факты о данном химическом элементе — в этом посте.
Факты о кислороде
Он ядовит

Этот газ необходим для дыхания как животных, так и растений. Интересно, но несмотря на то, что без него не было бы жизни, слишком большое его количество может привести к отравлению и даже смерти. Симптомы отравления кислородом включают в себя потерю зрения, кашель, мышечные спазмы и судороги. При нормальном атмосферном давлении отравление кислородом наступает, если его содержание в воздухе превышает 50 % (обычное содержание кислорода в атмосфере — 21 %).
2) Кислород не только нужен для жизни, но и существует благодаря ей
Когда было обнаружено, что кислород необходим для дыхания, учёные поначалу даже испугались. Ведь со временем кислород в атмосфере закончится, и тогда все умрут! Однако вскоре было обнаружено, что растения поглощают углекислый газ и вырабатывают кислород под действием света. Более того, сейчас известно, что до появления жизни в атмосфере вообще не было газообразного кислорода. И это не удивительно, поскольку кислород — очень активный химический элемент. Так что ещё до того, как Земля успела сформироваться, весь кислород соединился с другими химическими элементами.
Наполненная же кислородом атмосфера появилась далеко не сразу. Хотя жизнь возникла очень давно, первые формы жизни не нуждались в кислороде и не вырабатывали его. Около 3,5 млрд. лет назад появились первые цианобактерии, которые освоили процесс фотосинтеза. Газообразный кислород, который выделялся при этом, был побочным продуктом. Однако деятельность этих бактерий привела к глобальным и огромным изменениям. Миллиарды лет выделяемый бактериями кислород реагировал с веществами, растворёнными в океане, с газами в атмосфере и с горными породами. Но со временем все они окислились и кислород стал накапливаться в атмосфере. И только после этого вместо анаэробных форм жизни, живших в бескислородной среде, во множестве появились аэробные формы, которые, наоборот, стали использовать кислород для дыхания.
Кстати, микроскопические цианобактерии, возникшие миллиарды лет назад, до сих пор являются главным поставщиком кислорода в атмосферу Земли. Вклад больших зелёных растений заметно меньше. Все бактерии и растения вырабатывают примерно 200 млрд тонн в год, а общие запасы кислорода в атмосфере и океане составляют примерно 1200000 миллиардов тонн. Кажется, что это много, тем не менее, если на нашей планете вдруг прекратится фотосинтез, этого накопленного кислорода хватит всего на 6000 лет.
Чистый газ
Чистый кислород без примесей не имеет ни цвета, ни вкуса, ни запаха. Однако чистый кислород редко существует в природе без примесей.
3) В чистом кислороде сгорает почти всё
Привычный нам процесс горения — это соединение различных веществ с кислородом, содержащимся в атмосфере. Кислород — второй по активности неметалл после фтора, поэтому он очень активно вступает в химические реакции. И если многие вещества легко загораются даже в обычном воздухе, в котором всего 20% кислорода, то что будет, если взять чистый, концентрированный кислород?
В чистом кислороде прекрасно сгорают такие вещества, которые обычно не горят или горят плохо, например, железо:
Ещё быстрее всё сгорит, если использовать жидкий кислород:
Если же пропитать жидким кислородом пористое или порошкообразное горючее вещество (опилки, торф, мох и т. п.), то получается мощная взрывчатка — оксиликвит.
Твердая и жидкая форма

В твердой и жидкой форме кислород отличается голубоватым цветом. Под влиянием пониженных температур и повышенного давления голубые кристаллы кислорода меняют цвет на оранжевый, красный, черный и серый.
Рыбам не требуется большого количества кислорода
Но мало кто знает, что и среди них есть привереды, например, карп. Ему нужна кислородная концентрация минимум 4 мг/л. Карась же, наоборот, считается наименее придирчивым, поэтому он хорошо приживается даже в заросших и заиленных водоемах.
Проводимость

Кислород — неметаллический элемент. У него низкая термальная и электрическая проводимость, однако высокая ионизация. Этот газ в чистом виде плохо проводит электричество, однако очень быстро формирует химические связи с другими элементами.
7) Мало кислорода — вредно, много — тоже
Организм человека приспособлен к концентрации кислорода 21% (при атмосферном давлении). Но если эта концентрация снизится всего на несколько процентов, человек будет ощущать себя уже очень плохо. При падении содержания кислорода до 17% возникнет быстрая утомляемость, головокружение, головные боли, при 13% человек потеряет сознание, а при 7% умрёт.
А что будет, если дышать воздухом с повышенной концентрацией кислорода или вообще чистым кислородом? В определённых случаях это полезно. Например, в медицине применяют кислородотерапию — дыхание кислородом при лечении некоторых заболеваний (таких, как астма) и при отравлении ядовитыми газами. Тем не менее долго дышать чистым кислородом вредно, а при слишком больших концентрациях кислорода (если ещё и повысить давление) наступает кислородное отравление. Впервые столкнулись с этой проблемой водолазы, которые дышали кислородом из баллонов при повышенном давлении. При этом у них возникало онемение конечностей, тошнота и судороги. Пришлось снижать концентрацию кислорода в дыхательных аппаратах.
Валентность

В природе этот газ чаще всего встречается в двухвалентной молекуле O2 и трехвалентной молекуле O3 (озон). Синглетный кислород встречается в верхних слоях атмосферы, однако его атомы быстро формируют химические связи с другими элементами.
Горение

Процесс возгорания и горения невозможен без кислорода, однако этот газ не горит сам по себе.
Тело человека

Практически две трети массы человека составляет кислород. Это делает его самым изобильным элементом в организме. Большая часть кислорода в нашем организме является частью молекулы воды. Несмотря на то что молекул водорода в нашем теле почти в два раза больше, они значительно легче. Однако по массе во Вселенной водород значительно превышает кислород.
Кислород получил признание в медицине и косметологии
С ним оказывают помощь больным сердечно-сосудистыми заболеваниями, гипоксией различного происхождения, бронхиальной астмой, при шоке и удушье. Также для укрепления иммунной системы и профилактики многих недугов могут применяться кислородные коктейли.
Косметическая направленность этого вещества заключается в омолаживающем эффекте, улучшении состояния кожи, повышении ее эластичности и тонуса. Достигается результат разными способами, к примеру, с использованием кремов, масок, обогащенных кислородом, мезотерапией на основе того же элемента.
Другие интересные факты о кислороде можно найти на просторах сети Интернет.
Вы можете сохранить статью или поделиться ею, нажав на одну из кнопочек ниже
Молекулярная масса

До 1961 года масса атома кислорода являлась стандартом для атомной массы других элементов. После того как наука расширила свое понимание изотопов, в качестве стандарта атомной массы на место кислорода встал углерод.
Кол-во блоков: 26 | Общее кол-во символов: 18728
Количество использованных доноров: 5
Информация по каждому донору:
Кислород есть в воздухе, воде, этот газ нужен для поддержания жизни на Земле. Впервые этот элемент был открыт в 1773 году Карлом Вильгельмом Шеле. Этот исследователь на протяжении длительного времени не публиковал свои работы, поэтому иногда как первооткрывателя указывают Джозефа Пристли. Представляем интересные факты о кислороде.

Физика и химия
В газообразном виде кислород не имеет цвета и запаха. В жидком состоянии имеет голубой цвет. Кристаллы (они образовываются при низкой температуре и высоком давлении) имеют оранжевый, красный, черный и серый цвет.
Газ не горит, но способствует горению. В чистом кислороде горит все, например железо.
Кислород является часть молекулы воды. Атомов водорода в молекуле воды в два раза больше, чем атомов кислорода, однако атом кислорода в два раза тяжелее, чем атом водорода. Поэтому человеческий организм, который в основном состоит из воды, на 60 процентов состоит из кислорода.
Если древесные опилки пропитать жидким кислородом, получится взрывчатка – оксиликвит.
В земной коре кислород занимает около 50 процентов от массы.
Жидкий кислород притягивается к магниту.

Природа
За один год одно дерево вырабатывает до 125 килограмм кислорода. Этого достаточно, чтобы обеспечить воздухом два человека. За один год растения на Земле выделяют 3 триллиона тонн кислорода.
Рыбам не нужно много кислорода. Самое большое количество кислорода нужно карпу, карась наименее требователен к концентрации этого газа в воде, поэтому может обитать в заиленных водоемах.
Некоторые бактерии и вирусы могут жить без кислорода. Эти существа называются анаэробными, они получают энергию вследствие биохимических реакций, которые осуществляются не с помощью кислорода, а с помощью других веществ (например, нитратов).
Здоровье
Концентрация кислорода в воздухе – 21 процент. В больших городах с загрязненным воздухом концентрация этого газа может быть ниже, около 18 процентов. Если кислорода в воздухе менее 17 процентов, человек начнет чувствовать сильную усталость, при концентрации кислорода менее 13 процентов человек может потерять сознание. При концентрации кислорода менее 8 процентов, человек может умереть.
Человеческий мозг использует в 10 раз больше кислорода, чем остальной организм.
На вершине Эвереста (8848 метра) кислорода 21 процент (такая же концентрация, что и над уровнем моря). Но на самой высокой вершине нашей планеты воздух разрежен в три раза, значит человек при каждом вдохе получает в три раза меньше кислорода. Человек на такой высоте может получить отек мозга, при разгерметизации кабина самолета на высоте свыше 8 километров пилот теряет сознание через две минуты. Поэтому альпинисты при восхождении на высокие вершины используют кислородные баллоны. В 1978 году на вершину Эвереста без использования кислородных баллонов поднялись итальянец Райнхольд Месснер и австрийский альпинист Петер Хабелер.
Во все органы организма кислород попадает через кровеносные сосуды, только роговица глаза берет кислород из воздуха.
Если у человека есть проблемы с дыханием, ему в больнице могут дать кислородную маску.
В 70-х годах ХХ века в Токио воздух был очень загрязнен, на улицах стояли аппараты, с помощью которых за небольшую плату можно было подышать кислородом. Регулировщики на улицах работали в противогазах. В 80-х годах ХХ века экологическая обстановка улучшилась и кислородные аппараты исчезли с улиц японской столицы.
Читайте также:

