Ингибитор это в химии кратко
Обновлено: 02.07.2024
Ингибитор— вещество, замедляющее или предотвращающее течение какой-либо химической реакции: коррозии металла, старения полимеров, окисления топлива и смазочных масел, пищевых жиров и др.
Действие ингибиторов характерно для каталитических и цепных реакций, протекающих с участием активных центров или частиц. Торможение или предотвращение реакции обусловлено тем, что ингибитор блокирует активные центры катализатора или реагирует с активными частицами с образованием малоактивных радикалов. Ингибитор вводится в систему в намного меньшей концентрации, чем концентрация реагентов.
Особое практическое значение имеют ингибиторы коррозии металла. По современным представлениям, механизм действия ингибиторов коррозии имеет электрохимическую природу. Применительно к коррозии металла ингибитором называют вещество, которое, адсорбируясь на поверхности металла, делает её потенциал положительнее, тем самым замедляя процесс коррозии.
К ингибиторам также часто причисляют вещества, снижающие активность коррозионной среды или создающие на поверхности металла защитные пленки, являющиеся продуктом взаимодействия ингибитора с раствором, металлом или продуктом его коррозии (кроющие ингибиторы).
Ингибиторы горения являются отрицательными катализаторами, тормозящими реакцию при неизменной температуре горения, благодаря чисто химическому на него воздействию. Механизм их воздействия на процесс горения заключается в обрыве реакционных цепей при окислении горючего. Ингибитор легко реагирует с активными центрами реакции, превращая их в устойчивые продукты. В качестве ингибиторов горения применяют главным образом различные галогенопроизводные, причем ингибирующая активность бромпроизводных значительно выше, чем хлорпроизводных.
Ингибиторы горения применяют главным образом для пожаротушения и активного подавления взрыва. Для использования в технологических процессах применяют иногда флегматизаторы с высокой теплоемкостью, сочетающие в себе ингибирующую активность и тепловое воздействие.
Ингибитор легко реагирует с активными центрами реакции, превращая их в устойчивые продукты. В качестве ингибиторов применяют главным образом различные галогенопроизводные, причем ингибирующая активность бромпроизводных значительно выше, чем хлорпроизводных. Ведутся поиски других различных, в то же время эффективных ингибиторов горения. В нефтеперерабатывающей промышленности ингибиторы горения применяют для тушения пожаров различного типа горения: как связанных с природой.
Кроме вышеназванных ингибиторов горения в эпоксидных композициях применяют специфически действующие соли, оксиды и комплексные соединения некоторых металлов. Предполагают, что снижение горючести при этом может быть обусловлено как теплоизолирующим действием кокса, так и уменьшением количества газообразных горючих продуктов пиролиза полиэпоксидов.
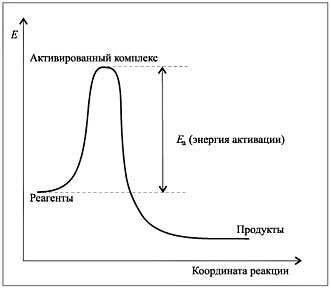
рис 1.Зависимость Энергии активации Е от координаты реакции.
Очевидно, что применение соединений, катализирующих пиролитические процессы, которые вызывают повышенное коксообразование в процессе горения, более целесообразно по сравнению с использованием традиционных замедлителей горения.
Является ингибитором горения и применяется для объемного тушения и флегматизации.
Обладает свойствами ингибитора различного типа горения так и самого горения.
Тормозящее действие ингибиторов горения связано с гибелью той части активных центров, которая соответствует сверхравновесному ( термодинамически) их содержанию. При снижении концентрации активных центров до равновесной гибель их в реакции с ингибитором становится затруднительной, поскольку убыль активных центров компенсируется поступлением новых в результате термической диссоциации. Поэтому окончательное прекращение горения, как правило, достигается при одновременном торможении реакции и охлаждении (например, при разбавлении зоны реакции избытком летучего ингибитора) реагирующей горючей смеси.
В качестве ингибиторов горения применяют галоген-углеводороды ( бромистый метилен, бромистый этил, трифторбромметан, тетрафтордибромэтан и др.) - О в 10 раз эффективнее диоксида углерода и в 20 раз эффективнее водяного пара. Однако их применение ограничено тем, что при термическом распаде таких веществ выделяется токсичный продукт.
Обладает свойствами ингибитора горения.
Более предпочтительными обычно являются ингибиторы горения второго типа, так как при химическом взаимодействии с полимером образуются более стабильные и однородные композиции. Однако в тех случаях, когда применение ингибиторов горения этого типа экономически невыгодно или практически трудно осуществимо, приходится использовать инертные добавки.
Следует также отметить, что ингибиторы горения даже в том случае, когда они введены сверх 100 % и ухудшают кислородный баланс системы, не оказывают заметного отрицательного влияния на скорость детонации.

Большая эффективность аммонийных солей как ингибиторов горения гексамона-1 обусловлена, по-видимому, тем, что разложение основного компонента смеси - селитры - является при горении ведущим. Так, уретан, например, замедлял горение гексогена при 100 ат в 2 4 раза, а горение гексамона-1 при этом же давлении - лишь в 1 5 раза. Следует также отметить, что с ростом давления ингибирующее действие добавок изменяется, и они могут поменяться местами по своей эффективности.
Влияние различных солей аммония на зависимость скорости горения перхлората аммония от давления. Зависимость эффективности ингибирующего действия солей аммония при горении перхлората аммония от давления. Фторид лития нашел применение в качестве ингибитора горения смесевых твердых топлив, что было установлено эмпирически, и механизм его действия оставался неизвестным.
Химически активные пламеные соединения, называемые ингибиторами горения, оказывают более значительное влияние на процессы горения, чем инертные флегматизаторы.
Ингибиторы более активно взаимодействуют с активными центрами цепной реакции, чем горючие компоненты смеси, переводя их в устойчивые соединения и прекращая таким образом развитие реакционных цепей. Незначительные количества ингибиторов существенно понижают концентрацию активных центров в зоне горения.
Из изложенного также следует, что тормозящее действие ингибиторов горения связано с гибелью той части активных центров, которая соответствует сверхравновесному. При снижении концентрации активных центров до равновесной гибель их в реакции с ингибитором становится затруднительной, поскольку убыль активных центров компенсируется поступлением новых в результате термической диссоциации. Поэтому окончательное прекращение горения, как правило, достигается при одновременном торможении реакции и охлаждении ( например, при разбавлении зоны реакции избытком летучего ингибитора) реагирующей горючей смеси.
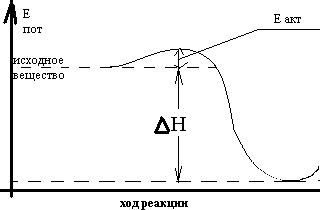
рис 2. для определения исходного вещества от ∆Н
При составлении композиций выбирают вещества с высоким содержанием ингибитора горения, а также вводят различные активаторы антипиренов. Например, для достижения одного и того же уровня горючести полистирола достаточно ввести 4 % тетрабромэтана с содержанием брома 92 % или смесь, состоящую из 0 5 % тетрабромэтана и 0 5 % перекиси дикумила. Уменьшения содержания окиси сурьмы в композициях достигают, применяя бораты цинка и бария. Кроме того, трехокись сурьмы иногда заменяют другими ее соединениями типа трифенилсурьмы, которые не снижают прозрачности пластиков и в меньшей степени сказываются на прочности и других характеристиках материалов.
Классификация легковоспламеняющихся жидкостей. Потенциал горючести газообразных смесей веществ, не являющихся катализаторами или ингибиторами горения, равен сумме произведений потенциалов горючести каждого вещества, входящего в смесь, на их мольную долю в смеси.
Эффективность ингибирования характеризуется величиной отношения fkt/kp. Для ингибирования цепных разветвленных реакций характерны критические явления, сущность которых состоит в резком снижении скорости реакции при очень незначительном увеличении концентрации ингибиторы Примером может служить ингибированное автоокисление углеводородов RH, в котором основным источником радикалов является продукт окисления ROOH. При достаточно высокой температуре или в присутствии катализатора, интенсивно превращающего ROOH в радикалы, окисление RH может протекать в квазистационарном режиме, когда скорость образования ROOH практически равна скорости его расходования. Т.к. скорость образования ROOH зависит и от концентрации ингибиторы, и от концентрации ROOH, существует некоторая критическая концентрация ингибитора, при которой система переходит от нестационарного к квазистационарному режиму при очень незначительном (на 0,1-1%) изменении концентрации ингибиторы Это выражается в резком изменении скорости реакции или периода индукции ингибитора.
Два ингибитора, введенных в реагирующую систему, могут взаимно усилить ингибирующее действие друг друга (т. наз. синергизм ингибиторов) или ослабить его (антагонизм ингибиторов); нередко наблюдается и аддитивное действие двух ингибиторов. Если t1и t2 - длительности тормозящего действия первого и второго ингибиторов, введенных порознь, а t12- длительность их совместного действия, то в случае синергизма t12 > (t1 + t2), в случае антагонизма t12
Действие ингибиторов характерно для каталитических и цепных реакций, протекающих с участием активных центров или частиц. Торможение или предотвращение реакции обусловлено тем, что ингибитор блокирует активные центры катализатора или реагирует с активными частицами с образованием малоактивных радикалов. Ингибитор вводится в систему в намного меньшей концентрации, чем концентрация реагентов.
Особое практическое значение имеют ингибиторы коррозии металла. По современным представлениям, механизм действия ингибиторов коррозии имеет электрохимическую природу. Применительно к коррозии металла ингибитором называют вещество, которое, адсорбируясь на поверхности металла, делает её потенциал положительнее, тем самым замедляя процесс коррозии.
К ингибиторам также часто причисляют вещества, снижающие активность коррозионной среды или создающие на поверхности металла защитные пленки, являющиеся продуктом взаимодействия ингибитора с раствором, металлом или продуктом его коррозии (кроющие ингибиторы).
Ингибиторы горения являются отрицательными катализаторами, тормозящими реакцию при неизменной температуре горения, благодаря чисто химическому на него воздействию. Механизм их воздействия на процесс горения заключается в обрыве реакционных цепей при окислении горючего. Ингибитор легко реагирует с активными центрами реакции, превращая их в устойчивые продукты. В качестве ингибиторов горения применяют главным образом различные галогенопроизводные, причем ингибирующая активность бромпроизводных значительно выше, чем хлорпроизводных.
Ингибиторы горения применяют главным образом для пожаротушения и активного подавления взрыва. Для использования в технологических процессах применяют иногда флегматизаторы с высокой теплоемкостью, сочетающие в себе ингибирующую активность и тепловое воздействие.
Ингибитор легко реагирует с активными центрами реакции, превращая их в устойчивые продукты. В качестве ингибиторов применяют главным образом различные галогенопроизводные, причем ингибирующая активность бромпроизводных значительно выше, чем хлорпроизводных. Ведутся поиски других различных, в то же время эффективных ингибиторов горения. В нефтеперерабатывающей промышленности ингибиторы горения применяют для тушения пожаров различного типа горения: как связанных с природой.
Кроме вышеназванных ингибиторов горения в эпоксидных композициях применяют специфически действующие соли, оксиды и комплексные соединения некоторых металлов. Предполагают, что снижение горючести при этом может быть обусловлено как теплоизолирующим действием кокса, так и уменьшением количества газообразных горючих продуктов пиролиза полиэпоксидов.

рис 1.Зависимость Энергии активации Е от координаты реакции.
Очевидно, что применение соединений, катализирующих пиролитические процессы, которые вызывают повышенное коксообразование в процессе горения, более целесообразно по сравнению с использованием традиционных замедлителей горения.
Является ингибитором горения и применяется для объемного тушения и флегматизации.
Обладает свойствами ингибитора различного типа горения так и самого горения.
Тормозящее действие ингибиторов горения связано с гибелью той части активных центров, которая соответствует сверхравновесному ( термодинамически) их содержанию. При снижении концентрации активных центров до равновесной гибель их в реакции с ингибитором становится затруднительной, поскольку убыль активных центров компенсируется поступлением новых в результате термической диссоциации. Поэтому окончательное прекращение горения, как правило, достигается при одновременном торможении реакции и охлаждении (например, при разбавлении зоны реакции избытком летучего ингибитора) реагирующей горючей смеси.
В качестве ингибиторов горения применяют галоген-углеводороды ( бромистый метилен, бромистый этил, трифторбромметан, тетрафтордибромэтан и др.) - О в 10 раз эффективнее диоксида углерода и в 20 раз эффективнее водяного пара. Однако их применение ограничено тем, что при термическом распаде таких веществ выделяется токсичный продукт.
Обладает свойствами ингибитора горения.
Более предпочтительными обычно являются ингибиторы горения второго типа, так как при химическом взаимодействии с полимером образуются более стабильные и однородные композиции. Однако в тех случаях, когда применение ингибиторов горения этого типа экономически невыгодно или практически трудно осуществимо, приходится использовать инертные добавки.
Следует также отметить, что ингибиторы горения даже в том случае, когда они введены сверх 100 % и ухудшают кислородный баланс системы, не оказывают заметного отрицательного влияния на скорость детонации.
Большая эффективность аммонийных солей как ингибиторов горения гексамона-1 обусловлена, по-видимому, тем, что разложение основного компонента смеси - селитры - является при горении ведущим. Так, уретан, например, замедлял горение гексогена при 100 ат в 2 4 раза, а горение гексамона-1 при этом же давлении - лишь в 1 5 раза. Следует также отметить, что с ростом давления ингибирующее действие добавок изменяется, и они могут поменяться местами по своей эффективности.
Влияние различных солей аммония на зависимость скорости горения перхлората аммония от давления. Зависимость эффективности ингибирующего действия солей аммония при горении перхлората аммония от давления. Фторид лития нашел применение в качестве ингибитора горения смесевых твердых топлив, что было установлено эмпирически, и механизм его действия оставался неизвестным.
Химически активные пламеные соединения, называемые ингибиторами горения, оказывают более значительное влияние на процессы горения, чем инертные флегматизаторы.

Ингибиторы более активно взаимодействуют с активными центрами цепной реакции, чем горючие компоненты смеси, переводя их в устойчивые соединения и прекращая таким образом развитие реакционных цепей. Незначительные количества ингибиторов существенно понижают концентрацию активных центров в зоне горения.
Из изложенного также следует, что тормозящее действие ингибиторов горения связано с гибелью той части активных центров, которая соответствует сверхравновесному. При снижении концентрации активных центров до равновесной гибель их в реакции с ингибитором становится затруднительной, поскольку убыль активных центров компенсируется поступлением новых в результате термической диссоциации. Поэтому окончательное прекращение горения, как правило, достигается при одновременном торможении реакции и охлаждении ( например, при разбавлении зоны реакции избытком летучего ингибитора) реагирующей горючей смеси.
рис 2. для определения исходного вещества от ∆Н
При составлении композиций выбирают вещества с высоким содержанием ингибитора горения, а также вводят различные активаторы антипиренов. Например, для достижения одного и того же уровня горючести полистирола достаточно ввести 4 % тетрабромэтана с содержанием брома 92 % или смесь, состоящую из 0 5 % тетрабромэтана и 0 5 % перекиси дикумила. Уменьшения содержания окиси сурьмы в композициях достигают, применяя бораты цинка и бария. Кроме того, трехокись сурьмы иногда заменяют другими ее соединениями типа трифенилсурьмы, которые не снижают прозрачности пластиков и в меньшей степени сказываются на прочности и других характеристиках материалов.
Классификация легковоспламеняющихся жидкостей. Потенциал горючести газообразных смесей веществ, не являющихся катализаторами или ингибиторами горения, равен сумме произведений потенциалов горючести каждого вещества, входящего в смесь, на их мольную долю в смеси.
Эффективность ингибирования характеризуется величиной отношения fkt/kp. Для ингибирования цепных разветвленных реакций характерны критические явления, сущность которых состоит в резком снижении скорости реакции при очень незначительном увеличении концентрации ингибиторы Примером может служить ингибированное автоокисление углеводородов RH, в котором основным источником радикалов является продукт окисления ROOH. При достаточно высокой температуре или в присутствии катализатора, интенсивно превращающего ROOH в радикалы, окисление RH может протекать в квазистационарном режиме, когда скорость образования ROOH практически равна скорости его расходования. Т.к. скорость образования ROOH зависит и от концентрации ингибиторы, и от концентрации ROOH, существует некоторая критическая концентрация ингибитора, при которой система переходит от нестационарного к квазистационарному режиму при очень незначительном (на 0,1-1%) изменении концентрации ингибиторы Это выражается в резком изменении скорости реакции или периода индукции ингибитора.
Два ингибитора, введенных в реагирующую систему, могут взаимно усилить ингибирующее действие друг друга (т. наз. синергизм ингибиторов) или ослабить его (антагонизм ингибиторов); нередко наблюдается и аддитивное действие двух ингибиторов. Если t1и t2 - длительности тормозящего действия первого и второго ингибиторов, введенных порознь, а t12- длительность их совместного действия, то в случае синергизма t12 > (t1 + t2), в случае антагонизма t12
Данные понятия можно назвать антонимами,поскольку они по-разному действуют на протекание реакции.Стоит отметить,что катализатор и ингибитор не входят в состав реагентов и продуктов (в идеале😱),то есть сколько было их в начале реакции,столько и останется в конце👩🏻🔬
Рассмотрим несколько примеров:
⭕Катализатор
☃2KClO3=2KCl+3O2 (в присутствии катализатора MnO2,t)
☃4KClO3 = 3KClO4 +KCl (только t) Далее нужно нагреть KClO4,чтобы получить O2 .Для получения кислорода из KClO3 нужно провести целых две реакции!
Поэтому можно сделать вывод о
том,что катализатор ускоряет химическую реакцию 💥
⭕Ингибитор
Чаще всего они применяются для защиты металлов от коррозии
Коррозия цинка в воде:
Zn+2H2O=Zn(OH)2+H2
Добавляем ингибитор Na2B4O7·10Н2О и вуаля,выделение водорода уменьшается,а значит и реакция замедляется
ИНГИБИТОРЫ
ИНГИБИТОРЫ (от лат mhibeo - останавливаю, сдерживаю), в-ва, тормозящие хим. р-ции. Ингибирование характерно для каталитич и цепных р-ций, к-рые протекают с участием активных центров или активных частиц. Тормозящее действие обусловлено тем, что ингибитор блокирует активные центры катализатора или реагирует с активными частицами с образованием малоактивных радикалов, не способных продолжать цепь. Ингибитор вводится в систему в концентрации много меньшей, чем концентрации реагирующих в-в (10 - 2 -10 - 5 моль%). Кинетика р-ций с участием ингибиторов принципиально различна для каталитических и цепных р-ций. В каталитич. р-ции число активных центров фиксировано и ингибитор, блокируя часть из них, не расходуется в ходе процесса. Поэтому при введении ингибитора скорость р-ции снижается, а затем процесс протекает длит. время с постоянной скоростью. В нек-рых случаях эта скорость может медленно возрастать из-за расходования ингибитора по к.-л. побочной р-ции. В цепной р-ции активные частицы непрерывно генерируются, что приводит к расходованию ингибитора и постепенному самоускорению р-ции (в случае цепной неразветвленной р-ции обычно восстанавливается исходная скорость).
Ингибирование цепных реакций. Длительность t тормозящего действия ингибитора наз. периодом индукции; число цепей f, к-рые обрывает одна молекула ингибитора, последовательно вступая в р-ции обрыва, наз. стехиометрич. коэф. ингибирования. При исходной концентрации ингибитора [И] 0 и скорости инициирования цепей v i период индукции равен: t = f [И] 0 /v i . Напр., хинон тормозит полимеризацию виниловых мономеров, вступая в след. р-ции:
В этом случае f= 2 и t = 2[И] 0 /v i . В нек-рых системах происходит регенерация ингибитора в р-циях обрыва цепи, в результате чего одна молекула ингибитора и образующийся из нее радикал многократно участвуют в р-циях обрыва. Напр., при введении ионов меди в окисляющийся изопропиловый спирт цепи обрываются в результате протекания след. чередующихся р-ций:
(от лат mhibeo - останавливаю, сдерживаю), в-ва, тормозящие хим. р-ции. Ингибирование характерно для каталитич и цепных р-ций, к-рые протекают с участием активных центров или активных частиц. Тормозящее действие обусловлено тем, что И. блокирует активные центры катализатора или реагирует с активными частицами с образованием малоактивных радикалов, не способных продолжать цепь. И. вводится в систему в концентрации много меньшей, чем концентрации реагирующих в-в (10 - 2 -10 - 5 моль%). Кинетика р-ций с участием И. принципиально различна для каталитических и цепных р-ций. В каталитич. р-ции число активных центров фиксировано и И., блокируя часть из них, не расходуется в ходе процесса. Поэтому при введении И. скорость р-ции снижается, а затем процесс протекает длит. время с постоянной скоростью. В нек-рых случаях эта скорость может медленно возрастать из-за расходования И. по к.-л. побочной р-ции. В цепной р-ции активные частицы непрерывно генерируются, что приводит к расходованию И. и постепенному самоускорению р-ции (в случае цепной неразветвленной р-ции обычно восстанавливается исходная скорость).
Ингибирование цепных реакций. Длительность t тормозящего действия И. наз. периодом индукции; число цепей f, к-рые обрывает одна молекула И., последовательно вступая в р-ции обрыва, наз. стехиометрич. коэф. ингибирования. При исходной концентрации И. [И]0 и скорости инициирования цепей i период индукции равен: t = f[И]0/ i . Напр., хинон тормозит полимеризацию виниловых мономеров, вступая в след. р-ции:
В этом случае f= 2 и t = 2[И]0/ i . В нек-рых системах происходит регенерация И. в р-циях обрыва цепи, в результате чего одна молекула И. и образующийся из нее радикал многократно участвуют в р-циях обрыва. Напр., при введении ионов меди в окисляющийся изопропиловый спирт цепи обрываются в результате протекания след.чередующихся р-ций:
В таких системах наблюдаются периоды индукции, намного превышающие 2[И]0/ i . Для каждой р-ции существует специфич. набор И.: р-цию водорода с хлором тормозят NCl3 и О 2, реагирующие с атомами хлора; полимеризацию виниловых мономеров -хиноны, нитросоединения, I2, стабильные радикалы (дифенилпикрилгидразил, нитроксильные радикалы), акцептирующие алкильные макрорадикалы; окисление орг соед. (углеводородов, каучуков и полиолефинов) фенолы, ароматич. амины, аминофенолы, реагирующие с пероксильными радикалами RO2; крекинг углеводородов олефины и оксиды азота, реагирующие с алкильными радикалами. Для тушения горения орг соед. используют галогенуглеводороды CF3Br, CF2ClBr, C2F4Br2. Их ингибирующее действие вызвано тем, что разветвляющими агентами при горении являются атомы Н, с к-рыми И. вступают в р-цию: RBr + Образующийся НВr вызывает дополнит. обрыв цепей по р-циям:
(М - любая третья частица). Для тушения горения применяют также огнегасящие порошки (напр.. NaHCO3, фосфорно-аммониевые соли), к-рые обладают комбинир. действием: снижают концентрацию радикалов из-за интенсивного обрыва цепей на пов-сти и вызывают повыш. теплоотвод (см. Горение). Различают слабые и сильные И. данной р-ции. Сильным считается такой И., к-рый, если его ввести в достаточно большой концентрации, сокращает длину цепи до единицы или уменьшает скорость р-ции в v0/ i раз, где v0 - исходная скорость р-ции. Слабый И., даже введенный в сравнительно высокой концентрации, снижает скорость р-ции от i до нек-рого значения vi.> Вызвано это тем, что из молекул слабого И. образуются радикалы, способные продолжать цепь, в силу чего отношение v0/vуменьшается с увеличением [И]0, не достигнув значения v0/ i.> И., оказывающий сильное тормозящее действие в небольшой концентрации, наз. эффективным. Эффективность И. характеризуют значением производной Чdv/d[И].Напр., окисление углеводорода RH в присут. инициатора, создающего скорость инициирования i , определяется скоростью продолжения цепи с участием пероксильного радикала:
Читайте также:

