Инертные газы это в химии 8 класс кратко
Обновлено: 02.07.2024
Благородные газы ( инертные либо редкие газы ) — группа химических элементов с похожими свойствами: при нормальных условиях они являются одноатомными газами.
При обычных условиях - это газы без цвета, вкуса и запаха, плохо растворимые в воде, не возгораются при нормальных условиях, с очень низкой химической реактивностью. Их температуры плавления и кипения закономерно увеличиваются с увеличением атомного номера.
Среди всех благородных газов лишь у Rn нет стабильных изотопов и только он является радиоактивным химическим элементом.
Редкими (инертными) газами являются:
- гелий (He) (атомный номер 2),
- неон (Ne) (10),
- аргон (Ar) (18),
- криптон (Kr) (36),
- ксенон (Xe) (54)
- радиоактивный радон (Rn) (86).
В последнее время к этой группе также причисляют унуноктий (Uuo) (118).
Все инертные газы собой завершают соответствующий период в Периодической системе и имеют полностью завершенный, устойчивый внешний электронный уровень.
У инертных газов электронная конфигурация ns 2 np 6 (у гелия 1s 2 ) и они образуют VIIIА группу. С возрастанием порядкового номера увеличиваются радиусы атомов и их способность к поляризуемости, что приводит к увеличению межмолекулярных взаимодействий, к увеличению Тпл и Ткип, к улучшению растворимости газов в воде и других растворителях. Для инертных газов существуют такие известные группы соединений: молекулярные ионы, соединения включения, валентные соединения.
Цвета и спектры инертных газов.
Цвета и спектры благородных газов. В первой строке таблицы изображены благородные газы в колбах, через которые пропущен ток, во второй — сам газ в трубке, в третьей — в трубках, которые изображают обозначение элемента в периодической таблице Менделеева.
Гелий
Неон
Аргон
Криптон
Ксенон


















Распространенность инертных (редких) газов в природе.
Из-за того, что инертные газы обладают химической инертностью, их довольно долго не получалось обнаружить, и их открытие состоялось лишь во 2-й половине XIX века.
Гелий – является вторым (после водорода) по распространенности элементом во Вселенной, в земной коре содержание гелия составляет лишь 1 · 10-6 масс. %. Гелий является продуктом радиоактивного распада и содержится в пустотах горных пород и в природном газе.
Все благородные газы являются составляющими воздуха. В 1 м 3 воздуха находится 9,3 л аргона, 18 мл неона, 5 мл гелия, 1 мл криптона и 0,09 мл ксенона. Солнце приблизительно на 10% состоит из гелия, образующийся из водорода по реакции ядерного синтеза:
(β + - позитрон, - антинейтрино). В спектре излучения Солнца довольно интенсивно проявляются линии гелия, которые были впервые обнаружены в 1868 г. На Земле гелий был найден только в 1895 г. при спектральном анализе газов, выделяющихся при растворении в кислотах минерала клевеита U2О3. Уран, входящий в состав минерала, самопроизвольно распадается по уравнению:
В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов.
Промышленное использование инертных газов основано на их низкой химической активности или специфических физические свойствах.
Некоторые характеристики элементов VIIIА подгруппы (инертных газов).
Элемент
Радиус атома, нм
Первый потенциал ионизации, эВ
Tпл., K
Tкип., K
Содержание
Химические свойства
Физические свойства

Инертные газы бесцветны и не имеют запаха. В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов.
Биологическое действие
Инертные газы не ядовиты. Однако атмосфера с увеличенной концентрацией инертных газов и соответствующим снижением концентрации кислорода может оказывать удушающее действие на человека, вплоть до потери сознания и смерти [3] [4] . Известны случаи гибели людей при утечках аргона.
Вдыхание радиоактивного радона может вызвать рак.
Применение
Инертные газы имеют очень низкие точки кипения и плавления, что позволяет их использовать в качестве холодильного агента в криогенной технике. В частности, жидкий гелий, который кипит при 4,2 К (−268,95 °C; −452,11 °F), используется для магнитной сверхпроводимости, которая используется для магнитно-резонансной томографии и ядерного магнитного резонанса. Жидкий неон хотя и не достигает таких низких температур как жидкий гелий, также находит применение в криогенике, потому что у него охлаждающие свойства более чем в 40 раз выше, чем у жидкого гелия и более чем в три раза выше, чем у жидкого водорода.
Гелий используется как компонент дыхательного газа (дыхательной смеси) вместо азота, благодаря пониженной растворимости в жидкостях, особенно в липидах. Газы поглощаются кровью и биологическими тканями, когда они находятся под давлением, как например в подводном плавании, что является причиной эффекта, известного как азотное отравление. Благодаря меньшей растворимости, маленький гелий задерживается клеточной мембраной, и поэтому гелий используется в дыхательных смесях, таких как тримикс и гелиокс, уменьшая наркотический эффект газов, возникающий на глубине. Пониженная растворимость гелия даёт другие выгоды в условии, известном как декомпрессионная болезнь. Уменьшение остатка растворённого газа в теле означает, что меньшее количество газовых пузырьков образуется во время всплытия. Другой инертный газ, аргон, рассматривается как лучший выбор для использования в качестве прослойки к сухому костюму [6] для подводного плавания, а также в больших количествах используется для обработки жидкой стали.
После крушения дирижабля Гинденбург в 1937, гелий заменил водород в качестве поднимающего газа в дирижаблях и воздушных шарах благодаря лёгкости и невоспламеняемости, несмотря на 8,6 % уменьшение плавучести (buoyancy).
К благородным (инертным) газам относятся элементы VIIIa группы: гелий, неон, аргон, криптон, ксенон. На их внешнем энергетическом уровне содержится 8 электронов.
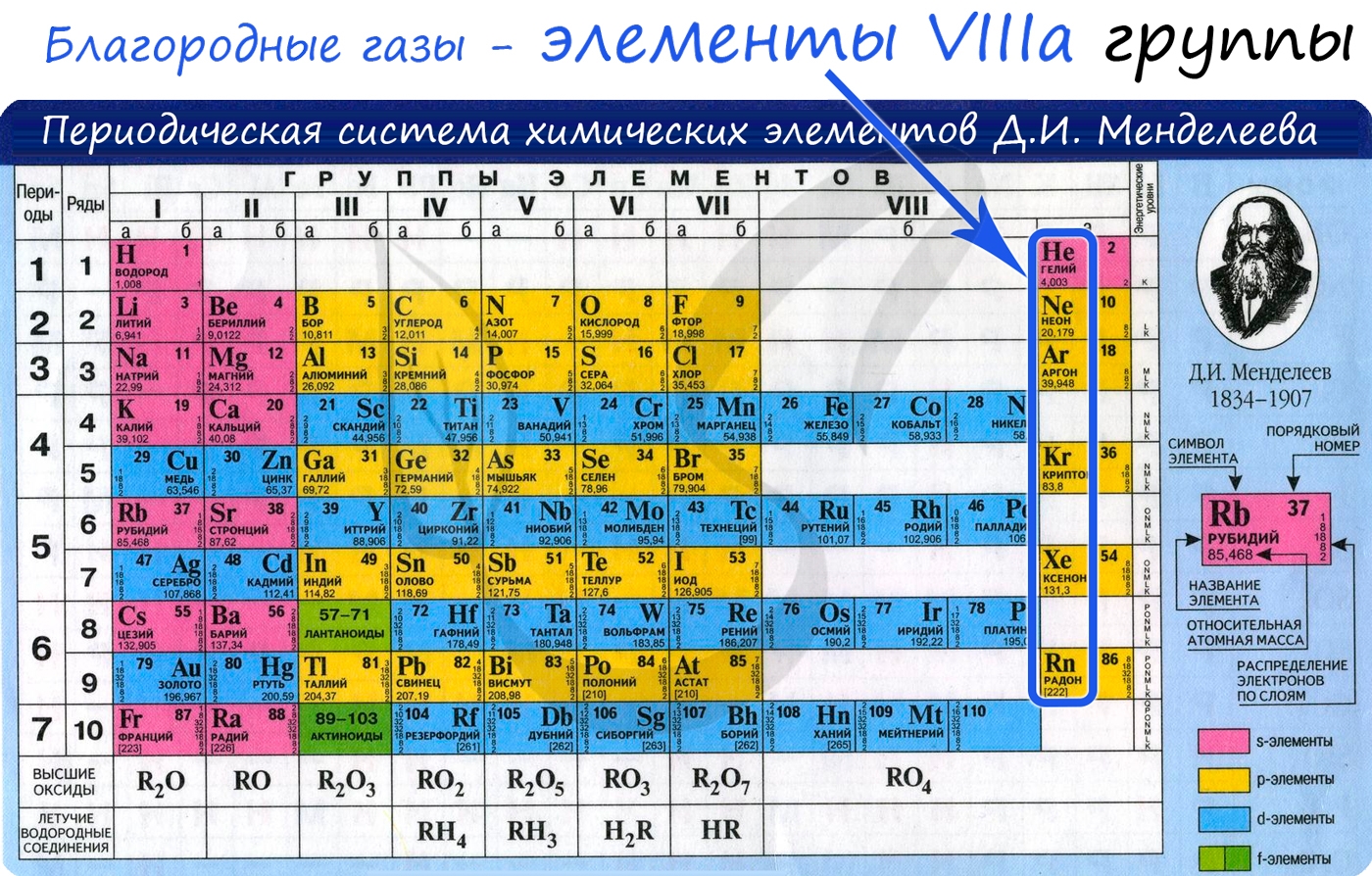
Они бесцветны, не имеют запаха, вкуса и обладают низкой химической активностью - инертны. Используются в лампочках для того, чтобы препятствовать окислению вольфрамовой нити.
При прохождении электрического тока гелий светится ярко-желтым, неон - огненно-красным, аргон - сине-голубым, криптон - синевато-белым, ксенон - белым цветом.
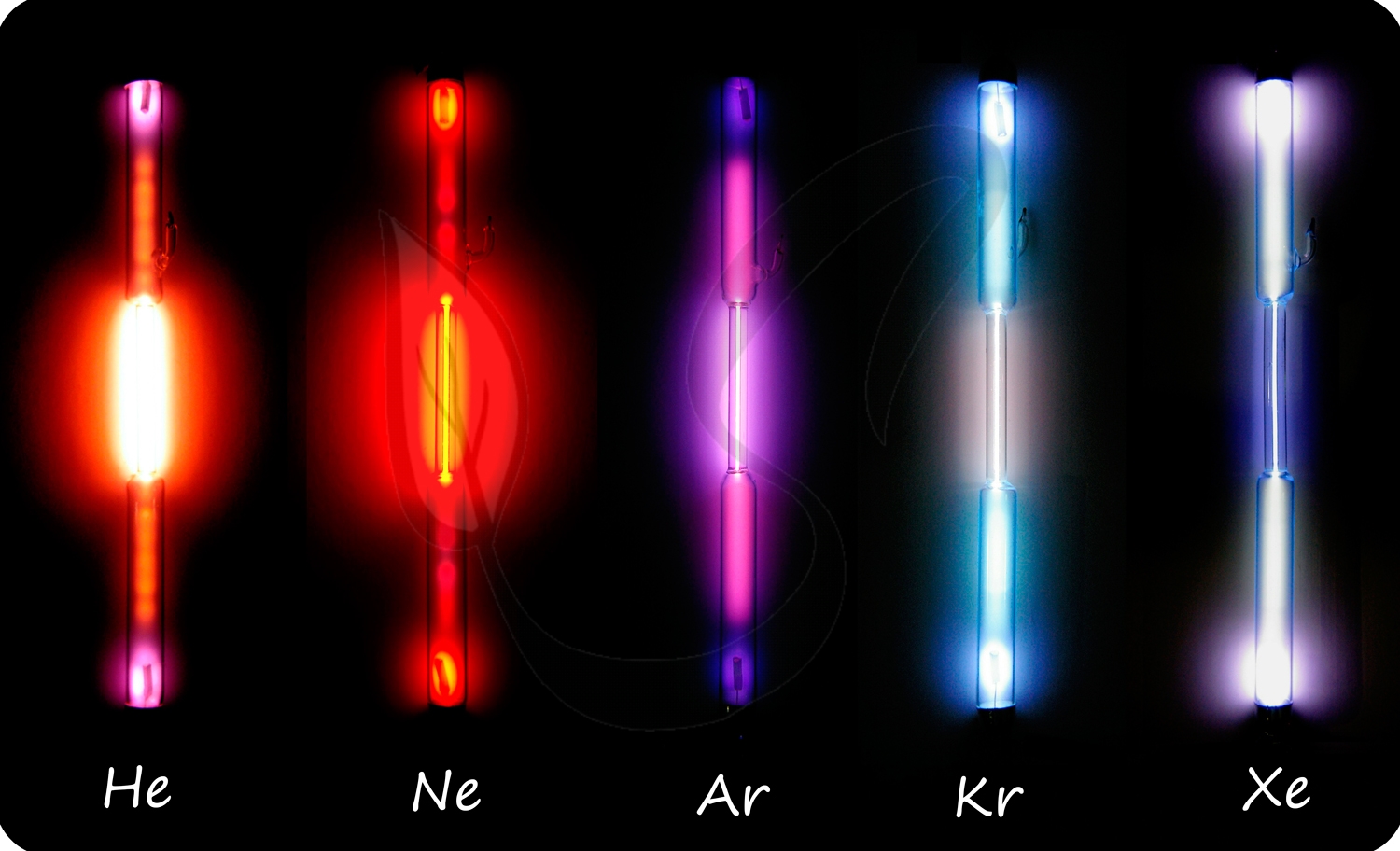
Аргон составляет 1% воздуха. Гелий является самым распространенным элементом в космосе после водорода.
В чистом виде инертные газы получают методом сжижения воздуха.
Сами по себе инертные газы не ядовиты, однако их утечка способна приводить к потере сознания.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.

Благородными газами называют элементы главной подгруппы VIII группы: гелий Не, неон Ne, аргон Ar, криптон Кr, ксенон Хе и радон Rn (радиоактивный элемент).
Каждый благородный газ завершает соответствующий период в периодической системе и имеет устойчивый, полностью завершенный внешний электронный уровень.
Все благородные газы входят в состав воздуха. В 1 м³ воздуха содержится 9,3 л аргона, 18 мл неона, 5 мл гелия, 1 мл криптона и 0,09 мл ксенона.
Гелий — второй по распространенности (после водорода) элемент во Вселенной. Из него примерно на 10% состоит Солнце (обнаружено в 1868 г). На земле гелий был найден в 1895 году в реакционных газах при растворении в кислотах минерала клевеита. Остальные благородные газы были выделены из воздуха.
Все благородные газы состоят из одноатомных молекул. При обычных условиях это газы без цвета и запаха, плохо растворимые в воде.
Уникальными физическими свойствами обладает гелий. Во-первых, он — единственный из веществ остается жидким при температурах вплоть до 0 К. Кристаллизуется только под давлением 25 атм. Во-вторых, гелий имеет самую низкую температуру кипения. И, наконец, при температурах ниже 2,2 К жидкий гелий существует в виде смеси двух жидкостей, одна из которых имеет аномальные свойства — в частности, сверхтекучесть (вязкость ниже в 10 млрд. раз, чем у воды).
Благородные газы чрезвычайно химически инертны. До 1962 г вообще считалось, что они не образуют химических соединений.
В 1962 г Бартлетт поместил в сосуд гексафторид платины, запустил туда отмеренное количества ксенона, и через несколько часов получил гексафторплатинат ксенона :
Xe + PtF6 = Xe[PtF6]
Вскоре Бартлетт осуществил и реакцию ксенона со фтором. Оказалось, что ксенон хорошо реагирует с фтором при нагревании в стеклянном сосуде, образуя смесь фторидов.
Фторид ксенона (II) XeF2 образуется под действием дневного света на смесь ксенона со фтором при обычной температуре:
или при взаимодействии ксенона и F2O2 при -120 °С:
Xe + F2O2 = XeF2 + O2
XeF2 + 4КОН = 2Xe + 4КF + O2 + 2H2O
Фторид ксенона (IV) XeF4 образуется при нагревании смеси ксенона с фтором до 400 ° С:
XeF4 + Pt = PtF4 + Xe
XeF4 + 2Hg = 2HgF2 + Xe
При взаимодействии с водой XeF4 диспропорционирует:
6XeF4 + 12H2O = 2XeО3 + 24НF + 4Xe + 3О2
Фторид ксенона (VI) XeF6 образуется при нагревании и повышенном давлении фтора:
XeF6 — бесцветные кристаллы. Молекула XeF6 представляет собой искаженный октаэдр с атомом ксенона в центре. Тоже очень сильный окислитель, может использоваться как фторирующий агент:
2XeF6 + SiO2 = SiF4 + 2XeOF4
Водой частично разлагается:
XeF6 + Н2O = 2НF + XeOF4
Оксид ксенона (VI) XeО3 образуется при гидролизе XeF4. Это белое нелетучее, очень взрывчатое вещество, хорошо растворимое в воде, причем раствор имеет слабощелочную реакцию.
При действии озона на такой раствор образуется соль ксеноновой кислоты, в которой ксенон имеет степень окисления +8:
XeО3 + О3 + 4NaOH = Na4 XeО6 + О2 + 2 Н2O
Оксид ксенона (VIII) XeО4 может быть получен при взаимодействии перксената бария с безводной серной кислотой при низких температурах:
Вa2 XeО6 + 2Н2SO4 = 2 ВaSO4 + XeО4↑ + 2 Н2O
XeО4 — бесцветный газ, который очень взрывоопасен и разлагается при температурах выше 0° С:
3XeО4 = 2XeО3 + Xe + 3О2
Из соединений других благородных газов известны KrF2, KrF4, RnF2, RnF4, RnF6, RnO3 . Считается, что аналогичные соединения гелия, неона и аргона вряд ли будут когда-нибудь получены в виде индивидуальных веществ.
Тем не менее химические соединения гелия, неона и аргона существуют в виде так называемых эксимерных молекул, молекул, у которых устойчивы возбужденные электронные состояния и неустойчиво основное состояние. Например, при электрическом возбуждении смеси аргона и хлора возможна газофазная реакция:
Ar + Cl2 = ArCl + Cl
с образованием эксимерной молекулы ArCl. Аналогично можно получить двухатомные молекулы неона, аргона Все эти молекулы неустойчивы и не могут быть выделены в виде индивидуальных веществ, однако их можно зарегистрировать и изучить из строение с помощью спектроскопических методов.
Читайте также:

