Химические свойства простых и сложных веществ кратко
Обновлено: 02.07.2024
В неорганической химии вещества по составу делятся на простые и сложные.
- состоят из атомов одного химического элемента: сера S, углерод С, железо Fe, серебро Ag;
- подразделяют на металлы и неметаллы (включая благородные газы).
Сложные вещества — соединения:
- состоят из атомов двух или более химических элементов: N a 2 O , H C l , C u S O 4 ;
- подразделяют на: оксиды, основания, кислоты и соли.
Классификация простых веществ
1. Простые вещества условно делят на две группы: металлы и неметаллы.
Неметаллы в Периодической системе — это все элементы VIII А-группы (благородные газы) и VII А-группы (галогены), элементы VI А-группы (кроме полония), элементы V А-группы: азот, фосфор, мышьяк; углерод, кремний (IV А-группа); бор (III А-группа), а также водород. Остальные элементы относят к металлам.
Отличия свойств металлов и неметаллов приведены в таблице 1:
- газообразные: водород H 2 , азот N 2 , фтор F 2 ;
- жидкие: только бром B r 2 ;
- твёрдые: кремний Si, бор B, мышьяк As.
Амфотерные элементы находятся в А-группах Периодической системы: бериллий Be, алюминий Al, галлий Ga, германий Ge, олово Sn, свинец Pb, сурьма Sb, висмут Bi, полоний Po и др., а также большинство элементов Б-групп: хром Cr, марганец Mn, железо Fe, цинк Zn, кадмий Cd, золото Au и др., проявляют и металлические (оснóвные для соединений), и неметаллические (кислотные для соединений) свойства.
Благородные (инертные) газы (VIII А-группа Периодической системы): гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радиоактивный радон Rn:
- обнаруживаются в воздухе, в малых количествах — в воде, горных породах, природных газах;
- не имеют цвета, вкуса и запаха;
- крайне химически инертны;
- используются в источниках света для создания освещения различных цветов (Ne — огненно-красный, Xe— синевато-серый, тусклый, Ar — фиолетово-голубой и др).
2. Сложные соединения и их отличия от простых веществ.
Сложные вещества бывают органические, в основе которых лежит углерод, и неорганические (безуглеродные и некоторые углеродсодержащие соединения: карбиды, карбонаты, оксиды углерода и другие). Неорганические чаще всего подразделяют на оксиды, основания, кислоты и соли.
Главные отличия сложных неорганических веществ:
- Свойства элементов, входящих в соединение, не сохраняются. Например, металл кальций Ca и неметалл хлор C l 2 . Каждому из этих простых веществ присущи свои характеристики. А соль C a C l 2 имеет новые, отличные от характеристик простых веществ, свойства, сходные со свойствами класса солей.
- В ходе химических реакций сложное вещество может быть получено или разложено на составные части.
- Количественный состав сложного соединения всегда одинаков, независимо от места нахождения и способа получения (для веществ молекулярного состава).
Классификация неорганических соединений и их основные свойства приведены в таблице 2.
- газы: N O , C O 2
- жидкости: H 2 O
- твёрдые: C u O , S i O 2
- газы: H 2 S , H C l
- жидкости: H N O 3 , H 2 S O 4
- твёрдые: H 3 P O 4 , H 3 B O 3
- оксиды металлов (оснóвные): K 2 O , CaO;
- оксиды неметаллов (кислотные): N 2 O 5 , S O 3 ;
- амфотерные: ZnO, A l 2 O 3 .
- оснóвные: LiOH, C a ( O H ) 2 ;
- амфотерные: B e ( O H ) 2 , C r ( O H ) 3 .
- кислородсодержащие: H 2 S O 4 , H N O 3 ;
- бескислородные: H J , H 2 S .
- средние: N a 3 ( P O 4 ) 2 , C a C l 2 ;
- кислые: K H C O 3 , N a 2 H P O 4 ;
- оснóвные: Mg(OH)Cl, C u 2 ( O H ) 2 C O 3 ;
- комплексные: K 2 [ B e ( C O 3 ) 2 ] .
Классы и номенклатура неорганических веществ
Номенклатура — способ называния веществ.
Химическая формула — представление состава вещества с использованием символов химических элементов, числовых индексов и других знаков. Химическое название определяется составом вещества и изображается с помощью слова или группы слов. Названия строятся по номенклатурным правилам, с использованием русских названий элементов, кроме случаев, когда традиционно употребляются латинские корни (таблица 3):
| Ag — аргент | C — карб, карбон | H — гидр, гидроген | N — нитр | Pb — плюмб, | Si — сил, силик, силиц |
| As — арс, арсен | Cu — купр | Hg — меркур | Ni — никкол | S — сульф | Sn -станн |
| Au — аур | Fe — ферр | Mn — манган | O — окс, оксиген | Sb — стиб | |
| Например, оксид натрия N a 2 O , карбонат кальция C a C O 3 , перманганат калия K M n O 4 | |||||
- Названия простых веществ чаще всего совпадают с русскими названиями соответствующих химических элементов. По необходимости к ним добавляется числовая греческая приставка: моно — 1, ди (латинский) — 2, три — 3, тетра — 4, пента — 5, гекса — 6, гепта — 7, окта — 8, нона (латинский) — 9, дека — 10. Например, (моно) кальций Ca, (моно) медь Cu, дикислород O 2 , трикислород O 3 , тетрафосфор P 4 . Исключение: аллотропные модификации: углерода С — графит, сажа, алмаз; кислорода — озон O3.
- Названия сложных веществ составляют по химической формуле справа налево. Для каждого класса веществ существуют свои правила составления формул и названий:
- формула оксидов: ЭnOm, где n и m — числовые индексы, определяющиеся степенями окисления элементов. Например,
Li+1 и O-2→ L i 2 O ; Al+3 и O-2→ A l 2 O 3 ; N+5 и O-2→ N 2 O 5 .
Если элемент образует несколько оксидов, то в конце добавляют степень окисления римскими цифрами, заключая их в скобки:
Оксиды, которым соответствуют кислоты, также называют ангидридами: серный ангидрид S O 3 , азотный ангидрид N 2 O 5 и др.
- формула оснований: Me+n(OH-)n, где нижний индекс n — количество гидроксид-анионов OH-.
K+1 и OH- → KOH, Mg+2 и OH- → M g ( O H ) 2 .
Если элемент образует несколько гидроксидов, то в конце добавляют степень окисления римскими цифрами, заключая их в скобки:
F e ( O H ) 2 — гидроксид железа (II), C r ( O H ) 3 — гидроксид хрома (III).
- формула кислот HnК, где K — кислотный остаток.
Названия наиболее распространенных кислот и их остатков приведены в таблице 4:
| Формула и название кислоты | Название кислотного остатка, образующего соль |
| H A l O 2 метаалюминиевая | метаалюминат |
| H 3 A l O 3 ортоалюминиевая | ортоалюминат |
| H A s O 3 метамышьяковая | метаарсенат |
| H 3 A s O 4 ортомышьяковая | ортоарсенат |
| H 3 B O 3 ортоборная | ортоборат |
| HBr бромоводородная | бромид |
| HBrO бромноватистая | гипобромит |
| H B r O 3 бромноватая | бромат |
| HCN циановодородная | цианид |
| H 2 C O 3 угольная | карбонат |
| HCl хлороводородная | хлорид |
| HClO хлорноватистая | гипохлорит |
| H C l O 2 хлористая | хлорит |
| H C l O 3 хлорноватая | хлорат |
| H C l O 4 хлорная | перхлорат |
| HF фтороводородная | фторид |
| HJ йодоводородная | йодид |
| H M n O 4 марганцовая | перманганат |
| H N O 2 азотистая | нитрит |
| H N O 3 азотная | нитрат |
| H P O 3 метафосфорная | метафосфат |
| H 3 P O 4 ортофосфорная | ортофосфат |
| H 2 S сероводородная | сульфид |
| H 2 S O 3 сернистая | сульфит |
| H 2 S O 4 серная | сульфат |
| H 2 S i O 3 метакремниевая | метасиликат |
| H 3 S i O 4 ортокремниевая | ортосиликат |
Название образуется в зависимости от типа соли.
Бинарные соединения — сложные вещества, состоящие из двух элементов. В таких соединениях встречается два типа химической связи: ковалентная полярная (для неметаллов и некоторых амфотерных элементов) или ионная (для солей бескислородных кислот).
Названия строятся по схеме: к корню более электроотрицательного элемента добавляется окончание -ид (оксид, гидрид, карбид и т.д.) в именительном падеже + название второго элемента в родительном падеже, при необходимости добавляется числовое значение степени окисления: C S 2 — дисульфид углерода или сульфид углерода (IV), M n F 4 — тетрафторид марганца или фторид марганца (IV).
Для некоторых есть тривиальные названия: N H 3 — аммиак, S i Н 4 — силан, P H 3 — фосфин и др.
Строение и химические свойства
Простые вещества состоят из атомов одного химического элемента:
- одноатомные: благородные газы — гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радон Rn;
- двухатомные: водород H 2 , кислород O 2 , азот N 2 и галогены: хлор C l 2 , йод J 2 , бром B r 2 ;
- трех и более атомные: озон O 3 , белый фосфор P 4 , кристаллическая (ромбическая и моноклинная) сера S 8 .
Порядок соединения атомов при образовании из них веществ обусловливает особенности строения веществ. Различают вещества молекулярного и немолекулярного строения. Немолекулярное строение имеют все металлы и большинство их соединений, графит, красный фосфор, алмаз, кремний Si и др. Большинство неметаллов и их соединений состоят из молекул, т. е. имеют молекулярное строение.
Химические свойства металлов и неметаллов
1. Химические свойства металлов определяются способностью отдавать свободные электроны с внешнего уровня. Они являются восстановителями. Взаимодействие идет с:
- неметаллами:
- +кислород O 2 (кроме золота и металлов группы платины) → оксиды: 2 C a + O 2 → 2 C a O ;
- +галогены ( F 2 , C l 2 , B r 2 ) → галогениды (фторид, хлорид, бромид и т.д.): C u + B r 2 → C u B 2 ;
- +азот, фосфор, сера, водород → нитриды, фосфиды, сульфиды, гидриды: 3 C a + N 2 → C a 3 N 2 .
- водой (только щелочные и щелочно-земельные металлы) → гидроксиды: 2 N a + 2 H 2 O → 2 N a O H + H 2 ↑ ;
- кислотами (металлы, стоящие в ряду активности до водорода) → соль: M g + 2 H C l → M g C l 2 + H 2 ↑ ;
- растворами солей менее активных металлов: F e + C u S O 4 → F e S O 4 + C u , при следующих условиях:
- соли, вступающие в реакцию и получающиеся в ходе нее, должны быть растворимы;
- металл вытесняет из соли другой металл, если находится левее в ряду активности;
- щелочные и щелочно-земельные металлы в данном случае будут вступать в реакцию с водой, а не с солью.
- оксидами (более активный металл вытесняет менее активный): F e 2 O 3 + 2 A l → A l 2 O 3 + 2 F e .
2. Химические свойства неметаллов обусловлены свободными электронами (от 3 до 7) на внешнем электронном уровне.
- окислительные свойства наиболее характерны (стремятся присоединять электроны) в реакциях с:
- металлами: O 2 + 2 M g → 2 M g O ; S + 2 N a → N a 2 S ;
- неметаллами:
- кислород O 2 (из галогенов реагирует только фтор): S + O 2 → S O 2 ;
- водород H 2 (кроме кремния, фосфора и бора) : С + 2 H 2 → C 4 ;
- неметалл c меньшей электроотрицательностью: 3 S + 2 P → P 2 S 3 (нагревание без доступа воздуха, сера — окислитель);
- солями (вытесняют менее активные неметаллы): C l 2 + 2 N a B r → 2 N a C l + B r 2 .
- восстановительные свойства (исключение: фтор F — всегда окислитель) в некоторых реакциях с:
- неметаллами, электроотрицательность которых ниже: C + O 2 → C O 2 (углерод — восстановитель);
- сложными веществами — окислителями ( C u O , H N O 3 ) : S + 6 H N O 3 → H 2 S O 4 + 6 N O 2 ↑ + 2 H 2 O .
- и окислительные, и восстановительные свойства проявляют хлор, сера, фосфор, йод и бром в реакциях диспропорционирования:
- C l 2 0 + H 2 O → H C l - 1 + H C l + 1 O ;
- 3 S 0 + 6 N a O H → 2 N a 2 S - 2 + N a 2 S + 6 O 3 + 3 H 2 O .
Химические свойства благородных газов
- плохо растворяются в воде и вступают в реакции с другими веществами только в специально созданных условиях;
- не горят; вытесняют кислород из воздуха, снижая его содержание до критически низких показателей, приводящих к смерти.
Строение и основные химические свойства сложных веществ
Сложные соединения имеют ионную или ковалентную связь между атомами.
- оснóвные + кислоты → соли: C a O + 2 H C l → C a C l 2 + H 2 O ;
- кислотные + основания → соли: S O 3 + 2 N a O H → N a 2 S O 4 + H 2 O ;
- амфотерные реагируют и с кислотами, и с основаниями → соли:
Z n O + H 2 S O 4 → Z n S O 4 + H 2 О ,
Z n O + 2 N a O H + H 2 O → N a 2 [ Z n ( O H ) 4 ] .
Все основания реагируют с кислотами (реакция нейтрализации):
- K O H + 2 H C l → K C l + H 2 O ;
- 2 F e ( O H ) 3 + 3 H 2 S O 4 → F e 2 ( S O 4 ) 3 + 6 H 2 O .
1. Щелочи взаимодействуют с:
- неметаллами: 6 K O H + 3 S → K 2 S O 3 + 2 K 2 S + 3 H 2 O ;
- кислотными оксидами: 2 N a O H + N O 2 → N a N O 2 + N a N O 3 + H 2 O .
2. Нерастворимые основания разлагаются при нагревании: C u ( O H ) 2 → C u O + H 2 O .
- + основания (реакция нейтрализации): 2 F e ( O H ) 3 + 3 H 2 S O 4 → F e 2 ( S O 4 ) 3 + 6 H 2 O ;
- + металлы, стоящие левее водорода в ряду активности: M g + 2 H C l → M g C l 2 + H 2 ↑ ;
- + основные и амфотерные оксиды: C a O + H 2 S O 4 → C a S O 4 + H 2 O ; Z n O + H 2 S O 4 → Z n S O 4 + H 2 O ;
- + соли: B a C l 2 + H 2 S O 4 → B a S O 4 + 2 H C l .
- + кислоты (сильные): N a 2 S i O 3 + 2 H C l → H 2 S i O 3 ↓ + 2 N a C l ;
- + щёлочи, если образуется нерастворимое основание: F e C l 3 + 3 N a O H → F e ( O H ) 3 ↓ + 3 N a C l ;
- + металлы: Z n + P b ( N O 3 ) 2 → P b ↓ + Z n ( N O 3 ) 2 ;
- + соли при условии необратимости реакции: N a 2 C O 3 + C a ( N O 3 ) 2 → C a C O 3 ↓ + 2 N a N O 3 .
В металлах – металлическая связь и металлическая кристаллическая решетка. В узлах решетки находятся положительно заряженные ионы металлов, связанные посредством обобществленных внешних электронов, принадлежащих всему кристаллу.
Это обуславливает все важнейшие физические свойства металлов: металлический блеск, электро- и теплопроводность, пластичность (способность изменять форму под внешним воздействием) и некоторые другие, характерные для этого класса простых веществ.
Металлы I группы главной подгруппы называют щелочными металлами.
Металлы II группы: кальций, стронций, барий – щелочноземельными.
В химических реакциях металлы проявляют только восстановительные свойства, т.е. их атомы отдают электроны, образуя в результате положительные ионы.
1. Взаимодействуют с неметаллами:
а) кислородом (с образованием оксидов)
Щелочные и щелочноземельные металлы окисляются легко при обычных условиях, поэтому их хранят под слоем вазелинового масла или керосина.
2Ca + O2 = 2CaO
Обратите внимание: при взаимодействии натрия – образуется пероксид, калия - надпероксид
2Na + O2 = Na2O2, К + О 2 = КО 2
а оксиды получают прокаливанием пероксида с соответствующими металлом:
Железо, цинк, медь и другие менее активные металлы медленно окисляются на воздухе и активно при нагревании.
3Fe + 2O2 = Fe3O4 (смесь двух оксидов: FeO и Fe2O3)
2Zn + O2 = 2ZnO
2Cu + O2 = 2CuO
Золото и платиновые металлы не окисляются кислородом воздуха ни при каких условиях.
б) водородом (с образованием гидридов)
2Na + H2 = 2NaH
в) хлором (с образованием хлоридов)
2K + Cl2 = 2KCl
Mg + Cl2 = MgCl2
2Al + 3Cl2 =2AlCl3
Обратите внимание: при взаимодействии железа образуется хлорид железа (III):
2Fe + 3Cl2 = 2FeCl3
г) серой (с образованием сульфидов)
2Na + S = Na2S
Hg + S = HgS
2Al + 3S = Al2S3
Обратите внимание: при взаимодействии железа образуется сульфид железа (II):
Fe + S = FeS
д) азотом (с образованием нитридов)
2Al + N2 = 2AlN
2. Взаимодействуют со сложными веществами:
Необходимо помнить, что по восстановительной способности металлы расположены в ряд, который называют электрохимическим рядом напряжений или активности металлов (вытеснительный ряд Бекетова Н.Н.):
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Au, Pt
а) водой
Металлы, расположенные в ряду до магния, при обычных условиях вытесняют водород из воды, образуя растворимые основания – щелочи.
2Na + 2H2O = 2NaOH + H2↑
Магний взаимодействует с водой при кипячении.
Алюминий при удалении оксидной пленки бурно реагирует с водой.
Остальные металлы, стоящие в ряду до водорода, при определенных условиях тоже могут вступать в реакцию с водой с выделением водорода и образованием оксидов.
б) растворами кислот
Обратите внимание: не используют для проведения реакций нерастворимую кремниевую кислоту
Металлы, стоящие в ряду до магния и активно реагирующие с водой, не используют для проведения таких реакций.
Металлы, стоящие в ряду от магния до водорода, вытесняют водород из кислот.
Mg + 2HCl = MgCl2 + H2↑
Обратите внимание: образуются соли двухвалентного железа.
Образование нерастворимой соли препятствует протеканию реакции. Например, свинец практически не реагирует с раствором серной кислоты из-за образования на поверхности нерастворимого сульфата свинца.
Металлы, стоящие в ряду после водорода, НЕ вытесняют водород.
в) растворами солей
Металлы, стоящие в ряду до магния и активно реагирующие с водой, не используют для проведения таких реакций.
Для остальных металлов выполняется правило:
Каждый металл вытесняет из растворов солей другие металлы, расположенные в ряду правее него, и сам может быть вытеснен металлами, расположенными левее него.
Cu + HgCl2 = Hg + CuCl2
Fe + CuSO4 = FeSO4 + Cu
Как и в случае с растворами кислот, образование нерастворимой соли препятствует протеканию реакции.
г) растворами щелочей
Взаимодействуют металлы, гидроксиды которых амфотерны.
2Al + 2KOH + 6H2O = 2K[Al(OH) 4] + 3H2↑
д) с органическими веществами
Щелочные металлы со спиртами и фенолом.
Металлы участвуют в реакциях с галогеналканами, которые используют для получения низших циклоалканов и для синтезов, в ходе которых происходит усложнение углеродного скелета молекулы (реакция А.Вюрца):
2CH2Cl + 2Na = C2H6(этан) + 2NaCl
В простых веществах атомы неметаллов связаны ковалентной неполярной связью. При этом образуются одинарные (в молекулах H2, F2, Cl2, Br2, I2), двойные (в молекулах О2), тройные (в молекулах N2) ковалентные связи.
1. молекулярное
При обычных условиях большинство таких веществ представляют собой газы (Н2, N2, O2, O3, F2, Cl2) или твердые вещества (I2, P4, S8) и лишь единственный бром (Br2) является жидкостью. Все эти вещества молекулярного строения, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
2. атомное
Эти вещества образованы кристаллами, в узлах которых находятся атомы: (Bn, Сn, Sin, Ge n , Sen, Ten). Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала.
Многие элементы – неметаллы образуют несколько простых веществ – аллотропных модификаций. Аллотропия может быть связана с разным составом молекул: кислород О2 и озон О3 и с разным строением кристаллов: аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен. Элементы – неметаллы, имеющие аллотропные модификации: углерод, кремний, фосфор, мышьяк, кислород, сера, селен, теллур.
У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны. Эту способность характеризует значение электроотрицательности. В ряду неметаллов
At, B, Te, H, As, I, Si, P, Se, C, S, Br, Cl, N, O, F
электроотрицательность возрастает и усиливаются окислительные свойства.
Отсюда следует, что для простых веществ – неметаллов будут характерны как окислительные, так и восстановительные свойства, за исключением фтора – самого сильного окислителя.
1. Окислительные свойства
а) в реакциях с металлами (металлы всегда восстановители)
2Na + S = Na2S (сульфид натрия)
3Mg + N2 = Mg3N2 (нитрид магния)
б) в реакциях с неметаллами, расположенными левее данного, то есть с меньшим значением электроотрицательности. Например, при взаимодействии фосфора и серы окислителем будет сера, так как фосфор имеет меньшее значение электроотрицательности:
2P + 5S = P2S5 (сульфид фосфора V)
Большинство неметаллов будут окислителями в реакциях с водородом:
в) в реакциях с некоторыми сложными веществами
Окислитель – кислород, реакции горения
Окислитель – хлор
2KI + Cl2 = 2KCl + I2
2. Восстановительные свойства
а) в реакциях с фтором
б) в реакциях с кислородом (кроме фтора)
в) в реакциях со сложными веществами – окислителями
H2 + CuO = Cu + H2O
3. Реакции диспропорционирования: один и тот же неметалл является и окислителем и восстановителем
Cl2 + H2O = HCl + HClO
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
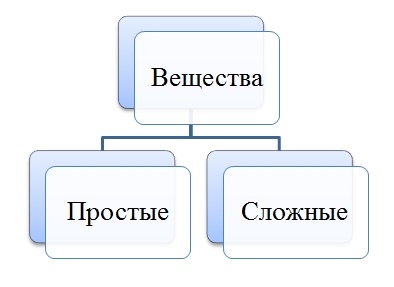
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: H2, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: H2O, NH3, OF2, H2SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
- С - алмаз, графит, карбин, фуллерен.
- O - кислород, озон.
- S - ромбическая, моноклинная, пластическая.
- P - белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:
- Различным числом атомов в молекуле, например кислород O2 и озон O3.
- Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).
Основные классы неорганических веществ
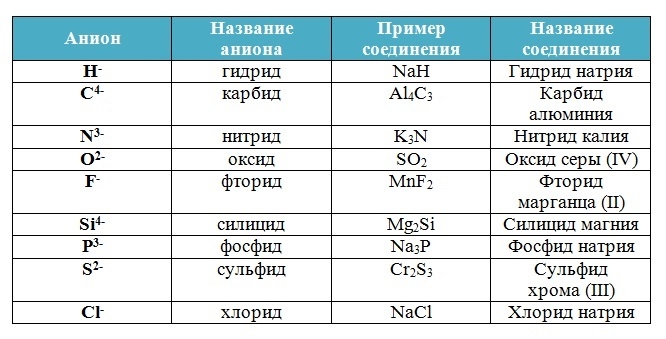
Бинарные соединения
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
- Na2O — Na2(+1)O(-2) — NaOH
- MgO — Mg(+2)O(-2) — Mg(OH)2
- FeO — Fe(+2)O(-2) — Fe(OH)2
- MnO — Mn(+2)O(-2) — Mn(OH)2
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Пример
Соответствие кислотных оксидов и кислот
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
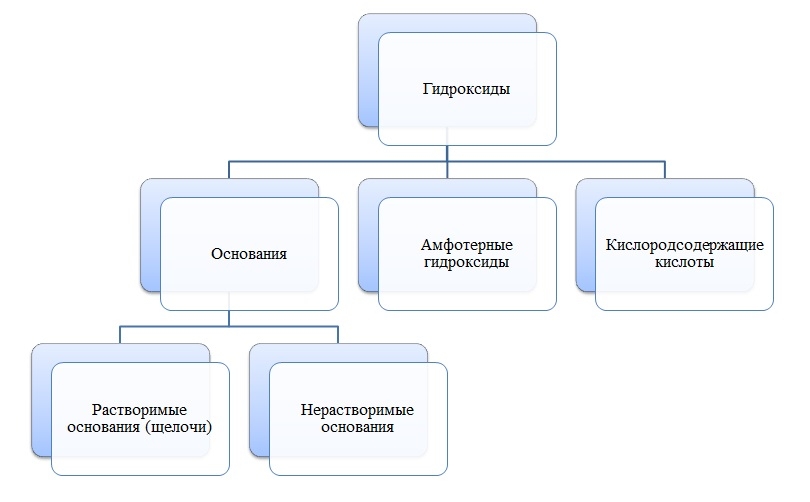
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония NH4+
Пример
NaOH, NH4OH, Ca(OH)2
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
Пример
H2SO4, HNO3, H2Cr2O7, HMnO4
Соли- соединения, состоящие из катионов металлов (или NH4+) и кислотных остатков.
Вещества могут существовать только в трёх агрегатных состояниях: газообразном, жидком и твёрдом.

В газообразном состоянии вещество существует в виде отдельных частиц (молекул, атомов или ионов). Расстояние между частицами в газах намного превышает размеры этих частиц. В жидкостях расстояние между отдельными частицами намного меньше, поэтому силы взаимного притяжения между ними существенно больше, чем в газах. В то время как частицы, составляющие твёрдое тело (атомы, молекулы или ионы), плотно упакованы и совершают колебательные движения. Различают кристаллические и аморфные твёрдые тела.
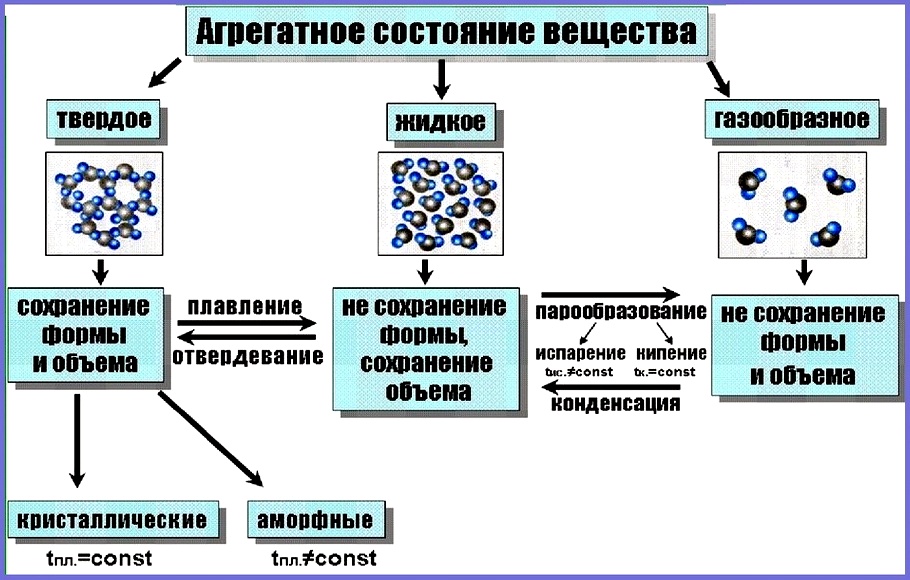
Для кристаллических веществ характерно упорядоченное расположение частиц, из которых они состоят. Например, снежинка имеет совершенную форму благодаря тому, что молекулы воды, из которых она состоит, располагаются упорядоченно по отношению друг к другу. Правильная форма кристаллов обусловлена особенностями их внутреннего строения. В кристаллах ионы, атомы или молекулы расположены в определённом порядке, на определённых расстояниях друг от друга.
Совокупность точек пространства, в которых располагаются частицы, образующие кристалл, называют КРИСТАЛЛИЧЕСКОЙ РЕШЁТКОЙ.
Вещества, которые состоят из молекул, — это вещества молекулярного строения. А вещества, которые состоят из атомов или ионов, — это вещества немолекулярного строения.

Вещества с молекулярным и немолекулярным строением существенно различаются по своим свойствам. Чтобы расплавить вещество, необходимо разрушить его кристаллическую решётку. Оказывается, что в кристаллической решётке связи между молекулами гораздо слабее, чем связи между атомами или ионами. Поэтому, как правило, вещества с молекулярным строением имеют низкие температуры плавления и кипения. Такие вещества часто летучи и имеют запах.
Вещества с немолекулярным строением имеют высокие температуры плавления и кипения. Эти вещества твёрдые, нелетучие и не имеют запаха.
Простые и сложные вещества
Сложные вещества — это вещества, которые образованы атомами разного вида. Например, такое сложное вещество, как вода, состоит из атомов кислорода и водорода, углекислый газ — из атомов углерода и кислорода.
Такие вещества, как, например, сера, железо, кислород и водород, нельзя ни получить из более простых веществ, ни разложить. Эти вещества относят только к простым веществам.
Простые вещества — это вещества, которые образованы атомами одного вида. Например, простое вещество кислород состоит только из атомов кислорода, простое вещество графит — только из атомов углерода.
Сложные вещества и простые вещества молекулярного строения часто называют химическими соединениями.
Аллотропия
Аллотропия — это явление образования химическим элементом нескольких простых веществ, различных по строению и свойствам. Образующиеся вещества называются аллотропными видоизменениями. Примеры аллотропии:
С (углерод) — алмаз, графит, карбин, фуллерен, графин;
О (кислород) — собственно кислород, озон;
Р (фосфор) — белый, красный, черный, фиолетовый;
S (сера) — ромбическая, моноклинная, пластическая;
Si (кремний) — аморфный, кристаллический;
As (мышьяк) — желтый, серый, черный.
Читайте также:

