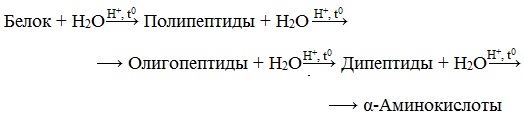Химические свойства белков кратко
Обновлено: 04.07.2024
Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
локальное упорядочивание фрагмента полипептидной цепи в спирали
пространственная ориентация полипептидной спирали или способ ее укладки определенном объеме в глобулы (клубки) или фибриллы (нити)
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Химические свойства белков
Гидролиз
Все белки способны вступать в реакцию гидролиза. В случае полного гидролиза белков образуется смесь из α -аминокислот:
Белок + nH2O => смесь из α-аминокислот
Денатурация
Разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры называют денатурацией. Денатурация белка может протекать под действием растворов солей натрия, калия или аммония – такая денатурация является обратимой:
Денатурация же протекающая под действием излучения (например, нагрева) или обработке белка солями тяжелых металлов является необратимой:
Так, например, необратимая денатурация белка наблюдается при термической обработке яиц в процессе их приготовления. В результате денатурации яичного белка его способность растворяться в воде с образованием коллоидного раствора исчезает.
Качественные реакции на белки
Биуретовая реакция
Если к раствору, содержащему белок добавить 10%-й раствор гидроксида натрия, а затем небольшое количество 1 %-го раствора сульфата меди, то появится фиолетовое окрашивание.
раствор белка + NаОН(10%-ный р-р) + СuSO4 = фиолетовое окрашивание
Ксантопротеиновая реакция
растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
Белки – природные полипептиды с огромной молекулярной массой. Они входят в состав всех живых организмов и выполняют различные биологические функции.
Строение белка.
У белков существует 4 уровня строения:
- первичная структура белка – линейная последовательность аминокислот в полипептидной цепи, свернутых в пространстве:

- вторичная структура белка – конформация полипептидной цепи, т.к. скручивание в пространстве за счет водородных связей между NH и СО группами. Есть 2 способа укладки: α-спираль и β- структура.

На одном витке укладываются 4 аминокислотных остатка, которые находятся снаружи спирали.

Полипептидная цепь растянута, ее участки располагаются параллельны друг другу и удерживаются водородными связями.
- третичная структура белка – это трехмерное представление закрученной α-спираль или β-структуры в пространстве:

Эта структура образуется за счет дисульфидных мостиков –S-S- между цистеиновыми остатками. В образовании такой структуры участвуют противоположно заряженные ионы.
- четвертичная структура белка образуется за счет взаимодействия между разными полипептидными цепями:

Синтез белка.
В основе синтеза лежит твердофазный метод, в котором первая аминокислота закрепляется на полимерном носителе, а к ней последовательно подшиваются новые аминокислоты. После полимер отделяют от полипептидной цепи.
Физические свойства белка.
Физические свойства белка определяются строением, поэтому белки делят на глобулярные (растворимые в воде) и фибриллярные (нерастворимые в воде).
Химические свойства белков.
1. Денатурация белка (разрушение вторичной и третичной структуры с сохранением первичной). Пример денатурации – свертывание яичных белков при варке яиц.
2. Гидролиз белков – необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот. Так можно установить количественный состав белков.
3. Качественные реакции:
Биуретовая реакция – взаимодействие пептидной связи и солей меди (II) в щелочном растворе. По окончанию реакции раствор окрашивается в фиолетовый цвет.
Ксантопротеиновая реакция - при реакции с азотной кислотой наблюдается желтое окрашивание.
Биологическое значение белка.
1. Белки – строительный материал, из него построены мышцы, кости, ткани.
2. Белки - рецепторы. Передают и воспринимают сигнал, поступающих от соседних клеток из окружающей среды.
3. Белки играют важную роль в иммунной системе организма.
4. Белки выполняют транспортные функции и переносят молекулы или ионы в место синтеза или накопления. (Гемоглобин переносит кислород к тканям.)
5. Белки – катализаторы – ферменты. Это очень мощные селективные катализаторы, которые ускоряют реакции в миллионы раз.
Есть ряд аминокислот, которые не могут синтезироваться в организме - незаменимые, их получают только с пищей: тизин, фенилаланин, метинин, валин, лейцин, триптофан, изолейцин, треонин.
По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
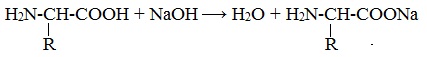
При действии же кислот он выступает в форме катиона:
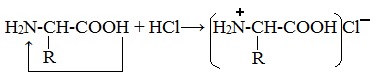
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
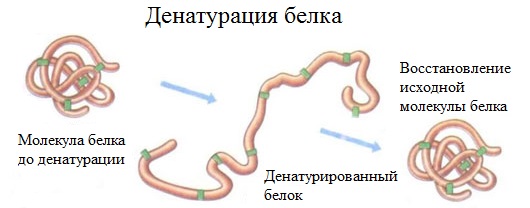
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg 2+ , Pb 2+ , Си 2+ ).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-70 0 С), теряя способность растворяться в воде.
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.


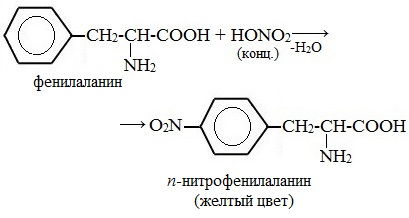
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина:
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.

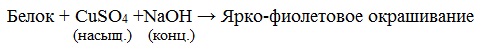
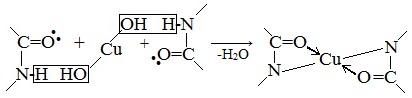
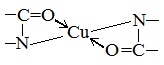
Причина появления окраски – образование комплексных соединений с координационным узлом:
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)

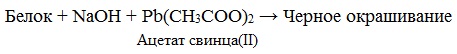
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.

Рубрики: Белки

Аминокислоты. Белки
Ключевые слова конспекта: Аминокислоты. Глицин. Пептидная связь. Белки. Качественные реакции на белки. Денатурация белка. ДНК. Ген.
Строение аминокислот
Аминокислоты представляют собой твёрдые кристаллические вещества, многие из них хорошо растворимы в воде, некоторые имеют сладкий вкус.

Способы получения и химические свойства аминокислот

В промышленности аминокислоты получают биотехнологическим путём как продукты жизнедеятельности микроорганизмов. Кроме того, разработано несколько лабораторных способов получения аминокислот. Один из них может быть представлен следующей схемой:
Простейшую аминокислоту называют аминоуксусной кислотой или глицином, её формула H2N—СН2—СООН.


Какие же свойства проявляют аминокислоты — кислотные или основные? Оказывается, подобно амфотерным неорганическим соединениям, в зависимости от природы реагента аминокислоты могут проявлять свойства как кислоты, так и основания. Например, глицин реагирует со щелочами с образованием солей, проявляя свойства кислоты:

В реакциях с кислотами глицин проявляет свойства органических оснований — аминов:
Понятие о пептидах и белках

Важное химическое свойство аминокислот — способность взаимодействовать друг с другом с отщеплением молекулы воды, образуя пептиды:

Между двумя остатками аминокислот образуется пептидная связь:
Получившийся в результате реакции дипептид может вступать в реакции с другими молекулами аминокислот, образуя полимеры — белки. Поскольку в результате этой реакции, помимо высокомолекулярного вещества, образуется второй продукт — вода, такой процесс относят к реакциям поликонденсации.
О важности белков для живых организмов свидетельствует тот факт, что в большинстве иностранных языков соединения такого типа называют протеинами (от греч. protos — первый). На Земле не существует ни одного живого организма, включая простейшие одноклеточные и бактерии, который не состоял бы из белковых молекул.
Структура и функции белков
Молекулы белков имеют также вторичную и третичную структуру. Характеристика этих структур белковых молекул приведена в таблице.

В зависимости от того, какую функцию выполняет белок в организме, различно его отношение к воде. Большинство белков в воде не растворяется, например кератины, которые составляют основу волос, ногтей, перьев, рогов и т. д. Для некоторых белков выполнение их функций невозможно без растворения. Так, в воде растворяются многие белки, выполняющие функции природных катализаторов, — ферменты.
Химические свойства белков
Для обнаружения белка проводят качественные реакции на белки. Белки дают фиолетовое окрашивание в щелочной среде под действием свежеприготовленного осадка гидроксида меди(II). Эту пробу называют биуретовой реакцией.
Вторую качественную реакцию на белки называют ксантопротеиновой. При действии на раствор белка концентрированной азотной кислоты образуется белый осадок, который быстро приобретает жёлтую окраску, а при добавлении водного раствора аммиака становится оранжевым.
Для обнаружения в белках соединений серы используют следующий тест. При горении серосодержащих белков появляется характерный запах жжёного рога.

Одно из важнейших химических свойств белков — реакции гидролиза. В присутствии природных катализаторов (ферментов) или сильных кислот молекулы воды расщепляют полимерную белковую молекулу до аминокислот:
Белки играют ключевую роль почти во всех структурах живых организмов и происходящих в них процессах.
В каждой клетке организма синтезируется множество белков. Информация о структуре всех белков организма зашифрована в ещё одних природных биополимерах — молекулах дезоксирибонуклеиновых кислот (ДНК). Мономеры ДНК — нуклеотиды. Молекулы ДНК человека содержат примерно 3,1 млрд пар нуклеотидов. Участок молекулы ДНК, отвечающий за синтез одного белка, называют геном.

Читайте также: