Генетика бактерий и вирусов кратко
Обновлено: 05.07.2024
• В клетках большинства прокариот присутствует одна кольцевая хромосома
• Генетическая гибкость прокариот и их адаптационные возможности усиливаются при заражении бактериофагами и при переносе плазмид
• Быстрая эволюция генома прокариот обеспечивается транспозонами и другими мобильными элементами
У большинства прокариот присутствует одна кольцевая хромосома, и они являются гаплоидными клетками. В следующем разделе рассмотрены вопросы организации хромосомы в дискретную структуру, нуклеоид. В настоящее время мы располагаем данными секвенирования более 200 геномов прокариот, размеры которых варьируют от 580 кнп (Mycoplasma genitalium) до 9 Мнп (Streptomyces, Myxococcus).
Геном таких хорошо известных бактерий, как Е. coli и В. subtilis, занимает среднее положение (4-5 Мнп). Относительно небольшие размеры прокариотических хромосом, по сравнению с хромосомами высших эукариот, объясняются их компактностью и небольшим количеством некодирующих последовательностей ДНК. В общем, гены, необходимые для постоянного роста и поддержания жизнеспособности прокариот, находятся в хромосоме, а генетическая гибкость микроорганизмов обеспечивается различными мобильными элементами.
У некоторых бактерий хромосома имеет линейную форму, или же в клетке содержится несколько таких хромосом. Встречаются виды, для которых характерны обе эти особенности. Например, клетки Streptomyces содержат линейную хромосому. Концы этой хромосомы замкнуты белковым мостиком, и это объясняет, почему долгое время на генетической карте этих бактерий изображали круговую хромосому.
Бактерии Rhodobacter sphaeroides обладают двумя большими кольцевыми хромосомами (3,0 и 0,9 Мнп), в каждой из которых присутствует много необходимых генов домашнего хояйства. Возбудитель Лайм-боррелиоза, бактерия Воrrelia burgdorferi характеризуется наличием нескольких линейных хромосом.
Стабильные элементы внехромосомной ДНК, которые не несут необходимых генов домашнего хозяйства и поэтому не являются существенными, называются плазмиды. На рисунке ниже перечислены некоторые хорошо изученные плазмиды бактерий. Эти данные дают представление о размерах генов, которые могут нести эти плазмиды. Плазмиды обычно невелики, варьируя по размерам от 2 до 1000 кнп, и обладают кольцевой структурой.
Так же как и в случае хромосом, известны исключения, и некоторые крупные плазмиды достигают размера 1 Мнп или больше, и небольшая их часть обладает линейной структурой. Все плазмиды несут гены, управляющие их репликацией, обычно включающей различные элементы аппарата репликации клетки хозяина. К числу важнейших генов, которые несут плазмиды, относятся гены устойчивости к антибиотикам и обусловливающие патогенные свойства или деградацию необычных источников углерода.
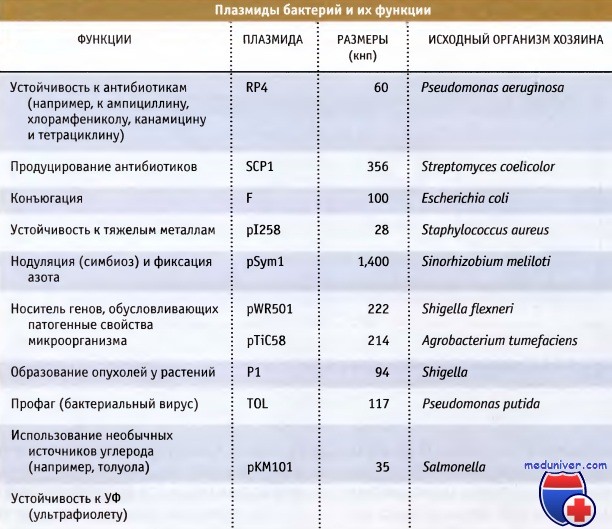
Плазмиды бактерий и их функции.
Плазмиды могут распространяться между организмами различными путями. Конъюгация представляет собой процесс, напоминающий спаривание, при котором присходит прямой перенос ДНК от клетки донора, содержащей плазмиду, в клетку реципиента. В донорской плазмиде закодированы функции, необходимые дляУ большинства прокариот присутствует одна кольцевая хромосома, и они являются гаплоидными клетками. В следующем разделе рассмотрены вопросы организации хромосомы в дискретную структуру, нуклеоид.
В настоящее время мы располагаем данными секвенирования более 200 геномов прокариот, размеры которых варьируют от 580 кнп (Mycoplasma genitalium) до 9 Мнп (Streptomyces, Myxococcus). Геном таких хорошо известных бактерий, как Е. coli и В. subtilis, занимает среднее положение (4-5 Мнп). Относительно небольшие размеры прокариотических хромосом, по сравнению с хромосомами высших эукариот, объясняются их компактностью и небольшим количеством некодирующих последовательностей ДНК. В общем, гены, необходимые для постоянного роста и поддержания жизнеспособности прокариот, находятся в хромосоме, а генетическая гибкость микроорганизмов обеспечивается различными мобильными элементами.
У некоторых бактерий хромосома имеет линейную форму, или же в клетке содержится несколько таких хромосом. Встречаются виды, для которых характерны обе эти особенности. Например, клетки Streptomyces содержат линейную хромосому. Концы этой хромосомы замкнуты белковым мостиком, и это объясняет, почему долгое время на генетической карте этих бактерий изображали круговую хромосому.
Бактерии Rhodobacter sphaeroides обладают двумя большими кольцевыми хромосомами (3,0 и 0,9 Мнп), в каждой из которых присутствует много необходимых генов домашнего хояйства. Возбудитель Лайм-боррелиоза, бактерия Воrrelia burgdorferi характеризуется наличием нескольких линейных хромосом.
Стабильные элементы внехромосомной ДНК, которые не несут необходимых генов домашнего хозяйства и поэтому не являются существенными, называются плазмиды. На рисунке ниже перечислены некоторые хорошо изученные плазмиды бактерий. Эти данные дают представление о размерах генов, которые могут нести эти плазмиды. Плазмиды обычно невелики, варьируя по размерам от 2 до 1000 кнп, и обладают кольцевой структурой.
Так же как и в случае хромосом, известны исключения, и некоторые крупные плазмиды достигают размера 1 Мнп или больше, и небольшая их часть обладает линейной структурой. Все плазмиды несут гены, управляющие их репликацией, обычно включающей различные элементы аппарата репликации клетки хозяина. К числу важнейших генов, которые несут плазмиды, относятся гены устойчивости к антибиотикам и обусловливающие патогенные свойства или деградацию необычных источников углерода.
Плазмиды могут распространяться между организмами различными путями. Конъюгация представляет собой процесс, напоминающий спаривание, при котором присходит прямой перенос ДНК от клетки донора, содержащей плазмиду, в клетку реципиента. В донорской плазмиде закодированы функции, необходимые для обеспечения контакта с клеткой реципиентом, инициации переноса реплицированной ДНК, и самого переноса ДНК в клетку реципиента.
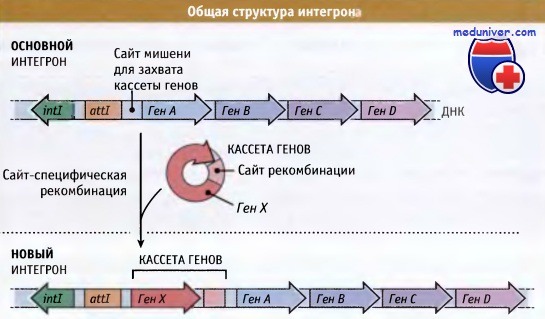
Структура типичного интегрона после накопления нескольких кассет генов.
Плазмиды также могут передаваться при прямом захвате ДНК (трансформация) или с участием бактериофага (трансдукция). Независимо от наличия экстрахромосомных элементов, изменения в бактериальном геноме могут возникать за счет процессов гомологичной и сайт-специфической рекомбинации.
Для многих бактерий важными источниками генетической вариабельности, по-видимому, являются бактериофаги (бактериальные вирусы). Результаты секвенирования показывают, что в геноме многих бактерий присутствуют интегрированные последовательности бактериофага (профаги). Например, у Е. coli их по меньшей мере 9, а у B. subtilis 10. Некоторые из этих профагов обладают дефектами, например у них присутствуют делеции и другие мутации, что делает маловероятным их дальнейшую активацию с образованием инфекционных бактериофагов.
В некоторых случаях профаги несут гены, которые обеспечивают некоторые преимущества клеткам хозяина: это относится к системам рестрикции и модификации, устойчивости к УФ и к таким детерминантом патогенности, как токсины.
Наконец, бактериальный геном также содержит много мобильных генетических элементов, которые распространяются посредством транспозиции. Инсерционные последовательности содержат минимальные элементы, которые, в своей простейшей форме, вместе с фланкирующими последовательностями, обладают только одним геном транспозазы. При инициации транспозиции, фланкирующие последовательности узнаются белком транспозазой.
Затем происходит мобилизация ферментов клетки хозяина, участвующих в репликации и репарации ДНК. Они завершают процесс вставки последовательности в необходимом месте. Более сложные транспозоны несут дополнительные гены, способные обеспечить адаптационные преимущества клеткам хозяина. Наиболее известными примерами транспозонов у бактерий являются гены устойчивости к антибиотикам, однако подобным образом могут переноситься также многие другие гены. Близкие к транспозонам элементы могут катализировать несколько таких типов перегруппировок ДНК, как инверсии и делеции.
Интегроны представляют собой особенно важный инструмент адаптивной перегруппировки генома. Как показано на рисунке ниже, интегроны обычно состоят из гена интегразы, примыкающего к нему сайта мишени для захвата кассеты генов, и сильного промотора, регулирующего экспрессию захваченных генов. В кассетах, часто включающих гены устойчивости к антибиотикам, содержатся последовательности, которые позволяют им включаться на место мишени под действием белка интегразы. Интегроны могут расти за счет последовательного захвата различных кассет генов, что способствует быстрому развитию таких бактерий, которые устойчивы к ряду антибиотиков.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Оглавление
- Вопрос 1. Основы микробиологии. Классификация микроорганизмов
- Вопрос 2. Особенности морфологии микроорганизмов
- Вопрос 3. Необязательные структурные компоненты бактериальной клетки
- Вопрос 4. Питание и особенности метаболизма бактерий
- Вопрос 5. Особенности белкового и углеводного обмена у бактерий
- Вопрос 6. Рост и размножение. Генетика бактерий
- Вопрос 7. Функциональные единицы генома. Изменчивость бактериальной клетки
- Вопрос 8. Нормальная микрофлора тела человека
Приведённый ознакомительный фрагмент книги Медицинская микробиология: конспект лекций для вузов предоставлен нашим книжным партнёром — компанией ЛитРес.
Вопрос 6. Рост и размножение. Генетика бактерий
1. Рост и размножение бактерий
Для микробиологической диагностики, изучения микроорганизмов и в биотехнологических целях микроорганизмы культивируют на искусственных питательных средах.
Под ростом бактерий понимают увеличение массы клеток без изменения их числа в популяции как результат скоординированного воспроизведения всех клеточных компонентов и структур.
В отличии от митотического цикла деления у эукариотов, размножение большинства прокариотов (бактерий) идет путем бинарного деления, а актиномицетов — почкованием. При этом все прокариоты существуют в гаплоидном состоянии, поскольку молекула ДНК представлена в клетке в единственном числе.
2. Бактериальная популяция. Колония
При изучении процесса размножения бактерий необходимо учитывать, что бактерии всегда существуют в виде более или менее многочисленных популяций, и развитие бактериальной популяции в жидкой питательной среде в периодической культуре можно рассматривать как замкнутую систему. В этом процессе выделяют 4 фазы:
• 1-я — начальная, или лаг-фаза, или фаза задержки размножения, она характеризуется началом интенсивного роста клеток, но скорость их деления остается невысокой;
• 2-я — логарифмическая, или лог-фаза, или экспоненциальная фаза, она характеризуется постоянной максимальной скоростью деления клеток и значительным увеличением числа клеток в популяции;
• 3-я — стационарная фаза, она наступает тогда, когда число клеток в популяции перестает увеличиваться. Это связано с тем, что наступает равновесие между числом вновь образующихся и гибнущих клеток. Число живых бактериальных клеток в популяции на единицу объема питательной среды в стационарной фазе обозначается как М-концентрация. Этот показатель является характерным признаком для каждого вида бактерий;
• 4-я — фаза отмирания (логарифмической гибели), которая характеризуется преобладанием в популяции числа погибших клеток и прогрессивным снижением числа жизнеспособных клеток популяции.
Прекращение роста численности (размножения) популяции микроорганизмов наступает в связи с истощением питательной среды и/или накоплением в ней продуктов метаболизма микробных клеток. Поэтому, удаляя продукты метаболизма и/или заменяя питательную среду, регулируя переход микробной популяции из стационарной фазы в фазу отмирания, можно создать открытую биологическую систему, стремящуюся к устранению динамического равновесия на определенном уровне развития популяции. Такой процесс выращивания микроорганизмов называется проточным культивированием (непрерывная культура). Рост в непрерывной культуре позволяет получать большие массы бактерий при проточном культивировании в специальных устройствах (хемостатах и турбидистатах) и используется при производстве вакцин, а также в биотехнологии для получения различных биологически активных веществ, продуцируемых микроорганизмами.
Для изучения метаболических процессов на протяжении цикла клеточного деления возможно также использование синхронных культур. Синхронные культуры — культуры бактерий, все члены популяции которых находятся в одной фазе цикла. Это достигается с помощью специальных методов культивирования, однако через несколько одновременных делений синхронизированная клеточная суспензия постепенно снова переходит к асинхронному делению, так что число клеток увеличивается в дальнейшем уже не ступенчато, а непрерывно.
При культивировании на плотных питательных средах бактерии образуют колонии. Это — видимое невооруженным глазом скопление бактерий одного вида, являющееся чаще всего потомством одной клетки. Колонии бактерий разных видов отличаются:
Характер колоний — один из таксономических признаков бактерий.
3. Генетика бактерий
Важнейшим признаком живых организмов являются изменчивость и наследственность. Основу наследственного аппарата бактерий, как и всех других организмов, составляет ДНК (у РНК-содержащих вирусов — РНК).
Наряду с этим наследственный аппарат бактерий и возможности его изучения имеют ряд особенностей. Прежде всего, бактерии — гаплоидные организмы, т. е. они имеют одну хромосому. В связи с этим при наследовании признаков отсутствует явление доминантности. Бактерии обладают высокой скоростью размножения, в связи с чем за короткий промежуток времени (сутки) сменяется несколько десятков поколений бактерий. Это дает возможность изучать огромные по численности популяции и достаточно легко выявлять даже редкие по частоте мутации.
На бактериальной хромосоме располагаются отдельные гены. У кишечной палочки, например, их более 2 тысяч. Однако генотип (геном) бактерий представлен не только хромосомными генами. Функциональными единицами генома бактерий, кроме хромосомных генов являются IS-последовательности, транспозоны и плазмиды.

Обзор
Человеческая Т-клетка (синий), атакованная ВИЧ (желтый). Вирус ориентирован на Т-клетки, которые играют важную роль в иммунной реакции организма против вторжений, таких как бактерии и вирусы.
Автор
Редакторы

Вопрос о происхождении вирусов
Существует три основные теории возникновения вирусов:
Зарождение жизни. Идея последнего универсального общего предка: каким он мог бы быть и что ему предшествовало?

Рисунок 1. Схема трехдоменной классификации, предложенная Вёзе. В основании этой схемы должен находиться последний универсальный общий предок (англ. last universal common ancestor, LUCA).
Самый сильный аргумент в пользу существования LUCA — сохранившаяся общая система экспрессии генов (передачи наследственной информации от гена с образованием РНК или белков), одинаковая для всех живущих организмов. Все известные клеточные формы жизни используют один и тот же генетический код из 20 универсальных аминокислот и стоп-сигналов, закодированных в 64 кодонах (единицах генетического кода). Трансляция генетической информации в процессе синтеза белков по заданной матрице выполняется рибосомами, состоящими из трех универсальных молекул РНК и примерно 50 белков, из которых 20 так же одинаковы для всех организмов.
В 2010 году американский биохимик Даглас Теобальд математически проверил вероятность существования LUCA [6]. Он выбрал 23 белка, встречающихся у организмов из всех трех доменов, но имеющих разную структуру у различных видов. И исследовал эти белки у 12 различных видов (по четыре из каждого домена), после чего использовал компьютерное моделирование различных эволюционных сценариев, чтобы понять, при каком из них наблюдаемая картина будет наиболее вероятной. Оказалось, что концепция, включающая существование универсального предка, значительно вероятнее концепций, где его нет. Еще более вероятна модель, основанная на существовании общего предка, но допускающая обмен генами между видами [7].
Предположение о том, что LUCA был прокариотической клеткой, похожей на современные, часто принимается по умолчанию. Однако мембраны архей и бактерий имеют разное строение (рис. 2). Получается, что общий предок должен был обладать комбинаторной мембраной. Новая информация о мембранах LUCA появилась в 2012 году, когда несколько групп ученых подробно проанализировали историю генов всех ферментов биосинтеза компонентов липидов у бактерий, архей и эукариот [8].

Рисунок 2. Строение мембранных липидов бактерий (справа) и архей (слева)
Родственными у архей и бактерий оказались ферменты для синтеза терпеновых спиртов и пришивания полярных голов к спиртам. Значит, эти реакции мог проводить и LUCA. Проще всего было предположить, что липиды LUCA состояли из одного остатка терпенового спирта, остатка фосфата и полярной группы (серина или инозитола). Подобные липиды были синтезированы искусственно. Образующиеся из них мембраны обладают высокой подвижностью по сравнению с современными мембранами, хорошо пропускают ионы металлов и малые органические молекулы. Это могло позволять древним протоклеткам поглощать готовую органику из внешней среды даже без транспортных белков.
Реконструкции LUCA методами сравнительной геномики указывают на то, что это должен быть сложный организм без обширного ДНК-генома (геном, состоящий из нескольких сотен РНК-сегментов или ДНК провирусного типа). Но даже если считать возможность существования общего предка доказанной, остается загадкой, в какой среде он мог бы появиться.

Рисунок 3. Сценарий вирусного мира в гипотезе доклеточного происхождения вирусов подпись
Предполагается, что идеальные условия для формирования жизни существовали вблизи термальных геоисточников (морских или наземных) в виде сети неорганических ячеек, обеспечивающих градиенты температуры и рН, способствующих первичным реакциям, и предоставляющих универсальные каталитические поверхности для примитивной биохимии [10].
Эти отсеки могли быть населены разнородной популяцией генетических элементов. Вначале сегментами РНК. Затем более крупными и сложными молекулами РНК (один или несколько белок-кодирующих генов). А позднее и сегментами ДНК, которые постепенно увеличивались (рис. 3).
Такие простейшие генетические системы использовали неорганические соединения из раствора и продукты деятельности других генетических систем. Сначала они должны были подчиняться индивидуальному отбору ввиду большого разнообразия. Но ясно, что важным фактором такого отбора была способность передавать генетическую информацию, то есть, копировать себя. Присутствие одновременно в одной ячейке молекул, способных копировать РНК, кодировать полезные белки и управлять синтезом новых молекул, давало больше шансов выживать в каждой отдельной ячейке. И в такой системе рано или поздно должны были появиться паразитирующие элементы. А если это так, то вирусные элементы стоят у самых истоков эволюции [11].
Возникновение паразитов — неизбежное последствие эволюционного процесса

Рисунок 4. Схематическое представление структуры модели эволюции РНК-подобной системы. На втором этапе цепочки последовательностей начинают соединяться комплементарными связями сами с собой. В результате у двух видов (cat-C и cat-A) возникает вторичная структура молекулы, которая обладает каталитическим свойством. Она ускоряет собственную репликацию (или репликацию несвернувшихся соседей). Два вида при этом приобретают паразитические свойства (par-G и par-U). Пояснения в тексте.
Таким образом, паразитарные репликаторы способствуют эволюции разнообразия, вместо того, чтобы мешать этому разнообразию. Это также делает существующую систему репликатора чрезвычайно стабильной при эволюции паразитов.
Согласно гипотезе Черной Королевы, чтобы поддержать свое существование в постоянно эволюционирующем мире, вид должен реагировать на эти эволюционные изменения и должным образом приспосабливаться к среде. Поэтому, если мы говорим о вирусах как о паразитах, мы обязаны представлять себе взаимоотношения вируса с хозяином. В борьбе с вирусом хозяева развивают новые защитные механизмы, а паразиты отвечают, развивая механизмы для атаки и взлома защиты. Этот процесс может длиться бесконечно либо до вымирания одной из противоборствующих сторон. Так множественные системы защиты составляют существенную часть геномов всех клеточных организмов, а взлом защиты — одна из основных функций генов у вирусов с большими геномами .
Механизмы клеточной защиты против вирусов
Механизмы защиты от вирусов стандартны, поскольку все вирусы уникальны, и приспособиться к каждому не представляется возможным. Это такие механизмы как:
- Деградация РНК (вирусных и клеточных) — РНК-интерференция;
- Угнетение синтеза белков (вирусных и клеточных);
- Ликвидация зараженных клеток — апоптоз (программируемая клеточная смерть);
- Воспаление.
Получается, что клетка борется с вирусом, нарушая собственные обмен веществ и/или структуру. Защитные реакции клетки — это в основном самоповреждающие механизмы.
Вирус заражает конкретную клетку потому, что его механизмы нападения направлены именно против данного типа клеток. Это такие механизмы как:
- Угнетение синтеза клеточной РНК;
- Угнетение синтеза клеточных белков;
- Нарушение клеточной инфраструктуры и транспорта;
- Подавление/включение апоптоза и других видов клеточной смерти.
Схемы защитных приемов клетки и противозащиты вирусов во многом идентичны. Вирусы и клетки применяют одни и те же приемы. Для подавления синтеза вирусных белков клетка использует интерферон, а чтобы подавить образование интерферона, вирус угнетает синтез белков.
Поскольку узнавание вируса неспецифическое, клетка не может знать намерения конкретного вируса. Она может бороться с вирусом лишь стандартными приемами, поэтому ее оборонные действия часто могут быть чрезмерными.
Понятие о вирусном геноме, типы вирусных генов, концепция генов-сигнатур
В исследовании, проведенном вирусологом Евгением Куниным и его коллегами [16], анализ последовательностей вирусных геномов выявил несколько категорий вирусных генов, принципиально отличающихся по происхождению. Можно обсуждать, какая степень дробности классификации оптимальна, но четко различаются пять классов, укладывающихся в две более крупные категории.
Гены с четко опознаваемыми гомологами у клеточных форм жизни:
- Гены, присутствующие у узких групп вирусов (обычно это гены, гомологичные генам хозяев этих вирусов).
- Гены, консервативные среди большой группы вирусов или даже нескольких групп и имеющие относительно отдаленные клеточные гомологи.
Таким образом, отличительные особенности генов-сигнатур:
- Происхождение из первичного пула генов;
- Наличие лишь очень отдаленных гомологов среди генов клеточных форм жизни, из чего можно сделать вывод, что они никогда не входили в геномы клеточных форм;
- Необходимость для репродукции вирусов.
Из всего вышесказанного следует, что эти гены переходили от вируса к вирусу (или к элементу, подобному вирусу) на протяжении четырех миллиардов лет эволюции жизни, а вирусные геномы появились благодаря перемешиванию и подгонке друг к другу генов в гигантской генетической сети, которую представляет собой мир вирусов. Многочисленные гены клеточных форм жизни также пронизывают эту сеть, прежде всего благодаря геномам крупных вирусов, таких как NCDLV и крупным бактериофагам, которые позаимствовали множество генов от своих хозяев на разных этапах эволюции. Однако большинство заимствованных генов сами по себе не критичны для репликации и экспрессии вирусного генома (исключая некоторые случаи возможного неортологичного замещения генов-сигнатур); обычно эти гены участвуют во взаимодействии между вирусом и хозяином. Таким образом, несмотря на интенсивный взаимообмен генами с хозяевами, вирусы всегда происходят от других вирусов.
Вирусы, встроенные в геном, и горизонтальный перенос генов
В процессе эволюции многие вирусы встроились в геномы клеточных форм жизни путем горизонтального переноса генов (ГПГ). Впервые горизонтальный перенос был описан в 1959 году, когда ученые продемонстрировали передачу резистентности к антибиотикам между разными видами бактерий. В 1999 году Рави Джайн, Мария Ривера и Джеймс Лейк в своей статье писали о произошедшей значительной передаче генов между прокариотами [17]. Этот процесс, по-видимому, оказал некоторое влияние также и на одноклеточные эукариоты. В 2004 году Карл Вёзе опубликовал статью, в которой утверждал, что между древними группами живых организмов происходил массивный перенос генетической информации. В древнейшие времена преобладал процесс, который он называет горизонтальным переносом генов. Причем, чем дальше в прошлое, тем это преобладание сильнее [18].
Горизонтальный перенос генов — процесс, в котором организм передаёт генетический материал другому организму, не являющемуся его потомком. Горизонтальная передача генов реализуется через различные каналы генетической коммуникации — процессы конъюгации, трансдукции, трансформации, переноса генов в составе плазмидных векторов, вирусов, мобильных генетических элементов (МГЭ).
Трансдукция — перенос бактериофагом (агентами переноса генов, АПГ) в заражаемую клетку фрагментов генетического материала клетки, исходно содержавшей бактериофаг [19]. Такой бактериофаг обычно переносит лишь небольшой фрагмент ДНК хозяина от одной клетки (донор) к другой (реципиент). В зависимости от типа трансдукции — неспецифической (общей), специфической или абортивной, геном фага или хозяина-бактерии может быть изменен тем или иным образом:
- При неспецифической трансдукции (рис. 5) ДНК клетки-хозяина включаются в частицу фага (дополнительно к его собственному геному или вместо него);
- При специфической трансдукции гены фага замещаются генами хозяина;
- При абортивной трансдукции внесённый фрагмент ДНК донора не встраивается в ДНК хозяина-реципиента, а остаётся в цитоплазме и не реплицируется. Это приводит к тому, что при клеточном делении он передаётся только одной из дочерних клеток и затем теряется в потомстве.

Рисунок 5. Схема общей трансдукции
Наиболее известным примером специфической трансдукции служит трансдукция, осуществляемая фагом λ. Поскольку этот фаг при переходе в состояние профага включается в хромосому бактерий между генами, кодирующими синтез галактозы и биотина, именно эти гены он может переносить при трансдукции.
Вот несколько примеров важных эволюционных событий, связанных с молекулярным одомашниванием:
- Ферменты теломеразы, служащие для восстановления концевых участков хромосом, возможно, ведут свое происхождение от обратных транскриптаз, кодируемых ретровирусами и ретротранспозонами [22];
- Белки RAG, играющие ключевую роль в системе адаптивного иммунитета, по-видимому, происходят от прирученных транспозаз — ферментов, кодируемых транспозонами;
- Ген Peg10, необходимый для развития плаценты, был позаимствован древними млекопитающими у ретротранспозона (рис. 6) [23].

Рисунок 6. Роль гена Peg10 в эмбриональном развитии. Ученые под руководством Рюичи Оно из Токийского медицинского университета Японии показали, что у мышей с выключенным геном Peg10 нарушается развитие плаценты, от чего эмбрион погибает через 10 дней после зачатия [24].
В 2008 году в ходе целенаправленного поиска неиспорченных вирусных генов в геноме человека исследователи нашли два очень похожих друг на друга ретровирусных гена (их назвали ENVV1 и ENVV2), которые, по всей видимости, находятся в рабочем состоянии [25]. Это гены белков оболочки ретровируса. Каждый из них входит в состав своего эндогенного ретровируса (ЭРВ), причем все остальные части этих ЭРВ давно не функционируют.
Вирусные гены ENVV1 и ENVV2 у человека и обезьян работают в плаценте и, скорее всего, выполняют следующие функции:
Таким образом, как минимум три полезных применения нашли себе вирусные гены в плаценте приматов. Это показывает, что генетические модификации, которым ретровирусы подвергают организмы, в долгосрочной перспективе могут оказаться полезными или даже определить развитие вида. И с учетом всего вышесказанного древо доменов должно выглядеть как на схеме ниже (рис. 7).

Рисунок 7. Горизонтальный перенос генов в рамках трехдоменного дерева
Заключение
Возникновение паразитов — обязательная черта эволюционирующих систем репликаторов, а соревнование хозяев и паразитов движет эволюцию тех и других. Любой организм является результатом миллионов лет борьбы клеток с невероятно разнообразным миром вирусов. Их действия и их эволюция пронизывают всю историю клеточной эволюции, и сейчас меняется само наше представление о них. Когда-то вирусы считали деградировавшими клетками, но чем больше мы узнаем о вирусах, тем очевиднее, что их роль в общей эволюции значительна. И невероятно много нам еще предстоит узнать.
Читайте также:

