Где применяют альдегиды перечислить кратко
Обновлено: 30.06.2024
Альдегиды – органические вещества, относящиеся к классу карбонильных соединений, содержащих в своем составе функциональную группу –СН = О, которая называется карбонильной.
Общая формула предельных альдегидов и кетонов CnH2nO. В названии альдегидов присутствует суффикс –аль.
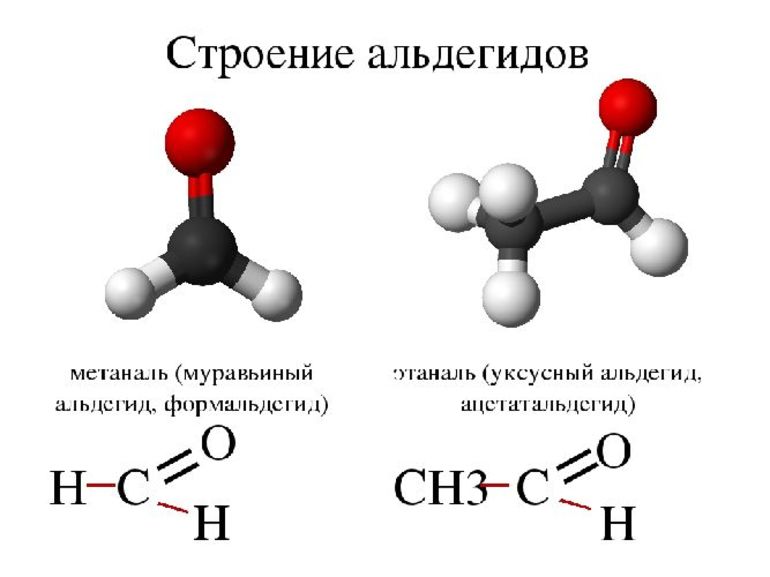
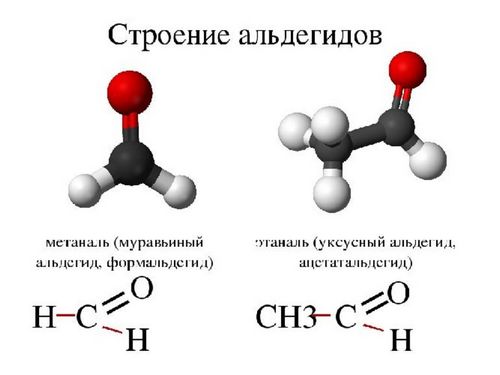
Простейшие представители альдегидов – формальдегид (муравьиный альдегид) –СН2 = О, ацетальдегид (уксусный альдегид) – СН3-СН = О. Существуют циклические альдегиды, например, циклогексан-карбальдегид; ароматические альдегиды имеют тривиальные названия – бензальдегид, ванилин.
Атом углерода в карбонильной группе находится в состоянии sp 2 -гибридизации и образует 3σ-связи (две связи С-Н и одну связь С-О). π-связь образована р-электронами атомов углерода и кислорода. Двойная связь С = О является сочетанием σ- и π-связей. Электронная плотность смещена в сторону атома кислорода.
Для альдегидов характерна изомерия углеродного скелета, а также межклассовая изомерия с кетонами:
Химические свойства альдегидов
В молекулах альдегидов имеется несколько реакционных центров: электрофильный центр (карбонильный атом углерода), участвующий в реакциях нуклеофильного присоединения; основный центр – атом кислорода с неподеленными электронными парами; α-СН кислотный центр, отвечающий за реакции конденсации; связь С-Н, разрывающаяся в реакциях окисления.
1. Реакции присоединения:
— воды с образованием гем-диолов
— спиртов с образованием полуацеталей
— тиолов с образованием дитиоацеталей (в кислой среде)
— гидросульфита натрия с образованием α-гидроксисульфонатов натрия
— аминов с образованием N-замещенных иминов (основания Шиффа)
— гидразинов с образованием гидразонов
— циановодородной кислоты с образованием нитрилов
— восстановление. При взаимодействии альдегидов с водородом получаются первичные спирты:
R-CH = O + Ag2O → R-CO-OH + 2Ag↓;
— окисление альдегидов гидроксидом меди (II), в результате которого выпадает осадок оксида меди (I) красного цвета
Эти реакции являются качественными реакциями на альдегиды.
Физические свойства альдегидов
Первый представитель гомологического ряда альдегидов – формальдегид (муравьиный альдегид) – газообразное вещество (н.у.), альдегиды неразветвленного строения и состава С2-С12 – жидкости, С13 и длиннее – твердые вещества. Чем больше атомов углерода входит в состав неразветвленного альдегида, тем выше его температура кипения. С увеличением молекулярной массы альдегидов увеличиваются значения величин их вязкости, плотности и показателя преломления. Формальдегид и ацетальдегид способны смешиваться с водой в неограниченных количествах, однако, с ростом углеводородной цепи эта способность альдегидов снижается. Низшие альдегиды обладают резким запахом.
Получение альдегидов
Основные способы получения альдегидов:
![]()
С и давлении 300 атм
— гидратация алкинов. Взаимодействие алкинов с водой происходит в присутствии солей ртути (II) и в кислой среде:
— окисление первичных спиртов (реакция протекает при нагревании)
Применение альдегидов
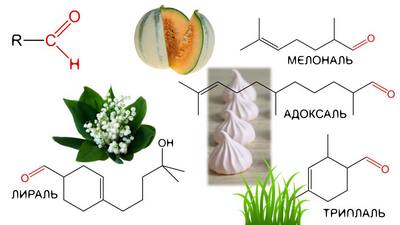
Альдегиды нашли широкое применение в качестве сырья для синтеза различных продуктов. Так, из формальдегида (крупнотоннажное производство) получают различные смолы (фенол-формальдегидные и т.д.), лекарственные препараты (уротропин); ацетальдегид — сырье для синтеза уксусной кислоты, этанола, различных производных пиридина и т.д. Многие альдегиды (масляный, коричный и др.) используют в качестве ингредиентов в парфюмерии.
Примеры решения задач
| Задание | Бромированием СnH2n+2получили 9,5 г монобромида, который при обработке разбавленным раствором NaOH превратился в кислородсодержащее соединение. Пары его с воздухом пропущены над раскаленной медной сеткой. При обработке образовавшегося при этом нового газообразного вещества избытком аммиачного раствора Ag2O выделилось 43,2 г осадка. Какой углеводород был взят и в каком количестве, если выход на стадии бромирования 50%, остальные реакции протекают количественно. |
| Решение | Запишем уравнения всех протекающих реакций: |
R-CH = O + Ag2O → R-CO-OH + 2Ag↓.
Осадок выделившийся в последней реакции – это серебро, следовательно, можно найти количество вещества выделившегося серебра:
v(Ag) = m/M = 43,2/108 = 0,4 моль.
По условию задачи, после пропускания вещества полученного в реакции 2 над раскаленной металлической сеткой образовался газ, а единственный газ –альдегид – это метаналь, следовательно, исходное вещество – это метан.
Количество вещества бромметана:
v(CH3Br) = m/M = 9,5/95 = 0,1 моль.
Тогда, количество вещества метана, необходимое для 50% выхода бромметана – 0,2 моль. М(CH4) = 16 г/моль. Следовательно масса и объем метана:
| Задание | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: бутен-1 → 1-бромбутан + NaOH → А – Н2 → В + [Ag(NH3)2]OH → С + HCl → D. |
| Решение | Для получения 1-бромбутана из бутена-1 необходимо провести реакцию гидробромирования в присутствии пероксидных соединений R2O2 (реакция протекает против правила Марковникова): |
При взаимодействии с водным раствором щелочи 1-бромбутан подвергается гидролизу с образованием бутанола-1 (А):
Бутанол-1 при дегидрировании образует альдегид – бутаналь (В):
Аммиачный раствор оксида серебра окисляет бутаналь до аммонийной соли – бутирата аммония (С):
Бутират аммония при взаимодействии с соляной кислотой образует масляную (бутановую) кислоту (D):
Любой представитель класса органических соединений, в котором углерод имеет двойную связь с кислородом, одинарную с водородом или другим атомом, обозначающимся R в структурных схемах, называется альдегидом. Многие из этих веществ имеют приятные запахи, и, в принципе, их получают довольно просто — из спиртов путём дегидрирования для того, чтобы использовать в различных промышленных целях.
Полезно знать
- витамина А — важный для человеческого зрения;
- пиридоксальфосфат — одна из форм витамина В6;
- глюкозы и других редуцированных сахаров;
- некоторых природных и синтетических гормонов.
Когда кислород образует двойную связь с углеродом, получается карбонильная функциональная группа (КГ) — СНО. Такое сочетание даёт широкий спектр функциональных возможностей.
Структура и номенклатура
В формальдегиде, простейшем альдегиде, молекула связана с двумя атомами водорода, а во всех других с одной. Его формула — HCHO, а, например, ацетальдегид выглядит как CH3CHO. Углерод, связанный с КГ, может быть частью алкильных или неалкильных групп, или они могут быть ациклическими, ароматическими или гетероциклическими кольцами. Органические соединения с двумя альдегидными группами — диальдегиды. Существует два основных способа именования альдегидов. Первый — основан на системе, используемой Международным союзом теоретической и прикладной химии, и его часто называют систематической номенклатурой. Этот метод предполагает самую длинную цепь атомов углерода, которая содержит карбонильную группу в качестве исходного алкана. При этом не принято использовать числовое определение КГ, поскольку она всегда находится в конце родительской цепи. Например, название может быть 2-метилбутаналь, или изомасляный альдегид будет указан как 2-метилпропаналь.
- по нормам Международного союза соединение будет называться — 2-пропеналь;
- по общей номенклатуре — акролеин (название происходит от акриловой кислоты, родительской карбоновой группы).
К альдегидам относят, например, формальдегид — СН2О (метаналь, муравьиный альдегид), ацетальдегид — C2H4O (этаналь, уксусный альдегид), пропионовый альдегид (пропаналь), бутиральдегид (бутаналь), пентаналь или валериановый альдегид и другие.
Отличительные свойства
Единственное структурное различие между углеводородами и альдегидами заключается в наличии у последней КГ, которая и несёт ответственность за различие в свойствах, как физических, так и химических. Карбонильная группа изначально полярна, то есть электроны, составляющие связь C=O, притягиваются ближе к кислороду, чем к углероду. Это даёт первому частичный отрицательный заряд, а второму — положительный. Важные физические свойства:
- Температуры плавления и кипения карбонилсодержащих соединений значительно выше, чем у тех, что состоят только из углерода и водорода. Например, бутан (CH3CH2CH2CH3), пропаналь (CH3CH2CHO) и ацетон (CH3COCH3) имеют одинаковую молекулярную массу, но углеводородный бутан закипает уже при 0 градусов Цельсия, тогда как ацетон только при +56. Ацетальдегид кипит при комнатной температуре, валериановый — при +100,4 градусах Цельсия, а изовалериановый — при +92,5. Другие альдегиды, за исключением высокомолекулярных, в обычных условиях представляют собой жидкости.
- Углеводороды нерастворимы в воде, потому что водные молекулы полярны. Однако альдегиды с менее чем примерно пятью атомами углерода могут растворяться, но углеводородная часть их молекул выше этого числа делает их нерастворимыми.
Промышленное производство
Поскольку эти вещества являются важными строительными блоками в органической химии, они используются для синтеза многих других соединений, поэтому есть много способов их получения.
Гидроформилирование является более важным методом для коммерческого применения, где он известен как оксопроцесс, чем для лабораторных синтезов. Оксоальдегиды сами по себе не имеют большого значения в качестве конечных продуктов. Обычно они восстанавливаются до спиртов или окисляются до карбоновых кислот. Оксоспирты используются как сырьё для синтеза моющих средств и текстильных волокон. Оксокарбоновые кислоты превращаются в сложные эфиры и применяются как промышленные или лабораторные растворители.
Где и как используются альдегиды

Сотни отдельных альдегидных соединений ежедневно используются химиками для синтеза других веществ, но они менее важны в промышленном производстве, то есть в масштабе тонн. Только формальдегид широко используется во всём мире, что определяется общим объёмом используемого химического вещества в год. Получают его путём окисления метанола. В итоге соединение представляет собой газ, но обычно его применяют в виде 37% водного раствора, называемого формалином. Используют его для дубления, консервации и бальзамирования, а также как бактерицидное, фунгицидное и инсектицидного средства для обработки растений. Но наибольшее его применение относится к производству некоторых полимерных материалов. Например, синтетическая смола бакелит образуется во время реакции между формальдегидом и фенолом. Это не просто линейная цепочка, а целая трёхмерная структура. Такие полимеры используются не только как пластмассы, но и чаще всего из них делают клей и различные покрытия. Например, фанера состоит из тонких слоёв дерева, склеенных одним из таких соединений.
Другие альдегиды промышленного значения в основном используют в качестве растворителей, отдушек, ароматизаторов. Они также являются промежуточными продуктами при изготовлении пластмасс, красителей и фармацевтических препаратов. Это паральдегид, гексаналь, гексилкоричный и ортофталевый альдегиды.
- бензальдегид — обеспечивает запах и вкус миндального ореха;
- коричный альдегид, или масло корицы;
- ванилин — основной ароматизатор ванильных бобов.
- Углеводы, включая сахара, крахмал и целлюлозу, которые основаны на соединениях, обладающих альдегидной или кетонной группой наряду с гидроксильной.
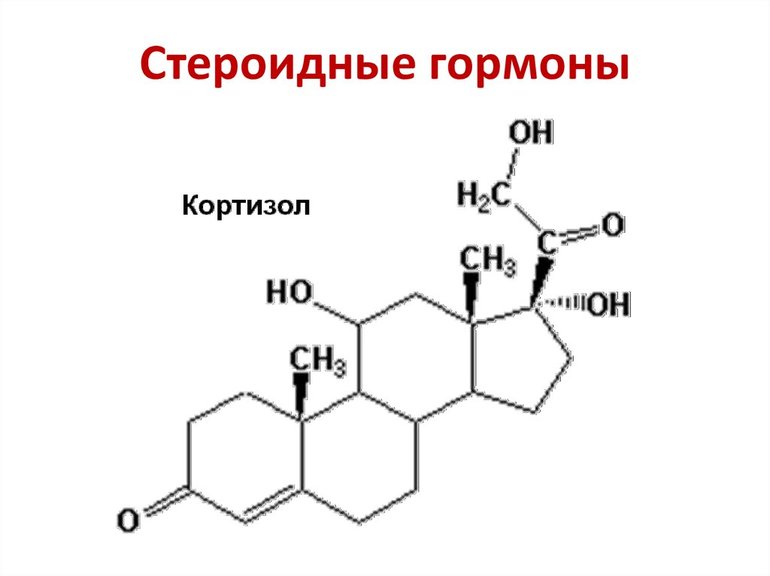
- Стероидные гормоны, многие из которых, в том числе прогестерон, тестостерон, кортизон и альдостерон, являются кетонами.
- Ретиналь альдегид, который после объединения с белком в сетчатке глаза, образующего родопсин, является основным соединением, участвующим в процессе зрения.
Воздействие на человека
Очевидно, что не все альдегидные соединения являются безопасными. Например, ацетальдегид — его молекулы всегда в низких концентрациях циркулируют в человеческой крови. Это вещество — канцероген и может нанести вред организму, а его продолжительное воздействие способно привести к раку и другим тяжёлым системным заболеваниям. Нужно сказать, что ацетальдегид вырабатывается в теле человека в ходе физиологических процессов, но здоровая печень в силах расщепить это вещество до безопасных соединений. Недостаток ацетальдегиддегидрогеназы (специального фермента) приводит к накоплению альдегидов и увеличивает риск развития онкопатологий пищеварительной системы. Внешние источники ацетальдегида:


В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Альдегиды. Свойства. Получение. Применение"
Альдегиды. Свойства. Получение и применение
Каждый из вас может представить себе запах гиацинтов. Этот аромат обусловлен наличием альдегида, который так и называют – гиацинтовый. А что же представляют собой альдегиды?

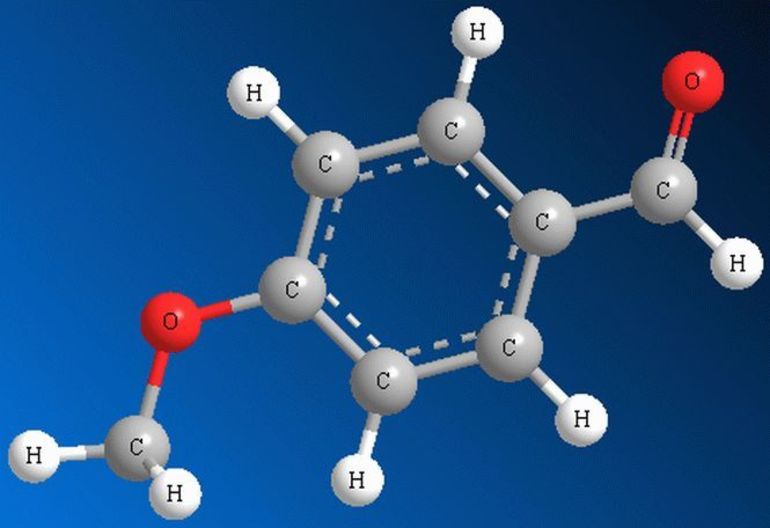
Альдегиды – это производные углеводородов, в молекулах которых атом водорода замещён на группу ― CHО. Эта группа называется альдегидной и для альдегидов она является функциональной, то есть определяет принадлежность к данному классу соединений.
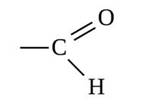
Общая формула альдегидов R – CHO, где R – углеводородный заместитель или атом водорода. Кроме этого, использую ещё и общую формулу CnH2nO, которая отражает молекулярный состав альдегидов, или такую формулу, как CnH2n+1CHO.

Первым представителем альдегидов является метаналь – HCHO или формальдегид, вторым альдегидом является этаналь – CH3 – CHO, или ацетальдегид, третьим представителем – пропаналь, или пропионовый альдегид – CH3 – CH2 – CHO.
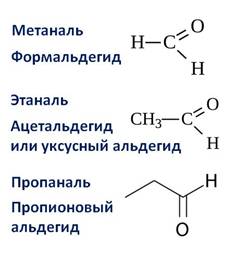
Названия альдегидов образуются от названий соответствующих алканов с добавлением суффикса –аль.

Метаналь при н.у. является бесцветным газом.
Альдегиды, у который от двух до двенадцати атомов углерода – жидкости, у которых больше атомов углерода – твёрдые вещества. Низшие альдегиды имеют резкий запах, у альдегидов, которые имеют от четырех до шести атомов углерода, неприятный запах, высшие альдегиды обладают цветочными запахами. Низшие альдегиды хорошо растворяются в воде. Сорока процентный раствор метаналя называют формалином. С увеличением молярной массы альдегидов их растворимость в воде уменьшается. Температуры кипения и плавления альдегидов с увеличением молярной массы возрастают.
Альдегиды – химически активные соединения, для которых характерны реакции присоединения по связи С=О и окисления по связи С–Н в альдегидной группе.
Например, при пропускании паров этаналя вместе с водородом над катализатором происходит присоединение водорода и образуется спирт этанол
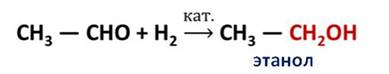
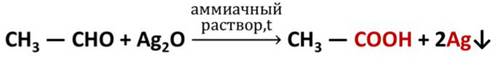
Если приготовить гидроксид меди (II) смешением растворов гидроксида натрия и сульфата меди (II), а затем к этому свежеприготовленному осадку гидроксида меди (II) прилить раствор этаналя и смесь нагреть, то происходит окисление альдегида до кислоты, а гидроксид меди (II) превращается в оксид меди (I) красного цвета. Эта реакция также используется для качественного обнаружения альдегидов.
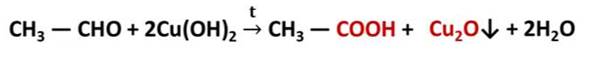
В лаборатории альдегиды получают окислением спиртов, в качестве окислителя используют оксид меди (II).
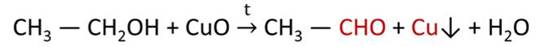
В промышленности метаналь получают окислением метанола кислородом воздуха в присутствии медного или серебряного катализатора:
Этаналь был выделен в лаборатории немецким химиком Ю. Либихом в 1835 году, а метаналь был получен в лаборатории немецким химиком А. Гофманом в 1868 году.


Основное количество получаемого в промышленности метаналя расходуется на производство фенолформальдегидных смол и пластмасс, полиформальдегид используют для изготовления плёнок и волокон, метаналь применяют при производстве некоторых лекарственных веществ, в частности уротропина. Метаналь используется для получения формалина, который обладает сильными дезинфицирующими свойствами, поэтому его применяют для дезинфекции и дубления кож, хранения анатомических препаратов, в сельском хозяйстве – для протравливания семян. Этаналь используют в промышленных масштабах для получения уксусной кислоты и её производных.
Таким образом, альдегиды – производные углеводородов, у которых атом водорода замещён на альдегидную группу. Общая формула альдегидов – CnH2n+1CHO. Для альдегидов характерны реакции присоединения по двойной связи и окисления по связи С–Н в альдегидной группе. К основным промышленным способам получения альдегидов относят окисление спиртов. Метаналь и этаналь используют во многих отраслях производства.
Альдегиды представляют собой органические соединения, в которых углерод имеет двойную связь с кислородом и одинарную с водородом либо атомом, который имеет обозначение R в структурных схемах. Многие из альдегидов обладают приятным запахом, вследствие чего находят активное применение в разных промышленных целях. Получают альдегиды из спиртов путем их дегидрирования. Об их физических и химических свойствах, применении и получении наша сегодняшняя статья.
Химические свойства
Практически все альдегиды способны вступать в разнообразные химические реакции, включая полимеризацию. Сочетание их с другими видами молекул ведет к созданию так званных конденсационных полимеров, которые активно используются, например, при производстве пластмассы, в качестве растворителей и парфюмерных ингредиентов.
А некоторые альдегиды даже принимают активное участие в физиологических процессах, так они являются частью:
- витамина А, очень важного для зрения,
- пиридоксальфосфата – одной из форм витамина В6,
- глюкозы и прочих редуцированных сахаров,
- некоторых природных и синтетических гормонов.
Важным отличием альдегидов от тех же углеродов является наличие у них карбонильной группы. Карбонильная группа эта изначально полярна, то есть электроны образующие связь С=О притягиваются больше к кислороду, нежели к углероду. Благодаря этому первый из электронов получает отрицательный заряд, а второй положительный.
Также стоит заметить, что альдегиды имеют более высокий дипольный момент по сравнению с остальными углеводородными соединениями.
Физические свойства
Температура кипения альдегидов и их плавления гораздо выше у карбонилсодержащих соединений, нежели у просто состоящих из углерода и водорода. К примеру, бутан и ацетон имея одинаковую молекулярную массу, закипают очень по разному: бутан закипает уже при 0 С, в то время как ацетону для кипения необходимо уже +56 С.
В отличие от углеводородов альдегиды способны растворятся в воде, но не все, а только имеющие менее пяти атомов углерода в молекуле. Но если углеводородная часть их молекул выше этого числа, это делает их нерастворимыми в воде.
Структура
Формальгид – простейший альдегид, имеет молекулу, связанную с двумя атомами водорода. У всех других альдегидов молекулы связаны лишь с одним атомом водорода.
Углерод, связанный с карбонильной группой может быть частью алкильных либо неалкильных групп, они в свою очередь могут быть ациклическими, ароматическими или гетероциклическими кольцами. Органические соединения, обладающие двумя альдегидными группами называются диальдегидами.
Номенклатура
Есть два способа наименования альдегидов. Один из них основан на системе, разработанной Международным союзом теоретической и прикладной химии, его еще называют систематической номенклатурой. Он предполагает использовать в качестве исходного алкана самую длинную цепь атомов углерода, содержащую карбонильную группу в качестве исходного алкана. Числовое определение исходной карбонильной группы при этом использовать не принято, так как она всегда находится в конце родительской цепи. Например, название может быть 2-метилбутаналь, или изомасляный альдегид будет указан как 2-метилпропаналь.
Другой метод представляет собой общую номенклатуру. Принцип общей номенклатуры заключается в том, чтобы называть соединения по общему наименованию соответствующей карбоновой кислоты. Иными словами структура та же, что и у альдегида, только вместо CHO появляется COOH, как у уксусной кислоты — CH3COOH или C2H4O2.
Производство
Так как альдегиды одни из ключевых строительных блоков органической химии, то не удивительно, что для их получения и производства существует множество разных методов:
- Окисление. Представляет собой один из основных методов для получения альдегидов. Обычно спирты могут быть окислены до состояния альдегидов. Для этого первичный спирт пропускается через горячий катализатор (гидроксид меди) или через аммиачный раствор оксида серебра (так званая реакция серебряного зеркала). Увы, но этот способ не подходит для маленьких лабораторий.
- Гидроформилирование – еще один способ для получения альдегидов, когда алкены обрабатываются монооксидом углерода, водородом и катализатором на основе переходного металла.
- Один из альдегидов (ацетальдегид) может быть получены путем взаимодействия ацетилена с водой.
Для коммерческого получения альдегидов чаще всего применяют гидроформилирование.

Практическое применение
Альдегиды находят многообразное применение в разных сферах человеческой жизни. Сотни их соединений используются химиками для синтеза других веществ. Например, благодаря формальдегиду мы получаем формалин, который в свою очередь активно применяется для дубления, консервации и бальзамирования, а также в качестве фунгицидного и бактериального средства для обработки растений.
Альдегиды, имеющие высокую молекулярную массу (к примеру, бензальдегид и фенилацетальдегид) обладают приятным запахом и поэтому используются в парфюмерии при производстве духов.
Читайте также:

