Физические свойства углерода кратко
Обновлено: 05.07.2024
№ 6 Углерод
Углерод известен с глубокой древности. В 1778 К. Шееле, нагревая графит с селитрой, обнаружил, что при этом, как и при нагревании угля с селитрой, выделяется углекислый газ. Химический состав алмаза был установлен в результате опытов А.Лавуазье (1772) по изучения горения алмаза на воздухе и исследований С.Теннанта (1797), доказавшего, что одинаковые количества алмаза и угля дают при окислении равные количества углекислого газа. Углерод как химический элемент был признан только в 1789 А.Лавуазье. В начале XIX в. старое слово уголь в русской химической литературе иногда заменялось словом "углетвор" (Шерер, 1807; Севергин, 1815); с 1824 г. Соловьев ввел название углерод. Латинское название сarboneum углерод получил от сarbo — уголь.
Получение:
Неполное сжигание метана : СН4 + О2 = С + 2Н2О (сажа);
Сухая перегонка древесины, каменного угля (древесный уголь, кокс).
Физические свойства:
Известны несколько кристаллических модификаций углерода: графит,алмаз, карбин, графен.
Графит - серо-черная, непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая масса с металлическим блеском. При комнатной температуре и нормальном давлении (0,1 Мн/м 2 , или 1кгс/см 2 ) графит термодинамически стабилен. При атмосферном давлении и температуре около 3700°С графит возгоняется. Жидкий углерод может быть получен при давлении выше 10,5 Мн/м 2 (1051 кгс/см2) и температурах выше 3700°С. Cтруктура мелкокристаллического графита лежит в основе строения "аморфного" углерода, который не представляет собой самостоятельной модификации (кокс, сажа, древесный уголь). Нагревание некоторых разновидностей "аморфного" углерода выше 1500-1600°С без доступа воздуха вызывает их превращение в графит. Физические свойства "аморфного" углерода очень сильно зависят от дисперсности частиц и наличия примесей. Плотность, теплоемкость, теплопроводность и электропроводность "аморфного" углерода всегда выше, чем графита.
Алмаз - очень твердое, кристаллическое вещество. Кристаллы имеют кубическую гранецентрированную решетку: а=3,560. При комнатной температуре и нормальном давлении алмаз метастабилен. Заметное превращение алмаза в графит наблюдается при температурах выше 1400°С в вакууме или в инертной атмосфере.
Карбин получен искусственно. Он представляет собой мелкокристаллический порошок черного цвета (плотность 1,9 - 2 г/см 3 ). Построен из длинных цепочек атомов С, уложенных параллельно друг другу.
Графен - мономолекулярный слой (слой, толщиной в одну молекулу) атомов углерода, которые плотно упакованы в двухмерную решетку, по форме напоминающую пчелиные соты. Графен был впервые получен и исследован Александром Геймом и Константином Новоселовым, которые стали за это открытие лауреатами Нобелевской премии по физике 2010 года.
Химические свойства:
Углерод малоактивен, на холоду реагирует только с F2 (образуя CF4). При нагревании реагирует со многими неметаллами и сложными веществами, проявляя восстановительные свойства:
CO2 + C = CO выше 900°С
2H2O + C = CO2 + H2 выше 1000°С или H2O + C = CO + H2 выше 1200°С
CuO + C = Cu + CO
HNO3 + 3C = 3 CO2 + 4 NO + 2 H2O
Слабые окислительные свойства проявляются в реакциях с металлами, водородом
Ca + С = CaС2 карбид кальция
Si + С = CSi карборунд
CaO + C = CaC2 + CO
Важнейшие соединения:
Оксиды СО, СО2
Угольная кислота Н2СО3, карбонаты кальция (мел, мрамор, кальцит, известняк),
Карбиды СаС2
Органические вещества , например углеводороды, белки, жиры
Применение:
Графит используется в карандашной промышленности, также исполузется как смазка при особо высоких или низких температурах. Алмаз используется в качестве абразивного материала, драгоценных камней в ювелирных украшениях . Алмазным напылением обладают шлифовальные насадки бормашин. В фармакологии и медицине используются соединения углерода — производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и др. Так, карболен (активированный уголь), применяется для абсорбции и выведения из организма различных токсинов; графит (в виде мазей) — для лечения кожных заболеваний; радиоактивные изотопы углерода — для научных исследований (радиоуглеродный анализ). Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ) — один из важнейших источников энергии для человечества.
Углерод – это один из самых важных химических элементов, без которого невозможна жизнь всех живых организмов. Он является основным компонентом всех органических соединений, которые поддерживают жизнь на Земле.
Положение углерода в периодической системе химических элементов
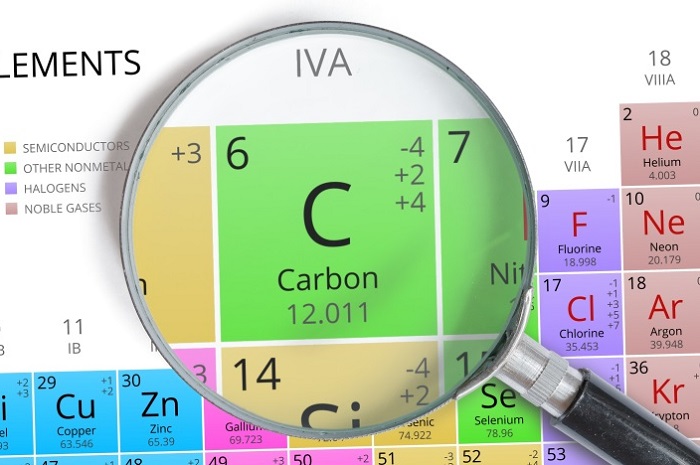
Кратко об углероде (С):
порядковый номер атома углерода – 6;
он расположен во втором периоде;
углерод занимает 4 группу, главную подгруппу (а).
Электронное строение углерода

У атома углерода всего два электронных уровня. На первом расположено 2 электрона, на втором – 4. Всего электронов 6, а значит, заряд ядра будет равен +6.
Атомная масса атома – 12.011.
Степень окисления углерода (-4; -2; 0; +2; +4) зависит от вещества, в котором он состоит.
Аллотропные модификации и физические свойства
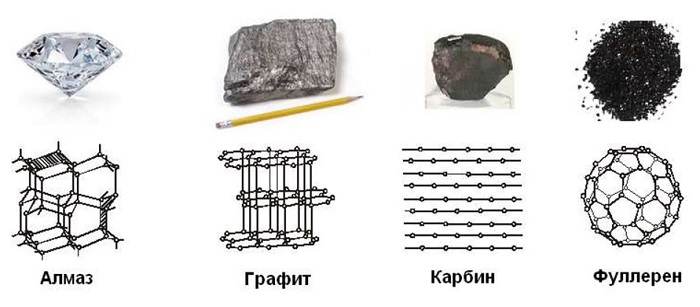
Рассмотрим 4 основные аллотропные модификации углерода, их формулы и физические свойства.
Алмаз (С)

Благодаря своей уникальной кристаллической решётке, алмаз считается самым твёрдым камнем на планете после корунда.
Из твёрдости алмаза следует ещё одно его важное физическое свойство – высокая плотность.
Алмаз отличается своей уникальной теплопроводностью, которая лидирует среди всех твёрдых тел. Кроме того, такая порода не проводит электричество.
Графит (С)

тёмный, ближе к чёрному цвет;
имеет сильно выраженный металлический блеск;
прозрачность проявляется в наименьшей степени;
имеет огромную температуру сгорания (38500 градусов по Цельсию);
температура плавления больше 3800 градусов по Цельсию:
теплопроводность 100 - 354 Вт.
Фуллерен (С60)

плотность 1,68 г/см 3 ;
температура плавления 1180 градусов по Цельсию;
не растворяется в воде (но растворим в бензоле);
плотность 1,69 г/см 3 ;
Карбин (CH3OH)
электропроводен (зависит от действия света: чем он больше, тем выше электропроводность);
плотность 1,9 -3,30 г/см 3 ;
высокая твёрдость и теплопроводность.
Качественные реакции
Цель проведения качественных реакций – выявление наличия нужного атома, вещества или иона.
Рассмотрим их подробнее:
Ca(OH)2 + CO2 = Ca(CO3) (осадок) + H2O – образование вещества, нерастворимого в воде, что свидетельствует о том, что в реакции присутствует углекислый газ.
CaCO3 + 2HCl = CaCl2 + H2O + CO2 – образование углекислого газа, что говорит о присутствии в реакции иона CO3 2- .
Соединения углерода

Углерод образует два оксида:
1. Оксид углерода (II) – CO. Другое название – угарный газ.
Характеристика: не имеет запаха и цвета. Опасен для жизни живых организмов. Молярная масса – 28,01 г/моль. Получают за счёт окисления углерода кислородом:
C + O2 = 2CO + Q (теплота).
Это кислотный оксид, которому соответствует угольная кислота. Молярная масса – 44,01 г/моль.
Карбиды – бесцветные вещества, имеющие форму кристаллов и содержащие в своём составе углерод. Примеры: SiC, Al3C4, CaC2, Cr3C2.
Органические соединения углерода:
углеводороды (алкины, алкены, алканы);
кислородосодержащие соединения (спирты, кислоты и альдегиды, кетоны);
азотосодержащие соединения (нитросоединения, амины, аминокислоты).
Химические свойства углерода
Углерод является и окислителем и восстановителем.

Восстановитель:
C 0 + 2CuO = 2Cu + C +4 O2
Углерод – это неметалл, т. е. принимает на внешний уровень недостающие атомы.
Таким образом, значение углерода в жизни всего живого очень велико. Его многочисленные уникальные свойства, различные модификации позволяют использовать углерод во множестве сфер промышленности.
Углерод (химический символ C) химический элемент 4-ой группы главной подгруппы 2-го периода периодической системы Менделеева, порядковый номер 6, атомная масса природной смеси изотопов 12,0107 г/моль.
История

Углерод в виде древесного угля применялся в глубокой древности для выплавки металлов. Издавна известны аллотропные модификации углерода— алмаз и графит. Элементарная природа углерода установлена А. Лавуазье в конце 1780-х годов.
Происхождение названия
Международное название: carbō — уголь.
Физические свойства
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Изотопы углерода
Природный углерод состоит из двух стабильных изотопов— 12 С (98,892%) и 13 С (1,108%) и одного радиоактивного изотопа 14 С (β-излучатель, Т½= 5730 лет), сосредоточенного в атмосфере и верхней части земной коры. Он постоянно образуется в нижних слоях стратосферы в результате воздействия нейтронов космического излучения на ядра азота по реакции: 14 N (n, p) 14 C, а также, с середины 1950-х годов, как техногенный продукт работы АЭС и в результате испытания водородных бомб.
На образовании и распаде 14 С основан метод радиоуглеродного датирования, широко применяющийся в четвертичной геологии и археологии.
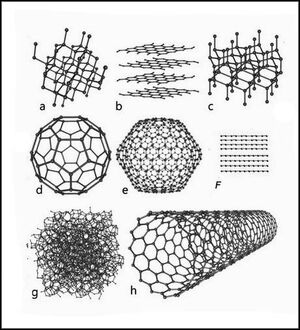
Аллотропные модификации углерода


Упрощенная фазовая диаграмма углерода, заштрихованы области где аллотропные модификации могут быть метастабильны. (diamond— алмаз, graphite— графит, liquid— жидкость, vapor— газ)


Схемы строения различных модификаций углерода
a: алмаз, b: графит, c: лонсдейлит
d: фуллерен— букибол C60, e: фуллерен C540, f: фуллерен C70
g: аморфный углерод, h: углеродная нанотрубка
уголь техуглерод сажа
Электронные орбитали атома углерода могут иметь различную геометрию, в зависимости от степени гибридизации его электронных орбиталей. Существует три основных геометрии атома углерода.
Тетраэдрическая — образуется при смешении одного s- и трех p-электронов (sp 3 -гибридизация). Атом углерода находится в центре тетраэдра, связан четырьмя эквивалентными σ-связями с атомами углерода или иными в вершинах тетраэдра. Такой геометрии атома углерода соответствуют аллотропные модификации углерода алмаз и лонсдейлит. Такой гибридизацией обладает углерод, например, в метане и других углеводородах.
Тригональная - образуется при смешении одной s- и двух p-электронных орбиталей (sp²-гибридизация). Атом углерода имеет три равноценные σ-связи, расположенные в одной плоскости под углом 120° друг к другу. Не участвующая в гибридизации p-орбиталь, расположенная перпендикулярно плоскости σ-связей, используется для образования π-связи с другими атомами. Такая геометрия углерода характерна для графита, фенола и др.
Дигональная — образуется при смешении одного s- и одного p-электронов (sp-гибридизация). При этом два электронных облака вытянуты вдоль одного направления и имеют вид несимметричных гантелей. Два других р-электрона дают π-связи. Углерод с такой геометрией атома образует особую аллотропную модификацию — карбин.
Графит и алмаз
Основные и хорошо изученные кристаллические модификации углерода— алмаз и графит. При нормальных условиях термодинамически устойчив только графит, а алмаз и другие формы метастабильны. При атмосферном давлении и температуре выше 1200 Kалмаз начинает переходить в графит, выше 2100 Kпревращение совершается за секунды. ΔН0 перехода— 1,898 кДж/моль. При нормальном давлении углерод сублимируется при 3780 K. Жидкий углерод существует только при определенном внешнем давлении. Тройные точки: графит-жидкость-пар Т =4130 K, р =10,7 МПа. Прямой переход графита в алмаз происходит при 3000 Kи давлении 11—12 ГПа.
При давлении свыше 60 ГПа предполагают образование весьма плотной модификации С III (плотность на 15—20% выше плотности алмаза), имеющей металлическую проводимость. При высоких давлениях и относительно низких температурах (ок. 1200 K) из высокоориентированного графита образуется гексагональная модификация углерода с кристаллической решеткой типа вюрцита— лонсдейлит (а =0,252 нм, с =0,412 нм, пространственная группа Р63/ттс), плотность 3,51 г/см³, то есть такая же, как у алмаза. Лонсдейлит найден также в метеоритах.
Ультрадисперсные алмазы (наноалмазы)
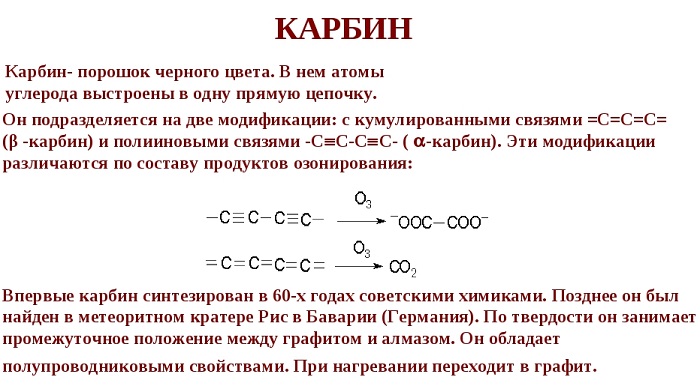
Карбин
Кристаллическая модификация углерода гексагональной сингонии с цепочечным строением молекул называется карбин. Цепи имеют либо полиеновое строение (—C≡C—), либо поликумуленовое (=C=C=). Известно несколько форм карбина, отличающихся числом атомов в элементарной ячейке, размерами ячеек и плотностью (2,68—3,30 г/см³). Карбин встречается в природе в виде минерала чаоита (белые прожилки и вкрапления в графите) и получен искусственно— окислительной дегидрополиконденсацией ацетилена, действием лазерного излучения на графит, из углеводородов или CCl4 в низкотемпературной плазме.
Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9-2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу.
Карбин— линейный полимер углерода. В молекуле карбина атомы углерода соединены в цепочки поочередно либо тройными и одинарными связями (полиеновое строение), либо постоянно двойными связями (поликумуленовое строение). Это вещество впервые получено советскими химиками В.В.Коршаком, А.М.Сладковым, В.И.Касаточкиным и Ю.П.Кудрявцевым в начале 60-х гг. в Институте элементоорганических соединений Академии наук СССР .Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение— в фотоэлементах.
Фуллерены и углеродные нанотрубки
Углерод известен также в виде кластерных частиц С60, С70, C80, C90, C100 и подобных (фуллерены), а также графенов и нанотрубок.
Аморфный углерод
В основе строения аморфного углерода лежит разупорядоченная структура монокристаллического (всегда содержит примеси) графита. Это кокс, бурые и каменные угли, техуглерод, сажа, активный уголь.
Нахождение в природе
Содержание углерода в земной коре 0,1% по массе. Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых— антрацит (94—97% С), бурые угли (64—80% С), каменные угли (76—95% С), горючие сланцы (56—78% С), нефть (82—87% С), горючих природных газов (до 99% метана), торф (53—56% С), а также битумы и др. В атмосфере и гидросфере находится в виде диоксида углерода СО2, в воздухе 0,046% СО2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~18%).
В организм человека углерод поступает с пищей (в норме около 300 г в сутки). Общее содержание углерода в организме человека достигает около 21% (15кг на 70кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани. Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина)
Кругооборот углерода в природе включает биологический цикл, выделение СО2 в атмосферу при сгорании ископаемого топлива, из вулканических газов, горячих минеральных источников, из поверхностных слоев океанических вод и др. Биологический цикл состоит в том, что углерод в виде СО2 поглощается из тропосферы растениями. Затем из биосферы вновь возвращается в геосферу: с растениями углерод попадает в организм животных и человека, а затем при гниении животных и растительных материалов— в почву и в виде СО2— в атмосферу.
В парообразном состоянии и в виде соединений с азотом и водородом углерод обнаружен в атмосфере Солнца, планет, он найден в каменных и железных метеоритах.
Большинство соединений углерода, и прежде всего углеводороды, обладают ярко выраженным характером ковалентных соединений. Прочность простых, двойных и тройных связей атомов С между собой, способность образовывать устойчивые цепи и циклы из атомов С обусловливают существования огромного числа углеродсодержащих соединений, изучаемых органической химией.
Химические свойства
При обычных температурах углерод химически инертен, при достаточно высоких соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—500 °C, 600—700 °C и 850—1000 °C.
Степени окисления +4, −4, редко +2 (СО, карбиды металлов), +3 (C2N2, галогенцианы); сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С 0 к С 4+ соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
Неорганические соединения
Углерод реагирует со многими элементами с образованием карбидов.
Продукты горения— оксид углерода CO и диоксид углерода СО2. Известен также неустойчивый оксид С3О2 (температура плавления −111°C, температура кипения 7°C) и некоторые другие оксиды. Графит и аморфный углерод начинают реагировать с Н2 при 1200°C, с F2— соответственно 900°C.
CO2 с водой образует слабую угольную кислоту— H2CO3, которая образует соли— Карбонаты. На Земле наиболее широко распространены карбонаты кальция (мел, мрамор, кальцит, известняк и др. минералы) и магния (доломит).
Графит с галогенами, щелочными металлами и др. веществами образует соединения включения. При пропускании электрического разряда между угольными электродами в среде N2 образуется циан, при высоких температурах взаимодействием углерода со смесью Н2 и N2 получают синильную кислоту. С серой углерод дает сероуглерод CS2, известны также CS и C3S2. С большинством металлов, бором и кремнием углерод образует карбиды. Важна в промышленности реакция углерода с водяным паром: С +Н2О =СО +Н2 (Газификация твердых топлив). При нагревании углерод восстанавливает оксиды металлов до металлов, что широко используется в металлургии.
Органические соединения
Благодаря способности углерода образовывать полимерные цепочки, существует огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, жиры и др.
Соединения углерода составляют основу земной жизни, а их свойства во многом определяют спектр условий, в которых подобные формы жизни могут существовать. По числу атомов в живых клетках доля углерода около 25%, по массовой доле— около 18%.
Применение
Графит используется в карандашной промышленности. Также его используют в качестве смазки при особо высоких или низких температурах.
Алмаз, благодаря исключительной твердости, незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бормашин. Кроме этого, ограненные алмазы — бриллианты используются в качестве драгоценных камней в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств, бриллиант неизменно является самым дорогим драгоценным камнем. Исключительно высокая теплопроводность алмаза (до 2000 Вт/м•К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров. Но относительно высокая цена (около 50 долларов/грамм) и сложность обработки алмаза ограничивают его применение в этой области.
В фармакологии и медицине широко используются различные соединения углерода— производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения. Так, карболен (активированный уголь), применяется для абсорбции и выведения из организма различных токсинов; графит (в виде мазей)— для лечения кожных заболеваний; радиоактивные изотопы углерода— для научных исследований (радиоуглеродный анализ).
Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент.
Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод— основа жизни. Источником углерода для живых организмов обычно является СО2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа пожирают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возврашением в атмосферу, либо захоронением в виде угля или нефти.
Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ)— один из важнейших источников энергии для человечества.
Токсическое действие
Углерод входит в состав атмосферных аэрозолей, в результате чего может изменяться региональный климат, уменьшаться количество солнечных дней. Углерод поступает в окружающую среду в виде сажи в составе выхлопных газов автотранспорта, при сжигании угля на ТЭС, при открытых разработках угля, подземной его газификации, получении угольных концентратов и др. Концентрация углерода над источниками горения 100—400 мкг/м³, крупными городами 2,4—15,9 мкг/м³, сельскими районами 0,5— 0,8 мкг/м³. С газоаэрозольными выбросами АЭС в атмосферу поступает (6—15)•10 9 Бк/сут 14 СО2.
Высокое содержание углерода в атмосферных аэрозолях ведет к повышению заболеваемости населения, особенно верхних дыхательных путей и легких. Профессиональные заболевания— в основном антракоз и пылевой бронхит. В воздухе рабочей зоны ПДК, мг/м³: алмаз 8,0, антрацит и кокс 6,0, каменный уголь 10,0, технический углерод и углеродная пыль 4,0; в атмосферном воздухе максимальная разовая 0,15, среднесуточная 0,05 мг/м³.
Токсическое действие 14 С, вошедшего в состав молекул белков (особенно в ДНК и РНК), определяется радиационным воздействием бета частиц и ядер отдачи азота ( 14 С (β) → 14 N) и трансмутационным эффектом— изменением химического состава молекулы в результате превращения атома С в атом N. Допустимая концентрация 14 С в воздухе рабочей зоны ДКА 1,3 Бк/л, в атмосферном воздухе ДКБ 4,4 Бк/л, в воде 3,0•10 4 Бк/л, предельно допустимое поступление через органы дыхания 3,2•10 8 Бк/год.
Дополнительная информация
— Соединения углерода
— Радиоуглеродный анализ
— Ортокарбоновая кислота
Аллотропные формы углерода:
Алмаз
Графен
Графит
Карбин
Лонсдейлит
Углеродные нанотрубки
Фуллерены
Аморфные формы:
Сажа
Технический углерод
Уголь
Изотопы углерода:
Нестабильные (менее суток): 8C: Углерод-8, 9C: Углерод-9, 10C: Углерод-10, 11C: Углерод-11
Стабильные: 12C: Углерод-12, 13C: Углерод-13
10—10 000 лет: 14C: Углерод-14
Нестабильные (менее суток): 15C: Углерод-15, 16C: Углерод-16, 17C: Углерод-17, 18C: Углерод-18, 19C: Углерод-19, 20C: Углерод-20, 21C: Углерод-21, 22C: Углерод-22
Таблица нуклидов
Углерод, Carboneum, С (6)
Углерод (англ. Carbon, франц. Carbone, нем. Kohlenstoff) в виде угля, копоти и сажи известен человечеству с незапамятных времен; около 100 тыс. лет назад, когда наши предки овладели огнем, они каждодневно имели дело с углем и сажей. Вероятно, очень рано люди познакомились и с аллотропическими видоизменениями углерода — алмазом и графитом, а также с ископаемым каменным углем. Не удивительно, что горение углеродсодержащих веществ было одним из первых химических процессов, заинтересовавших человека. Так как горящее вещество исчезало, пожираемое огнем, горение рассматривали как процесс разложения вещества, и поэтому уголь (или углерод) не считали элементом. Элементом был огонь — явление, сопровождающее горение; в учениях об элементах древности огонь обычно фигурирует в качестве одного из элементов. На рубеже XVII -- XVIII вв. возникла теория флогистона, выдвинутая Бехером и Шталем. Эта теория признавала наличие в каждом горючем теле особого элементарного вещества — невесомого флюида — флогистона, улетучивающегося в процессе горения.
Двадцать лет спустя Гитон де Морво путем осторожного нагревания превратил алмаз в графит, а затем в угольную кислоту.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда
Углеро́д в виде древесного угля применялся в глубокой древности для выплавки металлов. Издавна известны алмаз и графит. Элементарная природа углерода установлена А. Лавуазье в конце 1780-х годов.
Происхождение названия
Международное название происходит от латинского carbo — уголь, связанного с древним корнем kar — огонь. Этот же корень в латинском cremare — гореть, а возможно, и в русском «
Содержание
Физические свойства
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими и химическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать Изотопы углерода
Подробнее в статье изотопы углерода
Аллотропные модификации углерода

Упрощенная фазовая диаграмма углерода, заштрихованы области где аллотропные модификации могут быть метастабильны. (diamond — алмаз, graphite — графит, liquid — жидкость, vapor — газ)
Электронное строение атома углерода
Графит и алмаз

Элементарная ячейка (углерода) алмаза
Основные и хорошо изученные алмаз и графит. При нормальных условиях термодинамически устойчив только графит, а алмаз и другие формы плотность на 15—20 % выше плотности алмаза), имеющей металлическую проводимость. При высоких давлениях и относительно низких температурах (ок. 1 200 K) из высокоориентированного графита образуется гексагональная модификация углерода с кристаллической решеткой типа плотность 3,51 г/см³, т. е. такая же, как у алмаза. Лонсдейлит найден также в метеоритах.
Ультрадисперсные алмазы (наноалмазы)
Карбин
Кристаллическая модификация углерода гексагональной сингонии с цепочечным строением молекул называется карбин. Цепи имеют либо полиеновое строение (—C≡C—), либо поликумуленовое (=C=C=). Известно несколько форм карбина, отличающихся числом атомов в элементарной ячейке, размерами ячеек и плотностью (2,68—3,30 г/см³). Карбин встречается в природе в виде минерала Фуллерены и углеродные нанотрубки
Аморфный углерод
Содержание углерода в земной коре 0,1 % по массе. Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных известняки и доломиты), горючих ископаемых — антрацит (94—97 % С), бурые угли (64—80 % С), каменные угли (76—95 % С), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана), торф (53—56 % С), а также атмосфере и диоксида углерода СО2, в воздухе 0,046 % СО2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~18 %). Кругооборот углерода в природе включает биологический цикл, выделение СО2 в атмосферу при сгорании тропосферы растениями. Затем из биосферы вновь возвращается в азотом и водородом углерод обнаружен в атмосфере Солнца, планет, он найден в каменных и железных метеоритах.
Большинство соединений углерода, и прежде всего углеводороды, обладают ярко выраженным характером ковалентных соединений. Прочность простых, двойных и тройных связей атомов С между собой, способность образовывать устойчивые цепи и циклы из атомов С обусловливают существования огромного числа углеродсодержащих соединений, изучаемых органической химией.
Химические свойства
При обычных температурах углерод химически инертен, при достаточно высоких соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—500 °C, 600—700 °C и 850—1000 °C.
Степени окисления +4, −4, редко +2 (СО, карбиды металлов), +3 (C2N2, галогенцианы); сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С 0 к С 4+ соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
Неорганические соединения
Углерод реагирует со многими элементами с образованием карбидов.
Графит с галогенами, щелочными металлами и др. веществами образует серой углерод дает сероуглерод CS2, известны также CS и C3S2. С большинством металлов, бором и кремнием углерод образует Газификация твердых топлив ). При нагревании углерод восстанавливает оксиды металлов до металлов, что широко используется в металлургии.
Органические соединения
Благодаря способности углерода образовывать полимерные цепочки, существует огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, Применение
графит в форме пластин)
угля и нефть, природный газ) — один из важнейших источников энергии для человечества.
Углерод в сталелитейной промышленности один из важнеших компонентов сплавов железо-углерод (производсво чугуна и стали).
Графит используется в карандашной промышленности. Также его используют в качестве смазки при особо высоких или низких температурах.
Алмаз, благодаря исключительной твердости, незаменимый бриллианты используются в качестве теплопроводность алмаза (до 2000 Вт/м•К) делает его перспективным материалом для полупроводниковой техники в качестве Токсическое действие
Углерод входит в состав атмосферных аэрозолей, в результате чего может изменяться региональный климат, уменьшаться количество солнечных дней. Частицы углерода поглощают солнечное излучение, что может вызвать нагревание поверхности Земли. Углерод поступает в окружающую среду в виде сажи в составе выхлопных газов автотранспорта, при сжигании угля на верхних дыхательных путей и ДНК и РНК), определяется радиационным воздействием бета частиц и ядер отдачи азота ( 14 С (β) → 14 N) и трансмутационным эффектом — изменением химического состава молекулы в результате превращения атома С в атом N. Допустимая концентрация 14 С в воздухе рабочей зоны ДКА 1,3 Бк/л, в атмосферном воздухе ДКБ 4,4 Бк/л, в воде 3,0•10 4 Бк/л, предельно допустимое поступление через органы дыхания 3,2•10 8 Бк/год.
Читайте также:

