Физические свойства сложных эфиров кратко
Обновлено: 04.07.2024
Сложные эфиры простейших карбоновых кислот и низших спиртов представляют собой бесцветные летучие жидкости, которые малорастворимы в воде и обладают приятным запахом.
В отличие от спиртов и карбоновых кислот, молекулы сложных эфиров не способны образовывать водородные связи. Это обусловлено тем, что в молекулах отсутствуют гидроксильные группы − OH . В следствие этого сложные эфиры кипят при более низких температурах, чем соответствующие им кислоты.
Сложные эфиры, образованные высшими карбоновыми кислотами и одноатомными спиртами, представляют собой воскообразные вещества , нерастворимые в воде
Пчелиный воск содержит в своём составе около \(50\) веществ, основную массу которых составляют сложные эфиры высших карбоновых кислот (\(70\)-\(75\) % ).
Реакция кислотного гидролиза является обратимой, так как образующиеся в ходе реакции кислота и спирт взаимодействуют между собой с образованием сложного эфира.
Щелочной гидролиз, или омыление, протекает необратимо. Образующаяся в ходе этой реакции кислота нейтрализуется щёлочью, превращаясь в соль.

Запах банана и вкус грушевого лимонада — дело рук сложных эфиров. Жаль, что на контрольных по химии не просят определить сложный эфир по вкусу. 🍌 Зато обязательно спросят про названия, свойства и образование этого класса соединений — так что давайте разбираться.
О чем эта статья:
Для начала дадим определение и разберемся, почему эти эфиры — сложные.
Общая формула сложных эфиров выглядит так:

Однако представители сложных эфиров муравьиной кислоты выглядят иначе. Для них общая формула приобретает такой вид:

Номенклатура сложных эфиров
Теперь поговорим о том, как называть представителей данного класса. Различают два способа, позволяющие назвать сложные эфиры: по систематической номенклатуре (ИЮПАК) или по рациональной номенклатуре. Рассмотрим оба варианта.
По номенклатуре ИЮПАК название строится следующим образом:


По рациональной номенклатуре название строится так:




Изомерия сложных эфиров
Возможна ли изомерия для сложных эфиров? Давайте разбираться.
Возможна изомерия углеродного скелета у радикала кислоты и радикала спирта при наличии трех и более углеродных атомов.

Изомерия положения функциональной группы:

Межклассовая изомерия также определяется общей формулой органических соединений. Например:

Физические свойства сложных эфиров
Агрегатное состояние сложного эфира напрямую зависит от молекулярной массы образующих его кислоты и спирта. Так, например, сложные эфиры низших и средних гомологов являются летучими жидкостями с характерным запахом. Чаще всего у них фруктовые или плодовые ароматы. Сложные эфиры хуже растворяются в воде, чем образующие их кислоты и спирты. Чем больше атомов углерода в составе сложного эфира, тем хуже его растворимость в воде.
Эфиры высших карбоновых кислот и высших одноатомных первичных спиртов — основа природного воска. Например, известный пчелиный воск — это сложный эфир пальмитиновой кислоты (C15H31COOH) и мирицилового спирта (С31H63OH).
Химические свойства сложных эфиров
Сложные эфиры подвергаются гидролизу (разложению под действием воды), который бывает двух видов: в кислой среде и в щелочной. Рассмотрим каждый из этих видов.
В кислой среде реакция протекает следующим образом:

Эта реакция обратима, так как образующиеся в процессе кислота и спирт подвергаются взаимодействию с образованием этого же сложного эфира. Обратная реакция имеет название реакция этерификации.
Щелочной гидролиз или реакция омыления:

Этот вид гидролиза протекает необратимо, так как образовавшаяся в ходе реакции соль не может реагировать со спиртом.
Сложные эфиры можно восстановить водородом в присутствии катализатора до двух спиртов. Причем один из спиртов будет иметь в составе столько атомов углерода, сколько было в кислоте, а во втором спирте количество углерода будет соответствовать исходному спирту. Рассмотрим на примере:

Эфиры подвергаются полному окислению, то есть горят с образованием углекислого газа и воды:

Следующее химическое свойство относится только к тем сложным эфирам, которые образованы непредельной карбоновой кислотой. Сложные эфиры таких кислот могут подвергаться галогенированию. Посмотрим, как происходит эта реакция:

Способы получения сложных эфиров

Реакция обратимая, поэтому требуется либо избыток одного из реагентов, либо отгонка образующегося сложного эфира, чтобы предотвратить обратную реакцию гидролиза.
Взаимодействие ангидрида карбоновой кислоты со спиртом с образованием сложного эфира и карбоновой кислоты.

Взаимодействие солей карбоновых кислот с галогеналканами.

Нахождение сложных эфиров в природе и применение
Сложные эфиры широко представлены в природе, но их количество минимально. Они участвуют в процессах, которые протекают в живых организмах, а также являются компонентами аромата ряда растений.
Некоторые эфиры получают искусственным способом. Например, за грушевый вкус в лимонаде отвечает уксусноизоамиловый эфир, а за яблочный — изовалерианоэтиловый эфир.
Помимо пищевой промышленности, сложные эфиры применяют в качестве растворителей для приготовления лаков, а также как пластификаторы для приготовления пластических масс.
Сложные эфиры на основе ароматических спиртов нашли применение в парфюмерной промышленности.
Характеристики и физические свойства сложных эфиров
Сложные эфиры – это производные карбоновых кислот, в молекулах которых атом водорода карбоксильной группы замещен на углеводородный радикал (рис. 1).

Рис. 1. Строение молекулы сложного эфира.
Сложные эфиры низших карбоновых кислот и простейших спиртов – это летучие жидкости, плохо растворяющиеся в воде, обычно имеющие приятный запах, легче воды (например, плотность изоамилацетата – 0,876 г/см 3 ).
Сложные эфиры высших спиртов и карбоновых кислот – твердые, воскоподобные, напримерпальмитиновоцетиловый эфир (содержится в спермацете – одной из нуклеиновых кислот, участвующих в передаче наследственных признаков) и пальмитиновомирициловый эфир (содержится в пчелином воске).
Получение сложных эфиров
Основные способы получения сложных эфиров – это:
— взаимодействие кислот со спиртами
— взаимодействие ангидридов карбоновых кислот со спиртами
Химические свойства сложных эфиров
Химические свойства сложных эфиров обусловлены наличием функциональной группы. Наиболее важной является реакция гидролиза:
Сложные эфиры вступают в реакции взаимодействия со следующими веществами:
— спиртами (реакция переэтерификации)
— галогенирования, если в составе углеводородного радикала имеются кратные связи
Применение сложных эфиров
Сложные эфиры применяются для изготовления искусственных эссенций, используемых в производстве фруктовых вод, кондитерских изделий, косметических средств, отдушек для препаратов бытовой химии и т.д.
Примеры решения задач
| Задание | Какая масса метанола образуется при гидролизе метилацетата, массой 10 г? |
| Решение | Запишем уравнение гидролиза метилового эфира уксусной кислоты: |
Определим количество вещества метилацетата, используя значение его массы из условия задачи (молярная масса – 84 г/моль):
По уравнению n (CH3— C(O)O- CH3) = n (CH3OH) =0,12 моль. Рассчитаем массу метанола (молярная масса – 32 г/моль):
| Задание | Определите массу уксусной кислоты, которую можно получить в ходе реакции омыления этилацетата массой 180 г. |
| Решение | Запишем уравнение реакции гидролиза этилового эфира уксусной кислоты используя брутто формулы: |
Рассчитаем количество вещества этилацетата (молярная масса – 88 г/моль), используя значение массы из условий задачи:
Согласно уравнению реакции, число моль этилацетата и уксусной кислоты равны:
Тогда, можно определить массу уксусной кислоты (молярная масса – 60 г/моль):
m(CH3COOH)= n (CH3COOH) × M (CH3COOH) = 2 × 60 = 120 г.
Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие жидкости, многие из которых обладают приятным цветочным или фруктовым запахом. Они практически нерастворимы в воде и имеют более низкие температуры кипения, чем изомерные им карбоновые кислоты. Это связанно с тем, что в молекулах сложных эфиров отсутствуют межмолекулярные водородные связи.
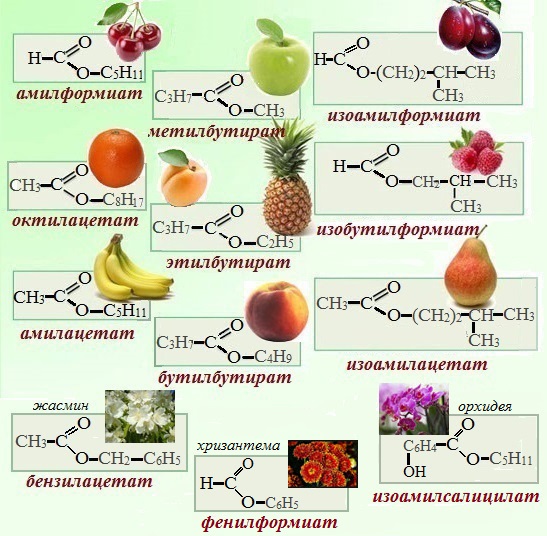

Приятный аромат цветов, плодов, ягод в значительной степени обусловлен присутствием в них тех или иных сложных эфиров.

Они являются составной частью эфирных масел.
Сложные эфиры высших жирных кислот и спиртов – воскообразные вещества, не имеют запаха, в воде не растворимы, хорошо растворяются в органических растворителях.
Воски бывают растительные, животные, ископаемые и синтетические.
Растительные воски
Пальмовый воск находится в углублениях кольчатого ствола восковой пальмы, откуда его соскабливают. Одно дерево дает 12 кг воска.
Японский воск добывают из лакового дерева, произрастающего в Японии и Китае.
Животные воски
Пчелиный воск наиболее известный из этого вида восков. Он содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат, пальмитиномирициловый эфир):

Миристилпальмитат, локализованный в углублениях костей черепа кашалота, является проводником звуков при эхолокации.
Шерстяной (шерстный) воск – ланолин – обильно покрывает шерсть животных.
Спермацет содержится в костных черепных углублениях некоторых видов китов, особенно кашалотов. На 90% состоит из пальмитиноцетилового эфира.
К воскам относятся кожное сало и ушная сера.
Воск бактерий покрывает поверхность кислотоупорных бактерий, например, туберкулезных, обеспечивая их устойчивость к внешним воздействиям.
Из пчелиного воска пчелы строят соты, шерстяной (ланолин) предохраняет шерсть и кожу животных от влаги, засорения и высыхания.
Ископаемые воски
Торфяной воск получают экстракцией бензином при 80 0 С верхового битуминозного торфа.
Буроугольный воск (монтан-воск) извлекают бензином из бурого битуминозного угля.
Горный воск (озокерит) – минерал из группы нефтяных битумов.
Синтетическим воски получают на основе нефтяных и смоляных парафинов и их производных.
Читайте также:

