Физические свойства простых эфиров кратко
Обновлено: 05.07.2024
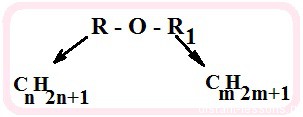
Простые эфиры – это органические вещества, которые имеют формулу R-O-R`. Знаками R и R` обозначаются алкильные, арильные или прочие заместители.
Простые эфиры – это бесцветные летучие жидкости, обладающие приятным запахом. Нашли широкое применение как растворители в промышленных предприятиях и лабораториях из-за химической инертности и особых сольватационных свойств.
Физические свойства эфиров
Температура кипения/плавления
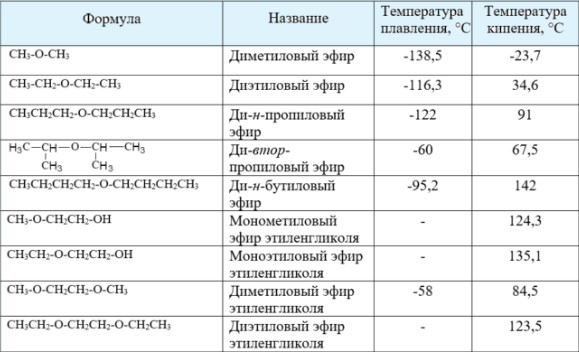
Вещества обладают более низким порогом кипения, нежели соответствующие спирты. Это объясняется отсутствием гидроксильного водорода в их составе, тогда как у спиртов он имеется. Благодаря гидроксильному водороду спирт может образовывать водородные связи, тем самым объединяя одну молекулу с другой. Простые эфиры на это не способны. Например, этиловый спирт имеет точку кипения 78,37 градусов по Цельсию, а этиловый эфир – 34,6 градусов.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Перечень температуры кипения/плавления некоторых веществ:
Химическое поведение и свойства
Простые эфиры можно отнести к малореакционноспособной группе органических соединений, так как они проявляются слабоосновные свойства. Расщепляются только некоторые вещества и только при нагревании.
Окисление
Реакция окисления проходит с образованием перекисных соединений, что называется автоокислением. При хранении способны окислятся при помощи кислорода и образовывать перекиси, а именно неустойчивые гидропероксиды и пероксиды. При перегонке простых эфиров особенно важно тщательно отчистить их от перекисей, так как они потенциально способны вызвать взрыв.
Разложение
Расщепляются при температуре до 120-150 градусов по Цельсию с концентрированными бромоводородом или ионоводородом 48% концентрацией.
Эфиры, которые содержат третичную алкильную группу, расщепляются легче.
Способны образовывать карбокатион, если есть третичная алкильная, бензильная или аллильная группа. Реакция происходит по Sn1-механизму в качестве интермедиата. Данные реакции протекают в мягких условиях, кислотным агентом может выступать трифторуксульная кислота.
Синтез
Синтез простых эфиров протекает по реакции Вильямсона. Суть реакции в том, что алкилгалогениды взаимодействуют с алкоголятами щелочных металлов.
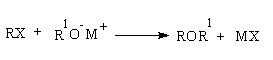
Таким образом получаются симметричные и ассиметричные эфиры.
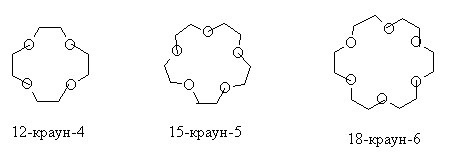
Реакция Вильямсона получила второе рождение после того, как открыли класс краун-эфиров. В них первая цифра означает размер цикла, вторая – число атомов кислорода, участвующих в цикле.
Восстановление
Реакция восстановления протекает согласно уравнению:
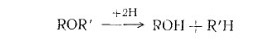
Для результата требуются жесткие условия. Труднее всего реакция протекает с дифениловым эфиром или его производными.
Применение простых эфиров
Среда для проведения синтезов
Циклический эфир и диоксан используют в качестве среды для проведения органических синтезов из-за их способности растворять жиры, воск, масла, эфиры, целлюлозу. По химическим свойствам они похожи на простые эфиры, но в отличие от последних могут бесконечно смешиваться с водой и большим количеством органических растворителей.
Экстрагирование
Диэтиловый эфир применяется для экстрагирования веществ. К таким процессам может относиться извлечение спиртов из водных растворов.
Растворение смол
В качестве растворителей используют диэтиловый эфир, тетрагидрофуран, диоксан. Диоксан, в свою очередь, имеет большую, чем диэтиловый спирт, способность растворять, кроме того, гигроскопичен и хорошо смешивается с водой. Также может служить как стабилизатор для хранения 1,1,1-трихлорэтана или транспортировки его в емкостях из алюминия.
Компонент топлива
Диэтиловый эфир может применяться в производстве топлива для авиамодельных карбюраторных двигателей.
Наркоз в медицине
В качестве препарата для наркоза используют диэтиловый эфир, который обладает общеанестезирующими свойствами, влияет на нейронные мембраны, способен обездвижить центральную нервную систему, данная реакция полностью обратима. Препарат для наркоза вскрывают непосредственно перед операцией, после хранения более 6 месяцев проверяют на соответствие установленным требованиям.
Выделение урана
Для выделения урана от остальных продуктов используют диизопропиловый эфир.
Производство лекарств, ароматизаторов
В производстве лекарств и туалетной воды используют метилфениловый эфир (анизол) или этилфениловый эфир (фенетол). Благодаря слабой токсичности данные реагенты практически не раздражают кожу.
Запах душистого мыла, ароматы парфюмерии и косметических средств заслуга сложных эфиров. В XVIII веке Л. Де Лаурагваис впервые перегнал органическую кислоту со спиртом и получил ароматную жидкость. Спустя несколько веков мы не представляем жизнь без эфиров. Эфиры делятся на два вида – простые и сложные. Простые эфиры – результат дегидратации от двух молекул спирта, а сложные эфиры – от молекулы карбоновой кислоты и молекулы спирта. Общий вид простых эфиров: R-O-R’ Общий вид сложных эфиров: R-C(O)O-R’
План урока:
Строение простых эфиров
Для атомов углерода насыщенных простых эфиров характерно состоянии sp 3 -гибридизации, а в ненасыщенных соединениях – sp 2 -гибридизации.
Строение молекулы диметилового эфира
Номенклатура эфиров
Например, симметричная молекула С2Н5-О-С2Н5 называется диэтиловым эфиром.
В несимметричной молекуле радикалы располагаются по алфавиту. Например, молекула СН3-О-С2Н5 называется метилэтиловым эфиром.
Строение сложных эфиров
Например, C2H5-C(O)O-CH3 также можно назвать как метиловый эфир этановой кислоты, а С2Н5-С(О)О-С2Н5 - этиловый эфир этановой кислоты.
Изомерия эфиров
Изомерия простых эфиров
Изомерия сложных эфиров
Классификация эфиров
Виды простых эфиров
Простые эфиры классифицируются по строению углеводородного скелета.
Виды сложных эфиров
Сложные эфиры классифицируются на несколько видов.
- Сложные эфиры, образованные низшими карбоновыми кислотами и спиртами
С5Н11-С(О)О-СН3 – метиловый эфир пентановой кислоты
- Сложные эфиры, образованные высшими карбоновыми кислотами и спиртами
СН3-(СН2)14-С(О)О-(СН2)29-СН3 – мирициловый эфир пальмитиновой кислоты (один из компонентов пчелиного воска)
СН3-(СН2)14-С(О)О-(СН2)15-СН3 – цетиловый эфир пальмитиновой кислоты (основной компонент спермацета)
Жиры отличаются от других представителей класса тем, что они образованы от глицерина ОН-СН2-СН(ОН)-СН2-ОН.
Общая формула жиров
Способы получения простых и сложных эфиров
Получение простых эфиров
Простые эфиры не встречаются в природе, но есть множество химических способов получения эфиров.
С помощью этого способа получают симметричные молекулы. Реакция дегидратации (отщепления молекулы воды) протекает в присутствии минеральной кислоты и при нагревании.
- Реакция Вильямсона (взаимодействие галогенпроизводных с алкоголятами)
С помощью этого метода можно синтезировать несимметричные молекулы.
Данным способом можно получать циклические соединения класса. Для проведения реакции необходимо нагревание и наличие катализатора.
Способ получения сложных эфиров
Реакция этерификации протекает в присутствии минеральной кислоты.
Физические свойства простых и сложных эфиров
Физические свойства простых эфиров
Для простых эфиров не характерно твердое состояние. Диметиловый эфир и метилэтиловый эфир – газы, а все остальные представители класса находятся в жидком состоянии. Простые эфиры кипят при более низких температурах, по сравнению со спиртами. Также им характерен приятный и сладкий запах.
Диэтиловый эфир – бесцветная жидкость, кипящая при температуре 35,5˚С. Он малорастворим в воде, но хорошо растворим в этиловом спирте. Температура воспламенения – 9,4˚С. При взаимодействии с воздухом образуется взрывоопасная смесь. Используется как растворитель. Это ядовитое вещество, которое опасно тем, что вызывает привыкание.
Простые эфиры не растворимы в воде. Эта особенность связана с неспособностью образовывать водородные связи. Простые эфиры – отличные растворители.
Физические свойства сложных эфиров
Сложные эфиры, образованные от низших карбоновых кислот и спиртов, находятся в жидком состоянии. Они обладают приятными запахами и не растворяются в воде. Приятные цветочные и плодовые запахи обусловлены наличием сложных эфиров.
У сложных эфиров более низкие температуры плавления и кипения, чем у карбоновых кислот. Эта особенность связана с отсутствием межмолекулярных водородных связей.
Сложные эфиры, образованные от высших карбоновых кислот и спиртов – воски. У них отсутствуют запахи. Также они совсем не растворимы в воде, но растворимы в органических растворителях. Воски бывают растительными, животными, ископаемыми и синтетическими.
Соты из пчелиного воска
Растительные воски можно встретить на поверхностях листовых пластин, стеблей, плодов. Они защищают от проникания лишней воды, высыхания, попадания микроорганизмов. Наиболее популярный животный воск – пчелиный. Из него насекомые строят соты. Также животный воск находится на шерсти животных. Он предотвращает попадание избыточной влаги на кожу.
Ланолин (воск шерсти животных)
Представитель ископаемых восков – горный воск, который представляет собой минерал из группы нефтяных битумов. Синтетические воски получают на основе нефтяных и смоляных парафинов и их производных.
Химические реакции простых и сложных эфиров
Химические реакции простых эфиров
- Взаимодействие с йодоводородной (HI) или бромоводородной (HBr) кислотой
Под действием концентрированной кислоты происходит разложение простого эфира.
R-O-R’ + HI →R-OH + R’-I
В результате данной реакции образуются нестойкие соли оксония.
При хранении простых эфиров на воздухе образуются перекиси.
Из-за образованных перекисей в процессе перегонки эфира может произойти взрыв, поэтому особенно важно очищать эфиры перед началом работы.
Химические реакции сложных эфиров
Химические реакции сложных эфиров обусловлены нуклеофильной атакой по атому углерода, находящимся в карбонильной группе, и замещением алкоксигруппы.
При кислотном гидролизе сложный эфир превращается в исходную карбоновую кислоту и спирт. Реакция проходит в присутствии минеральной кислоты.
При щелочном гидролизе образуются соль карбоновой кислоты и спирт. Данная реакция необратима.
Следует обратить внимание на то, что кислотный гидролиз обратим.
- Взаимодействие с водородом (гидрирование, или восстановление)
В процессе гидрирования образуются две молекулы спирта. Реакция идет при наличии катализатора.
При взаимодействии сложных эфиров и аммиака образуются амиды кислот и спирты.
Применение эфиров
Простым эфирам характерна химическая инертность, поэтому они могут играть роль растворителя. Эфиры с разветвленными радикалами применяются в качестве антидетонационных добавок в моторных топливах. Также благодаря приятным запахам их можно встретить в парфюмерной продукции.
Сложные эфиры используются в парфюмерной, косметической продукции, пищевой промышленности, производстве лаков, красок, клеев и лекарственных препаратов. Также они могут выступать в роли растворителей.
Применение сложных эфиров.
Из сложных эфиров низших карбоновых кислот и спиртов, производят различные эссенции, а от ароматических спиртов – парфюмерную продукцию. Воски входят в состав смазочных веществ, кремов и мазей.
В XIX-ХХ веках ученые получили и изучили сложные эфиры, которые легли в основу многих лекарств. В число препаратов из эфиров входят салол, валидол. Раньше в качестве обезволивающего средства использовался метилсалицилат, который на современном рынке вытеснен другими эффективными лекарственными препаратами.
Некоторые способы получения простых эфиров были рассмотрены при изучении галогеналканов, алкенов, одноатомных спиртов. В данном разделе подробнее рассмотрим получение, физические и химические свойства простых эфиров .
При этом способе получения используются первичные реагирующие соединения.

Его получение происходит в 2 стадии. Сначала, при взаимодействии этанола с избытком серной кислоты, получается этилсерная кислота, которая, затем реагирует с новой порцией этанола с образованием диэтилового эфира:
При присоединении спиртов к алкинам образуются виниловые эфиры:

- Оксимеркурирование алкенов протекает в несколько стадий. Сначала при действии на алкены ацетата ртути в водном растворе тетрагидрофурана (ТГФ) или в водной уксусной кислоте при 20°С образуется ртутьорганические соединения. При этом присоединение ацетата ртути к алкену происходит согласно правилу Марковникова. Далее при воздействии таких растворителей как спирты, уксусная кислота, ацетонитрил и др. получаются простые эфиры:

Физические свойства
Растворимость простых эфиров

Простые эфиры растворимы в протонных кислотах, что связано с основными свойствами эфирного кислорода. Этот кислород имеет две свободные электронные пары, которые не могут использоваться для проявления обычной валентности и принять электроны. Однако для осуществления связи кислород может предоставить свою электронную пару в общее пользование:
В зависимости от строения эфира, они могут иметь хорошую растворимость в воде или вовсе не растворяться (см. таблицу ниже). В большинстве органических растворителей простые эфиры хорошо растворимы.
Точки плавления и кипения простых эфиров
Простые эфиры кипят при гораздо более низких температурах, чем соответствующие спирты. Например, метиловый спирт кипит при +65°С, а метиловый эфир – при -23,7°С. Это связано с тем, что эфиры, в отличие от спиртов, лишены гидроксильного водорода и поэтому не имеют возможности образовывать водородные связи, объединяющие одну молекулу с другой. Т.е. простые эфиры не способны к ассоциации молекул.

Химические свойства простых эфиров
Простые эфиры – малореакционноспособная группа органических соединений, проявляющие слабоосновные свойства. Они могут расщепляются лишь некоторыми веществами при нагревании (концентрированной йодистоводородной кислотой или воздействием металлического натрия). Водные растворы кислот и щелочей не действуют на простые эфиры.
Под действием концентрированных йодоводородной или бромоводородной кислот:
![]()
Под действием активных металлов при повышенной температуре (Шорыгин П.П.):
![]()
Под действием серной кислоты:

- Окисление простых эфиров происходит с образованием перекисных соединений (автоокисление):

Простые эфиры при хранении легко окисляются кислородом воздуха с образованием перекисей. При использовании простых эфиров, особенно при перегонке их необходимо хорошо очистить от накопленных перекисей, которые могут стать причиной взрыва.
Получение простых эфиров
Простые эфиры применимы и в медицине. Например, диэтиловый эфир C2H5 — O — C2H5 — это вещество, которое входит в состав наркоза.
Бесцветная, прозрачная, очень подвижная, летучая жидкость со своеобразным запахом и жгучим вкусом. Эфир для наркоза содержит 96–98% диэтилового эфира. Эфирный наркоз отличается хорошей контролируемостью и управляемостью.
Диметиловый эфир CH3 — O — CH3 — используется при удалении бородавок, а в Китае -это возможная альтернатива дизельному топливу.
в ЕГЭ это вопрос А16 — Rислородсодержащие органические соединения
Читайте также:

