Физические свойства алканов кратко
Обновлено: 04.07.2024
II. Химические свойства алканов
1. Реакции замещения
а) Галогенирование
При действии света - hν или нагревании (стадийно – замещение атомов водорода на галоген носит последовательный цепной характер. Большой вклад в разработку цепных реакций внёс физик, академик, лауреат Нобелевской премии Н. Н. Семёнов )
В реакции образуются вещества галогеналканы RГ или С n H 2n+1 Г
(Г - это галогены F, Cl, Br, I)
CH 4 + Cl 2 hν → CH 3 Cl + HCl (1 стадия)
CH 3 Cl + Cl 2 hν → CH 2 Cl 2 + HCl (2 стадия)
Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле:
Электронная плотность связи С – Cl смещена к более электроотрицательному хлору, в результате на нём скапливается частичный отрицательный заряд, а на атоме углерода – частичный положительный заряд.
На атом углерода в метильной группе ( - СН3) создаётся дефицит электронной плотности, поэтому он компенсирует свой заряд за счёт соседних атомов водорода, в результате связь С – Н становится менее прочной и атомы водорода легче замещаются на атомы хлора. При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайщего к заместителю:
Со фтором реакция идёт со взрывом.
С хлором и бромом требуется инициатор.
Иодирование происходит обратимо, поэтому требуется окислитель для удаления HI из рекции.
Внимание!
В реакциях замещения алканов легче всего замещаются атомы водорода у третичных атомов углерода, затем у вторичных и, в последнюю очередь, у первичных. Для хлорирования эта закономерность не соблюдается при T>400˚C.
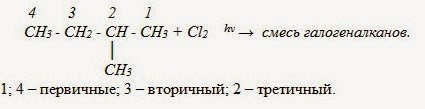
б) Нитрование (реакция М.И. Коновалова , он провёл её впервые в 1888 г)
2. Реакции отщепления (дегидрирование)
б) При нагревании до 1500 С происходит образование ацетилена и водорода:
3. Реакции перегруппировки (изомеризация)
4. Реакции горения (горят светлым не коптящим пламенем)
Помните! Смесь метана с воздухом и кислородом взрывоопасна
5. Реакции разложения
а) Крекинг при температуре 700-1000°С разрываются (-С-С-) связи:
б) Пиролиз при температуре 1000°С разрываются все связи,
продукты – С и Н2:
в) Конверсия метана с образованием синтез – газа (СО + Н2)
III. Получение алканов
1. Получение в лаборатории
1. Гидролиз карбида алюминия (получение метана):
2. Реакция Вюрца (взаимодействие натрия с галогенпроизводными алканов):
(R- это радикал; Г- это галоген)
3. Термическое декарбоксилирование солей карбоновых кислот в присутствии щелочей:
(ацетат натрия+ едкий натр=(метан+карбонат натрия)
этилат натрия этан
4. Каталитическое гидрирование алкенов и алкинов:
5. Электролиз растворов солей карбоновых кислот - реакция КОЛЬБЕ
Пример. Электролиз водного раствора ацетата натрия
Катод (-): H2O , Na + - Процесс восстановления: 2H 2 O + 2ē → H 2 ↑ + 2OH -
Анод (+): H 2 O, CH3COO - (анионы органических кислот активнее воды) – Процесс окисления:
2H2O + 2CH3COONa эл . ток = H2 + 2NaHCO3 + C2H6
2. Получение в промышленности
1. Из природного и попутного нефтяного газа
Важнейшим источником алканов в природе является природный газ, минеральное углеводородное сырье - нефть и сопутствующие ей нефтяные газы. Природный газ на 95 процентов состоит из метана. Такой же состав имеет болотный газ, образующийся в результате переработки бактериями (гниения) углеводов.
Метан называют ещё и болотным; рудничным газом.
Попутные нефтяные газы состоят в основном из этана, пропана, бутана и частично пентана. Их отделяют от нефти на специальных установках по подготовке нефти. При отсутствии газоконденсатных станций попутные нефтяные газы сжигают в факелах, что является крайне неразумной и разорительной практикой в нефтедобыче. Одновременно с газами нефть очищается от воды, грязи и песка, после чего поступает в трубу для транспортировки. Из нефти при ее разгонке (перегонке, дистилляции) отбирая последовательно все более и более высококипящие фракции получают:
бензины - т. кип. от 40 до 180 С, (содержит углеводороды С5-С10), состоит более, чем из 100 индивидуальных соединений, нормальных и разветвленных алканов, циклоалканов, алкенов и ароматических углеводородов;
легкий газойль (дизельное топливо) 230-305 С (С13-С17);
тяжелый газойль и легкий дистиллят смазочного масла 305-405 С (С18-С25);
смазочные масла 405-515 С (С26-С38).
Остаток после перегонки нефти называется асфальтом или битумом.
2. Синтезом из водяного газа:
3. Синтезом из простых веществ:
IV. Применение
1. Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека.
2. Использование в качестве топлива – в котельных установках, бензин, дизельное топливо, авиационное топливо, баллоны с пропан-бутановой смесью для бытовых плит.
3. Вазелин используется в медицине, парфюмерии, косметике, высшие алканы входят в состав смазочных масел, соединения алканов применяются в качестве хладагентов в домашних холодильниках.
4. Смесь изомерных пентанов и гексанов называется петролейным эфиром и применяется в качестве растворителя. Циклогексан также широко применяется в качестве растворителя и для синтеза полимеров.
5. Метан используется для производства шин и краски.
6. Значение алканов в современном мире огромно. В нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ. Велико значение в медицине, парфюмерии и косметике.
Алканы образуют гомологический ряд, каждое химическое соединение которого по составу отличается от последующего и предыдущего на одинаковое число атомов углерода и водорода – CH2, а вещества, входящие в гомологический ряд, называются гомологами. Гомологический ряд алканов представлен в таблице 1.
Таблица 1. Гомологический ряд алканов.
В молекулах алканов выделяют первичные (т.е. связанные одной связью), вторичные (т.е. связанные двумя связями), третичные (т.е. связанные тремя связями) и четвертичные (т.е. связанные четырьмя связями) атомы углерода.
C 1 H3 – C 2 H2 – C 1 H3 (1 – первичные, 2- вторичные атомы углерода)
CH3 –C 3 H(CH3) – CH3 (3- третичный атом углерода)
Для алканов характерна структурная изомерия (изомерия углеродного скелета). Так, у пентана имеются следующие изомеры:
Для алканов, начиная с гептана, характерна оптическая изомерия.
![]()
.
Химические свойства алканов
При обычных условиях алканы химически инертны — не реагируют ни с кислотами, ни со щелочами. Это объясняется высокой прочностью -связей С-С и С-Н. Неполярные связи С-С и С-Н способны расщепляться только гомолитически под действием активных свободных радикалов. Поэтому алканы вступают в реакции, протекающие по механизму радикального замещения. При радикальных реакция в первую очередь замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
Реакции радикального замещения имеют цепной характер. Основные стадии: зарождение (инициирование) цепи (1) – происходит под действием УФ-излучения и приводит к образованию свободных радикалов, рост цепи (2) – происходит за счет отрыва атома водорода от молекулы алкана; обрыв цепи (3) – происходит при столкновении двух одинаковых или разных радикалов.
X:X → 2X . (1)
R:H + X . → HX + R . (2)
R . + X:X → R:X + X . (2)
R . + R . → R:R (3)
R . + X . → R:X (3)
X . + X . → X:X (3)
Галогенирование. При взаимодействии алканов с хлором и бромом при действии УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогензамещенных алканов:
![]()
С и небольшом давлении протекает радикальная реакция:
Сульфохлорирование и сульфоокисление. Прямое сульфирование алканов протекает с трудом и чаще всего сопровождается окислением, в результате чего образуются алкансульфонилхлориды:
Реакция сульфоокисления протекает аналогично, только в этом случае образуются алкансульфоновые кислоты:
Крекинг – радикальный разрыв связей С-С. Протекает при нагревании и в присутствии катализаторов. При крекинге высших алканов образуются алкены, при крекинге метана и этана образуется ацетилен:
Окисление. При мягком окислении метана кислородом воздуха могут быть получены метанол, муравьиный альдегид или муравьиная кислота. На воздухе алканы сгорают до углекислого газа и воды:
Физические свойства алканов
При обычных условиях С1-С4 – газы, С5-С17 – жидкости, начиная с С18 – твердые вещества. Алканы практически нерастворимы в воде, но, хорошо растворимы в неполярных растворителях, например, в бензоле. Так, метан СН4 (болотный, рудничий газ) – газ без цвета и запаха, хорошо растворимый в этаноле, эфире, углеводородах, но плохо растворимый в воде. Метан используют в качестве высококалорийного топлива в составе природного газа, в качестве сырья для производства водорода, ацетилена, хлороформа и других органических веществ в промышленных масштабах.
Пропан С3Н8 и бутан С4Н10 – газы, применяемые в быту, в качестве балонных газов, за счет легкой сжижаемости. Пропан используется в качестве автомобильного топлива, поскольку является более экологически чистым, чем бензин. Бутан – сырье для получения 1,3 –бутадиена, использующегося в производстве синтетического каучука.
Получение алканов
Алканы получают из природных источников – природного газа (80-90% — метан, 2-3% — этан и другие предельные углеводороды), угля, торфа, древесины, нефти и горного воска.
Выделяют лабораторные и промышленные способы получения алканов. В промышленности алканы получают из битумного угля (1) или по реакции Фишера-Тропша (2):
К лабораторным способам получения алканов относят: гидрирование непредельных углеводородов при нагревании и в присутствии катализаторов (Ni, Pt, Pd) (1), взаимодействием воды с металлоорганическими соединениями (2), электролизом карбоновых кислот (3), по реакциям декарбоксилирования (4) и Вюрца (5) и другими способами.
R-Cl + Mg → R-Mg-Cl + H2O → R-H (алкан) + Mg(OH)Cl (2)
Примеры решения задач
| Задание | Определите массу хлора, необходимого для хлорирования по первой стадии 11,2 л метана. |
| Решение | Запишем уравнение реакции первой стадии хлорирования метана (т.е. в реакции галогенирования происходит замещения всего одного атома водорода, в результате чего образуется монохлорпроизводное): |
Найдем количество вещества метана:
v(CH4) = 11,2/22,4 = 0,5 моль
По уравнению реакции количество моль хлора и количество моль метана равны 1 моль, следовательно, практическое количество моль хлора и метана также будет одинаковым и будет равно:
Зная количество вещества хлора можно найти его массу (что и поставлено в вопросе задачи). Масса хлора рассчитывается как произведение количества вещества хлора на его молярную массу (молекулярная масса 1 моль хлора; молекулярная масса рассчитывается с помощью таблицы химических элементов Д.И. Менделеева). Масса хлора будет равна:
Алканы – насыщенные (предельные) углеводороды. Представителем этого класса является метан (СН4). Все последующие предельные углеводороды отличаются на СН2 – группу, которая называется гомологической группой, а соединения – гомологами.

Строение алканов.
Каждый атом углерода находится в sp 3 – гибридизации, образует 4 σ- связи (1 С-С и 3 С-Н). Форма молекулы в виде тетраэдра с углом 109,5°.
Связь образуется посредством перекрывания гибридных орбиталей, причем максимальная область перекрывания лежит в пространстве на прямой, соединяющей ядра атомов. Это наиболее эффективное перекрывание, поэтому σ-связь считается наиболее прочной.
Изомерия алканов.
Для алканов свойственна изомерия углеродного скелета. Предельные соединения могут принимать различные геометрические формы, сохраняя при этом угол между связями. Например,


Изомерия углеродного скелета алканов.
Количество изомеров возрастает с увеличением роста углеродной цепи. Например у бутана известно 2 изомера:

Для пентана – 3, для гептана – 9 и т.д.
Если у молекулы алкана отнять один протон (атом водорода), то получится радикал:

Физические свойства алканов.
В нормальных условиях – С1-С4 – газы, С5-С17 – жидкости, а углеводороды с количеством атомов углерода больше 18 – твердые вещества.
С ростом цепи повышается температура кипения и плавления. Разветвленные алканы имеют более низкие температуры кипения, чем нормальные.
Алканы нерастворимы в воде, но хорошо растворяются в неполярных органических растворителях. Легко смешиваются друг с другом.
Получение алканов.
Синтетические методы получения алканов:

2. Из галогенпроизводных – реакция Вюрца: взаимодействие моногалогенаклканов с металлическим натрием, в результате чего получаются алканы с удвоенным числом углеродных атомов в цепи:

3. Из солей карбоновых кислот. При взаимодействии соли с щелочи, получаются алканы, которые содержат на 1 атом углерод меньше по сравнению с исходной карбоновой кислотой:

4. Получение метана. В электрической дуге в атмосфере водорода:
В лаборатории метан получают так:
Химические свойства алканов.
В нормальных условиях алканы – химически инертные соединения, они не реагируют с концентрированной серной и азотной кислотой, с концентрированной щелочью, с перманганатом калия.
Устойчивость объясняется прочностью связей и их неполярностью.
Соединения не склонны к реакциях разрыва связи (реакция присоединения), для них свойственно замещение.
1. Галогенирование алканов. Под воздействием кванта света начинается радикальное замещение (хлорирование) алкана. Общая схема:

Реакция идет по цепному механизму, в которой различают:
А) Инициирование цепи:



Суммарно можно представить в виде:

2. Нитрование (реакция Коновалова) алканов. Реакция протекает при 140 °С:

Легче всего реакция протекает с третитичным атомом углерода, чем с первичным и вторичным.
3. Изомризация алканов. При конкретных условиях алканы нормального строения могут превращаться в разветвленные:

4. Крекинг алканов. При дейсвии высоких температур и катализаторов высшие алканы могут рвать свои связи, образуя алкены и алканы более низшие:

5. Окисление алканов. В различных условиях и при разных катализаторах окисление алкана может привести к образованию спирта, альдегида (кетона) и уксусной кислоты. В условиях полного окисления реакция протекает до конца – до образования воды и углекислого газа:


Применение алканов.
Алканы нашли широкое применение в промышленности, в синтезе нефти, топлива и т.д.

Количество атомов углерода в молекуле вещества определяет физические свойства алканов. Чем длиннее углеродная цепь, тем твёрже вещество. Подробнее о физических свойствах алканов читайте ниже.
Гомологи
Алканы имеют общую формулу CnH2n+2. Самое простое вещество, относящееся к алканам – метан. Его также называют болотным газом. Метан образует гомологический ряд, в котором каждое последующее вещество отличается на одну группу CH2. Всего насчитывается 390 алканов.
Гомологи имеют схожие названия, состоящие из суффикса -ан и приставки, указывающей на число атомов в веществе:
- ун- или ген- – один;
- до- – два;
- три- – три;
- тетра- – четыре;
- пент- – пять;
- гекс- – шесть;
- гепт- – семь;
- окт- – восемь;
- нон- – девять;
- дек- – десять.
Приставки отсутствуют у первых четырёх гомологов. Их нужно запомнить: метан, этан, пропан, бутан.

Рис. 1. Гомологический ряд.
Начиная с бутана, все алканы имеют изомеры. Их названия соответствуют основным названиям алканов с приставкой изо-. Для указания расположения метильной группы используются более точные длинные названия. Например, диметилпропан, 3-метилпентан, 2,2-диметилоктан. Цифры в названии соответствуют атомам, к которым примыкают метильные группы.

Рис. 2. Изомеры с названиями.
Алканы – предельные углеводороды, получаемые из природных ископаемых – нефти, каменного угля, газа. Также их могут выделять из солей карбоновых кислот, путём превращения алкенов и алкинов.
Физические свойства
От положения в гомологическом ряду зависят физические свойства алканов. В таблице указано физическое состояние первых 20 алканов.
Название
Формула
Агрегатное состояние
Бесцветные газы, без запаха и вкуса. Горят бледным или голубым пламенем (пламя газовой горелки) с большим выделением тепла
Алканы реагируют при освещении с галогенами (хлором и бромом). При этом постепенно происходит замещение атомов водорода в молекуле алкана на атомы галогена:




Газообразные алканы (метан — бутан) входят в состав природного газа . Жидкие и твёрдые алканы содержатся в нефти .
Выделение большого количества теплоты позволяет использовать насыщенные углеводороды в качестве топлива .
Способность вступать в химические реакции даёт возможность применять алканы в качестве сырья для производства разнообразных органических веществ.
Читайте также:

