Физическая химия это кратко
Обновлено: 05.07.2024
Предмет физической химии – химические процессы и сопровождающие из физические явления, различные виды энергии, которые сопровождают изменение состояния веществ.
Разделы физической химии:
- Термодинамика
- Фазы переменного состава (растворы, расплавы)
- Химическое равновесие
- Химическая кинетика (скорость химической реакции)
- Теория катализа
- Электрохимия
Термодинамика изучает взаимные превращения разных видов энергий в процессах с веществами (химические реакции, изменение состояния).
Основные понятия термодинамики
Термодинамическая система – совокупность физических тел (веществ), которые обмениваются энергией и ограничены поверхностью раздела от внешней среды.
- Изолированная система – поверхность не пропускает потоки тепла и вещества
- Закрытая система – поверхность пропускает тепло
- Адиабатная система — поверхность пропускает вещество, но не тепло
- Открытая система — поверхность пропускает вещество и тепло
Термодинамические параметры
Термодинамические параметры – физические величины, описывающие состояние термодинамической системы.
Классификация термодинамических параметров
- Экстенсивные – зависят от количества вещества: объем, теплота, энергия, энтропия
- Интенсивные – не зависят от количества вещества: температура, молярные величины (теплоемкость)
- Независимые – заданы, контролируются
- Зависимые – определяются на основе независимых, рассчитываются
Независимые параметры связаны уравнением основного состояния системы:

– Уравнение идеального газа Менелеева-Клапейрона

– Уравнение Ван-дер-Ваальса неидеальный газ
- Внутренние – описывают состояние системы
- Внешние — действуют на систему
- Обобщенные координаты (xK) – изменяются, характеризуют состояние системы
- Обобщенные силы (PK) – вызывают изменение обобщенных координат

(A – работа термодинамического процесса)

Различные виды работ
μ (химический потенциал)
Функции состояние и функции процесса
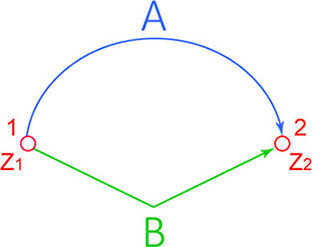
Функция состояния – функция, величина которой не зависит от пути процесса, зависит от конечного и начального состояния.




Свойства функций состояния
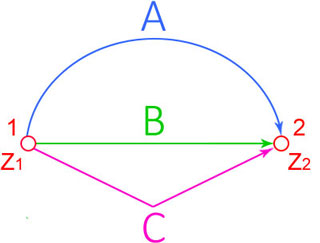
Функция процесса – функция, изменение которой зависит от пути процесса.
ХИМИЯ ФИЗИЧЕСКАЯ, раздел химии, в котором изучаются химические свойства веществ на основе физических свойств составляющих их атомов и молекул. Современная физическая химия – широкая междисциплинарная область, граничащая с различными разделами физики, биофизики и молекулярной биологии. Она имеет множество точек соприкосновения и с такими разделами химической науки, как органическая и неорганическая химия.
Отличительная особенность химического подхода (в противоположность физическому и биологическому) заключается в том, что в его рамках, наряду с описанием макроскопических явлений, объясняется их природа исходя из свойств отдельных молекул и взаимодействий между ними.
Новые инструментальные и методологические разработки в области физической химии находят применение в других разделах химии и смежных науках, например фармакологии и медицине. В качестве примеров можно привести электрохимические методы, инфракрасную (ИК-) и ультрафиолетовую (УФ-) спектроскопию, лазерную и магниторезонансную технику, которые широко используются в терапии и для диагностики различных заболеваний.
Основными разделами физической химии традиционно считаются: 1) химическая термодинамика; 2) кинетическая теория и статистическая термодинамика; 3) вопросы строения молекул и спектроскопия; 4) химическая кинетика.
Химическая термодинамика.
Химическая термодинамика непосредственно связана с применением термодинамики – науки о теплоте и ее превращениях – к проблеме химического равновесия. Суть проблемы формулируется следующим образом: если имеется смесь реагентов (система) и известны физические условия, в которых она находится (температура, давление, объем), то какие самопроизвольные химические и физические процессы могут привести эту систему к равновесию? Первый закон термодинамики гласит, что теплота есть одна из форм энергии и что полная энергия системы (вместе с ее окружением) остается неизменной. Таким образом, этот закон является одной из форм закона сохранения энергии. Согласно второму закону, самопроизвольно протекающий процесс приводит к возрастанию общей энтропии системы и ее окружения. Энтропия – это мера того количества энергии, которое система не может потратить на совершение полезной работы. Второй закон указывает направление, по которому пойдет реакция без каких-либо внешних воздействий. Чтобы изменить характер реакции (например, ее направление), нужно затратить энергию в той или иной форме. Таким образом, он налагает строгие ограничения на величину работы, которая может быть совершена в результате преобразования теплоты или химической энергии, выделяющихся в обратимом процессе.
Важными достижениями в химической термодинамике мы обязаны Дж.Гиббсу, который заложил теоретический фундамент этой науки, позволившей объединить в единое целое результаты, полученные многими исследователями предыдущего поколения. В рамках разработанного Гиббсом подхода не делается никаких допущений о микроскопической структуре материи, а рассматриваются равновесные свойства систем на макроуровне. Вот почему можно думать, что первый и второй законы термодинамики носят универсальный характер и останутся справедливыми даже тогда, когда мы узнаем гораздо больше о свойствах молекул и атомов.
Несмотря на то что законы химической термодинамики уже установлены, на макроскопическом уровне термодинамика – активно развивающаяся область науки. Большой практический интерес представляет термодинамическое описание некоторых необычных химических реакций и систем, а также применение термодинамических концепций к решению таких жизненно важных проблем, как получение энергии, утилизация отходов, использование теплоты, выделяющейся в некоторых технологических процессах. По мере того как синтезируются новые химические соединения и на их основе создаются новые материалы, возникает необходимость в определении их термодинамических характеристик (см. также ТЕПЛОТА; ТЕРМОДИНАМИКА; ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА).
Кинетическая теория и статистическая термодинамика.
Каковы изменения энергии и энтропии в ходе химических реакций? Ответ на этот вопрос дают кинетическая теория и статистическая термодинамика. Согласно кинетической теории, все вещества, в каком бы состоянии они ни находились – жидком, твердом или газообразном, – состоят из атомов, находящихся в постоянном движении. В твердых телах и жидкостях атомы так или иначе связаны друг с другом, а в газах практически свободны. Термодинамические свойства систем – уравнения состояния (соотношения, связывающие давление, объем, температуру и число атомов), теплоемкость, энтропия и другие величины – выводятся из представления о том, что движение атомов подчиняется законам классической, ньютоновской механики. Статистическая термодинамика расширяет это представление, полагая, что молекулы – основные единицы материи – ведут себя в соответствии с законами квантовой механики, а не классической физики. Квантовая механика - это математическая теория, описывающая свойства микромира исходя из допущения об их вероятностном характере. Так, физики говорят не о точном положении частицы в пространстве, а о вероятности нахождения ее в определенной области пространства. Кинетическая теория и статистическая термодинамика трактуют понятие энтропии на молекулярном уровне как меру неупорядоченности системы; эта мера определяется уравнением Больцмана, где S – энтропия, k – постоянная Больцмана W – число микроскопических состояний системы (см. также ЖИДКОСТЕЙ ТЕОРИЯ; КВАНТОВАЯ МЕХАНИКА).
Статистическая термодинамика (как и квантовая механика) позволяет предсказать положение равновесия для некоторых реакций в газовой фазе. С помощью квантовомеханического подхода удается описать поведение сложных молекул ряда веществ, находящихся в жидком и твердом состоянии. Однако существуют реакции, скорость которых не может быть рассчитана ни в рамках кинетической теории, ни с помощью статистической термодинамики.
Настоящая революция в классической статистической термодинамике произошла в 70-х годах 20 в. Новые концепции, такие, как универсальность (представление о том, что члены некоторых широких классов соединений обладают одинаковыми свойствами) и принцип подобия (оценка неизвестных величин исходя из известных критериев), позволили лучше понять поведение жидкостей вблизи критической точки, когда исчезает различие между жидкостью и газом. С помощью ЭВМ были смоделированы свойства простых (жидкий аргон) и сложных (вода и спирт) жидкостей в критическом состоянии. Сравнительно недавно свойства таких жидкостей, как жидкий гелий (поведение которых прекрасно описывается в рамках квантовой механики), и свободных электронов в молекулярных жидкостях были всесторонне исследованы с применением компьютерного моделирования (см. также ГЕЛИЙ; СВЕРХПРОВОДИМОСТЬ). Это позволило лучше понять свойства обычных жидкостей. Компьютерные методы в сочетании с новейшими теоретическими разработками интенсивно используются для изучения поведения растворов, полимеров, мицелл (специфических коллоидных частиц), белков и ионных растворов. Для решения задач физической химии, в частности для описания некоторых свойств систем в критическом состоянии и исследования вопросов физики высоких энергий, все чаще применяется математический метод ренормализационной группы (см. также МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ).
Строение молекул и спектроскопия.
Химики-органики 19 в. разработали простые правила определения валентности (способности к объединению) многих химических элементов. Например, они установили, что валентность углерода равна 4 (один атом углерода может присоединить четыре атома водорода с образованием молекулы метана CH4), кислорода – 2, водорода – 1. Исходя из эмпирических представлений, основанных на опытных данных, высказывались предположения о пространственном расположении атомов в молекулах (например, молекула метана имеет тетраэдрическую структуру, при этом атом углерода находится в центре треугольной пирамиды, а водород – в четырех ее вершинах). Однако этот подход не позволял раскрыть механизм образования химических связей, а значит, оценить размеры молекул, определить точное расстояние между атомами.
С помощью спектроскопических методов, разработанных в 20 в., была определена структура молекул воды (H2O), этана (C2H6), а затем и гораздо более сложных молекул, таких, как белки. Методы СВЧ-спектроскопии (ЭПР, ЯМР) и электронной дифракции позволили установить длины связей, углы между ними (валентные углы) и взаимное расположение атомов в простых молекулах, а рентгеноструктурный анализ – аналогичные параметры для более крупных молекул, образующих молекулярные кристаллы. Составление каталогов молекулярных структур и использование простых представлений о валентности заложили основы структурной химии (пионером ее был Л.Полинг) и дали возможность использовать молекулярные модели для объяснения сложных явлений на молекулярном уровне. Если бы молекулы не имели определенной структуры или если бы параметры связей C–C и С–H в хромосомах сильно отличались от таковых в молекулах метана или этана, то с помощью простых геометрических моделей Дж.Уотсон и Ф.Крик не смогли бы построить в начале 1950-х годов свою знаменитую двойную спираль – модель дезоксирибонуклеиновой кислоты (ДНК). Исследуя методами ИК- и УФ-спектроскопии колебания атомов в молекулах, удалось установить природу сил, удерживающих атомы в составе молекул, что, в свою очередь, навело на мысль о наличии внутримолекулярного движения и позволило исследовать термодинамические свойства молекул (см. выше). Это был первый шаг к определению скоростей химических реакций. Далее, спектроскопические исследования в УФ-области помогли установить механизм образования химической связи на электронном уровне, что позволило описывать химические реакции, основываясь на представлении о переходе реагентов в возбужденное состояние (часто под действием видимого или УФ-света). Возникла даже целая научная область – фотохимия. Спектроскопия ядерного магнитного резонанса (ЯМР) дала возможность химикам исследовать отдельные стадии сложных химических процессов и идентифицировать активные центры в молекулах ферментов. Этот метод позволил также получить трехмерные изображения интактных клеток и отдельных органов. См. также МАГНИТНЫЙ РЕЗОНАНС; ФОТОХИМИЯ.
Теория валентности.
Используя эмпирические правила валентности, разработанные химиками-органиками, периодическую систему элементов и планетарную модель атома Резерфорда, Г.Льюис установил, что ключом к пониманию химической связи является электронная структура вещества. Льюис пришел к выводу, что ковалентная связь образуется в результате обобществления электронов, принадлежащих разным атомам; при этом он исходил из представления о том, что связывающие электроны находятся на строго определенных электронных оболочках. Квантовая теория позволяет предсказать структуру молекул и характер образующихся ковалентных связей в самом общем случае (см. также ХИМИЯ).
Наши представления о строении вещества, сформировавшиеся благодаря успехам квантовой физики в первой четверти 20 в., можно вкратце изложить следующим образом. Структура атома определяется балансом электрических сил отталкивания (между электронами) и притяжения (между электронами и положительно заряженным ядром). Почти вся масса атома сосредоточена в ядре, а его размер определяется объемом пространства, занятого электронами, которые вращаются вокруг ядер. Молекулы состоят из относительно стабильных ядер, удерживаемых вместе быстро движущимися электронами, так что все химические свойства веществ можно объяснить исходя из представления об электрическом взаимодействии элементарных частиц, из которых состоят атомы и молекулы. Таким образом, главные положения квантовой механики, касающиеся строения молекул и образования химических связей, создают основу для эмпирического описания электронной структуры вещества, природы химической связи и реакционной способности атомов и молекул (см. также АТОМ).
Химическая кинетика
занимается изучением механизма химических реакций и определением их скоростей. На макроскопическом уровне реакцию можно представить в виде последовательных превращений, в ходе которых из одних веществ образуются другие. Например, кажущееся простым превращение
на самом деле состоит из нескольких последовательных стадий:
и каждая из них характеризуется своей константой скорости k. С.Аррениус предположил, что абсолютная температура T и константа скорости реакции k связаны соотношением k = A exp( - Eакт)/RT, где А – предэкспоненциальный множитель (т.н. частотный фактор), Еакт – энергия активации, R – газовая постоянная. Для измерения k и Т нужны приборы, позволяющие отслеживать события, которые происходят за время порядка 10 –13 с, с одной стороны, и за десятилетия (и даже тысячелетия) – с другой (геологические процессы); необходимо также уметь измерять ничтожно малые концентрации чрезвычайно нестабильных реагентов. В задачу химической кинетики входит, кроме того, прогнозирование химических процессов, протекающих в сложных системах (речь идет о биологических, геологических, атмосферных процессах, о горении и химическом синтезе).
где CH3-группа ориентирована по-разному относительно приближающегося атома калия.
Один из вопросов, которым занимается физическая химия (а также химическая физика), – расчет констант скоростей реакции. Здесь широко применяется разработанная в 1930-х годах теория переходного состояния, в которой используются термодинамические и структурные параметры. Эта теория в сочетании с методами классической физики и квантовой механики позволяет моделировать ход реакции, как если бы она протекала в условиях эксперимента с молекулярными пучками. Проводятся опыты по лазерному возбуждению определенных химических связей, позволяющие проверить правильность статистических теорий деструкции молекул. Разрабатываются теории, обобщающие современные физические и математические концепции хаотических процессов (например, турбулентности). Мы уже не так далеки от того, чтобы до конца понять природу как внутри-, так и межмолекулярных взаимодействий, раскрыть механизм реакций, протекающих на поверхностях с заданными свойствами, установить структуру каталитических центров ферментов и комплексов переходных металлов. Что касается микроскопического уровня, можно отметить работы по изучению кинетики образования таких сложных структур, как снежинки или дендриты (кристаллы с древовидной структурой), которые стимулировали развитие компьютерного моделирования, основанного на простых моделях теории нелинейной динамики; это открывает перспективы создания новых подходов к описанию строения и процессов развития сложных систем. См. также БИОХИМИЯ; БИОФИЗИКА; ХИМИИ ИСТОРИЯ; КРИСТАЛЛЫ И КРИСТАЛЛОГРАФИЯ; ФИЗИКА; РАСТВОРЫ; СВЕРХТЕКУЧЕСТЬ.
Даниэлс Ф., Олберти Р. Физическая химия. М., 1978
Эткин П.М. Физическая химия. М., 1980
Фролов Ю.Г., Белик В.В. Физическая химия. М., 1993
Грязнов В.М., Гульянова С.Г. Физическая химия. М., 1994

Физи́ческая хи́мия — наука об общих законах, определяющих строение и химические превращения веществ при различных внешних условиях. Исследует химические явления с помощью теоретических и экспериментальных методов физики.
Содержание
История физической химии
Различие между физической химией и химической физикой
Обе эти науки находятся на стыке между химией и физикой, иногда химическую физику включают в состав физической химии. Провести чёткую границу между этими науками не всегда возможно. Однако с достаточной степенью точности это отличие можно определить следующим образом:
- физическая химия рассматривает суммарно процессы, протекающие с одновременным участием множества частиц;
- химическая физика рассматривает отдельные частицы и взаимодействие между ними, то есть конкретные атомы и молекулы (таким образом, в ней нет места понятию « Разделы физической химии
Коллоидная химия
[2] . Она изучает адгезию, адсорбцию, смачивание, коагуляцию, электрофорез и разрабатывает технологии строительных материалов, бурения горных пород, золь-гель-технологии. Современная коллоидная химия представляет собой науку, которая находится на стыке химии, физики, биологии.
Основные направления современной коллоидной химии:
- Термодинамика поверхностных явлений.
- Изучение адсорбции ПАВ.
- Изучение образования и устойчивости дисперсных систем, их молекулярно-кинетических, оптических и электрических свойств.
- Физико-химическая механика дисперсных структур.
- Разработка теории и молекулярных механизмов процессов, происходящих в дисперсных системах под влиянием ПАВ, электрических зарядов, механического воздействия и т. п.
Кристаллохимия
[3] . Будучи разделом химии, кристаллохимия тесно связана с кристаллографией и изучает пространственное расположение и химическую связь атомов в кристаллах, а также зависимость физических и химических свойств кристаллических веществ от их строения. С помощью рентгеноструктурного анализа, структурной электронографии и нейтронографии кристаллохимия определяют абсолютные величины межатомных расстояний и углы между линиями химических связей (валентные углы). Кристаллохимия располагает обширным материалом о кристаллических структурах более 425 тысяч соединений, более половины из которых составляют неорганические соединения.
В задачи кристаллохимии входит:
- систематика кристаллических структур и описание наблюдающихся в них типов химической связи;
- интерпретация кристаллических структур (выяснение причин, определяющих строение того или иного кристаллического вещества) и их предсказание; * изучение связи физических и химических свойств кристаллов с их структурой и характером химической связи.
Радиохимия
Радиохимия ведёт работу со сверхмалыми количествами веществ и с очень сильно разбавленными растворами, а также с источниками ионизирующих излучений [4] . Радиоактивность изучаемых радиохимией веществ позволяет и требует использовать специфические высокочувствительные методы измерения их микроскопических количеств, дистанционные автоматизированные методы анализа.
Термохимия
Сравнительный размер атома гелия и его ядра
А́том (от др.-греч. ἄτομος — неделимый) — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. В некоторых случаях под атомами понимают только электронейтральные системы, в которых заряд ядра равен суммарному заряду электронов, тем самым противопоставляя их электрически заряженным ионам.
Ядро, несущее более чем 99,9 % массы атома, состоит из положительно заряженных протонов и незаряженных нейтронов, которые связанны между собой при помощи сильного взаимодействия. Атомы классифицируются по количеству протонов и нейтронов в ядре: число протонов Z соответствует порядковому номеру атома в периодической системе и определяет его принадлежность к некоторому химическому элементу, а число нейтронов N — определённому изотопу этого элемента. Число Z также определяет суммарный положительный электрический заряд (Ze) атомного ядра и число электронов в нейтральном атоме, задающее его размер. Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы.

Ржавчина, самый распространенный вид коррозии.
Учение о коррозии металлов
Учение о растворах
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений [6] .
Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц:
Реакции с молекулярностью более трёх неизвестны.
Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Чётко определенной взаимосвязи между понятиями молекулярности и порядка реакции нет, так как порядок реакции характеризует кинетическое уравнение реакции, а молекулярность — механизм реакции.
Фотохимия
Основными направлениями химической термодинамики являются:
- Классическая химическая термодинамика, изучающая термодинамическое равновесие вообще.
- Термохимия, изучающая тепловые эффекты, сопровождающие химические реакции.
- Теория растворов, моделирующую термодинамические свойства вещества исходя из представлений о молекулярном строении и данных о межмолекулярном взаимодействии.
Химическая термодинамика тесно соприкасается с такими разделами химии, как
Физико-химический анализ — комплекс методов анализа физико-химических систем путем построения и геометрического анализа диаграмм состав-свойство. Этот метод позволяет обнаружить существование соединений (например, температур фазовых переходов от состава. Однако на рубеже XIX—XX веков Н. С. Курнаков показал, что любое физическое свойство системы является функцией состава, а для изучения фазового состояния можно использовать коэффициент рефракции, [8] .
Теория реакционной способности химических соединений
Химия высоких энергий
Химия высоких энергий — раздел физической химии, описывающий химические и физико-химические процессы, происходящие в веществе при воздействии нетепловыми энергетическими агентами — ионизирующим излучением, светом, плазмой, ультразвуком, механическим ударом и другими [9] .
Химия высоких энергий (ХВЭ) изучает химические реакции и превращения, происходящие в веществе под воздействием нетепловой энергии. Механизмы и кинетика таких реакций и превращений характеризуются существенно неравновесными концентрациями быстрых, возбужденных или ионизированных частиц с энергией большей, чем энергия их теплового движения и в ряде случаев химической связи. Носители нетепловой энергии, воздействующей на вещество: ускоренные электроны и ионы, быстрые и медленные нейтроны, альфа- и бета-частицы, позитроны, мюоны, пионы, атомы и молекулы при сверхзвуковых скоростях, кванты электромагнитного излучения, а также импульсные электрические, магнитные и акустические поля.
Внешним проявлением ХВЭ служит образование ионов и возбуждённых состояний атомов и молекул при комнатных температурах, при которых эти частицы не могут возникнуть за счет равновесных процессов. Н. Е. Аблесимов сформулирован релаксационный принцип управления свойствами неравновесных физико-химических систем. В случае, когда времена релаксации много больше длительности физического воздействия, существует возможность управления выходом химических форм, фаз и, как следствие, свойствами веществ (материалов), используя сведения о механизмах релаксации в неравновесных конденсированных системах на физико-химической стадии релаксационных процессов (в том числе и в процессе эксплуатации).
Основные разделы ХВЭ
Лазерная химия
лазерного излучения и в которых специфические свойства лазерного излучения играют решающую роль, а также хемолазерные процессы ( [10] . Монохроматичность лазерного излучения позволяет селективно возбуждать спектре поглощения вещества. Таким образом подбирая частоту возбуждения, удается не только осуществлять избирательную активацию молекул, но и менять глубину проникновения излучения в зону реакции.
Возможность фокусировки лазерного излучения позволяет вводить энергию локально, в определенную область объёма, занимаемого реагирующей смесью. Лазерное воздействие на химические реакции может быть тепловым и фотохимическим. Лазерная офтальмология и микрохирургия, в конечном счете, та же лазерная химия, но для медицинских целей.
Радиационная химия
химии высоких энергий , раздел физической химии — изучает химические процессы, вызываемые воздействием ионизирующих излучений на вещество [11] .
В рамках радиационной химии рассматриваются некоторые химические процессы, невозможные при использовании традиционных химических подходов. Ионизирующие излучения могут сильно снижать температуру протекания химических реакций без применения катализаторов и инициаторов.
История радиационной химии
Радиационная химия возникла после открытия x-лучей радиоактивности А. Беккерелем в 1896 году, которые первыми наблюдали радиационные эффекты в фотопластинках.
Основные направления ядерной химии:
химической науки, в котором рассматриваются системы и электрического тока, исследуются процессы в проводниках, на металлов или полупроводников, включая графит) и в ионных проводниках ( восстановления , протекающие на пространственно-разделённых электродах, перенос ионов и электронов. Прямой перенос заряда с Электролитическая диссоциация Теория Дебая-Хюккеля Двойной электрический слой Химические источники тока ( Звукохимия
Физическая химия — наука, которую часто называют центральной из-за ключевых позиций в современной науке и технике. Большинство явлений в биологических науках, науках о земле можно охарактеризовать с точки зрения поведения атомов и молекул, а также принципов, лежащих в основе значительного прогресса в медицине и технике. Теоретическое и практическое мышление присутствует в этой науке.
Физическая химия-это количественная химия.
Он действует на стыке физики, биологии, медицины и химии. Это одна из традиционных дисциплин химии, которая занимается применением концепций и теорий физики к анализу химических свойств и реактивного поведения вещества.
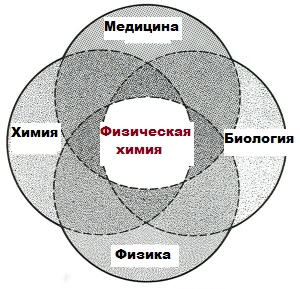
Кроме того физико химические системы увлекательные и часто красивые в их собственном праве.
Современные исследования в области химических наук во все большей степени направлены на изучение явлений на наноуровне в диапазоне размеров между отдельными молекулами и макроскопической материей.
Физическая химия — раздел химии, занимающийся взаимодействиями и превращениями материалов. Раздел имеет дело с принципами физики, лежащими в основе всех химических взаимодействий стремясь измерить, соотнести и объяснить количественные аспекты реакций. Химические реакции лежат в основе производства практически всего в нашем современном мире.
- Но какова же движущая сила реакций?
- Почему одни реакции происходят в геологических масштабах времени, а другие настолько быстры, что для их изучения нам нужны фемтосекундные импульсные лазеры?
- В конечном счете, что же происходит на атомном уровне?
На такие фундаментальные вопросы и многое другое пытается ответить наука физическая химия.
Физическая химия объединяет химию с физикой. Физико-химики изучают взаимодействие материи и энергии. Термодинамика и квантовая механика являются двумя важными разделами физической химии.
Возможность измерить, понять и контролировать свойства материи на этих масштабах позволяет проводить концептуальные и практические связи между субмикроскопическим миром атомов и молекул, и макроскопическим миром, с которыми мы взаимодействуем.
Наука на основе физики
Физическая химия изучает то, как вещество ведет себя на молекулярном и атомном уровне и как происходят химические реакции.
На основе их анализа, физикохимики могут разрабатывать новые теории, например, как формируются сложные структуры. Имеющие эту специальность люди часто работают в тесном сотрудничестве с другими учеными для исследования и разработке потенциальных возможностей использования новых материалов.
Эта наука о законах строения и превращения веществ традиционно располагает к работе способствуя различным научным карьерам. Многие люди, обученные в качестве физических химиков, в конечном счете работают как химики-аналитики, понимая фундаментальный процесс, связанный с аналитическими методами, что позволяет им улучшать и расширить эти методы.
Что делают физикохимики
Физикохимик сосредоточен на понимании свойств атомов и молекул: как химические реакции работают и эти свойства раскрываются. Работа включает в себя анализ материалов, разработку методов тестирования и характеризует свойства материалов, разработку теории об этих свойствах и открывают для себя возможности использования материалов. Использование сложных приборов и оборудования всегда было важным аспектом этих знаний. Большинство лабораторий имеют аналитические инструменты, которые могут включать в себя лазеры, масс-спектрометры, приборы ядерного магнитного резонанса и электронные микроскопы.
Открытия физикохимиков основаны на понимании химических свойств и описания их поведения с помощью теории науки о законах природы и математических вычислений. Ученые в этой специальности рассматривают свойства и прогнозируют реакции химических веществ, а затем проверяют и уточняют процессы. При этом используется математический анализ и статистические данные об огромных массивах данных, иногда с миллионами точек данных, чтобы выявить скрытую информацию о соединениях, материалах и процессах.

Чтобы выявить свойства материалов ученые могут также проводить моделирование, разработку математических уравнений, которые предсказывают, как соединения будут реагировать с течением времени.
В последнее время все больше и больше ученых задействованы в новых областях материаловедения и молекулярного моделирования, где их навыки в анализе и прогнозировании поведения свойств имеют новые приложения.
Объединив математическую жесткость физической химии с практичностью новых материалов и новых приложений, область этой науки расширяет и новые интересные способы.
Рождение физической химии было чревато противоречиями и спорами. Современная физическая химия имеет тенденцию к доминированию тем в атомной и молекулярной структуре, квантовой химии и спектроскопии.
Читайте также:

