Фазы железоуглеродистых сплавов кратко
Обновлено: 03.07.2024
Фазовые диаграммы представляют собой изображение зон существования фаз, которые имеются в сплаве при различных условиях (температура, давление, химсостав).
Диаграмма железо углерод описывает подходящие условия для существования двух или более фаз в равновесии. Популярная аналогия: фазовая диаграмма воды описывает точку (тройную точку), в которой вода может сосуществовать в трёх разных фазах одновременно. Это происходит при температуре чуть выше точки замерзания (0,01 ° C) и при давлении 0,006 атм.
Существует четыре основных применения фазовых диаграмм:
- Разработка новых сплавов на основе требований применения.
- Производство этих сплавов.
- Разработка и контроль соответствующих процедур термообработки, которые предназначены для улучшения химических, физических и механических свойств сплавов.
- Устранение проблем, возникающих при применении новых сплавов, что в конечном итоге улучшает предсказуемость свойств продукта.
При разработке сплава фазовые диаграммы помогают предотвращать проектирование чрезмерно большого количества вариантов, сокращая затраты и время обработки. Они также помогают разрабатывать альтернативные сплавы или такие же, но с альтернативными легирующими элементами.
Компонентный состав
Диаграмма железо-углерод была разработана, чтобы показать микроструктурное состояние металла как функцию температуры и содержания углерода. Она показывает, что, в зависимости от интенсивности охлаждения стали, в ней могут возникать очень разные микроструктуры.
Когда металл расплавлен, то есть находится в жидком состоянии, решётчатые структуры отсутствуют. Атомы могут свободно перемещаться во всех направлениях. Чтобы достичь желаемых кристаллических структур, необходимо, чтобы металл медленно и полностью остыл при комнатной температуре. Промежуточные термические обработки положительно влияют на формирование кристаллических структур.
По вертикальной оси диаграммы железо-углерод располагается шкала температур в °C. Металл показан здесь от твердого до жидкого состояния. Например, чистое железо начинает плавиться при 1147°C. Температура устойчивого состояния расплава - 1536 °C.
По горизонтальной оси указывается процентное содержание углерода в металле.
Диаграмма показывает участки, в которых металл находится только в состоянии. расплава, феррита или аустенита. Остальные зоны характеризуются определённым сочетанием свойств. Это, например, расплав и аустенит, аустенит и феррит, феррит и перлит.
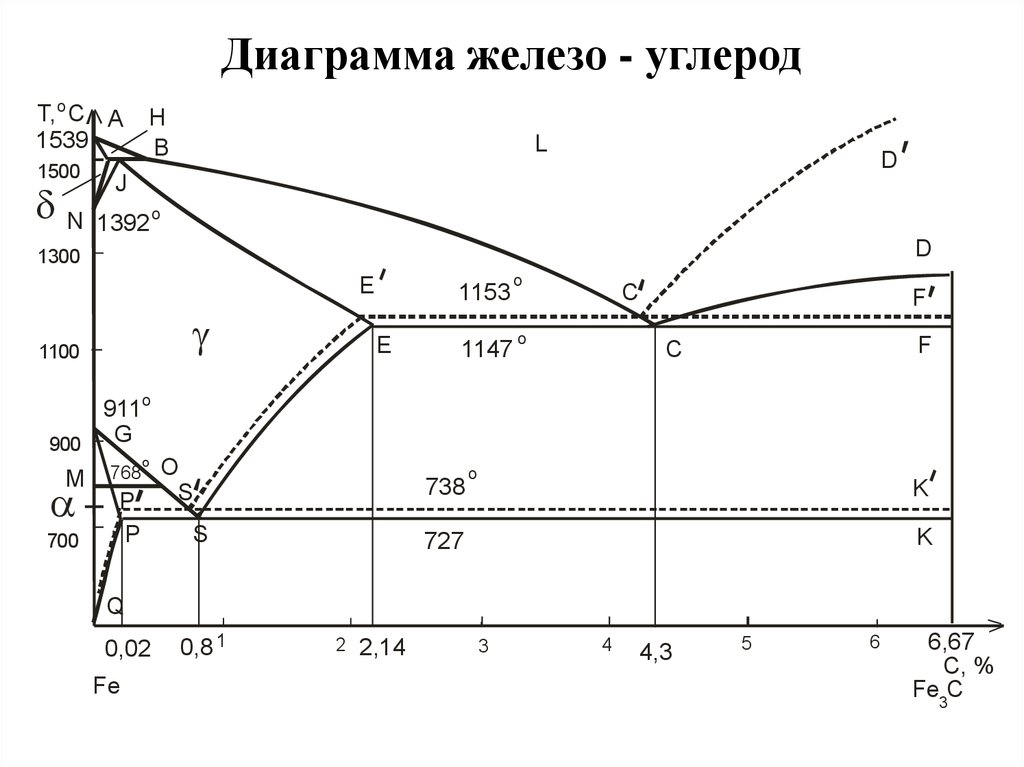
Обозначение точек пересечения заглавными буквами на линиях преобразования предназначено для лучшего понимания. Они указывают на переход в другое состояние или условие.
Диаграмма предполагает постоянное охлаждение металлов. Если металл медленно охлаждать, образуются крупные зёрна, если же металл остывает быстро, то размеры зёрен уменьшаются. Тип зерна металла определяет его прочностные свойства. Крупнозернистый материал имеет меньшую прочность, но его можно сделать более мелким и, следовательно, более прочным путём термической обработки или пластического деформирования (упрочнением). Самый высокий уровень прочности имеет именно мелкозернистый металл.
Выполним краткую характеристику основных химических компонентов диаграммы.
Железо
Железо образует кубическую пространственную решётку. Атомы железа расположены по углам этой решётки. Количество углерода, которое может быть растворено в железе, зависит от модификации железа, потому что разные формы кристаллической решетки железа (например, кубическая пространственно-центрированная и кубическая гранецентрированная) имеют межстраничные промежутки разного размера.
Второстепенную роль играет дельта-смешанный кристалл, который имеет объемно-центрированные атомы, но существует только в высоколегированных сталях. Эти кристаллы образуются в диапазоне температур от 1536 °C (точка плавления чистого железа) до 1392 °C.
Альфа-смешанный кристалл существует как объемно-центрированная кубическая решетка. Эти структуры образуются в чистом железе до температуры 911 °C.
В гамма смешанном кристалла атомы железа гранецентрированы, и это означает, что они расположены в середине каждой грани куба. Эти кристаллы образуются при температурах от 1392 °C до 911 °C в чистом железе.
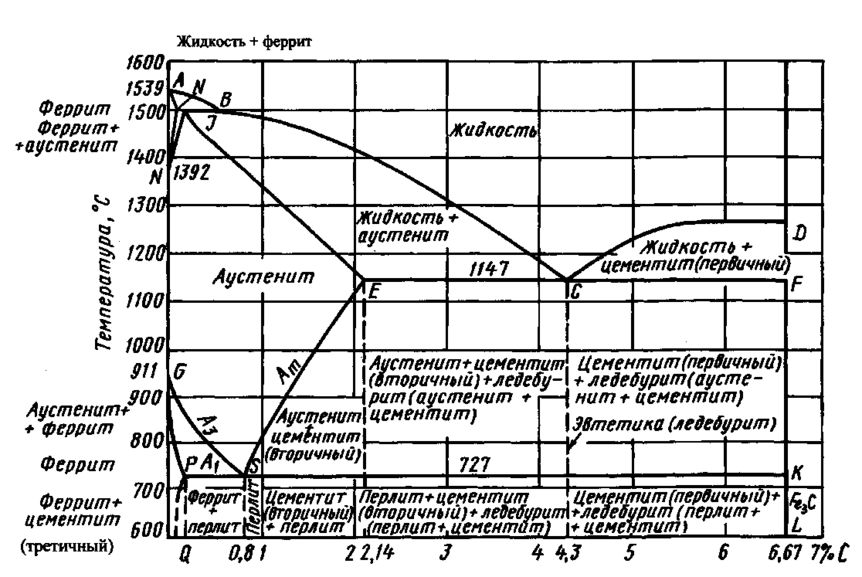
Углерод
В низких концентрациях, углерод не образует твёрдого химического соединения с железом, но откладывается в промежутках кристаллической решетки железа.
Углерод в железе является примесью внедренияи может существовать в форме гранецентрированную или объемно-центрированной кубической решётки. Диаграмма состояния сплавов железо-углерод устанавливает области стабильного существования твёрдого раствора с α, γ и δ фазами железа.
Описанные выше кристаллические решётки имеют различную растворимость углерода в зависимости от температуры. Углерод осаждается в междуузельных пространствах кристаллической решётки, при этом гранецентрированная кубическая решетка, также называемая аустенитом, имеет растворимость не более чем в сто раз выше, чем кристаллы феррита.
Цементит
Цементит - метастабильная фаза сплава с фиксированным составом, имеющий химическую формулу Fe3C. При комнатной температуре цементит очень медленно разлагается на железо и углерод (графит).
Некоторые другие факторы (например, высокие температуры и добавление определенных легирующих элементов) могут влиять на это разложение, поскольку они способствуют образованию графита.
Цементит твёрдый и хрупкий, что делает его пригодным для упрочнения сталей (существует специальная технология химико-термической обработки стали, которая называется цементацией). Механические свойства цементита зависят от его микроструктуры, а также от условий связи с ферритом.
Жидкий раствор Fe-C на диаграмме обозначается выше линии L (ликвидус). Поскольку δ-феррит плавится при 1538 °C, очевидно, что температура плавления железа снижается с увеличением содержания углерода.
Перлит
Зёрна перлита включают в себя структурные объединения, где все образовавшиеся пластины между собой параллельны. При возрастании числа перлитных конкреций рост размеров пластин приостанавливается, а сами они могут изменить направление своего движения. С уменьшением температуры колонии перлита превращаются в шаровидные мелкозернистые образования.
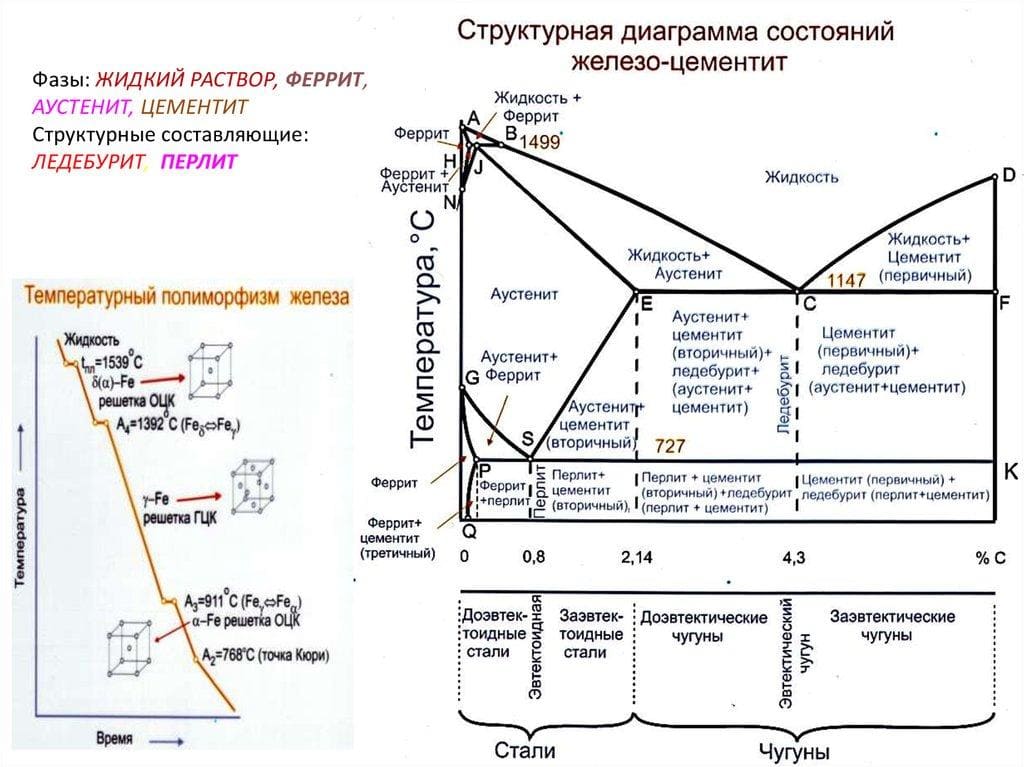
Ледебурит в сталях
Ледебурит - один из основных структурных компонентов железоуглеродистых сплавов и является эвтектическую смесью аустенита и цементита, которая образуется при 1145°C и ниже (для чистых железоуглеродистых сплавов). Аустенит превращается в ферритно-цементитную смесь при температурах ниже 723°C. В сталях ледебурит, состоящий из аустенита и карбидов, образуется только при очень высоком содержании компонентов сплава и углерода (0,7…1,0%); такие стали (называются ледебуритовыми сталями.
Метастабильная нелегированная эвтектика ледебурита Fe – Fe3C классифицируется как квазирегулярная. Доказано, что после зарождения Fe3C рост пластин цементита происходит быстро, в результате на стыках образуется аустенит, и возникает взаимосвязь ориентации. Fe3C и аустенит также растут совместно и образуют стержневую структуру, которая располагается перпендикулярно пластинам цементита. Эти два режима роста образуют квазирегулярную структуру, но рост по краю происходит быстрее, чем по бокам, и доминирует в структуре. Эксперименты по направленной кристаллизации показали, что рабочая точка на кривой роста квазирегулярной структуры близка к точке экстремума. Такую квазирегулярную структуру можно модифицировать закалкой, но модификация примесей пока не исследовалась.
Структурная подложка сталей ледебуритного класса имеет доэвтектические компоненты, включающие перлит, ледебурит и шаровидный графит. Легированный слой состоит из дендритов и междендритов. В чугуне с шаровидным графитом конкреции графита постепенно растворяются в ванне расплава, и в то же время под действием гидродинамических сил и сил текучести перемещаются к поверхности.

Фазы в системе “железо-углерод”
Фазы - это физически однородные состояния сплава. Фаза имеет точный химический состав - определенное расположение и связь между атомами. Такая структура атомов придает разные свойства различным фазам.
Некоторые специальные сплавы могут существовать в нескольких фазах, что достигается нагревом металла до определенных температур и использованием разных процедур термообработки.
Жидкая
Существует при температуре, которая превышает 1457 o C. Фазовое превращение при этой температуре означает полное плавление, поэтому на диаграмме жидкая фаза всегда обозначается линией L.
Феррит
На диаграмме присутствует в трёх разных фазах:
- Фаза дельта-феррита (δ-Fe) представляет собой твердый раствор C в δ-Fe (ОЦК) в высокотемпературной области диаграммы. Раствор стабилен при температуре выше 1400 °C и плавится при температуре выше 1539 °C. Структурно подобен α-ферриту;
- Фаза гамма-феррита (γ-Fe) является твёрдым раствором C в γ-Fe, который называют аустенитом. Нестабилен ниже температуры 910 °C, превращаясь в δ-феррит при 1395 ° C.. Максимальная растворимость углерода составляет около 2,1% при 1147 °C. Аустенит мягок и пластичен, не обладает магнитными свойствами;
- Фаза альфа-феррита (α-Fe) представляет собой твердый раствор C в α-Fe с ОЦК-решёткой. Считается самой стабильной формой железа при комнатной температуре. Максимальная растворимость углерода составляет около 0,02% при 727 °C. Мягче аустенита, магнитен.
Аустенит в сталях
Аустенит всегда присутствует в нержавеющих сталях, которые содержат от 16 до 26 процентов хрома и до 35 процентов никеля. Аустенитные стали, помимо высокой коррозионной стойкостью, не закаливаются при термической обработке и немагнитны.

Формы существования цементита важны для определения коррозионной стойкости сталей. Доказано, что цементит (Fe3C) увеличивает скорость коррозии, причём этот эффект более выражен, когда он образует когерентную сеть на поверхности. В нормализованных сталях цементит образует когерентную сетку, а в отпущенном мартенсите - нет. Поэтому цементит влияет на скорость коррозии нормализованной, но не закалённой стали.
В целом скорость коррозии углеродистой стали снижается с увеличением содержания хрома из-за образования защитного оксида хрома. Однако, когда хром соединяется с углеродом с образованием карбида хрома, положительный эффект хрома теряется.
Влияние микроструктуры различных низколегированных сталей, показанное на этой модели, распространяется только на условия, в которых не образуются защитные плёнки. Более того, образование карбидной сетки на поверхности нормализованной стали - процесс, зависящий от времени.
Узловые критические точки

В этих точках происходят эвтектические реакции, при которых жидкая фаза затвердевает и превращается в смесь двух твердых фаз. Это происходит при охлаждении жидкого сплава эвтектического состава до его эвтектической температуры.
Сплавы, образующиеся на этом этапе, известны как эвтектические сплавы. Слева от этой точки сплавы называются заэвтектическими, а справа – заэвтектическими.
Значение линий диаграммы
Границы, пересекающиеся друг с другом, отмечают определенные области на диаграмме. Внутри каждой зоны может существовать отдельная фаза или две фазы. На границе происходит фазовый переход. Эти области являются фазовыми полями, они указывают фазы, присутствующие для определенного состава и температуры сплава.
На диаграмме имеется несколько характерных линий, обозначаемых как A1, A2, A3, A4 и ACM. При повышении или понижении температуры металла на этих границах происходит фазовый переход. Обычно при нагревании сплава его температура повышается, но вдоль этих линий нагрев приводит к перестройке структуры в другую фазу, и, таким образом, температура перестаёт расти до тех пор, пока фаза полностью не изменится. Этот процесс называется термической остановкой.
Элементы легированной стали - никель, марганец, хром, и молибден - влияют на положение этих границ на фазовой диаграмме. Границы могут сдвигаться в любом направлении в зависимости от используемого элемента. Например, на диаграмме состояния железа и углерода добавление никеля понижает границу A3, а добавление хрома увеличивает её.
Компонентами железоуглеродистых сплавов являются железо, углерод и цементит.
1. Железо – имеет высокую температуру плавления – 1539 o С± 5 o С.
В твердом состоянии железо может находиться в двух модификациях (рис.1.2). Полиморфные превращения происходят при температурах 911 о С и 1392 o С. При температуре ниже 911 o С существует Feα с объемно-центрированной кубической решеткой. В интервале температур 911…1392 o С устойчивым является Feγ с гранецентрированной кубической решеткой. Выше 1392 o С железо имеет объемно-центрированную кубическую решетку и называется Feδ или высокотемпературное Feα. Высокотемпературная модификация Feα не представляет собой новой аллотропической формы. Критическую температуру 911 o С превращения Feα ↔Feγ обозначают точкой A3, а температуру 1392 o С превращения Feα ↔Feγ - точкой А4.
Рис. 1.1. Диаграмма состояния железо - цементит
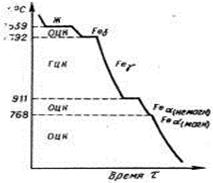
Рис. 1.2. Кривая охлаждения чистого железа
При температуре ниже 768 o С железо ферромагнитно, а выше – парамагнитно. Точка Кюри железа 768 o С обозначается А2.
Железо технической чистоты обладает невысокой твердостью (80 НВ) и прочностью (предел прочности – σв=250 МПа, предел текучести – σт= 120 МПа) и высокими характеристиками пластичности (относительное удлинение – δ=50%, а относительное сужение – ψ=80%). Свойства могут изменяться в некоторых пределах в зависимости от величины зерна.
Железо характеризуется высоким модулем упругости, наличие которого проявляется и в сплавах на его основе, обеспечивая высокую жесткость деталей из этих сплавов.
Железо со многими элементами образует растворы: с металлами – растворы замещения, с углеродом, азотом и водородом – растворы внедрения.
2. Углерод относится к неметаллам. Обладает полиморфным превращением, в зависимости от условий образования существует в форме графита с гексагональной кристаллической решеткой (температура плавления – 3500 о С, плотность – 2,5 г/см 3 ) или в форме алмаза со сложной кубической решеткой с координационным числом равным четырем (температура плавления – 5000 о С).
В сплавах железа с углеродом углерод находится в состоянии твердого раствора с железом и в виде химического соединения – цементита (Fe3C), а также в свободном состоянии в виде графита (в серых чугунах).
3. Цементит (Fe3C) – химическое соединение железа с углеродом (карбид железа), содержит 6,67 % углерода.
Аллотропических превращений не испытывает. Кристаллическая решетка цементита состоит из ряда октаэдров, оси которых наклонены друг к другу (рис.1.3).
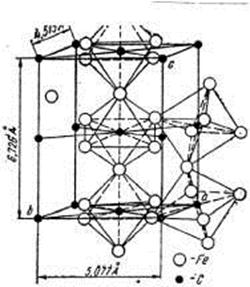
Рис. 1.3. Кристаллическая решетка цементита
Температура плавления цементита точно не установлена (1250, 1550 o С). При низких температурах цементит слабо ферромагнитен, магнитные свойства теряет при температуре около 217 o С.
Цементит имеет высокую твердость (более 800 НВ, легко царапает стекло), но чрезвычайно низкую, практически нулевую, пластичность. Такие свойства являются следствием сложного строения кристаллической решетки.
Цементит способен образовывать твердые растворы замещения. Атомы углерода могут замещаться атомами неметаллов: азотом, кислородом; атомы железа – металлами: марганцем, хромом, вольфрамом и др. Такой твердый раствор на базе решетки цементита называется легированным цементитом.
Цементит – соединение неустойчивое и при определенных условиях распадается с образованием свободного углерода в виде графита. Этот процесс имеет важное практическое значение при структурообразовании чугунов.
В системе железо – углерод существуют следующие фазы: жидкая фаза, феррит, аустенит, цементит.
1. Жидкая фаза. В жидком состоянии железо хорошо растворяет углерод в любых пропорциях с образованием однородной жидкой фазы.
2. Феррит (Ф)Feα(C) – твердый раствор внедрения углерода в α-железо.
Феррит имеет переменную предельную растворимость углерода: минимальную – 0,006 % при комнатной температуре (точка Q), максимальную – 0,02 % при температуре 727 o С (точка P). Углерод располагается в дефектах решетки.
При температуре выше 1392 o С существует высокотемпературный феррит (δ) (Feδ (C), с предельной растворимостью углерода 0,1 % при температуре 1499 o С (точка J)
Свойства феррита близки к свойствам железа. Он мягок (твердость – 130 НВ, предел прочности –σв=300 МПа) и пластичен (относительное удлинение – δ=30%), магнитен до 768 o С.

3. Аустенит (А)Feγ(С) – твердый раствор внедрения углерода в γ-железо.
Углерод занимает место в центре гранецентрированной кубической ячейки (рис.1.4).
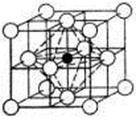
Рис. 1.4. Аустенит в углеродистой стали
Аустенит имеет переменную предельную растворимость углерода: минимальную – 0,8 % при температуре 727 o С (точка S), максимальную – 2,14 % при температуре 1147 o С (точка Е).
Аустенит имеет твердость 200…250 НВ, пластичен (относительное удлинение –δ=40…50%), парамагнитен.
При растворении в аустените других элементов могут изменяться свойства и температурные границы существования.
4. Цементит – характеристика дана выше.
В железоуглеродистых сплавах присутствуют фазы: цементит первичный (ЦI), цементит вторичный (ЦII), цементит третичный (ЦIII). Химические и физические свойства этих фаз одинаковы. Влияние на механические свойства сплавов оказывает различие в размерах, количестве и расположении этих выделений. Цементит первичный выделяется из жидкой фазы в виде крупных пластинчатых кристаллов. Цементит вторичный выделяется из аустенита и располагается в виде сетки вокруг зерен аустенита (при охлаждении – вокруг зерен перлита). Цементит третичный выделяется из феррита и в виде мелких включений располагается у границ ферритных зерен.
Компонентами железоуглеродистых сплавов являются железо, углерод и цементит.
1. Железо – имеет высокую температуру плавления – 1539 o С± 5 o С.
В твердом состоянии железо может находиться в двух модификациях (рис.1.2). Полиморфные превращения происходят при температурах 911 о С и 1392 o С. При температуре ниже 911 o С существует Feα с объемно-центрированной кубической решеткой. В интервале температур 911…1392 o С устойчивым является Feγ с гранецентрированной кубической решеткой. Выше 1392 o С железо имеет объемно-центрированную кубическую решетку и называется Feδ или высокотемпературное Feα. Высокотемпературная модификация Feα не представляет собой новой аллотропической формы. Критическую температуру 911 o С превращения Feα ↔Feγ обозначают точкой A3, а температуру 1392 o С превращения Feα ↔Feγ - точкой А4.
Рис. 1.1. Диаграмма состояния железо - цементит

Рис. 1.2. Кривая охлаждения чистого железа
При температуре ниже 768 o С железо ферромагнитно, а выше – парамагнитно. Точка Кюри железа 768 o С обозначается А2.
Железо технической чистоты обладает невысокой твердостью (80 НВ) и прочностью (предел прочности – σв=250 МПа, предел текучести – σт= 120 МПа) и высокими характеристиками пластичности (относительное удлинение – δ=50%, а относительное сужение – ψ=80%). Свойства могут изменяться в некоторых пределах в зависимости от величины зерна.
Железо характеризуется высоким модулем упругости, наличие которого проявляется и в сплавах на его основе, обеспечивая высокую жесткость деталей из этих сплавов.
Железо со многими элементами образует растворы: с металлами – растворы замещения, с углеродом, азотом и водородом – растворы внедрения.
2. Углерод относится к неметаллам. Обладает полиморфным превращением, в зависимости от условий образования существует в форме графита с гексагональной кристаллической решеткой (температура плавления – 3500 о С, плотность – 2,5 г/см 3 ) или в форме алмаза со сложной кубической решеткой с координационным числом равным четырем (температура плавления – 5000 о С).
В сплавах железа с углеродом углерод находится в состоянии твердого раствора с железом и в виде химического соединения – цементита (Fe3C), а также в свободном состоянии в виде графита (в серых чугунах).
3. Цементит (Fe3C) – химическое соединение железа с углеродом (карбид железа), содержит 6,67 % углерода.
Аллотропических превращений не испытывает. Кристаллическая решетка цементита состоит из ряда октаэдров, оси которых наклонены друг к другу (рис.1.3).

Рис. 1.3. Кристаллическая решетка цементита
Температура плавления цементита точно не установлена (1250, 1550 o С). При низких температурах цементит слабо ферромагнитен, магнитные свойства теряет при температуре около 217 o С.
Цементит имеет высокую твердость (более 800 НВ, легко царапает стекло), но чрезвычайно низкую, практически нулевую, пластичность. Такие свойства являются следствием сложного строения кристаллической решетки.
Цементит способен образовывать твердые растворы замещения. Атомы углерода могут замещаться атомами неметаллов: азотом, кислородом; атомы железа – металлами: марганцем, хромом, вольфрамом и др. Такой твердый раствор на базе решетки цементита называется легированным цементитом.
Цементит – соединение неустойчивое и при определенных условиях распадается с образованием свободного углерода в виде графита. Этот процесс имеет важное практическое значение при структурообразовании чугунов.
В системе железо – углерод существуют следующие фазы: жидкая фаза, феррит, аустенит, цементит.
1. Жидкая фаза. В жидком состоянии железо хорошо растворяет углерод в любых пропорциях с образованием однородной жидкой фазы.
2. Феррит (Ф)Feα(C) – твердый раствор внедрения углерода в α-железо.
Феррит имеет переменную предельную растворимость углерода: минимальную – 0,006 % при комнатной температуре (точка Q), максимальную – 0,02 % при температуре 727 o С (точка P). Углерод располагается в дефектах решетки.
При температуре выше 1392 o С существует высокотемпературный феррит (δ) (Feδ (C), с предельной растворимостью углерода 0,1 % при температуре 1499 o С (точка J)
Свойства феррита близки к свойствам железа. Он мягок (твердость – 130 НВ, предел прочности –σв=300 МПа) и пластичен (относительное удлинение – δ=30%), магнитен до 768 o С.
3. Аустенит (А)Feγ(С) – твердый раствор внедрения углерода в γ-железо.
Углерод занимает место в центре гранецентрированной кубической ячейки (рис.1.4).

Рис. 1.4. Аустенит в углеродистой стали
Аустенит имеет переменную предельную растворимость углерода: минимальную – 0,8 % при температуре 727 o С (точка S), максимальную – 2,14 % при температуре 1147 o С (точка Е).
Аустенит имеет твердость 200…250 НВ, пластичен (относительное удлинение –δ=40…50%), парамагнитен.
При растворении в аустените других элементов могут изменяться свойства и температурные границы существования.
4. Цементит – характеристика дана выше.
В железоуглеродистых сплавах присутствуют фазы: цементит первичный (ЦI), цементит вторичный (ЦII), цементит третичный (ЦIII). Химические и физические свойства этих фаз одинаковы. Влияние на механические свойства сплавов оказывает различие в размерах, количестве и расположении этих выделений. Цементит первичный выделяется из жидкой фазы в виде крупных пластинчатых кристаллов. Цементит вторичный выделяется из аустенита и располагается в виде сетки вокруг зерен аустенита (при охлаждении – вокруг зерен перлита). Цементит третичный выделяется из феррита и в виде мелких включений располагается у границ ферритных зерен.
Мы уже начинали рассматривать диаграммы состояния в этой публикации и там разобрали основные понятия, которые важно осмыслить, прежде, чем вникать в тему более глубоко. Но тут меня попросили разобрать диаграмму состояния железо-углерод (её ещё частенько называют железо-цементит). Ну что же, запасаемся попкорном и пытаемся вместе разобраться в этом крокодиле.
Диаграмма состояния железо-углерод , в том или ином количестве, встречается всем инженерам. Изучают её на курсе материаловедения, а прослушивают этот курс все технари. В большинстве случаев, изучение этой темы превращается в кошмар. Особенно, когда тебя просят нарисовать этот кошмар по памяти на листочке. Но главный вопрос - почему именно эта диаграмма? Ответ простой. На диаграмме железо-углерод есть большая часть сложных моментов, которые вообще встречаются на диаграммах состояния. От того, поняв её мы разберемся и со всеми основами чтения диаграмм. Кроме всего этого, сплавы железа всё ещё продолжают заниматься лидирующее положение среди конструкционных материалов. Поэтому, вперёд друзья.
Как мы помним, диаграмма состояния - это график фазовых состояний в зависимости от концентрации каждого химического элемента и температуры.
Значит, диаграмма железо-углерод - это отображение фазового состояния сплавов железа с углеродом в зависимости от их химсостава и температуры.
Это нужно для того, чтобы мы, зная химический состав стали и температуру системы, могли понять, какой фазовый состав будем иметь. Знания эти необходимы для того, чтобы выбрать правильный режим термической обработки или подобрать вариант механической обработки (ведь зная фазовый состав мы уже примерно представляем свойства).
Вот, собственно, и всё, что нужно знать про диаграмму :). Теперь остается научиться её читать. И с этим есть масса сложностей.
Вот диаграмма железо-углерод на рисунке ниже. И что это? А мы не понимаем, что это :)! Давайте разбираться, ибо сейчас оно выглядит скорее как клетчатый листочек с нарисованным динозавром.
По оси ординат у нас обозначены температуры системы . По оси абцисс - химические составы .
Максимальная температура системы ограничивается температурами плавления компонентов. Выше идёт только жидкость. Но про фазы чуть позднее.
Слева у нас феррит . Справа - углерод . Количество углерода растёт слева направо.
Обратите внимание и на нижнюю шкалу, где отложен Fe3C.
Это цементит . Его количество также увеличивается слева направо. Цементит - это карбид железа или химическое соединение железа с углеродом . Но есть подлянка, куда же без неё :). Максимальное количество углерода в этой системе у нас 6,67% . А вот цементита будет 100%. Процентное содержание цементита не соответствует проценту углерода.
Это появилось из-за того, что в системе железо-углерод в целом возможно максимальное содержание углерода 6,67% на физическом уровне .
И вот тут внимание! Чистое железо (альфа-железо) у нас на диаграмме есть только в крайней левой точке . Этот вопрос любят задавать на защитах. Всё что дальше вправо - это феррит. А феррит, как мы помним, это твёрдый раствор углерода в альфа железе . Или, сплав железа с углеродом.
На диаграмме мы видим и сталь, и чугун . Их отличие в том, что сталь - это содержание углерода в сплаве с железом от 0,02 до 2,14%. Чугун - тот же сплав железа с углеродом, но с содержанием от 2,14% углерода.
Фазы на диаграмме
Само собой, из диаграммы состояния можно узнать фазовый состав . Или на кой чёрт она бы ещё сдалась :) Тут мы видим следующие фазы .
- Жидкая фаза - это коктейль, который получается, если всё расплавить. Обращаем внимание, что при разных химических составах мы имеем разные температуры плавления.
- Феррит - уже обсудили, что это твердый раствор внедрения углерода в альфа железо.
- Аустенит - это твёрдый раствор внедрения углерода в гамма железо.
- Цементит - тоже уже обсудили. Химическое соединение железа с углеродом. Максимальная концентрация углерода в цементите 6,67% по массе и это предельная для железоуглеродистых сплавов концентрация.
- Графит - это фаза состоящая только из углерода со слоистой гексагональной решёткой. Он выделяется в системе железо-углерод при определенных условиях.
Сразу отмечу, что на этом фазы заканчиваются. Преподы любят заваливать на подобных вопросах. Фаз на диаграмме у нас больше нет, зато есть кое-что ещё. Об этом далее.
Наверняка возникает вопрос что это за альфа-железо и за гамма-железо . Это так называемый полиморфизм. Химический состав один, а вид кристаллической решетки разный.
На самой же диаграмме есть ещё всякие буковки . И если буквы А (аустенит), Ж (жидкость), Ц (цементит), то всё ясно. Но ещё есть буквы Л и П. Что это такое?
Структуры на диаграмме
Л - это ледебурит . Так называется особенная структура, характерная преимущественно для чугунов. Представляет собой эвтектическую смесь аустенита и цементита. Её же можно назвать механической смесью.
П - это перлит . Ещё одна структура, которая представлена эвтектоидной смесью из тонких пластинок феррита и цементита.
Новые слова для нас эвтектическая и эветктоидная. Эвтектическая в данном случае означает образование гетерогенной структуры сплава. Эвтектоидная - по сути тоже самое, только образуется изначально не из жидких фаз, а из твердых.
Эветктика же, это точка, в которой находятся в термодинамическом равновесии n - твёрдых фаз и жидкая фаза. Жидкая эвтектика кристаллизуется при температуре более низкой, чем температура кристаллизации каждого из веществ, входящих в состав смеси. Температура плавления твёрдой эвтектики — самая низкая для данной смеси компонентов.
Что происходит на диаграмме железо-углерод
Теперь самое веселое. Вроде бы всё, что вокруг на диаграмме есть, мы проанализировали. Остается понять что во что и когда превращается :)
Ну, мы уже поняли, что отправная точка - это температура. Греем систему из железа и углерода и видим изменения.
На диаграмме мы видим многочисленные линии ликвидуса и солидуса . Это линии, по которым идёт плавление и кристаллизация соответственно.
Удобно пользоваться следующей картинкой. Здесь расставлены все фазы и структуры.
Если путешествовать по линиям, то видим протекающие процессы.
Всё, что выше линий ABCD - жидкая фаза. Значит это линия ликвидус . Выше неё только жидкая фаза. Дальше работаем по правилу фаз Гиббса. Линию солидус найти сложнее. Ниже неё только твердая фаза. Тут солидусов несколько.
Не знаю, стоит ли досконально разбирать каждую линию. Если у вас есть вопросы, задавайте их в комментариях и я дополню материалы.
Сейчас же попробую обобщить всё одной фразой . Читаем внимательно. Диаграмма состояния железо-углерод, с размеченными областями, как показано на рисунке выше, указывает нам фазовые и структурные состояния, которые мы имеем в системе при данных параметрах (температура и химсостав) . Линии указывают начало или конец процесса кристаллизации или плавления. Всё! Другого секрета тут нет.
Как пользоваться диаграммой железо-углерод
Часто преподы гасят студентов вопросами про использование диаграммы состояния. Ученик не понимает, как диаграммой пользоваться и зачем её вообще нужно изучать. Рассмотрим типичную задачу.
Нужно нам изучить состояния сплава, содержащего 0,4% углерода в своем составе . Имеем дело с обычной сталью.
Поднимаем перпендикуляр из точки, соответствующей количеству углерода в 0,4%.
Видим, что система, в диапазоне от 0 до 700 градусов, представляет собой твердую смесь перлита и цементита. В точке 4 происходит переход и в диапазоне от 700 до 800 градусов и мы попадаем в зону аустенита и феррита.
В диапазоне от 800 до 1450 градусов сплав имеет состав аустенита, а переход состоялся в точке 3.
В диапазоне от 1450 до 1520 градусов рассматриваемый сплав начинает постепенно плавиться и представлен аустенитом и жидким раствором. Переход происходил в точке 2.
Ну и всё что выше - это уже жидкость, где произошла гомогенизация. Вот такие данные можно выцепить.
Часто возникают вопросы, что именно происходит в точках перехода (которые у нас отмечены 1,2,3 и 4). Там мы имеем адский коктейль. Нестабильную смесь. Например, в точке 4 будет месиво из феррита, перлита и аустенита. Пропорции тут можно определить только лабораторным испытанием.
Ещё может появиться вопрос, а что у нас, например, на отрезке 2 - 3. Тут ответ очевиден - там 100% аустенита. Т.е. 0,4% углерода внедрились в структуру гамма железа и застыли .
Сложнее ситуация на отрезках, типа 0 - 4. Там у нас феррит + перлит. Но чего сколько? Ответ кроется в понимании характерных точек. Перлит у нас в точке S. Значит, просто смотрим насколько далеко точка 4 от точки S.
Характерные точки на диаграмме железо-углерод
В системе железо-углерод происходит невероятное количество превращений. Несколько мы уже обсудили. Но систематизируем все знания.
В сплавах железа с углеродом (сталях и чугунах) могут образовываться следующие фазы: феррит, аустенит, цементит и графит.
Феррит - является твёрдым раствором внедрения углерода в альфа-железе. (Обозначается Fea(C) или Ф). a-железо устойчиво при температурах ниже 911 °С. Оно отличается объёмоцентрированной кубической решёткой (ОЦК – решёткой), в междоузлиях (порах) которой размещаются атомы растворяющегося углерода. Растворимость углерода в a-железе крайне низкая, максимум 0,02 % по массе при температуре 727 °С. С понижением температуры она снижается и достигает 0,006 % при комнатной температуре. По этой причине феррит можно считать практически чистым железом. Феррит, так же как и чистое железо, является мягкой, пластичной фазой с твёрдостью от 80 до100 НВ, в зависимости от содержания углерода.
Необходимо отметить, что ОЦК – решётку железо имеет в двух температурных интервалах: при температурах ниже 911 °С (a-железо) и в диапазоне температур от 1392 °С до температуры плавления, равной 1539 °С (это так называемое d-железо). Твёрдый раствор внедрения углерода в d-железе называют высокотемпературным ферритом.
В интервале температур от 911 до 1392 °С железо имеет гранецентрированную кубическую решётку (ГЦК-решётку). Это так называемое g-железо. В g-железе углерод растворяется значительно лучше, чем в железе с ОЦК-решёткой. Твёрдый раствор внедрения углерода в g-железе называют аустенитом (обозначают Feg( C ) или А). Максимальная растворимость углерода в аустените наблюдается при 1147 °С и составляет 2,14 %, что в 100 раз выше, чем у феррита. С понижением температуры эта растворимость падает, достигая 0,8 % при температуре 727 °С. Аустенит пластичная фаза, но примерно в 2 раза твёрже феррита (160 – 200 НВ).
Цементит (Ц)- это химическое соединение железа с углеродом - карбид железа с химической формулой Fe3C. Содержание углерода в цементите постоянное - 6,67 % по массе. Цементит отличается высокой твёрдостью и хрупкостью. Твёрдость этой фазы в 10 раз выше твёрдости феррита и составляет @ 800 НВ. Различают цементит первичный, вторичный и третичный. (ЦI, ЦII и ЦIII). Первичный цементит образуется из жидкого расплава при кристаллизации. Вторичный цементит выпадает из аустенита при его остывании, что обусловлено снижением предельной растворимости углерода в аустените с уменьшением температуры. Третичный цементит выпадает из феррита в процессе его остывания, что обусловлено снижением растворимости углерода в феррите. Цементит является метастабильной (неустойчивой) фазой. При нагреве и длительной выдержке он распадается на железо и углерод, а точнее на феррит и графит, который является более стабильной чем цементит фазой.
Графит это углерод с гексагональной, слоистой структурой. Он отличается мягкостью и малой пластичностью, имеет температуру плавления 3500 °С. Графит наблюдается в высокоуглеродистых сплавах (чугунах) при их равновесном (медленном) затвердевании. В этом случае создаются благоприятные условия для диффузии атомов углерода и формирования в структуре сплава графитных включений.
Помимо вышеназванных четырёх фаз, в сплавах железа с углеродом различают ещё две самостоятельные структурные составляющие - перлит и ледебурит, которые, по сути, являются двухфазными смесями.
Перлит (П) – является механической смесью феррита и цементита. Это эвтектоид системы Fe–C, который образуется из аустенита посредством эвтектоидной реакции, протекающей при температуре 727 °С. Перлит содержит 0,8 % С и может иметь пластинчатую или зернистую структуру.
Ледебурит (Л) – представляет собой механическую смесь аустенита и цементита. Ледебурит является эвтектикой системы Fe–C и образуется из жидкой фазы при температуре 1147 °С в результате эвтектической реакции. Содержание углерода в ледебурите – 4,3 %. При температуре 727 °С аустенит ледебурита претерпевает эвтектоидное превращение (превращается в перлит), поэтому при температурах ниже 727 °С ледебурит является механической смесью перлита и цементита.
Диаграммы состояния железоуглеродистых сплавов
Существует две диаграммы состояния железоуглеродистых сплавов - метастабильная и стабильная. Метастабильная диаграмма отражает структурно-фазовое состояние сплавов, в которых углерод находится в связанном состоянии - в виде метастабильного химического соединения – цементита. Хотя цементит термодинамически менее устойчив, чем графит, его образование по кинетическим соображениям является более вероятным.
Фазовые диаграммы представляют собой изображение зон существования фаз, которые имеются в сплаве при различных условиях (температура, давление, химсостав).
Диаграмма железо углерод описывает подходящие условия для существования двух или более фаз в равновесии. Популярная аналогия: фазовая диаграмма воды описывает точку (тройную точку), в которой вода может сосуществовать в трёх разных фазах одновременно. Это происходит при температуре чуть выше точки замерзания (0,01 ° C) и при давлении 0,006 атм.
Существует четыре основных применения фазовых диаграмм:
- Разработка новых сплавов на основе требований применения.
- Производство этих сплавов.
- Разработка и контроль соответствующих процедур термообработки, которые предназначены для улучшения химических, физических и механических свойств сплавов.
- Устранение проблем, возникающих при применении новых сплавов, что в конечном итоге улучшает предсказуемость свойств продукта.
При разработке сплава фазовые диаграммы помогают предотвращать проектирование чрезмерно большого количества вариантов, сокращая затраты и время обработки. Они также помогают разрабатывать альтернативные сплавы или такие же, но с альтернативными легирующими элементами.
Компонентный состав
Диаграмма железо-углерод была разработана, чтобы показать микроструктурное состояние металла как функцию температуры и содержания углерода. Она показывает, что, в зависимости от интенсивности охлаждения стали, в ней могут возникать очень разные микроструктуры.
Когда металл расплавлен, то есть находится в жидком состоянии, решётчатые структуры отсутствуют. Атомы могут свободно перемещаться во всех направлениях. Чтобы достичь желаемых кристаллических структур, необходимо, чтобы металл медленно и полностью остыл при комнатной температуре. Промежуточные термические обработки положительно влияют на формирование кристаллических структур.
По вертикальной оси диаграммы железо-углерод располагается шкала температур в °C. Металл показан здесь от твердого до жидкого состояния. Например, чистое железо начинает плавиться при 1147°C. Температура устойчивого состояния расплава - 1536 °C.
По горизонтальной оси указывается процентное содержание углерода в металле.
Диаграмма показывает участки, в которых металл находится только в состоянии. расплава, феррита или аустенита. Остальные зоны характеризуются определённым сочетанием свойств. Это, например, расплав и аустенит, аустенит и феррит, феррит и перлит.

Обозначение точек пересечения заглавными буквами на линиях преобразования предназначено для лучшего понимания. Они указывают на переход в другое состояние или условие.
Диаграмма предполагает постоянное охлаждение металлов. Если металл медленно охлаждать, образуются крупные зёрна, если же металл остывает быстро, то размеры зёрен уменьшаются. Тип зерна металла определяет его прочностные свойства. Крупнозернистый материал имеет меньшую прочность, но его можно сделать более мелким и, следовательно, более прочным путём термической обработки или пластического деформирования (упрочнением). Самый высокий уровень прочности имеет именно мелкозернистый металл.
Выполним краткую характеристику основных химических компонентов диаграммы.
Железо
Железо образует кубическую пространственную решётку. Атомы железа расположены по углам этой решётки. Количество углерода, которое может быть растворено в железе, зависит от модификации железа, потому что разные формы кристаллической решетки железа (например, кубическая пространственно-центрированная и кубическая гранецентрированная) имеют межстраничные промежутки разного размера.
Второстепенную роль играет дельта-смешанный кристалл, который имеет объемно-центрированные атомы, но существует только в высоколегированных сталях. Эти кристаллы образуются в диапазоне температур от 1536 °C (точка плавления чистого железа) до 1392 °C.
Альфа-смешанный кристалл существует как объемно-центрированная кубическая решетка. Эти структуры образуются в чистом железе до температуры 911 °C.
В гамма смешанном кристалла атомы железа гранецентрированы, и это означает, что они расположены в середине каждой грани куба. Эти кристаллы образуются при температурах от 1392 °C до 911 °C в чистом железе.

Углерод
В низких концентрациях, углерод не образует твёрдого химического соединения с железом, но откладывается в промежутках кристаллической решетки железа.
Углерод в железе является примесью внедренияи может существовать в форме гранецентрированную или объемно-центрированной кубической решётки. Диаграмма состояния сплавов железо-углерод устанавливает области стабильного существования твёрдого раствора с α, γ и δ фазами железа.
Описанные выше кристаллические решётки имеют различную растворимость углерода в зависимости от температуры. Углерод осаждается в междуузельных пространствах кристаллической решётки, при этом гранецентрированная кубическая решетка, также называемая аустенитом, имеет растворимость не более чем в сто раз выше, чем кристаллы феррита.
Цементит
Цементит - метастабильная фаза сплава с фиксированным составом, имеющий химическую формулу Fe3C. При комнатной температуре цементит очень медленно разлагается на железо и углерод (графит).
Некоторые другие факторы (например, высокие температуры и добавление определенных легирующих элементов) могут влиять на это разложение, поскольку они способствуют образованию графита.
Цементит твёрдый и хрупкий, что делает его пригодным для упрочнения сталей (существует специальная технология химико-термической обработки стали, которая называется цементацией). Механические свойства цементита зависят от его микроструктуры, а также от условий связи с ферритом.
Жидкий раствор Fe-C на диаграмме обозначается выше линии L (ликвидус). Поскольку δ-феррит плавится при 1538 °C, очевидно, что температура плавления железа снижается с увеличением содержания углерода.
Перлит
Зёрна перлита включают в себя структурные объединения, где все образовавшиеся пластины между собой параллельны. При возрастании числа перлитных конкреций рост размеров пластин приостанавливается, а сами они могут изменить направление своего движения. С уменьшением температуры колонии перлита превращаются в шаровидные мелкозернистые образования.

Ледебурит в сталях
Ледебурит - один из основных структурных компонентов железоуглеродистых сплавов и является эвтектическую смесью аустенита и цементита, которая образуется при 1145°C и ниже (для чистых железоуглеродистых сплавов). Аустенит превращается в ферритно-цементитную смесь при температурах ниже 723°C. В сталях ледебурит, состоящий из аустенита и карбидов, образуется только при очень высоком содержании компонентов сплава и углерода (0,7…1,0%); такие стали (называются ледебуритовыми сталями.
Метастабильная нелегированная эвтектика ледебурита Fe – Fe3C классифицируется как квазирегулярная. Доказано, что после зарождения Fe3C рост пластин цементита происходит быстро, в результате на стыках образуется аустенит, и возникает взаимосвязь ориентации. Fe3C и аустенит также растут совместно и образуют стержневую структуру, которая располагается перпендикулярно пластинам цементита. Эти два режима роста образуют квазирегулярную структуру, но рост по краю происходит быстрее, чем по бокам, и доминирует в структуре. Эксперименты по направленной кристаллизации показали, что рабочая точка на кривой роста квазирегулярной структуры близка к точке экстремума. Такую квазирегулярную структуру можно модифицировать закалкой, но модификация примесей пока не исследовалась.
Структурная подложка сталей ледебуритного класса имеет доэвтектические компоненты, включающие перлит, ледебурит и шаровидный графит. Легированный слой состоит из дендритов и междендритов. В чугуне с шаровидным графитом конкреции графита постепенно растворяются в ванне расплава, и в то же время под действием гидродинамических сил и сил текучести перемещаются к поверхности.

Фазы в системе “железо-углерод”
Фазы - это физически однородные состояния сплава. Фаза имеет точный химический состав - определенное расположение и связь между атомами. Такая структура атомов придает разные свойства различным фазам.
Некоторые специальные сплавы могут существовать в нескольких фазах, что достигается нагревом металла до определенных температур и использованием разных процедур термообработки.
Жидкая
Существует при температуре, которая превышает 1457 o C. Фазовое превращение при этой температуре означает полное плавление, поэтому на диаграмме жидкая фаза всегда обозначается линией L.
Феррит
На диаграмме присутствует в трёх разных фазах:
- Фаза дельта-феррита (δ-Fe) представляет собой твердый раствор C в δ-Fe (ОЦК) в высокотемпературной области диаграммы. Раствор стабилен при температуре выше 1400 °C и плавится при температуре выше 1539 °C. Структурно подобен α-ферриту;
- Фаза гамма-феррита (γ-Fe) является твёрдым раствором C в γ-Fe, который называют аустенитом. Нестабилен ниже температуры 910 °C, превращаясь в δ-феррит при 1395 ° C.. Максимальная растворимость углерода составляет около 2,1% при 1147 °C. Аустенит мягок и пластичен, не обладает магнитными свойствами;
- Фаза альфа-феррита (α-Fe) представляет собой твердый раствор C в α-Fe с ОЦК-решёткой. Считается самой стабильной формой железа при комнатной температуре. Максимальная растворимость углерода составляет около 0,02% при 727 °C. Мягче аустенита, магнитен.
Аустенит в сталях
Аустенит всегда присутствует в нержавеющих сталях, которые содержат от 16 до 26 процентов хрома и до 35 процентов никеля. Аустенитные стали, помимо высокой коррозионной стойкостью, не закаливаются при термической обработке и немагнитны.

Формы существования цементита важны для определения коррозионной стойкости сталей. Доказано, что цементит (Fe3C) увеличивает скорость коррозии, причём этот эффект более выражен, когда он образует когерентную сеть на поверхности. В нормализованных сталях цементит образует когерентную сетку, а в отпущенном мартенсите - нет. Поэтому цементит влияет на скорость коррозии нормализованной, но не закалённой стали.
В целом скорость коррозии углеродистой стали снижается с увеличением содержания хрома из-за образования защитного оксида хрома. Однако, когда хром соединяется с углеродом с образованием карбида хрома, положительный эффект хрома теряется.
Влияние микроструктуры различных низколегированных сталей, показанное на этой модели, распространяется только на условия, в которых не образуются защитные плёнки. Более того, образование карбидной сетки на поверхности нормализованной стали - процесс, зависящий от времени.
Узловые критические точки

В этих точках происходят эвтектические реакции, при которых жидкая фаза затвердевает и превращается в смесь двух твердых фаз. Это происходит при охлаждении жидкого сплава эвтектического состава до его эвтектической температуры.
Сплавы, образующиеся на этом этапе, известны как эвтектические сплавы. Слева от этой точки сплавы называются заэвтектическими, а справа – заэвтектическими.
Значение линий диаграммы
Границы, пересекающиеся друг с другом, отмечают определенные области на диаграмме. Внутри каждой зоны может существовать отдельная фаза или две фазы. На границе происходит фазовый переход. Эти области являются фазовыми полями, они указывают фазы, присутствующие для определенного состава и температуры сплава.
На диаграмме имеется несколько характерных линий, обозначаемых как A1, A2, A3, A4 и ACM. При повышении или понижении температуры металла на этих границах происходит фазовый переход. Обычно при нагревании сплава его температура повышается, но вдоль этих линий нагрев приводит к перестройке структуры в другую фазу, и, таким образом, температура перестаёт расти до тех пор, пока фаза полностью не изменится. Этот процесс называется термической остановкой.
Элементы легированной стали - никель, марганец, хром, и молибден - влияют на положение этих границ на фазовой диаграмме. Границы могут сдвигаться в любом направлении в зависимости от используемого элемента. Например, на диаграмме состояния железа и углерода добавление никеля понижает границу A3, а добавление хрома увеличивает её.
Читайте также:

