Элементарная боровская теория водородного атома кратко
Обновлено: 05.07.2024
Первый шаг на пути разрешения противоречий между теорией и результатами эксперимента в физике атома был сделан в 1913 г. Н. Бором. Свои представления о механизме излучения и поглощения света атомом он сформулировал в виде следующих постулатов.
Первый постулат Бора: атом может находиться только в некоторых состояниях, в которых не происходит излучения, хотя при этом электроны в атоме движутся с ускорением. Такие состояния называются стационарными состояниями атома.
Второй постулат Бора: излучение света атомом происходит при переходе атома из одного стационарного состояния с большей энергией в другое стационарное состояние с меньшей энергией. При этом энергия кванта света определяется уравнением:
где Еn - энергия начального состояния; Еk - энергия конечного состояния.
При поглощении кванта света или любой другой энергии атом переходит из одного стационарного состояния с меньшей энергией в другое стационарное состояние с большей энергией.
Для наглядного представления возможных энергетических состояний атомов и переходов атомов из одного состояния в другое используются энергетические диаграммы, на которых каждое стационарное состояние атома отмечается горизонтальной линией, называемой энергетическим уровнем (рис. 18.2).
Все стационарные состояния, кроме одного, являются стационарными лишь условно. Бесконечно долго каждый атом может находиться лишь в стационарном состоянии с минимальной энергией Е1 . Это состояние атома называется основным состоянием. Все остальные стационарные состояния атома с энергиями Е2, Е3 , . Еп называются возбужденными состояниями.
Ниже всех остальных на диаграмме располагается энергетический уровень основного состояния атома, энергетические уровни возбужденных состояний располагаются над основным уровнем на расстояниях, пропорциональных разности энергий возбужденного и основного состояний.
Переходы атома из одного состояния в другое изображаются вертикальными линиями между соответствующими уровнями на диаграмме энергий, направление перехода обозначается стрелкой (рис. 18.2).
В результате соударения с другим атомом, с любой заряженной частицей или при поглощении фотона атом может перейти из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией (рис. 18.2а). Из любого возбужденного состояния атом самопроизвольно переходит в основное состояние или в другое возбужденное состояние с меньшей энергией. Этот переход сопровождается излучением фотонов (рис. 18.2б). Время жизни атомов в возбужденных состояниях обычно не превышает 10 -7 -10 -9 с.
Основное изменение, внесенное в физику атома постулатами Бора, заключалось в отказе от представлений о непрерывности изменения всех физических величин и в принятии идеи квантования значений физических величин, которыми описывается внутреннее состояние атома. Квантование энергии атома объясняет линейчатый спектр излучения атомов.
Линейчатые спектры были открыты еще в начале XIX в., однако закономерности линейчатых спектров и их происхождение долго не удавалось установить. Первые успехи были достигнуты при изучении спектра водорода. Экспериментально было обнаружено, что спектральные линии группируются в отдельные серии. Анализ измеренных значений длин волн позволил получить эмпирическую формулу, по которой можно было рассчитать значения этих длин волн:
где R = 1,097×10 7 м -1 - постоянная Ридберга; k и n – целые числа; k=1, n =2, 3, 4. - серия Лаймана (ультрафиолетовая область спектра); k=2, n=3, 4, 5. - серия Бальмера (видимая и близкая ультрафиолетовая область); k=3, n=4, 5, 6. - серия Пашена (инфракрасная область спектра). Эта формула получила название – обобщенная формула Бальмера.
Боровская теория атома водорода была разработана с использованием законов классической механики Ньютона и постулатов Бора. Для электрона, движущегося по стационарной орбите с номером n, Бор записал второй закон Ньютона:
и правило квантования стационарных орбит:
где m – масса электрона; vn – скорость электрона на орбите радиуса rn; - постоянная Планка с чертой (= 1,054×10 -34 Дж×с); е – элементарный электрический заряд.

Из уравнений (18.3) и (18.4) были получены следующие формулы:
где ro = 0,529×10 -10 м - боровский радиус атома водорода, n- номер орбиты; rn – радиус стационарной орбиты с номером n;
где En - энергия стационарного состояния атома водорода; eo - электрическая постоянная, h- постоянная Планка, Ei=13,6 эВ - энергия ионизации атома водорода.
Второй постулат Бора позволяет определить энергию кванта света, излучаемого атомом, и длину волны излучения:
Последняя формула находится в прекрасном согласии с экспериментальной формулой (18.2).
Боровская теория атома водорода позволяет объяснить происхождение линейчатых спектров испускания, связывая их появление с наличием дискретного ряда энергетических состояний атомов и переходами между ними.
Согласно представлениям Бора, движение электронов вокруг ядра в стационарных состояниях определяется законами обычной механики, для описания же процессов перехода атома из одного стационарного состояния в другое эти законы не применимы, и следует воспользоваться квантовыми представлениями.
На рис. 18.3 представлена схема энергетических уровней атома водорода. Значения энергии каждого уровня рассчитывались по формуле (18.6). Стрелками показаны переходы атома из одного стационарного состояния в другое, которые сопровождаются излучением квантов света. Серия Лаймана возникает при переходе атомов с вышележащих уровней энергии на первый (основной, n=1), серия Бальмера – при переходе на второй уровень энергии (n=2), серия Пашена – при переходе на третий уровень энергии (n=3).
 |
Первый шаг на пути разрешения противоречий между теорией и результатами эксперимента в физике атома был сделан в 1913 г. Н. Бором. Свои представления о механизме излучения и поглощения света атомом он сформулировал в виде следующих постулатов.
Первый постулат Бора: атом может находиться только в некоторых состояниях, в которых не происходит излучения, хотя при этом электроны в атоме движутся с ускорением. Такие состояния называются стационарными состояниями атома.
Второй постулат Бора: излучение света атомом происходит при переходе атома из одного стационарного состояния с большей энергией в другое стационарное состояние с меньшей энергией. При этом энергия кванта света определяется уравнением:
где Еn - энергия начального состояния; Еk - энергия конечного состояния.
При поглощении кванта света или любой другой энергии атом переходит из одного стационарного состояния с меньшей энергией в другое стационарное состояние с большей энергией.
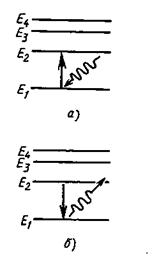
Для наглядного представления возможных энергетических состояний атомов и переходов атомов из одного состояния в другое используются энергетические диаграммы, на которых каждое стационарное состояние атома отмечается горизонтальной линией, называемой энергетическим уровнем (рис. 18.2).
Все стационарные состояния, кроме одного, являются стационарными лишь условно. Бесконечно долго каждый атом может находиться лишь в стационарном состоянии с минимальной энергией Е1 . Это состояние атома называется основным состоянием. Все остальные стационарные состояния атома с энергиями Е2, Е3 , . Еп называются возбужденными состояниями.
Ниже всех остальных на диаграмме располагается энергетический уровень основного состояния атома, энергетические уровни возбужденных состояний располагаются над основным уровнем на расстояниях, пропорциональных разности энергий возбужденного и основного состояний.
Переходы атома из одного состояния в другое изображаются вертикальными линиями между соответствующими уровнями на диаграмме энергий, направление перехода обозначается стрелкой (рис. 18.2).
В результате соударения с другим атомом, с любой заряженной частицей или при поглощении фотона атом может перейти из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией (рис. 18.2а). Из любого возбужденного состояния атом самопроизвольно переходит в основное состояние или в другое возбужденное состояние с меньшей энергией. Этот переход сопровождается излучением фотонов (рис. 18.2б). Время жизни атомов в возбужденных состояниях обычно не превышает 10 -7 -10 -9 с.
Основное изменение, внесенное в физику атома постулатами Бора, заключалось в отказе от представлений о непрерывности изменения всех физических величин и в принятии идеи квантования значений физических величин, которыми описывается внутреннее состояние атома. Квантование энергии атома объясняет линейчатый спектр излучения атомов.
Линейчатые спектры были открыты еще в начале XIX в., однако закономерности линейчатых спектров и их происхождение долго не удавалось установить. Первые успехи были достигнуты при изучении спектра водорода. Экспериментально было обнаружено, что спектральные линии группируются в отдельные серии. Анализ измеренных значений длин волн позволил получить эмпирическую формулу, по которой можно было рассчитать значения этих длин волн:
где R = 1,097×10 7 м -1 - постоянная Ридберга; k и n – целые числа; k=1, n =2, 3, 4. - серия Лаймана (ультрафиолетовая область спектра); k=2, n=3, 4, 5. - серия Бальмера (видимая и близкая ультрафиолетовая область); k=3, n=4, 5, 6. - серия Пашена (инфракрасная область спектра). Эта формула получила название – обобщенная формула Бальмера.
Боровская теория атома водорода была разработана с использованием законов классической механики Ньютона и постулатов Бора. Для электрона, движущегося по стационарной орбите с номером n, Бор записал второй закон Ньютона:
и правило квантования стационарных орбит:
где m – масса электрона; vn – скорость электрона на орбите радиуса rn; - постоянная Планка с чертой (= 1,054×10 -34 Дж×с); е – элементарный электрический заряд.
Из уравнений (18.3) и (18.4) были получены следующие формулы:
где ro = 0,529×10 -10 м - боровский радиус атома водорода, n- номер орбиты; rn – радиус стационарной орбиты с номером n;
где En - энергия стационарного состояния атома водорода; eo - электрическая постоянная, h- постоянная Планка, Ei=13,6 эВ - энергия ионизации атома водорода.
Второй постулат Бора позволяет определить энергию кванта света, излучаемого атомом, и длину волны излучения:
Последняя формула находится в прекрасном согласии с экспериментальной формулой (18.2).
Боровская теория атома водорода позволяет объяснить происхождение линейчатых спектров испускания, связывая их появление с наличием дискретного ряда энергетических состояний атомов и переходами между ними.
Согласно представлениям Бора, движение электронов вокруг ядра в стационарных состояниях определяется законами обычной механики, для описания же процессов перехода атома из одного стационарного состояния в другое эти законы не применимы, и следует воспользоваться квантовыми представлениями.
На рис. 18.3 представлена схема энергетических уровней атома водорода. Значения энергии каждого уровня рассчитывались по формуле (18.6). Стрелками показаны переходы атома из одного стационарного состояния в другое, которые сопровождаются излучением квантов света. Серия Лаймана возникает при переходе атомов с вышележащих уровней энергии на первый (основной, n=1), серия Бальмера – при переходе на второй уровень энергии (n=2), серия Пашена – при переходе на третий уровень энергии (n=3).
Согласно (16.7) возможны только такие орбиты, для которых момент импульса электрона удовлетворяет условию?
Число называется главным квантовым числом.
Рассмотрим электрон, движущийся в поле атомного ядра с зарядом Ze. При Z = 1 такая система соответствует атому водорода, при иных Z — водородоподобному иону, т. е. атому с порядковым номером Z, из которого удалены все электроны, кроме одного. Уравнение движения электрона имеет вид
Исключив v из уравнений (17.1) и (17.2), получим выражение для радиусов допустимых орбит:
Радиус первой орбиты водородного атома называется воровским радиусом. Его значение равно
Отметим, что боровский радиус имеет значение порядка газокинетических размеров атома.
Внутренняя энергия атома слагается из кинетической энергии электрона (ядро неподвижно) и энергии взаимодействия электрона с ядром:
Из (17.2) следует, что
Подставив сюда выражение (17.3) для , найдем дозволенные значения внутренней энергии атома:
Схема энергетических уровней, определяемых формулой (17.5), дана на рис. 17.1.
При переходе атома водорода (Z = 1) из состояния в состояние излучается фотон
Частота испущенного света равна
Мы пришли к обобщенной формуле Бальмера (см. (12.4)), причем для постоянной Ридберга получилось значение
При подстановке в это выражение числовых значений получается величина, поразительно хорошо согласующаяся с экспериментальным значением постоянной Ридберга.
Теория Бора была крупным шагом в развитии теории атома. Она с полной отчетливостью показала неприменимость классической физики к внутриатомным явлениям и главенствующее значение квантовых законов в микромире.
В настоящее время теория Бора имеет преимущественно историческое значение. После первых успехов теории все яснее давали себя знать ее недочеты. Особенно тягостной была неудача всех попыток построения теории атома гелия — одного из простейших атомов, непосредственно следующего за атомом водорода.
Самой слабой стороной теории Бора, обусловившей последующие неудачи, была ее внутренняя логическая противоречивость: она не была ни последовательно классической, ни последовательно квантовой теорией. После открытия волновых свойств вещества стало совершенно ясно, что теория Бора, опирающаяся на классическую механику, могла быть только переходным этапом на пути к созданию последовательной теории атомных явлений.
Выход из тупика был найден датским ученым Нильсом Бором в 1913 году, получившим Нобелевскую премию в 1922 году.
 | БОР Нильс Хендрик Давид (1885–1962) – выдающийся датский физик-теоретик, один из создателей современной физики. Сформулировал идею о дискретности энергетических состояний атомов, в свете новых идей построил атомную модель, открыв условия устойчивости атомов, и объяснил большой круг явлений. Создал первую квантовую модель атома, основанную на двух постулатах, которые прямо противоречили классическим представлениям и законам. Автор теории составного ядра, один из создателей капельной модели ядра и теории деления атомного ядра. |
Бор высказал предположения, которые были названы постулатами Бора.
· Первый постулат(постулат стационарных состояний): электроны движутся только по определенным (стационарным) орбитам. При этом, даже двигаясь с ускорением, они не излучают энергию.

· Второй постулат(правило частот): излучение и поглощение энергии в виде кванта света (hn) происходит лишь при переходе электрона из одного стационарного состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается скачок электрона: .
Отсюда следует, что изменение энергии атома, связанное с излучением при поглощении фотона, пропорционально частоте ν:
 или  . | (6.3.1) |
Правило квантования орбит: из всех орбит электрона возможны только те, для которых момент импульса равен целому кратному постоянной Планка:
где n = 1, 2, 3,… – главное квантовое число.
Получим выражение для энергии электрона в атоме.

Рассмотрим электрон (рис. 6.6,а), движущийся со скоростью в поле атомного ядра с зарядом Ze (при Z = 1 – атом водорода).
 |  |
| а | б |
Уравнение движения электрона имеет вид:

Из формулы (6.3.3) видно, что центробежная сила равна кулоновской силе, где .
Подставим значение υ из (6.3.2) в (6.3.3) и получим выражение для радиусов стационарных орбит (рис.6.6,б):
Радиус первой орбиты водородного атома называют боровским радиусом. При n =1, Z = 1 для водорода имеем:

Å = 0,529·10 –10 м.
Внутренняя энергия атома слагается из кинетической энергии электрона (ядро неподвижно) и потенциальной энергией взаимодействия электрона с ядром:

.

Из уравнения движения электрона следует, что , т.е. кинетическая энергия равна потенциальной. Тогда можно записать:

.
Подставим сюда выражение для радиуса первой орбиты и получим:
Здесь учтено, что постоянная Планка , т.е. .
Для атома водорода при Z = 1 имеем:

Из формулы (6.3.6) видно, что принимает только дискретные значения энергии, т.к. n = 1, 2, 3….
Схема энергетических уровней, определяемых уравнением (6.3.6) показана на рис. 6.1 и 6.7.


При переходе электрона в атоме водорода из состояния n в состояние k излучается фотон с энергией:

.

.
Получена обобщенная формула Бальмера, которая хорошо согласуется с экспериментом. Выражение перед скобками, как уже было сказано, носит название постоянной Ридберга:

.

Серьезным успехом теории Бора явилось вычисление постоянной Ридберга для водородоподобных систем и объяснение структуры их линейчатых спектров. Бору удалось объяснить линии спектра ионизованного гелия. Он теоретически вычислил отношение массы протона к массе электрона , что находилось в соответствии с экспериментом, является важным подтверждением основных идей, содержащихся в его теории. Теория Бора сыграла огромную роль в создании атомной физики. В период ее развития (1913–1925) были сделаны важные открытия, навсегда вошедшие в сокровищницу мировой науки.
Однако, наряду с успехами, в теории Бора с самого начала обнаружились существенные недостатки. Главнейшим из них была внутренняя противоречивость теории: механическое соединение классической физики с квантовыми постулатами. Теория не могла объяснить вопрос об интенсивностях спектральных линий. Серьезной неудачей являлась абсолютная невозможность применить теорию для объяснения спектров атома гелия, содержащего два электрона на орбите и тем более для многоэлектронных атомов (рис. 6.8).

Стало ясно, что теория Бора является лишь переходным этапом на пути создания более общей и правильной теории. Такой теорией и явилась квантовая механика.

По мере накопления знаний о материи и веществе происходило появление и уточнение теорий, объясняющих особенности строения атомов. Поговорим кратко о теории строения атома Бора.
Проблемы планетарной модели атома
В начале XXв Э. Резерфорд установил, что распределение заряда внутри атома крайне неравномерно. В центре атома находится компактное ядро, содержащее весь положительный заряд, а вокруг него на достаточно большом расстоянии (по сравнению с ядром) обращаются электроны. Была построена планетарная модель атома.
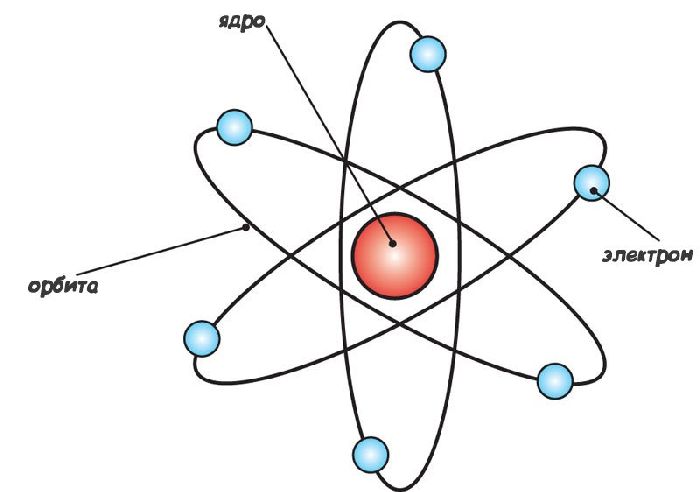
Рис. 1. Планетарная модель атома.
Эта модель хорошо объяснила результаты опытов по зондированию атомов α-частицами, однако, она противоречила достаточно хорошо обоснованной и подтвержденной к тому времени теории электродинамики Максвелла.
Согласно теории Максвелла, любой заряд, движущийся с ускорением, излучает электромагнитные волны и теряет энергию. Электрон, двигаясь по круговой орбите вокруг ядра, движется с постоянным центростремительным ускорением, и поэтому должен излучать, терять энергию, и в конце концов, упасть на ядро. Расчеты показывали, что это должно происходить в очень короткий промежуток времени, порядка десятков наносекунд. В реальности же атомы стабильны.
Вторым затруднением планетарной модели были сложности объяснения линейчатых спектров – противоречия здесь не было, но и обосновать наличие спектральных линий эта модель не могла.
Постулаты Бора
Для объяснения наблюдаемых явлений в 1913 г Н. Бор предложил свою теорию, базирующуюся на двух постулатах:
- Существуют особые стационарные состояния атома, находясь в которых электроны не излучают энергию, хотя двигаются с ускорением. В каждом стационарном состоянии электрон обладает некоторой энергией $E_n$, разной для разных состояний.
- Электроны излучают или поглощают энергию, переходя из одного стационарного состояния в другое, количество излучаемой или поглощаемой энергии равно разности энергий стационарных состояний.
Постулаты Н.Бора были допущениями, которые никак не обосновывались, исходя из классических теорий того времени. Однако, они явились первой ласточкой новой теории – квантовой механики.
Модель атома Н. Бора
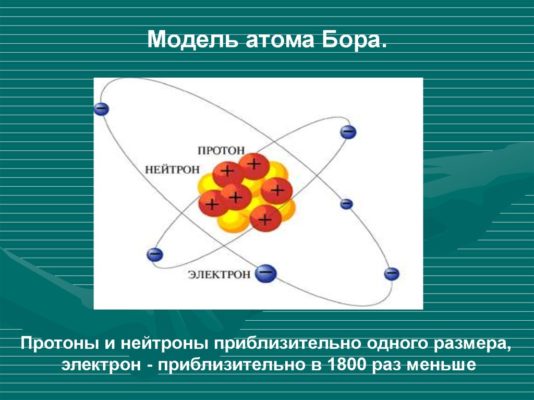
Рис. 2. Модель атома Бора.
На основе своих постулатов и законов механики И.Ньютона Н.Бор смог определить радиусы орбит электрона в атоме водорода, а также энергию, соответствующую стационарному уровню $n$:
- $n$ – номер энергетического уровня (1,2,3…);
- $E_n$ – энергия электрона на уровне $n$;
- $R_y$ – постоянная Ридберга, численно равная 13.6 эВ.
Теория Бора объяснила как стабильность атомов, так и линейчатый характер спектров. Например, серия самых ярких линий спектра водорода, открытая в 1885 г И. Бальмером (названная его именем), соответствует переходам на второй энергетический уровень с третьего, четвертого и более высоких уровней.
Атом водорода способен излучать и более мощную серию, соответствующую переходам на первый энергетический уровень с более высоких, однако, эта серия лежит в ультрафиолетовой области, и была открыта только в 1906 г. Т. Лайманом. Есть и другие серии линий, соответствующих переходам на третий и более высокие уровни.
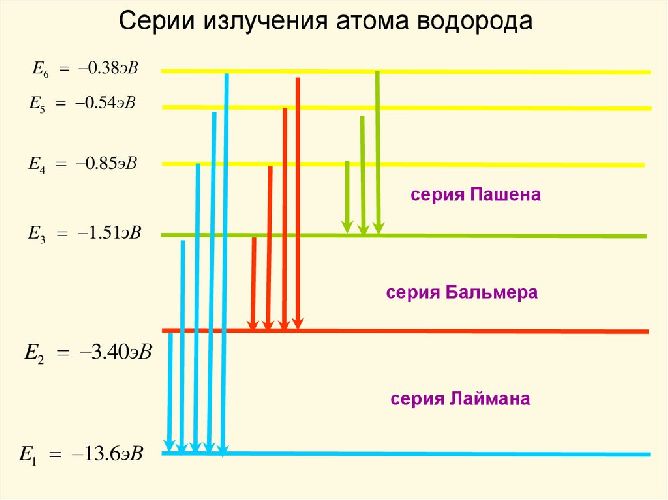
Рис. 3. Серия Бальмера серия Лаймана серия Пашена.
Что мы узнали?
Н. Бор разработал теорию строения атомов на основе своих двух допущений-постулатов. Эта теория смогла объяснить противоречие с электродинамикой Максвелла и линейчатый спектр излучения вещества.
Читайте также:

