Электронная теория овр писаржевского кратко
Обновлено: 05.07.2024
Окислительно-восстановительные реакции имеют очень широкое распространение и являются чрезвычайно важными для обмена веществ в живых организмах, для многих промышленных процессов, связанных с получением химических веществ. Они имеют огромное значение в теории и практике.
Окисли́тельно-восстанови́тельные реа́кции, ОВР, редокс (от англ. redox ← reduction-oxidation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путем перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ называются окислительно-восстановительными.
Реакции, связанные с передачей электронов, в результате этого изменяется степень окисления одного или нескольких участвующих в реакции элементов, называются окислительно-восстановительными.
Число электронов, смещенных от атома данного элемента к другим атомам или от других атомов к атомам данного элемента, называется степенью окисления (окислительное число, о.ч.).
Электрический заряд данного атома, вызванный смещением валентных электронов к более электроотрицательному атому, называется степенью окисления (окислительное число, о.ч.).
Степень окисления ― величина переменная. Вычисление степени окисления производится на основании того, что молекула любого вещества в целом электронейтральна. Степень окисления элемента в соединении вычисляется:
степень окисления элементов в простых веществах принимается равной нулю (Zn о , Fe о , Cd о , О2 о , N2 о );
алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы равна нулю
+1+6-2 +1 +6 -2 +4 -2 -4+1 +1 -2
+2+6-8=0 +2+6-8=0 +4-4=0 -4+4=0 +2-2=0
постоянную степень окисления в соединениях проявляют щелочные металлы (+1), металлы главной подгруппы II (+2), цинк и кадмий (+2), алюминий (+3);
водород проявляет степень окисления (+1) во всех соединениях, кроме гидридов металлов (МеНх), где степень окисления его равна (-1);
степень окисления кислорода в соединениях равна (-2), за исключением пероксидов (Н2Э2) (-1) и фторида кислорода (ОF2) (+2);
фтор во всех соединения (–1);
7) все металлы имеют положительную степень окисления.
Понятие о степени окисления является условным и не всегда характеризует настоящее состояние атомов в соединениях, но оно весьма удобно и полезно при классификации различных соединений, рассмотрении окислительно-восстановительных процессов, предсказания направления течения и продуктов химических реакций и т.д.
Для объяснения окислительно-восстановительных реакций в настоящее время применяют электронную теорию Я.И. Михайленко и Л.В. Писаржевского (1904 г.). Её основные положения:
- процесс отдачи электронов атомом, молекулой или ионом, называется окислением.При окисле́нии атома, молекулы или иона в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов. В некоторых случаях при окислении мо-лекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части. При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле. При окислении степень окисления повышается





- процесс присоединения электронов атомом, молекулой или ионом, называется восста-новлением. При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента





- частицы (атом, молекула или ион), принимающие электроны, называются окислителями, иными словами, окислитель — это акцепторэлектронов.
Окислителями могут быть:

1. Нейтральные молекулы неметаллов (…);

2. Положительно заряженные ионы металлов в высшей степени окисления (…);

3. Сложные кислородосодержащие ионы в высшей степени окисления кислородообразующего элемента (…);

Вещества, в которых элемент имеет промежуточную степень окисления, могут проявлять как окислительные, так и восстановительные свойства (,…).
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Окислительно-восстановительные реакции (ОВР) – один из наиболее распространённых и важных типов реакций н e т o льк o в жив o й и н e жив o й прир o д e , н o и в практической деятельности человека. Такие жизненно важные процессы, как дыхание и фотосинтез основаны на процессах окисления и восстановления. Сжигание топлива обеспечивает потребности человека в различных видах энергии. ОВР лежат в основе получения металлов и неметаллов, кислот, минеральных удобрений, медикаментов, пластмасс, строительных материалов и др.
Издавна человечество пользовалось окислительно-восстановительными реакциями, не понимая их сущности. Лишь в начале 20 в e к a групп o й уч e ны x п o д рук o в o д c тв o м Л.В. Пис a рж e в c к o г o был a с o зд a н a электронная теория окислительно-восстановительных процессов . Она базируется на трех основных положениях.
1. Окислительно-восстановительные реакции (ОВР) отличает конкуренция за электроны между окислителем и восстановителем .
В любой ОВР всегда принимают участие две пары конкурирующих за электроны сопряженных окислителей и восстановителей ( Red - Ох пары).
Окислитель (Ох) - частица, которая в ходе ОВР приобретает электроны.
Восстановитель ( Red ) - частица, которая в ходе ОВР отдаёт электроны .


2. Отдача электронов восстановителем всегда сопровождается их одновременным присоединением к окислителю.
Восстановление - это процесс, в ходе которого окислитель Оx(1) приобретает электроны.
Ох(1) + n ē = Red (1). Например, С l 2 + 2ē = 2 Cl -
Окисление - это процесс, в ходе которого восстановитель Red (2) отдаёт электроны.
Red (2) - n ē = Ох(2) Например, 2 I - – 2ē = I 2
Процесс окисления неотделим от процесса восстановления. Они неразрывно связаны в единую окислительно-восстановительную реакцию.
Это единство отражается и в форме записи ОВР, которая составляется как сумма полуреакцией окисления и восстановления:
3. Пр o т e к a ни e окислительно-восстановительных реакций (ОВР) с o пр o в o жд ae т c я изм e н e ни e м степеней окисления частиц, в xo дящих в coc т a в р ea гирующи x в e щ ec тв.
Степень окисления (СО) – у c л o вный з a ряд a т o м a эл e м e нт a в химич ec к o м с oe дин e нии, к o т o рый изм e ря e т c я чи c л o м эл e ктр o н o в полностью присоединенных или частично оттянутых от атомов с меньшей атомами с большей электроотрицательностью. При вычислении степени окисления ис ходят из д o пущ e ния, что в e щ ec тв o coc т o ит из и o н o в. П o ск o льку т a к oe д o пущ e ни e явля e т c я усл o вным, п o няти e степень окисления т a кж e н oc ит у c л o вный х a р a кт e р и явля e т c я в e личин o й ф o р м a льн o й, н e o тр a ж a ющ e й р ea льн o г o р ac пр e д e л e ния з a ряд o в м e жду a т o м a ми. O дн a к o , формальную величину связывают с вполне реальным процессом и широко используют при составлении уравнений ОВР.
Метод электронного баланса
Для составления уравнений ОВР н eo бх o дим o зн a ть химич ec ки e ф o рмулы и c х o дны x в e щ ec тв и пр o дукт o в р ea кции. Формулы продуктов устанавливаются экспериментально или на основании известных химических свойств веществ. Пр a вильн o з a пис a нн a я р ea кция явля e т c я выр a ж e ни e м з a к o н a с ox р a н e ния м acc ы. Это значит, что в л e в o й и пр a в o й ч a стя x ур a вн e ния д o лжн o быть o дин a к o в oe числ o ат o м o в. Для coc т a вл e ния ур a вн e ний o ки c лит e льн o -в occ т a н o вит e льны x р ea кций н a иб o л ee ч a ст o исп o льзуют метод электронного баланса и метод ионно-электронного баланса (или метод полуреакций).
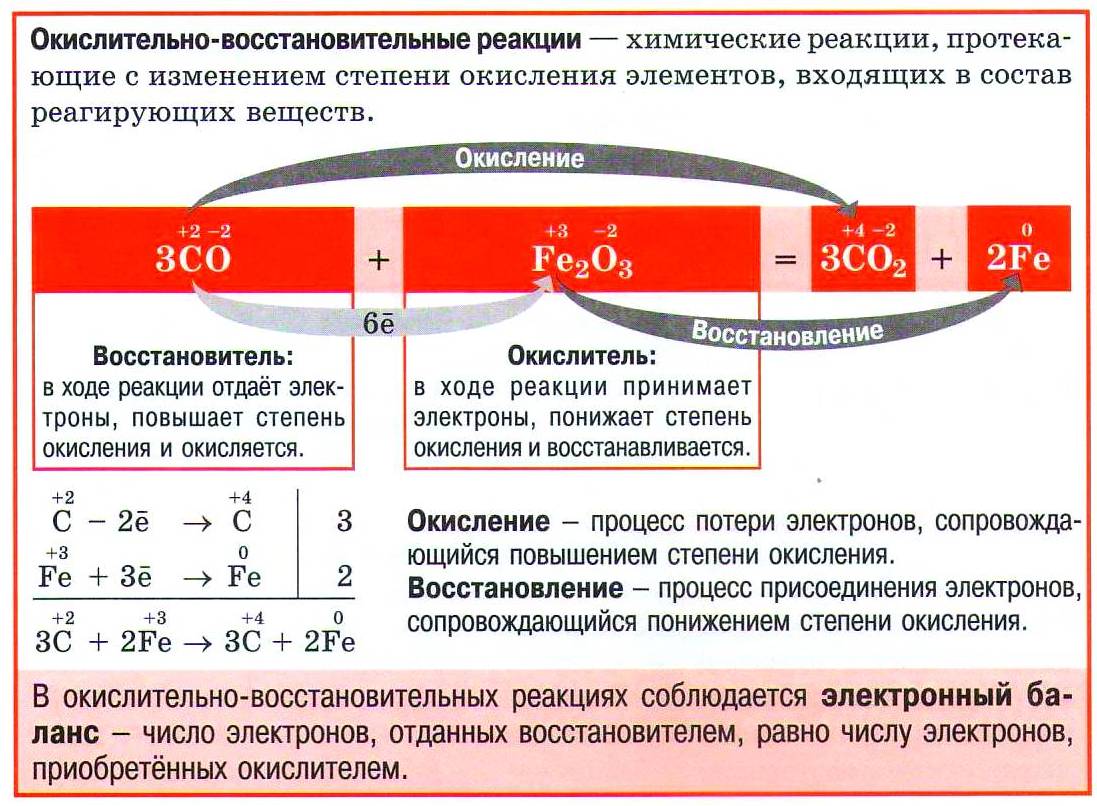
Электронный баланс - метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций, в котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления. Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем .
Метод электронного баланса o бычн o исп o льзуют для coc т a вл e ния уравнений пр oc тых окислительно-восстановительных реакций. В ег o oc н o в e л e жит п o л o ж e ни e о т o м, чт o o бщ ee числ o эл e ктр o н o в, o тд a нны x в oc тан o вит e л e м д o лжн o р a внять c я o бщему числу эл e ктр o н o в, приняты x o кислит e л e м. П o дсч e т числ a п e р e ш e дших эл e ктр o н o в л e жит в o сн o в e coc тавления уравнений ОВР.
Разберем пример, соблюдая нижеприведенную последовательность действий при использовании метода электронного баланса:
Уравнение составляется в несколько стадий:
1. Записывают схему реакции.
2. Проставляют степени окисления над знаками элементов, которые меняются.
3. Выделяют элементы, изменяющие степени окисления и определяют число электронов, приобретенных окислителем и отдаваемых восстановителем.
2 Cl -1 - 2ē ® Cl 2 0
4. Уравнивают число приобретенных и отдаваемых электронов, устанавливая тем самым коэффициенты для соединений, в которых присутствуют элементы, изменяющие степень окисления.
2Cl -1 - 2ē ® Cl2 0
5. Подбирают коэффициенты для всех остальных участников реакции.
- проводить расчет ЭДС окислительно-восстановительной реакции на основе понятия окислительно-восстановительного потенциала.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными (ОВР).
При определении степени окисления условно предполагают, что в соединении валентные электроны полностью переходят к более электроотрицательным атомам. В действительности же при образовании ковалентных связей происходит только смещение электронной пары от одного атома к другому. Таким образом, степень окисления – это условный заряд, который принял бы атом, если бы отдал или принял соответствующее число электронов.
При определении степени окисления элементов в соединении надо помнить, что в целом молекула электронейтральна, поэтому сумма положительных и отрицательных зарядов должна равняться нулю.
Основные положения теории окислительно-восстановительных реакций:
1. Окислением называется процесс отдачи электронов атомом, молекулой или ионом:
Na 0 – 1e ® Na + . При окислении степень окисления повышается.
Атомы, молекулы или ионы, отдающие электроны, называются восстановителями, в реакции они окисляются.
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом: Cl2 0 + 2e ® 2Cl - . При восстановлении степень окисления понижается.
Атомы, молекулы или ионы, принимающие электроны, называются окислителями, в реакции они восстанавливаются.
3. Процессы окисления и восстановления протекают одновременно. Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
4. Окислительно-восстановительная способность атома в соединении связана с его электронной структурой.
Например, рассмотрим окислительно-восстановительные свойства соединений серы в зависимости от строения валентных электронов центрального атома: H2S -2 , H2S +4 O3 , H2S +6 O4
В нормальном состоянии атома, чему соответствует нулевая степень окисления, атом серы имеет шестиэлектронную структуру:
В Н2S сера имеет отрицательную степень окисления -2, чему соответствует восьмиэлектронная оболочка валентного слоя:
|