Электролитическая диссоциация водородный показатель кратко
Обновлено: 02.07.2024
описывается константой Кw, которая носит название “ионное произведение воды”. Ионное произведение воды равно:
Кw = [Н + ] [ОН — ] (1)
Для разбавленных водных растворов ионное произведение воды не зависит от состава раствора и постоянно при данной температуре. Так, Кw=10 — 14 для воды, миллимолярных растворов К2SO4, H2SO4 и KOH при Т=298 К. Строго говоря, постоянство Кw справедливо в случае, когда аналитические концентрации ионов заменены их активностями (лишь для малых концентраций Н + и ОН — значения концентрации и активности практически совпадают).
Процесс диссоциации Н2О идет с поглощением теплоты, поэтому при повышении температуры в интервале от 0 до 100 о С величина Кw увеличивается.
Для практических целей удобно пользоваться не концентрацией ионов водорода, а её водородным показателем – отрицательным десятичным логарифмом – рН. Величина рН равна:
рН = — lg[H + ]. (2)
Как выше отмечалось, более строгим является уравнение рН = – lg aН+, где aН+ – активность ионов водорода. Однако для практических целей при расчете рН разбавленных растворов обычно используется уравнение (2).
рН + рОН = 14, (3)
Для нейтральных растворов рН = 7, для кислых растворов рН 7. В аналитической практике редко приходится работать с растворами, рН которых выходит из интервала 0 ÷14. Тем не менее, в сильнощелочной среде рН может быть немного больше 14, а в очень кислой среде может принимать отрицательные значения.
Задача 1. Вычислите рН 0,001М растворов HСl и КОН.
Решение. HСl и КОН являются сильными электролитами и в разбавленных растворах практически полностью диссоциируют на ионы. В растворе НСl: [Н + ] = 0,001 моль/л.
рН = –lg [H + ] = –lg 0,001 = 3
В растворе КОН: [ОН – ] = 0,001 моль/л. рОН = –lg [ОH — ] = –lg 0,001 = 3. рН=14 – 3 = 11.
Задача 2. Рассчитайте рН раствора КОН, 350 мл которого содержат 0,0035 моль КОН.
Решение.
КОН → К + + ОН —
рОН = –lg [ОH — ] = –lg 0,01 = 2.
рОН + рН = 14. рН = 14 – 2 = 12
или [Н + ] = 10 –14 /[ОН – ] = 10 –14 /0,01 = 10 –12 моль/л.
рН = –lg 10 –12 = 12.
Задача 3. Вычислите молярную концентрацию раствора Ba(OH)2, если рН раствора составляет 12 при 298 К.
Решение.
Ba(OH)2 → Ва 2+ + 2ОН –
-lg [ОH – ] = 2, откуда [ОH – ] = 0,01 М.
Задача 4. Рассчитайте степень диссоциации и рН 0,01 М водного раствора аммиака при 298 К, если константа диссоциации NH4OH при указанной температуре равна 1,76·10 –5 .
Решение.
NH3 H2O ⇔ NH4 + + OH — или упрощенно: NH4ОH ⇔ NH4 + + OH —
[Н + ] = 10 -14 /[ОН — ] = 10 -14 /4,2·10 -4 = 2,4·10 -11 моль/л.
рН = –lg [H + ] = –lg 2,4·10 –11 = 10,6.
Задача 5. К 1 л 0,01М раствора CH3CОOH добавили 6 г СН3СООNa. Определите рН полученного раствора при Т = 298 К, если при указанной температуре Кд(CH3CОOH) = 1,75·10 –5 .
Решение.
Присутствие в растворе CH3CОOH сильного электролита СН3СООNa приводит к сдвигу равновесия диссоциации уксусной кислоты влево в силу действия принципа Ле Шателье. В результате степень диссоциации уксусной кислоты уменьшается.
n(СН3СООNa) = 6:82 = 0,073 моль.
(считаем, что объем раствора после добавления 6 г СН3СООNa не изменился).
Ацетат–ионы в растворе образуются как за счет диссоциации уксусной кислоты:
CH3CОOH ⇔ СН3СОО – + Н + ,
так и за счет диссоциации СН3СООNa:
СН3СООNa → СН3СОО — + Na +
Поскольку СН3СООNa в растворе диссоциирует полностью, то концентрацией ацетат-ионов, образующихся при диссоциации уксусной кислоты можно пренебречь, так как она мала по сравнению с величиной 0,073 моль/л. Принимаем, что:
Электролитическая диссоциация, полный или частичный распад молекул растворенного вещества на катионы и анионы. Электролитической диссоциацией называют также распад на катионы и анионы ионных кристаллов при растворении или расплавлении.
Ионное произведение воды - произведение равновесных концентраций катионов водорода и гидроксид ионов, величина постоянная и равна 10 -14 моль-ион/л.
[Н + ]·[ОН - ]=1·10 -14 моль-ион/л (ионное произведение воды или константа автопротолиза).
Таким образом, ионное произведение воды позволяет для любого водного раствора найти концентрацию ОН - по известной концентрации Н + , и наоборот.
Водородный показатель рН - количественная характеристика кислотности среды, равная отрицательному десятичному логарифму концентрации свободных ионов водорода в растворе:
рН=-lg[Н + ], рОН=-lg[ОН - ], рН+рОН=14
В кислых растворах рН 7.
Гидроксильный показатель рОН — это десятичный логарифм концентрации гидроксильных ионов, взятый с обратным знаком: рОН=— lg[OH~].
Степень диссоциации (а) электролита, как количественная характеристика равновесия процесса ионизации. Деление электролитов на сильные и слабые по величине степени диссоциации. Факторы, влияющие на степень диссоциации.
Степень диссоциации α - отношение числа молекул, распавшихся на ионы, к общему числу молекул
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
Степень диссоциации равна отношению продиссоциированных молекул вещества к общему числу его молекул . Выражается в долях или процентах.

По степени диссоциации в растворах все электролиты делятся на две группы.
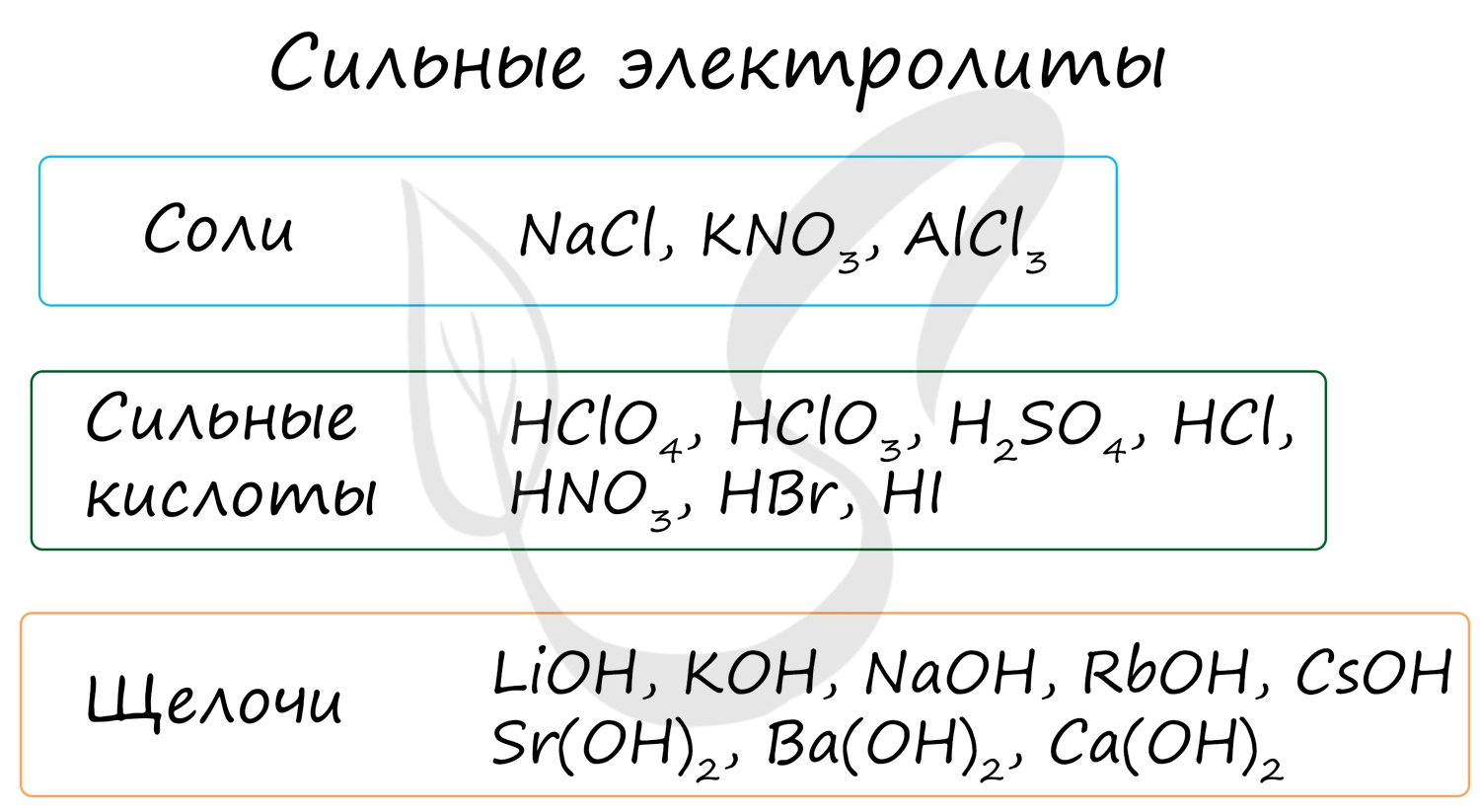
Сильные электролиты, электролиты, степень диссоциации которых в растворах α > 30 % и почти не зависит от концентрации раствора.
К сильным электролитам в водных растворах относятся щелочи: КОН, NaOH, Ba(OH)2, Са(ОН)2; кислоты: HNO3, НСl, H2SO4, НClO4, а также их соли.
Слабые электролиты, электролиты, степень диссоциации которых в растворах α
Степень диссоциации зависит:
1) от природы растворителя;
2) природы растворяемого вещества;
3) концентрации раствора (при разбавлении степень диссоциации a сильно возрастает);
Электролитическая диссоциация, полный или частичный распад молекул растворенного вещества на катионы и анионы. Электролитической диссоциацией называют также распад на катионы и анионы ионных кристаллов при растворении или расплавлении.
Ионное произведение воды - произведение равновесных концентраций катионов водорода и гидроксид ионов, величина постоянная и равна 10 -14 моль-ион/л.
[Н + ]·[ОН - ]=1·10 -14 моль-ион/л (ионное произведение воды или константа автопротолиза).
Таким образом, ионное произведение воды позволяет для любого водного раствора найти концентрацию ОН - по известной концентрации Н + , и наоборот.
Водородный показатель рН - количественная характеристика кислотности среды, равная отрицательному десятичному логарифму концентрации свободных ионов водорода в растворе:
рН=-lg[Н + ], рОН=-lg[ОН - ], рН+рОН=14
В кислых растворах рН 7.
Гидроксильный показатель рОН — это десятичный логарифм концентрации гидроксильных ионов, взятый с обратным знаком: рОН=— lg[OH~].
Степень диссоциации (а) электролита, как количественная характеристика равновесия процесса ионизации. Деление электролитов на сильные и слабые по величине степени диссоциации. Факторы, влияющие на степень диссоциации.
Степень диссоциации α - отношение числа молекул, распавшихся на ионы, к общему числу молекул

Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
Степень диссоциации равна отношению продиссоциированных молекул вещества к общему числу его молекул . Выражается в долях или процентах.

По степени диссоциации в растворах все электролиты делятся на две группы.
Сильные электролиты, электролиты, степень диссоциации которых в растворах α > 30 % и почти не зависит от концентрации раствора.
К сильным электролитам в водных растворах относятся щелочи: КОН, NaOH, Ba(OH)2, Са(ОН)2; кислоты: HNO3, НСl, H2SO4, НClO4, а также их соли.
Слабые электролиты, электролиты, степень диссоциации которых в растворах α
Вода — слабый амфотерный электролит.
Уравнение ионизации воды с учетом гидратации ионов водорода Н + таково:
Без учета гидратации ионов Н + уравнение диссоциации воды имеет вид:

Как видно из второго уравнения, концентрации ионов водорода Н + и гидроксид-ионов ОН — в воде одинаковы. При 25 о С [Н + ] = [ОН — ] = 10 -7 моль/л.
Произведение концентраций ионов водорода и гидроксид-ионов называется ионным произведением воды (KH2O).
KH2O — величина постоянная, и при температуре 25 о С
В разбавленных водных растворах электролитов, как и в воде, произведение концентраций ионов водорода Н + и гидроксид-ионов ОН — — величина постоянная при данной температуре. Ионное произведение воды дает возможность для любого водного раствора вычислить концентрацию гидроксид-ионов ОН — , если известна концентрация ионов водорода Н + , и наоборот.
Среду любого водного раствора можно охарактеризовать концентрацией ионов водорода Н + или гидроксид-ионов ОН — .
В водных растворах различают три типа сред: нейтральную, щелочную и кислую.
Нейтральная среда — это среда, в которой концентрация ионов водорода равна концентрации гидроксид-ионов:
[Н + ] = [OH — ] = 10 -7 моль/л
Кислая среда — это среда, в которой концентрация ионов водорода больше концентрации гидроксид-ионов:
[Н + ] > [ОН — ], [H+] > 10 -7 моль/л
Щелочная среда — это среда, в которой концентрация ионов водорода меньше концентрации гидроксид-ионов:
[H + ] — ], [H + ] -7 моль/л
Для характеристики сред растворов удобно использовать так называемый водородный показатель рН (пэ-аш).
Водородным показателем рН называется отрицательный десятичный логарифм концентрации ионов водорода: рН = -lg[H + ].

Например, если [H + ] = 10 -3 моль/л, то pН = 3, среда раствора — кислая; если [Н + ] = 10 -12 моль/л, то pН = 12, среда раствора — щелочная:
Чем рН меньше 7, тем больше кислотность раствора. Чем рН больше 7, тем больше щелочность раствора.
Зависимость между концентрацией ионов Н + , величиной рН и средой раствора показана на следующей схеме:

Существуют различные методы измерения рН. Качественно характер среды водных растворов электролитов определяют с помощью индикаторов.
Индикаторами называются вещества, которые обратимо изменяют свой цвет в зависимости от среды растворов, т. е. рН раствора.
На практике применяют индикаторы лакмус, метиловый оранжевый (метилоранж) и фенолфталеин. Они изменяют свою окраску в малом интервале рН: лакмус — в интервале рН от 5,0 до 8,0; метилоранж — от 3,1 до 4,4 и фенолфталеин — от 8,2 до 10,0.

Изменение цвета индикаторов показано на схеме:
Заштрихованные области показывают интервал изменения окраски индикатора.

Кроме указанных выше индикаторов, применяют также универсальный индикатор, который можно использовать для приблизительного определения рН в широком интервале от 0 до 14.
Величина рН имеет большое значение в химических и биологических процессах, так как в зависимости от характера среды эти процессы могут протекать с разными скоростями и в разных направлениях.
Поэтому определение рН растворов очень важно в медицине, науке, технике, сельском хозяйстве. Изменение рН крови или желудочного сока является диагностическим тестом в медицине. Отклонения рН от нормальных, величин даже на 0,01 единицы свидетельствуют о патологических процессах в организме. Постоянство концентраций ионов водорода Н + является одной из важных констант внутренней среды живых организмов.
Так, при нормальной кислотности желудочный сок имеет рН 1,7; рН крови человека равен 7,4; слюны — 6,9. Каждый фермент функционирует при определенном значении рН: каталаза крови при рН 7 пепсин желудочного сока — при рН 1,5—2; и т. д.
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A - (анион)
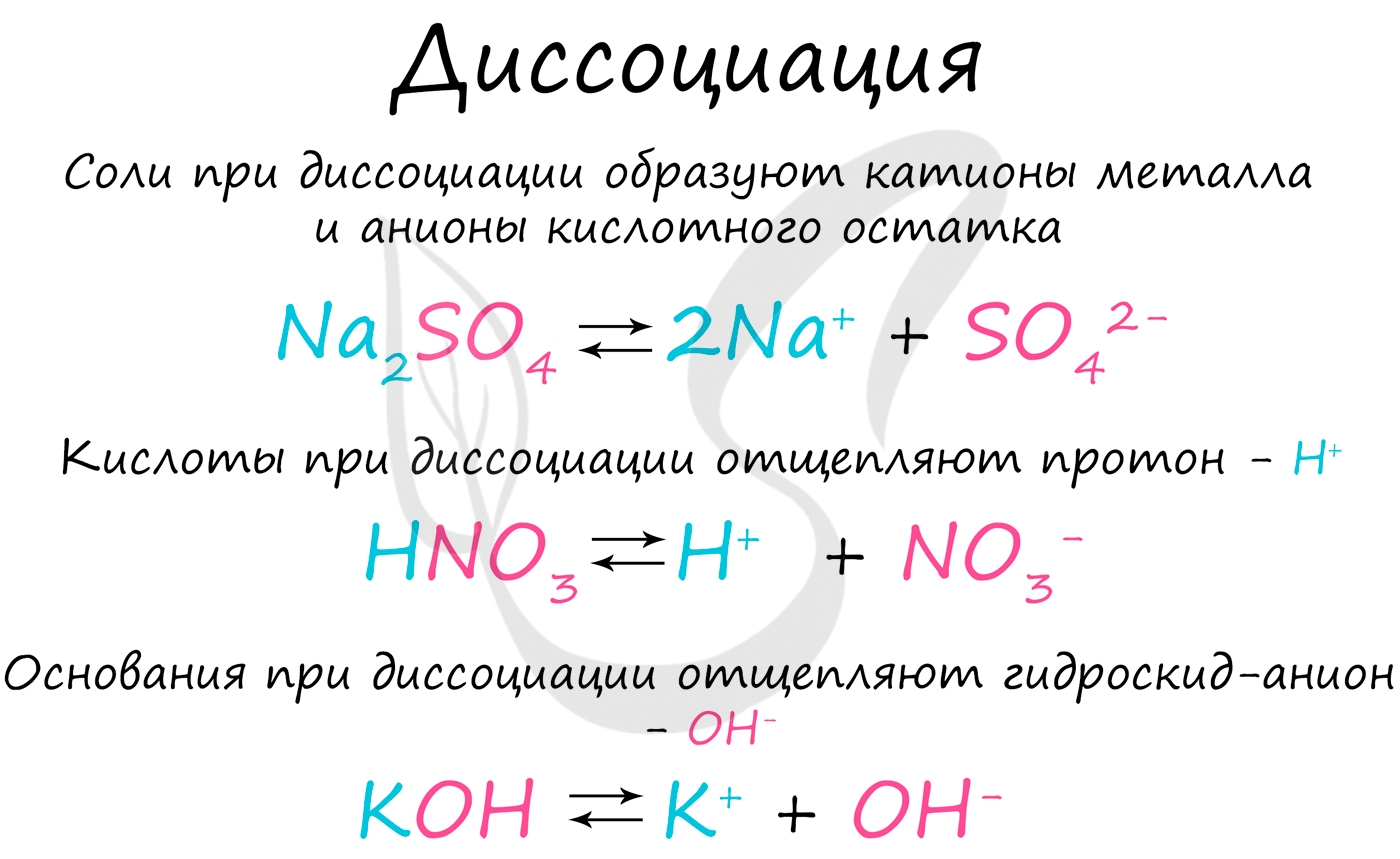
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
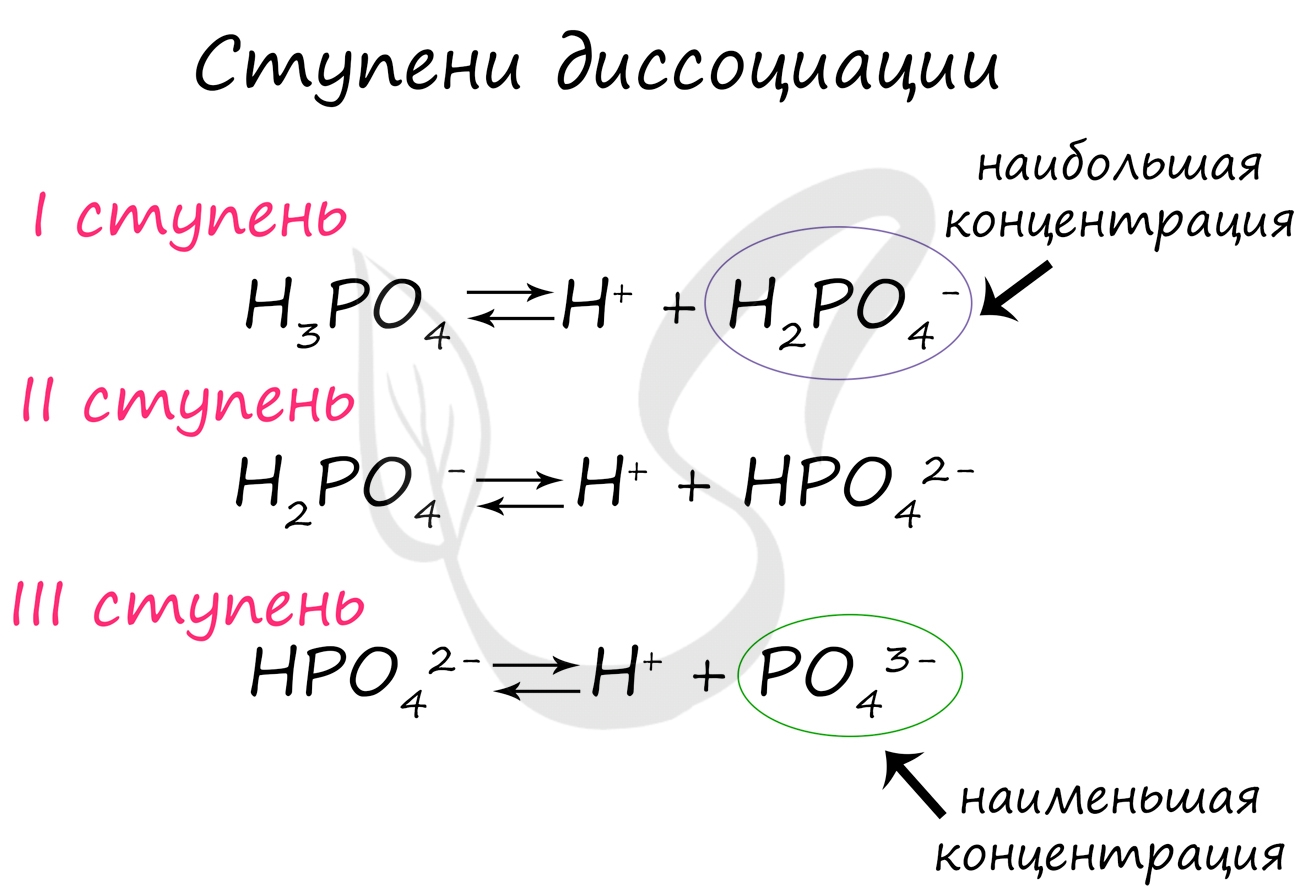
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
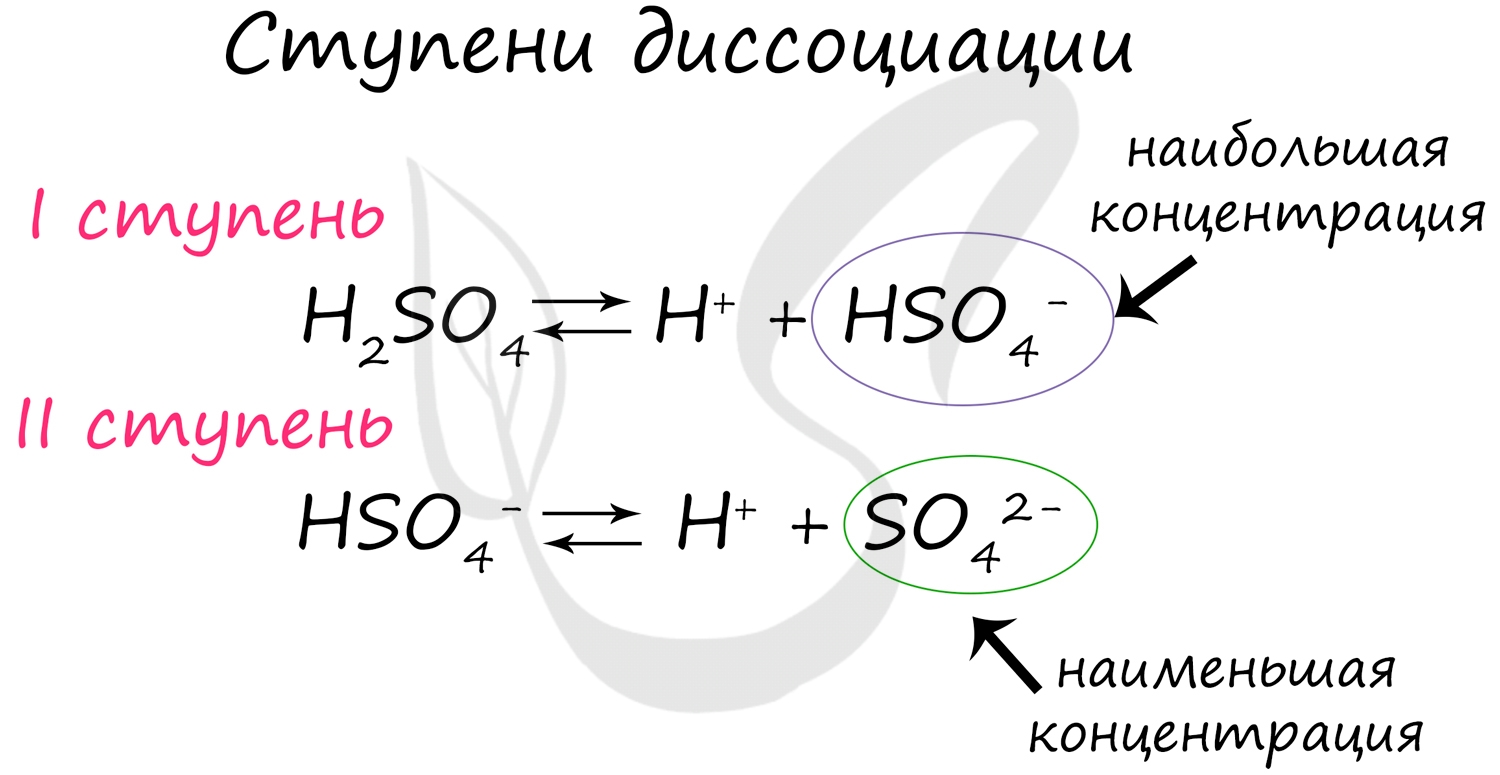
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.

Электролиты - жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты - вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
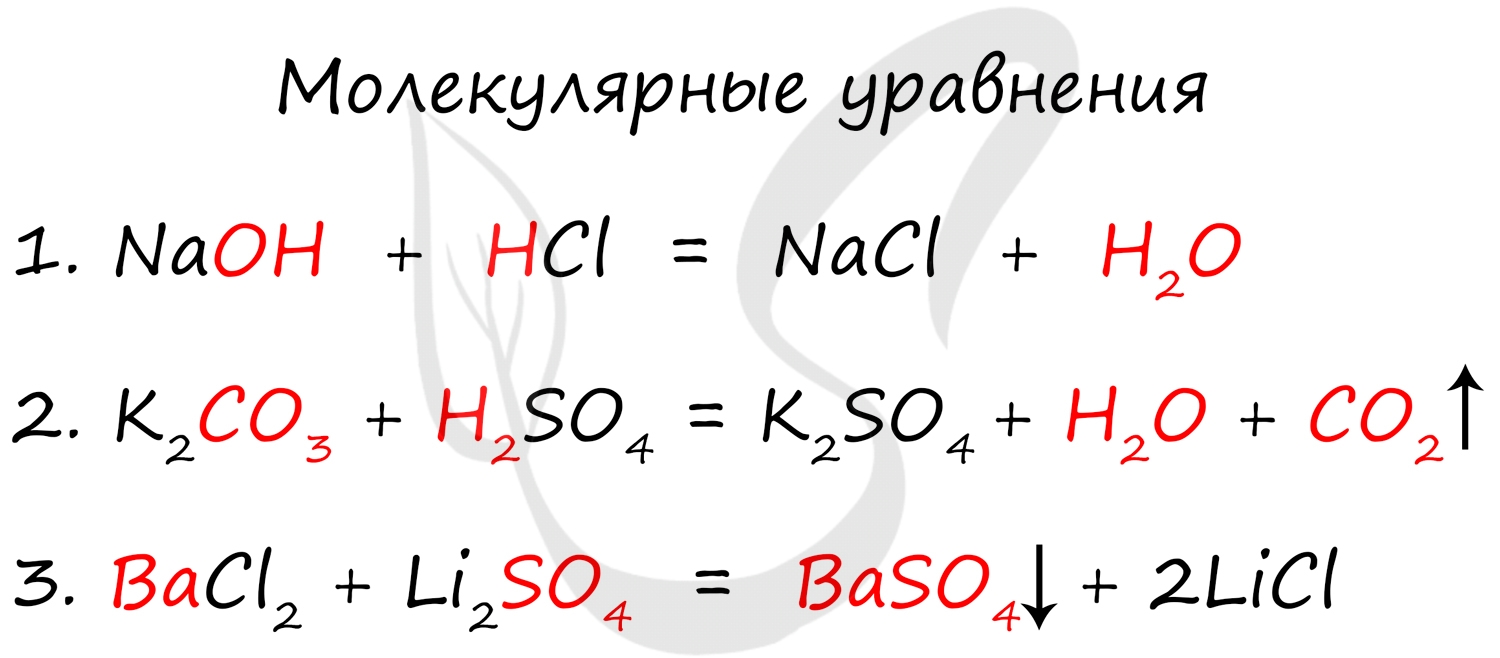
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
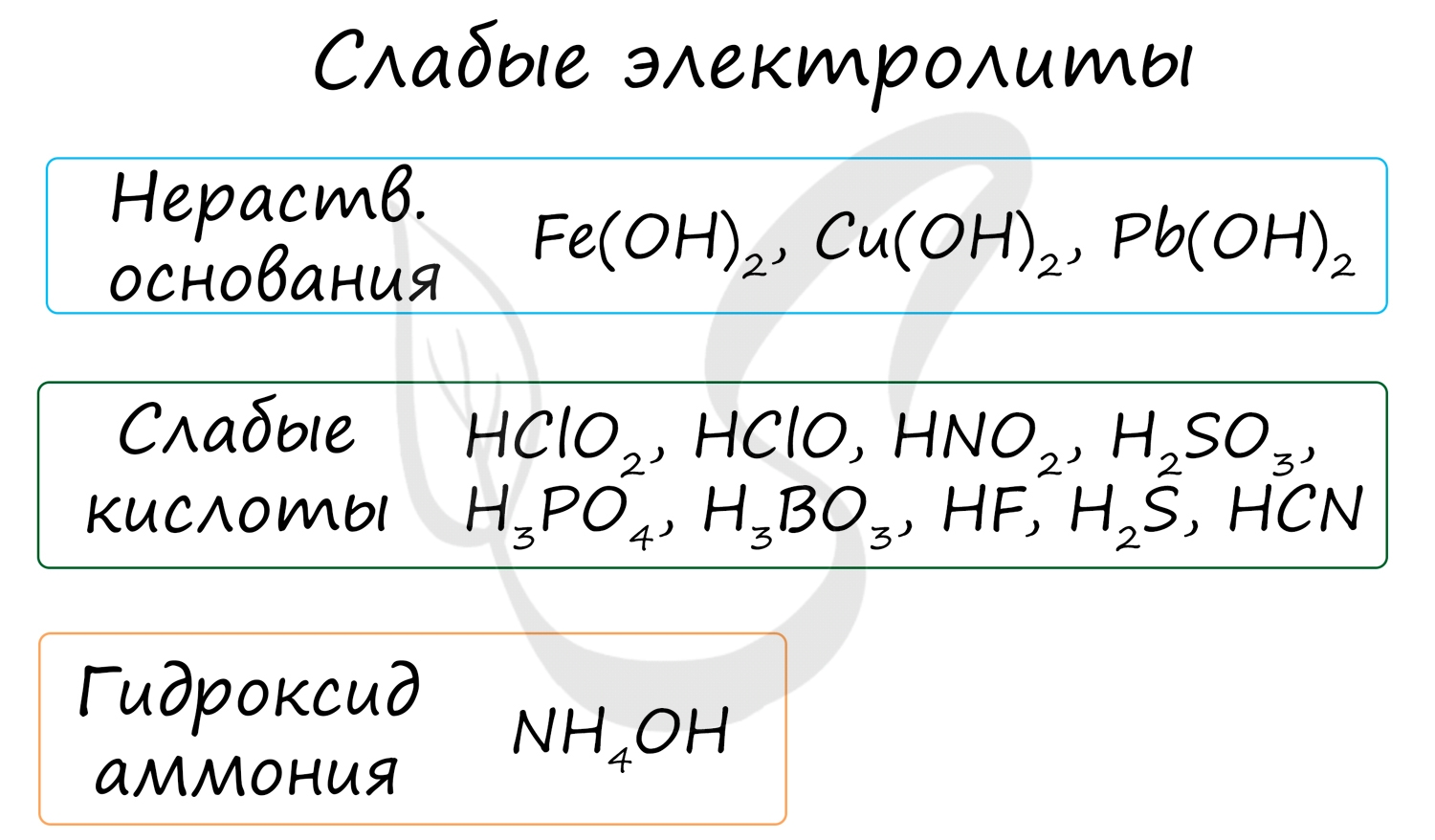
- Слабые электролиты (в их числе вода)
- Осадки
- Газы

Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике - остается только то, что сократить нельзя.
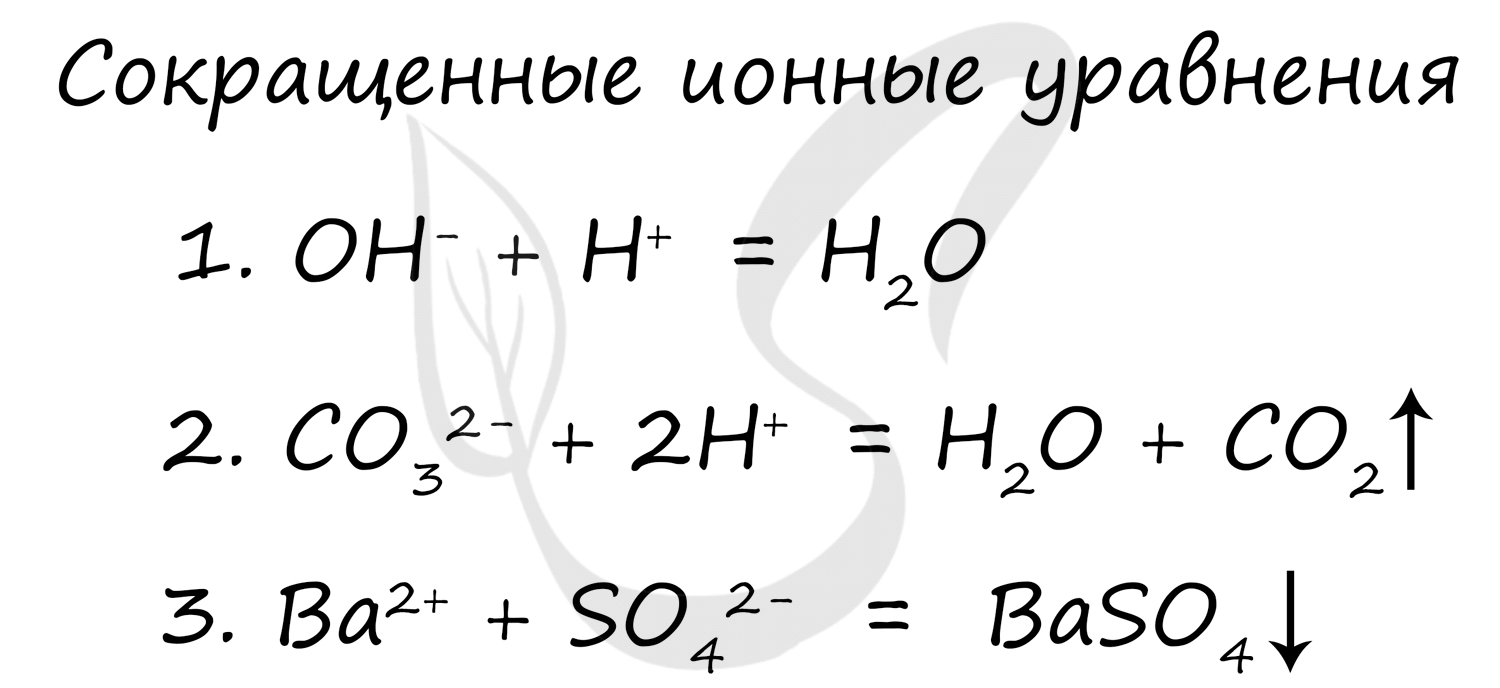
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

