Диаграмма состояния воды кратко
Обновлено: 02.07.2024
Диаграмма цветная — степени сухости, температура, давление и объем выделены разными цветами, что делает работу с диаграммой очень удобной.
Большой размер позволит распечатать диаграмму на формате А3 и больше.
is-диаграмма применяется для практических расчетов процессов водяного пара. На ней теплота и энтальпия измеряются линейными отрезками.
is-диаграмма обладает рядом важных свойств: по ней можно быстро определить параметры пара и разность энтальпий в виде отрезков, наглядно изобразить адиабатный процесс, и решать другие задачи.
Так же вы можете использовать очень удобную и наглядную программу.
Описание is-диаграммы
На is-диаграмме изображены термодинамические процессы:
- Изобарный процесс (p = const) — фиолетовые линии (изобары),
- Изотермический процесс (t = const) — зеленые линии (изотермы),
- Изохорный процесс (v = const) — красные линии (изохоры).
Степень сухости и паросодержание (х) — розовые линии. Жирная розовая линия — степень сухости х=1. Все что ниже этой линии — зона влажного пара.

Семейство изобар в области насыщения представляет собой пучок расходящихся прямых, начинающихся на нижней и оканчивающихся на верхней пограничной кривой. Чем больше давление, тем выше лежит соответствующая изобара. Переход изобар из области влажного насыщенного в область перегретого пара происходит без перелома на верхней пограничной кривой.
В i, s-диаграмме водяного пара наносятся также линии постоянного паросодержания (x = const) и линии постоянного удельного объема (v = const). Изохоры идут несколько круче, чем изобары.
Состояние перегретого пара обычно определяется в технике давлением p и температурой t. Точка, изображающая это состояние, находится на пересечении соответствующей изобары и изотермы. Состояние влажного насыщенного пара определяется давлением p и паросодержанием x.
Точка, изображающее это состояние, определяется пересечением изобары и линии x = const.
Как пользоваться is-диаграммой
Для описания воспользуемся небольшой задачей. Возьмем с потолка условие.
Пусть начальные параметры пара будут: давление пара р = 120 бар, температура пара t = 550°С. Пар адиабатно расширяется в турбине до температуры, например, 400 °С.
Для примера этого будет достаточно.
Адиабатный процесс на is-диаграмме — это вертикальная линия (горизонтальная линия — дросселирование). Это для справки.
Итак, начальное давление и температура у нас есть. Найдем эту точку на is-диаграмме:
Нам нужна изобара, соответствующая давлению 120 бар и изотерма, соответствующая температуре 550 °С. На их пересечении и будет точка, соответствующая начальным параметрам пара в нашей задаче.

i = ~3480 кДж/кг, S = 6,65 кДж/(кг•К)
Далее нам нужно узнать параметры пара после адиабатного расширения. Мы знаем, что по поставленным нами условиям, пар расширился и его температура в точке 2 = 400 °С. Я уже упоминал, что на is-диаграмме адиабатный процесс изображается в виде вертикальной линии. Проведем эту линию из точки 1 (начальные параметры) до пересечения с изотермой 400 °С.

Получена точка 2. Через эту точку проходит изобара. Она соответствует давлению 50 бар. Энтропия у нас не изменилась, так как процесс адиабатный, а вот энтальпия стала равна i = 3200 кДж/кг.
В физической химии одним из важнейших и очень сложных с точки зрения вывода является закон равновесия фаз, который также называется правилом фаз Гиббса. Мы только познакомимся с этим правилом на примере фазовых состояний воды.
На любом поле диаграммы состояния воды (рис. 5.11) поставьте точку, соответствующую некоторым температуре и давлению. Проведите из этой точки горизонтальную прямую в виде стрелки до пересечения с кривой диаграммы. Если изменять температуру, двигаясь по этой стрелке, то существующая фаза не изменится (пока не будет пересечена кривая).
Рис. 5.11.
Диаграмма состояния воды
Теперь такую же прямую в виде стрелки из той же точки проведите в вертикальном направлении. Передвижение вдоль этой прямой (при постоянной температуре) соответствует изменению давления, которое не приводит к исчезновению данной фазы и появлению другой.
Из той же точки (или любой другой того же поля) можно провести прямую, направленную под любым углом к осям координат. Передвижение вдоль такой прямой до ее пересечения с кривой диаграммы состояния означает возможность одновременного изменения температуры и давления при условии существования фазы данного поля. Таким образом, на поле можно одновременно изменять температуру и давление, не изменяя вида и числа фаз. Мы говорим, что на поле система имеет две степени свободы, по числу условий (температура и давление), которые можно варьировать, не изменяя вида и числа фаз или льда, или жидкости, или пара.
Число степеней свободы С – это число условий, которые можно изменять в определенных пределах без изменения числа и вида фаз.
Вы нагреваете воду от комнатной температуры, предположим, до 80 °С в разные дни, когда давление изменяется, но жидкость остается жидкостью, хотя одновременно изменяются и температура, и давление. В этих условиях система имеет две степени свободы, т. е. С = 2.
Теперь поставьте точку, например, на кривой диаграммы состояния равновесия между жидкостью и паром (см. рис. 5.11). Жидкая вода и пар могут находиться в равновесии при некоторых различных температурах и давлениях, но каждой температуре отвечает строго определенное давление, и, наоборот, каждому давлению соответствует строго определенная температура, при которой сосуществуют две фазы. В этом случае мы говорим, что система обладает одной степенью свободы, т. е. С = 1.
Теперь остановимся на тройной точке О, в которой при строго определенных температуре и давлении сосуществуют в равновесии три фазы – лед, жидкость и пар. Тройная точка характеризуется единственным сочетанием температуры и давления, поэтому-то температуру тройной точки и выбрали как начало отсчета абсолютной температуры в градусах Кельвина (273,16 К). Стоит незначительно изменить давление или температуру, как одна из фаз или сразу две переходят в другую, и система становится двух- или однофазной – мы попадаем на соответствующую кривую или поле. Одним словом, в тройной точке система не имеет ни одной степени свободы, т. е. С = 0.
При исследовании фазового состояния систем (не только воды!) знание числа степеней свободы при данных условиях очень важно, т. к. позволяет предсказывать, сколько условий равновесия можно изменять, не боясь появления новых фаз или исчезновения имеющихся.
Число степеней свободы С равновесной термодинамической системы подсчитывается по правилу фаз Гиббса и равно числу компонентов системы К минус число фаз Ф плюс число факторов n, влияющих на равновесие:
Здесь дана та формулировка правила фаз Гиббса, которая приводится в строгой научной физической или химической литературе, поэтому, наверное, следует объяснить некоторые термины.
Компоненты системы – это те ее составные части, которые могут быть выделены из системы и могут существовать в индивидуальном виде. Вода – компонент системы, но ионы воды или другие ионы в водном растворе не считаются компонентами, т. к. не могут быть выделены и не существуют индивидуально. Чистая вода – однокомпонентная система.
Если мы приготовим раствор поваренной соли NaCl в воде, то система будет состоять из воды Н2О, ионов натрия Na + и хлорид-ионов Cl – (и, конечно, ионов водорода Н + и гидроксид-ионов ОН – , образующихся в крайне незначительном количестве при диссоциации воды). Но система будет двухкомпонентной [Н2О + NaCl], т. к. индивидуально можно выделить из раствора жидкую воду и кристаллический хлорид натрия NaCl.
Факторы, влияющие на равновесие, – это то, что мы называли раньше условиями существования системы. Для рассмотренной диаграммы состояния воды два фактора влияют на образование и существование фаз – температура и давление, n = 2. Формула правила фаз в этом случае имеет вид:
В большинстве случаев в лабораторной работе проводят эксперименты при постоянном (атмосферном) давлении, поэтому только температура будет играть роль фактора, влияющего на равновесие, т. е. n = 1. Формула правила фаз в этом случае такова:
В последнее время обнаружено влияние электромагнитного и гравитационного полей и многих других факторов на равновесие. Но в обычной научной работе эти факторы не учитываются.
Сейчас выполним следующий мысленный эксперимент, хотя его очень просто проделать реально. Откройте страницу учебника с диаграммой состояния воды, выберите на поле льда диаграммы любую точку, расположенную выше тройной точки и ниже критической точки. Опыт проводим при постоянном давлении, поэтому число факторов n = 1. Число степеней свободы подсчитываем по формуле
Нагревание при постоянном давлении на диаграмме состояния выражается передвижением по горизонтальной прямой вправо, в сторону поля жидкости. Эта прямая до пересечения с кривой описывает однофазную однокомпонентную систему с числом степеней свободы:
Рис. 5.12.
График нагревания воды:
к – лед, ж – жидкость, г – пар
Температура системы поднялась до значения, отвечающего пересечению горизонтальной прямой на диаграмме состояния с кривой зависимости давления пара воды от температуры. Началось кипение воды. Система стала двухфазной, с числом степеней свободы снова равным нулю:
Вода встречается в природных условиях в трех состояниях: твердом, жидком, газообразном. Эти состояния воды называют агрегатными состояниями, или же соответственно твердой, жидкой и парообразной фазами. Переход воды из одной фазы в другую обусловлен изменением ее температуры и давления.
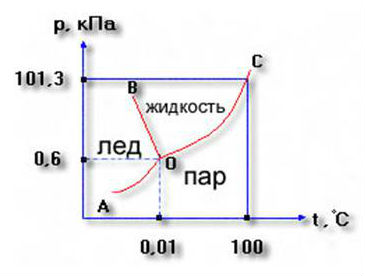
Диаграмма показывает состояния воды, термодинамически устойчивые при определенных значениях температуры и давления.
Она состоит из трех кривых, разграничивающих все возможные температуры и давления на три области, отвечающие льду, жидкости и пару.
лед = пар (кривая ОА)
лед = жидкость (кривая ОВ)
жидкость = пар (кривая ОС)
О – точка замерзания воды
Пересечение трех кривых происходит в точке О – тройной точке, в которой все три фазы находятся между собой в равновесии.
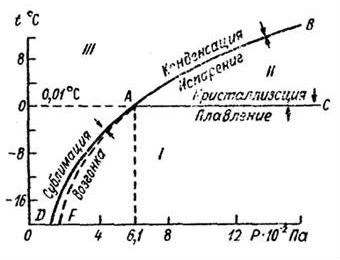
Рис.2 Диаграмма агрегатных состояний воды в области тройной точки А. I — лед. II — вода. III — водяной пар.
Вдоль кривой AC она находится в состоянии равновесия между твердой и жидкой фазами (плавление льда и кристаллизация воды);
вдоль кривой AB — в состоянии равновесия между жидкой и газообразной фазами (испарение воды и конденсация пара);
вдоль кривой AD — в равновесии между твердой и газообразной фазами (сублимация водяного пара и возгонка льда).
Равновесие фаз по рис.2 вдоль кривых AB, АС и AD надо понимать как динамическое равновесие, т. е. вдоль этих кривых число вновь образующихся молекул одной фазы строго равно числу вновь образующихся молекул другой фазы.
Если постепенно охлаждать воду при любом давлении, то в пределе окажемся на кривой AC, где будет наблюдаться вода при соответствующих температуре и давлении.
Диаграмма состояния (или фазовая диаграмма) представляет собой графическое изображение зависимости между величинами, характеризующими состояние системы, и фазовыми превращениями в системе (переход из твердого состояния в жидкое, из жидкого в газообразное и т. д.).
Рис. 72. Схема структуры льда.
Рис. 73. Диаграмма состояния воды в области невысоких давлений.
Рис. 74. Цилиндр с водой, находящейся в равновесии с водяным паром.
Диаграммы состояния широко применяются в химии. Для однокомпонентных систем обычно используются диаграммы состояния, показывающие зависимость фазовых превращений от температуры и давления; они называются диаграммами состояния в координатах Р—Т.
На рис. 73 приведена в схематической форме (без строгого соблюдения масштаба) диаграмма состояния воды. Любой точке на диаграмме отвечают определенные значения температуры и давления.
Диаграмма показывает те состояния воды, которые термодинамически устойчивы при определенных значениях температуры и давления. Она состоит из трех кривых, разграничивающих все возможные температуры и давления на три области, отвечающие льду, жидкости и пару.
Рассмотрим каждую из кривых более подробно. Начнем с кривой ОА (рис. 73), отделяющей область пара от области жидкого состояния. Представим себе цилиндр, из которого удален воздух, после чего в него введено некоторое количество чистой, свободной от растворенных веществ, в том числе от газов, воды; цилиндр снабжен поршнем, который закреплен в некотором положении (рис. 74). Через некоторое время часть воды испарится и над ее поверхностью будет находиться насыщенный пар. Можно измерить его давление и убедиться в том, что оно не изменяется с течением времени и не зависит от положения поршня. Если увеличить температуру всей системы и вновь измерить давление насыщенного пара, то окажется, что оно возросло. Повторяя такие измерения при различных температурах, найдем зависимость давления насыщенного водяного пара от температуры. Кривая ОА представляет собой график этой зависимости: точки кривой показывают те пары значений температуры и давления, при которых жидкая вода и водяной пар находятся в равновесии друг с другом — сосуществуют. Кривая ОА называется кривой равновесия жидкость — пар или кривой кипения. В табл. 8 (стр. 202) приведены значения давления насыщенного водяного пара при нескольких температурах.
Попытаемся осуществить в цилиндре давление, отличное от равновесного, например, меньшее, чем равновесное. Для этого освободим поршень и поднимем его. В первый момент давление в цилиндре, действительно, упадет, но вскоре равновесие восстановится: испарится добавочно некоторое количество воды и давление вновь достигнет равновесного значения. Только тогда, когда вся вода испарится, можно осуществить давление, меньшее, чем равновесное. Отсюда следует, что точкам, лежащим на диаграмме состояния ниже или правее кривой ОА, отвечает область пара.
Таблица 8. Давление насыщенного водяного пара при различных температурах
Если пытаться создать давление, превышающее равновесное, то этого можно достичь, лишь опустив поршень до поверхности воды. Иначе говоря, точкам диаграммы, лежащим выше или левее кривой ОА, отвечает область жидкого состояния.
До каких пор простираются влево области жидкого и парообразного состояния? Наметим по одной точке в обеих областях и будем двигаться от них горизонтально влево. Этому движению точек на диаграмме отвечает охлаждение жидкости или пара при постоянном давлении. Известно, что если охлаждать воду при нормальном атмосферном давлении, то при достижении вода начнет замерзать. Проводя аналогичные опыты при других давлениях, придем к кривой ОС, отделяющей область жидкой воды от области льда. Эта кривая — кривая равновесия твердое состояние — жидкость, или кривая плавления, — показывает те пары значений температуры и давления, при которых лед и жидкая вода находятся в равновесии.
Двигаясь по горизонтали влево в области пара (в нижней части диаграммы), аналогичным образом придем к кривой ОВ. Это — кривая равновесия твердое состояние — пар, или кривая сублимации. Ей отвечают те пары значений температуры и давления, при которых в равновесии находятся лед и водяной пар.
Все три кривые пересекаются в точке О. Координаты этой точки — это единственная пара значений температуры и давления, при которых в равновесии могут находиться все три фазы: лед, жидкая вода и пар. Она носит название тройной точки.
Кривая плавления исследована до весьма высоких давлений. В этой области обнаружено несколько модификаций льда (на диаграмме не показаны).
Справа кривая кипения оканчивается в критической точке. При температуре, отвечающей этой точке, — критической температуре — величины, характеризующие физические свойства жидкости и пара, становятся одинаковыми, так что различие между жидким и парообразным состоянием исчезает.
Существование критической температуры установил в 1860 г. Д. И. Менделеев, изучая свойства жидкостей. Он показал, что при температурах, лежащих выше критической, вещество не может находиться в жидком состоянии. В 1869 г. Эндрьюс, изучая свойства газов, пришел к аналогичному выводу.
Критические температура и давление для различных веществ различны. Так, для водорода , , для хлора , , для воды , .
Одной из особенностей воды, отличающих ее от других веществ, является понижение температуры плавления льда с ростом давления (см. § 70). Это обстоятельство отражается на диаграмме. Кривая плавления ОС на диаграмме состояния воды идет вверх влево, тогда как почти для всех других веществ она идет вверх вправо.
Превращения, происходящие с водой при атмосферном давлении, отражаются на диаграмме точками или отрезками, расположенными на горизонтали, отвечающей . Так, плавление льда или кристаллизация воды отвечает точке D (рис. 73), кипение воды — точке Е, нагревание или охлаждение воды — отрезку DE и т. п.
Диаграммы состояния изучены для ряда веществ, имеющих научное или практическое значение. В принципе они подобны рассмотренной диаграмме состояния воды. Однако на диаграммах состояния различных веществ могут быть особенности. Так, известны вещества, тройная точка которых лежит давлении, превышающем атмосферное. В этом случае нагревание кристаллов при атмосферном давлении приводит не к плавленню этого вещества, а к его сублимации — превращению твердой фазы непосредственно в газообразную,
Читайте также:

