Частица в химии это кратко
Обновлено: 04.07.2024
ЭЛЕМЕНТА́РНЫЕ ЧАСТИ́ЦЫ, первичные (неделимые) мельчайшие частицы, из которых состоит вся материя. Исторически к первым Э. ч. относили атомы, пока не была обнаружена их сложная структура: атом состоит из атомного ядра и вращающихся вокруг него электронов. Открытие структуры атомных ядер, построенных из двух частиц, протонов и нейтронов, собственно и стало рождением физики Э. ч. К Э. ч. стали относить протоны , нейтроны , электроны и позднее нейтрино . Вся наблюдаемая вокруг нас материя состоит из атомов, которые, в свою очередь, состоят из протонов, нейтронов и электронов, а нейтрино рождаются в процессе распада нейтрона. Некоторое время спустя было обнаружено, что кроме этих частиц существует ещё много других, которые, однако, имеют очень короткое время жизни и почти мгновенно распадаются. На 2017 известно ок. 150 Э. ч., и число их возрастает.
Ключевое различие между Атомами и Частицами состоит в том, что Атомы представляют собой небольшие единицы, состоящие из нескольких частиц, тогда как Частицы представляют собой мельчайшие части вещества.
Содержание
- Обзор и основные отличия
- Что такое Атомы
- Что такое Частицы
- В чем разница между Атомами и Частицами
- Заключение
Что такое Атомы?
Атомы — это самые маленькие частицы химического элемента, которые могут существовать. Следовательно, это наименьшая единица вещества, и определенный атом представляет свойства химического элемента, к которому он принадлежит. Все газы, твердые вещества, жидкости и плазма содержат атомы. Это очень мелкие единицы, как правило, размер которых составляет около 100 пикометров.

Строение атома
Атом содержит ядро и электроны, движущиеся вокруг ядра. Атомное ядро состоит из протонов и нейтронов (а также некоторых других субатомных частиц). Как правило, число нейтронов, протонов и электронов равны друг другу, но в случае изотопов число нейтронов отличается от числа протонов. Около 99% массы атома сосредоточено в ядре, потому что масса электрона практически ничтожна. Среди этих субатомных частиц протон имеет заряд +1, а электрон имеет заряд -1, нейтрон же, не имеет заряда. Если атом имеет одинаковое количество протонов и электронов, то общий заряд атома равен нулю, недостаток одного электрона приводит к заряду +1, а увеличение на один электрон дает атому -1 заряд.
Количество протонов в атоме определяет химический элемент, к которому принадлежит этот атом. Это означает, что определенный химический элемент имеет определенное количество протонов в своих атомах.
Кроме того, атомы участвуют в химической связи посредством приобретения, удаления или совместного использования своих электронов на самых внешних орбиталях. Образование химических связей приводит к образованию химических соединений или молекул. Большинство физических изменений в природе происходят из-за способности этих атомов связываться и диссоциировать.
Что такое Частицы?
Частица — это мельчайшая часть материи. Это небольшой локализованный объект, обладающий такими свойствами, как масса, объем и плотность. Размер частиц может варьироваться от субатомных частиц, таких как электроны, до микроскопических частиц, таких как молекулы, и даже до макроскопических частиц, то есть гранулированного материала.

Макроскопические частицы в порошке
Как правило, мы используем термин частица для трех основных размеров частиц: макроскопические, микроскопические и субатомные частицы. Макроскопические частицы крупнее атомов и молекул и видны невооруженным глазом. Н апример частицы порошка и пыли мы видим невооруженным взлядом. Микроскопические частицы невидимы невооруженным глазом, но видны через микроскопы. В основном это частицы с размерами от атомов до молекул. К ним относятся наночастицы и коллоидные частицы. Субатомные частицы — это компоненты в атомах: протоны, нейтроны, электроны и т.д.
В чем разница между Атомами и Частицами?
Ключевое различие между атомами и частицами состоит в том, что атомы представляют собой небольшие единицы, содержащие несколько частиц, тогда как частицы представляют собой мельчайшие порции вещества. Существует три различных типа частиц: макроскопические, микроскопические и субатомные частицы. При рассмотрении разных типов атомов они принадлежат разным химическим элементам в зависимости от атомных номеров. Размер атома составляет около 100 пикометров, в то время как размер частиц варьируется от субатомных частиц до макроскопических частиц.
Заключение — Атомы против Частиц
Атомы представляют собой небольшие единицы вещества, которые содержат несколько частиц, которые называются субатомными частицами. Однако термин частица относится к любому маленькому объекту. Следовательно, ключевое различие между атомами и частицами заключается в том, что атомы представляют собой небольшие единицы, состоящие из нескольких частиц, тогда как частицы представляют собой мельчайшие части вещества.
Элементарная частица
Элементарная частица — собирательный термин, относящийся к микрообъектам в субъядерном масштабе, которые невозможно расщепить на составные части.
Следует иметь в виду, что некоторые элементарные частицы (электрон, нейтрино, кварки и т. д.) на данный момент считаются бесструктурными и рассматриваются как первичные фундаментальные частицы. Другие элементарные частицы (так называемые составные частицы — протон, нейтрон и т. д.) имеют сложную внутреннюю структуру, но, тем не менее, по современным представлениям, разделить их на части невозможно (см. Конфайнмент).
Строение и поведение элементарных частиц изучается физикой элементарных частиц.
В период заключительного повторения в выпускном классе важно построить уроки таким образом, чтобы охватить в определенной логике всю систему теоретических и фактических знаний. Эти уроки должны помочь учащимся в самостоятельной работе с учебником, конспектами и дополнительной литературой. Здесь следует обратить внимание на структурные частицы вещества, основные понятия, законы и теории химии, классы неорганических и органических веществ, количественные закономерности химии.
Есть много вариантов уроков, посвященных обобщающему повторению. Для определения понятий и установления связи между ними мы используем структурные схемы.
На рис. 1 представлены структурные частицы атома.
Рис. 1.
Дискретные частицы вещества, их связь и единство
Протон p – ядерная частица, относительная масса которой несколько больше единицы, а относительный заряд равен +1. Здесь и далее исходим из количественного определения:
поз. 5: Na 0 – 1e = Na + ,
S 0 + 2e = S 2– ;
поз. 6: Fe 3+ + 3e = Fe 0 ;
поз. 7: I – – 1e = I 0 ;
поз. 12: Fe 2+ – 1e = Fe 3+ ,
Fe 3+ + 1e = Fe 2+ ;
поз. 14: Fe 2+ + 6CN – = [Fe(CN – )6] 4– ;
Эксперимент 1. Собрать прибор для получения NО (бесцветный газ) в реакции меди Сu (атомы) с разбавленной азотной кислотой НNО3. При открывании пробирки наблюдается превращение бесцветного газа в газ бурого цвета:
Эксперимент 2. В пробирку с несколькими миллилитрами раствора йодида калия прилить такой же по объему раствор хлорного железа (концентрация растворов может быть минимальной). Наблюдается постепенное, но достаточно быстрое окрашивание раствора, усиливающееся со временем. Протекает реакция:
Fe 3+ + 3Сl – + K + + I – = Fe 2+ + 2Cl – + K + + Cl – + 1/2I2.
Подтвердить образование свободного йода можно реакцией с некрепким раствором крахмального клейстера:
Эксперимент 3. К раствору сульфата меди(II) прилить несколько капель крепкого раствора аммиака (концентрация раствора такова, что ощутим запах аммиака). Раствор окрасится в интенсивно-синий цвет (см. выше реакцию к поз. 13).
Другой пример (см. далее) – получение полиэтилена из этилена. Примерами надмолекулярных структур могут служить вирус табачной мозаики и гемоглобин крови, состоящий из двух белковых цепей.
Рис. 2.
Строение и свойства атома, образование частиц и веществ,
взаимопревращения частиц
Задача учителя – демонстрировать учащимся общекультурную значимость и познавательную ценность своего предмета. Поэтому в схеме структурирования вещества и его частиц появляется запись – проявления жизни. Каков ее смысл? Существует особый род физических тел – носителей жизни. К ним относятся люди и многочисленные животные и растительные организмы. Процесс дыхания (поступление О2) обеспечивает жизнедеятельность мозга, перенос кислорода осуществляется надмолекулярной структурой – гемоглобином. Для получения энергии и строительного материала в организм человека – в желудок и пищевые пути – должны попасть белки, жиры, углеводы, витамины, многие химические элементы, в том числе ионы натрия, калия, железа, кальция. Молекулы сложных веществ, в том числе высокомолекулярных соединений, превращаются в низкомолекулярные соединения. В атмосферу через дыхательные пути выбрасывается углекислый газ. В живом организме осуществляется синтез сложных веществ (анаболизм), происходят многочисленные биохимические процессы. Знание общих принципов функционирования своего собственного организма необходимо каждому человеку.
В результате перераспределения электронной плотности атомы углерода могут находиться в
sp 2 -валентном состоянии, тогда образуется графит – природное простое вещество. Атомы углерода в sp 3 -валентном состоянии образуют алмаз – второе аллотропное видоизменение углерода, встречающееся в природе. В искусственно полученном веществе карбине углерод находится в sp-валентном состоянии.
Таким образом, в случае образования простого вещества имеем:
Рис. 3.
Классификация частиц
Под формулой молекулы метана мы видим атом углерода с тетраэдрической направленностью будущих связей в алмазе и предельных углеводородах. Образование метана прямым синтезом связано с разрывом ковалентных (очень прочных) углерод-углеродных связей (–С:С–). Поэтому только использование катализатора позволяет проводить процесс, хоть и с низким выходом продукта:
Вообще, процесс восстановления проходит сложно:
Возможен и процесс частичного восстановления:
Окисление углерода кислородом и другими окислителями можно представить в виде:
Для получения соединения углерода в двухвалентном состоянии, как показано на схеме генетических переходов, окисленную частицу необходимо восстановить:
Естественно, что это состояние энергетически неустойчиво. Поэтому оксид углерода(II) горит голубым пламенем, отдавая ту энергию, которая была затрачена на его образование:
Из карбида кальция можно получить ацетилен:
СaС2 + 2Н–ОН = Са(ОН)2 + Н–СС–Н + Q кДж.
Гидрированием ацетилена получают этилен, который разными способами превращают в полиэтилен.
В качестве домашнего задания учащимся можно предложить следующую схему генетических превращений, которая носит частично репродуктивный характер:

Достоинство такого подхода к организации материала в повторительный период состоит в том, что удается соединить в один блок разные вещи. Разговор о частицах связывает вещества неорганические с веществами органическими, что суть важно. Мы выбрали углерод, как видно, не случайно. Одновременно затрагиваются многие теоретические вопросы химии. По ходу повторения задаются вопросы, обозначенные в схеме, – простое вещество или сложное, низкомолекулярное или высокомолекулярное, какой класс оксидов, названия веществ, радикалов, типов химической связи; условия протекания химической реакции, экзотермическая или эндотермическая реакция. И, конечно же, даются определения понятий.
Нельзя на одном уроке, говоря словами Козьмы Пруткова, объять необъятное. От себя могу только добавить: сегодня я вижу данный предмет под одним углом зрения, на следующий год появятся новые идеи и конструкции урока. Даже в процессе самого урока может случиться резкий поворот в общем плане урока, и тогда можно в конспект не заглядывать: а что там дальше?
Существует соблазн выйти за рамки темы урока, расширяя его содержательную базу. В частности, сказать об изотопах, изомерах, мономерах. Попробуем оценить целесообразность рассмотрения этих понятий на данном уроке, ведь время урока не резиновое. Обратимся к самим понятиям.
Изотопы – это атомы одного и того же элемента (заряд ядра Z постоянный), различающиеся массовыми числами А, например, 39 К, 40 К, 41 К, Z = 19.
Изомеры – это молекулы различных веществ, имеющих одинаковый качественный и количественный состав, но различное строение.
Например:
Мономеры – это молекулы низкомолекулярных соединений, способные в реакции полимеризации или поликонденсации превращаться в высокомолекулярные соединения. Например:
Рис. 4.
Логика и диалектика частиц
0,05–0,25 нм 100 нм).
В принципе можно моделировать коллоидные частицы – для наглядности и лучшего восприятия:

Из чего мы состоим?
Ну что же, наше путешествие в микромир мы начнём с незатейливого вопроса: из чего состоят окружающие нас предметы? Наш мир, как дом, состоит из множества небольших кирпичиков, которые особым образом соединяясь, создают что-то новое, не только по внешнему виду, но ещё и по своим свойствам. На деле, если сильно к ним приглядеться, то можно обнаружить, что различных видов блоков не так уж и много, просто каждый раз они соединяются друг с другом по-разному, образуя новые формы и явления. Каждый блок — это неделимая элементарная частица, о которой и пойдёт речь в моём рассказе.
Для примера, возьмём какое-нибудь вещество, пусть у нас это будет второй элемент периодической системы Менделеева, инертный газ, гелий. Как и остальные вещества во Вселенной, гелий состоит из молекул, которые в свою очередь образованы связями между атомами. Но в данном случае, для нас, гелий немного особенный, потому что он состоит всего из одного атома.
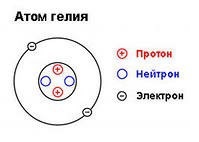
Из чего состоит атом?
Атом гелия, в свою очередь, состоит из двух нейтронов и двух протонов, составляющих атомное ядро, вокруг которого вращаются два электрона. Самое интересное, что абсолютно неделимым здесь является лишь электрон.
Интересный момент квантового мира
Чем меньше масса элементарной частицы, тем больше места она занимает. Именно по этой причине электроны, которые в 2000 раз легче протона, занимают гораздо больше места по сравнению с ядром атома.
Нейтроны и протоны относятся к группе так называемых адронов (частиц, подверженных сильному взаимодействию), а если быть ещё точнее, барионов.
- Барионов, которые состоят из трёх кварков
- Мезонов, которые состоят из пары: частица-античастица
Нейтрон, как ясно из его названия, является нейтрально заряженным, и может быть поделён на два нижних кварка и один верхний кварк. Протон, положительно заряженная частица, делится на один нижний кварк и два верхних кварка.
Да, да, я не шучу, они действительно называются верхний и нижний. Казалось бы, если мы открыли верхний и нижний кварк, да ещё электрон, то сможем с их помощью описать всю Вселенную. Но это утверждение было бы очень далеко от истины.
Главная проблема — частицы должны как-то между собой взаимодействовать. Если бы мир состоял лишь из этой троицы (нейтрон, протон и электрон), то частицы бы просто летали по бескрайним просторам космоса и никогда бы не собирались в более крупные образования, вроде адронов.
Фермионы и Бозоны
Достаточно давно учёными была придумана удобная и лаконичная форма представления элементарных частиц, названная стандартной моделью. Оказывается, все элементарные частицы делятся на фермионы, из которых и состоит вся материя, и бозоны, которые переносят различные виды взаимодействий между фермионами.
Разница между этими группами очень наглядна. Дело в том, что фермионам для выживания по законам квантового мира необходимо некоторое пространство, а для бозонов почти не важно наличие свободного места.
Фермионы
Группа фермионов, как было уже сказано, создаёт видимую материю вокруг нас. Что бы мы и где ни увидели, создано фермионами. Фермионы делятся на кварки, сильно взаимодействующие между собой и запертые внутри более сложных частиц вроде адронов, и лептоны, которые свободно существуют в пространстве независимо от своих собратьев.
- Верхнего типа. К кваркам верхнего типа, с зарядом +2\3, относят: верхний, очарованный и истинный кварки
- Нижнего типа. К кваркам нижнего типа, с зарядом -1\3, относят: нижний, странный и прелестный кварки
Возникает вопрос, не найдут ли физики ещё несколько поколений частиц, которые будут еще более массивными, по сравнению с предыдущими. На него ответить трудно, однако теоретики считают, что поколения лептонов и кварков исчерпываются тремя.
Не находите никакого сходства? И кварки, и лептоны делятся на две группы, которые отличаются друг от друга зарядом на единицу? Но об этом позже.
Бозоны
Без них бы фермионы сплошным потоком летали по вселенной. Но обмениваясь бозонами, фермионы сообщают друг другу какой-либо вид взаимодействия. Сами бозоны же с друг другом практически не взаимодействуют.
На самом деле, некоторые бозоны всё же взаимодействуют друг с другом, но об этом будет рассказано более подробно в следующих статьях о проблемах микромира
Взаимодействие, передаваемое бозонами, бывает:
- Электромагнитным, частицы — фотоны. С помощью этих безмассовых частиц передаётся свет.
- Сильным ядерным, частицы — глюоны. С их помощью кварки из ядра атома не распадаются на отдельные частицы.
- Слабым ядерным, частицы — ±W и Z бозоны. С их помощью фермионы перекидываются массой, энергией, и могут превращаться друг в друга.
- Гравитационным, частицы — гравитоны. Чрезвычайно слабая в масштабах микромира сила. Становится видимой только на сверхмассивных телах.
Оговорка о гравитационном взаимодействии.
Существование гравитонов экспериментально ещё не подтверждено. Они существуют лишь в виде теоретической версии. В стандартной модели в большинстве случаев их не рассматривают.
Вот и всё, стандартная модель собрана.

Проблемы только начались
Несмотря на очень красивое представление частиц на схеме, осталось два вопроса. Откуда частицы берут свою массу и что такое Бозон Хиггса, который выделяется из остальных бозонов.
Для того, что бы понимать идею применения бозона Хиггса, нам необходимо обратиться к квантовой теории поля. Говоря простым языком, можно утверждать, что весь мир, вся Вселенная, состоит не из мельчайших частиц, а из множества различных полей: глюонного, кваркового, электронного, электромагнитного и.т.д. Во всех этих полях постоянно возникают незначительные колебания. Но наиболее сильные из них мы воспринимаем как элементарные частицы. Да и этот тезис весьма спорный. С точки зрения корпускулярно-волнового дуализма, один и тот же объект микромира в различных ситуациях ведёт себя то как волна, то как элементарная частица, это зависит лишь от того, как физику, наблюдающему за процессом, удобнее смоделировать ситуацию.
Поле Хиггса
Оказывается, существует так называемое поле Хиггса, среднее значение которого не хочет стремиться к нулю. В результате чего, это поле старается принять некоторое постоянное ненулевое значение во всей Вселенной. Поле составляет вездесущий и постоянный фон, в результате сильных колебаний которого и появляется Бозон Хиггса.
И именно благодаря полю Хиггса, частицы наделяются массой.
Масса элементарной частицы, зависит от того, насколько сильно она взаимодействует с полем Хиггса, постоянно пролетая внутри него.
И именно из-за Бозона Хиггса, а точнее из-за его поля, стандартная модель имеет так много похожих групп частиц. Поле Хиггса вынудило сделать множество добавочных частиц, таких, например, как нейтрино.
Итоги
То, что было рассказано мною, это самые поверхностные понятия о природе стандартной модели и о том, зачем нам нужен Бозон Хиггса. Некоторые учёные до сих пор в глубине души надеются, что частица, найденная в 2012 году и похожая на Бозон Хиггса в БАКе, была просто статистической погрешностью. Ведь поле Хиггса нарушает многие красивые симметрии природы, делая расчёты физиков более запутанными.
Некоторые даже считают, что стандартная модель доживает свои последние годы из-за своего несовершенства. Но экспериментально это не доказано, и стандартная модель элементарных частиц остаётся действующим образцом гения человеческой мысли.
Читайте также:

