Благородные газы особенность строения их атомов очень кратко
Обновлено: 02.07.2024
Благородные газы ( инертные либо редкие газы ) — группа химических элементов с похожими свойствами: при нормальных условиях они являются одноатомными газами.
При обычных условиях - это газы без цвета, вкуса и запаха, плохо растворимые в воде, не возгораются при нормальных условиях, с очень низкой химической реактивностью. Их температуры плавления и кипения закономерно увеличиваются с увеличением атомного номера.
Среди всех благородных газов лишь у Rn нет стабильных изотопов и только он является радиоактивным химическим элементом.
Редкими (инертными) газами являются:
- гелий (He) (атомный номер 2),
- неон (Ne) (10),
- аргон (Ar) (18),
- криптон (Kr) (36),
- ксенон (Xe) (54)
- радиоактивный радон (Rn) (86).
В последнее время к этой группе также причисляют унуноктий (Uuo) (118).
Все инертные газы собой завершают соответствующий период в Периодической системе и имеют полностью завершенный, устойчивый внешний электронный уровень.
У инертных газов электронная конфигурация ns 2 np 6 (у гелия 1s 2 ) и они образуют VIIIА группу. С возрастанием порядкового номера увеличиваются радиусы атомов и их способность к поляризуемости, что приводит к увеличению межмолекулярных взаимодействий, к увеличению Тпл и Ткип, к улучшению растворимости газов в воде и других растворителях. Для инертных газов существуют такие известные группы соединений: молекулярные ионы, соединения включения, валентные соединения.
Цвета и спектры инертных газов.
Цвета и спектры благородных газов. В первой строке таблицы изображены благородные газы в колбах, через которые пропущен ток, во второй — сам газ в трубке, в третьей — в трубках, которые изображают обозначение элемента в периодической таблице Менделеева.
Гелий
Неон
Аргон
Криптон
Ксенон












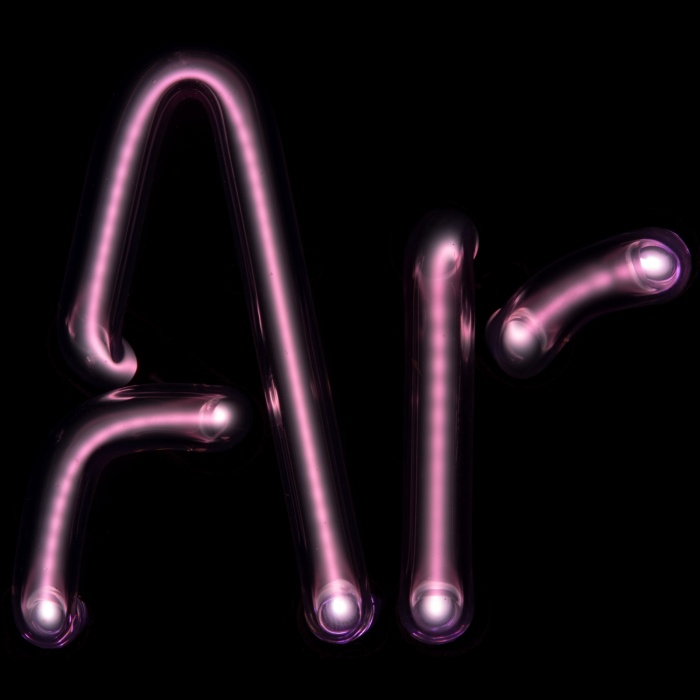

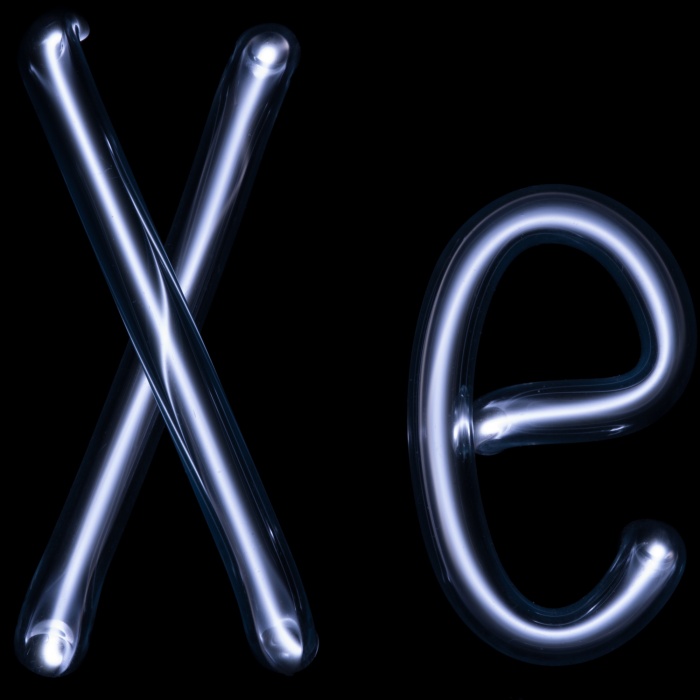





Распространенность инертных (редких) газов в природе.
Из-за того, что инертные газы обладают химической инертностью, их довольно долго не получалось обнаружить, и их открытие состоялось лишь во 2-й половине XIX века.
Гелий – является вторым (после водорода) по распространенности элементом во Вселенной, в земной коре содержание гелия составляет лишь 1 · 10-6 масс. %. Гелий является продуктом радиоактивного распада и содержится в пустотах горных пород и в природном газе.
Все благородные газы являются составляющими воздуха. В 1 м 3 воздуха находится 9,3 л аргона, 18 мл неона, 5 мл гелия, 1 мл криптона и 0,09 мл ксенона. Солнце приблизительно на 10% состоит из гелия, образующийся из водорода по реакции ядерного синтеза:
(β + - позитрон, - антинейтрино). В спектре излучения Солнца довольно интенсивно проявляются линии гелия, которые были впервые обнаружены в 1868 г. На Земле гелий был найден только в 1895 г. при спектральном анализе газов, выделяющихся при растворении в кислотах минерала клевеита U2О3. Уран, входящий в состав минерала, самопроизвольно распадается по уравнению:
В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов.
Промышленное использование инертных газов основано на их низкой химической активности или специфических физические свойствах.
Некоторые характеристики элементов VIIIА подгруппы (инертных газов).
Элемент
Радиус атома, нм
Первый потенциал ионизации, эВ
Tпл., K
Tкип., K
На нашей планете благородные газы преимущественно содержатся в воздухе, но они есть в небольших количествах в воде, горных породах, природных газах и нефти.
Много гелия в космическом пространстве, это второй по распространенности элемент после водорода. В Солнце его почти 10%. Судя по имеющимся данным, благородных газов много в атмосферах крупных планет Солнечной системы.
Все газы, кроме гелия и радона, добывают из сжиженного воздуха фракционным разделением. Гелий получают как сопутствующий продукт при добыче природного газа.
Свойства
Газы без цвета, запаха и вкуса. Они всегда есть в атмосферном воздухе, но их невозможно увидеть или почувствовать. Плохо растворяются в воде. Не горят и не поддерживают горение. Плохо проводят тепло. Хорошо проводят ток и при этом светятся. Практически не реагируют с металлами, кислородом, кислотами, щелочами, органическими веществами. Химическая активность растет по мере увеличения атомной массы.
Инертные газы не ядовиты, но способны вытеснять кислород из воздуха, понижая его концентрацию до смертельно низкого уровня.
Смеси тяжелых благородных газов с кислородом оказывают на человека наркотическое воздействие, поэтому при работе с ними следует использовать средства защиты и строго следить за составом воздуха в помещении.
Хранят газы в баллонах, вдали от источников пламени и горючих материалов, в хорошо проветриваемых помещениях. При транспортировке баллоны следует хорошо укрепить, чтобы они не бились друг о друга.
Применение
- В газовой и газово-дуговой сварке в металлургии, строительстве, автостроении, машиностроении, коммунальной сфере и пр. Для получения сверхчистых металлов.
- Нерадиоактивные благородные газы применяются в цветных газоразрядных трубках, часто используемых в уличных вывесках и рекламе, а также в лампах дневного света и лампах для загара.
Гелий

- Жидкий гелий — самая холодная жидкость на планете (кипит при +4,2 °К), востребована для исследований при сверхнизких температурах, для создания эффекта сверхпроводимости в электромагнитах, например, ядерных ускорителей, аппаратов МРТ (магнитно-резонансной томографии).
- Гелий-газ применяют в смесях для дыхания в аквалангах. Он не вызывает наркотического отравления на больших глубинах и кессонной болезни при подъеме на поверхность.
- Так как он значительно легче воздуха, им заполняют дирижабли, воздушные шары, зонды. К тому же он не горит и гораздо безопаснее ранее использовавшегося водорода.
- Гелий отличается высокой проницаемостью — на этом свойстве основаны приборы поиска течи в системах, работающих при низком или высоком давлении.
- Смесь гелия с кислородом применяется в медицине для лечения болезней органов дыхания.

Газ вёл себя парадоксально: он не вступал в реакции с хлором, металлами, кислотами, щелочами, т. е. был абсолютно химически инертен. И ещё одна неожиданность: Рамзай доказал, что его молекула состоит из одного атома, а до той поры одноатомные газы были неизвестны.

Ответ на этот вопрос пришёл не сразу. Прежде всего, вспомнили об открытии, которое сделали почти одновременно, в 1868 г., два астронома — француз Пьер Жюль Сезар Жансен и англичанин Джозеф Норман Локьер. Эти ученые с помощью недавно изобретённого прибора — спектроскопа изучали спектр солнечных протуберанцев и обнаружили в нём жёлтую линию, принадлежащую новому элементу. Но официальное признание он получил лишь четверть века спустя. Это случилось только после того как гелий (так его назвали в честь греческого бога Солнца Гелиоса) открыли на Земле.
Теперь уже двум элементам не было места в периодической системе: аргону и гелию. После длительных дискуссий Менделеев и Рамзай пришли к выводу, что инертным, т. е. лишенным химических свойств, газам надо отвести отдельную, так называемую нулевую группу между галогенами и щелочными металлами.
За исследования в области инертных газов Рэлей и Рамзай были удостоены Нобелевской премии.
Чтобы дать наглядное представление о содержании благородных газов в земной атмосфере, отметим, что 1 м 3 (1000 л)воздуха включает 9,3 л Ar, 18 мл Ne, 4,6 мл Не, 1,1 мл Kr, 0,086 мл Хе и лишь 6 • 10 -16 мл радиоактивного радона. Если бы молекулы воздуха были видимы и проходили перед наблюдателем по одной в секунду, то молекула аргона появлялась бы в среднем каждые две минуты, криптона — один раз в десять дней, молекулу ксенона пришлось бы дожидаться четыре месяца, а молекулу радона — 50 триллионов лет! Однако абсолютное количество благородных газов в атмосфере огромно. Только ксенона в ней содержится 430 млн тонн.
Электронное строение
С развитием представлений об электронном строении атомов стало ясно, что инертные газы имеют целиком заполненные s- и р-подуровни. На единственном электронном уровне атома гелия располагаются два электрона ( ls 2 ), а остальные представители группы являются р-элементами, и у них на внешнем электронном уровне находятся по восемь электронов (ns 2 np 6 , где n — номер периода). Поэтому с точки зрения электронного строения неон и более тяжелые газы следует поместить в главную подгруппу VIII группы. Гелий можно было бы отнести к s-элементам и формально поставить в группу IIА. Однако он настолько непохож по свойствам на элементы II группы: бериллий, магний и другие, что его оставили в VIII группе вместе с подобными ему газами.
Химические свойства
Долгое время считалось, что инертные газы не вступают в химические реакции. Однако в 1962 г. канадский химик Нилл Бартлетт при нагревании смеси ксенона с сильным окислителем — гексафторидом платины PtF6 получил желтое кристаллическое вещество состава XePtF6.
После публикации результатов Бартлетга за один год удалось синтезировать фториды ксенона — XeF2, XeF4, XeF6 — и исследовать их строение и свойства.
К концу ХХ столетия число полученных соединений ксенона превысило сотню, соединений криптона — уже более двух десятков, среди них KrF2, KrF4, соли криптоновой кислоты H2KrO4. Самым химически активным должен быть радон, но он слишком нестабилен, и синтезировано всего несколько его соединений. Теперь очередь за аргоном для него пока известны только соединения включения, например клатрат Ar ∙ 6Н2О (гидрат аргона), где аргон не образует химической связи, а включен в кристаллическую решетку льда.
Физические свойства и применение благородных газов
Все элементы VIIIA группы представляют собой одноатомные газы, которые только при очень низких температурах могут быть переведены в жидкое и твёрдое состояние.
Интересно, что температуры кипения и плавления каждого газа различаются всего лишь на несколько градусов. Это объясняется слабым межмолекулярным взаимодействием как в жидкой, так и в твердой фазе.
Гелий обладает самой низкой температурой кипения и плавления. Перевести его в твердое состояние удается только при давлении порядка 25 ∙10 5 Па.

Жидкий гелий впервые получил в 1908 г. нидерландский физик Хейке Камерлинг-Оннес, удостоенный за это Нобелевской премии (1913 г.).
В 1938 г. выдающийся советский физик Пётр Леонидович Капица (1894—1984) установил, что при температурах ниже 2,17 К (—271 о С) жидкий гелий не обладает вязкостью, т. е. становится сверхтекучим. В таком состоянии теплопроводность в миллион раз больше, чем при 4 К (—269 о С). За открытие и исследование этого явления ученому в 1978 г. была присуждена Нобелевская премия, а в 1962 г. Нобелевскую премию получил Лев Давыдович Ландау, давший теоретическое обоснование явления сверхтекучести. Сверхтекучесть жидкого гелия позволит использовать его в будущем для создания сверхпроводящих электромагнитов.
Гелий получают не из воздуха, а из природного газа: в нем содержание гелия может достигать нескольких процентов, а это в тысячу раз больше, чем в атмосфере.
Остальные благородные газы выделяют путем низкотемпературной фракционной разгонки жидкого воздуха. Ксенон образуется в реакторах в результате распада ядерного горючего.
Поскольку гелий обладает низкой плотностью (в семь раз меньше плотности воздуха) и негорюч, им заполняют метеорологические шары, зонды, аэростаты, дирижабли. Жидкий гелий используется для создания низких температур, близких к абсолютному нулю.
Аргон служит для создания инертной атмосферы в металлургических процессах, в химическом производстве, при электросварке. Криптон и ксенон используются для заполнения ламп накаливания и в производстве источников света высокой мощности. Газоразрядные лампы, заполняемые неоном, раньше применялись в рекламе, но в последнее время на смену им пришли люминесцентные лампы.
В целом промышленное значение благородных газов, несомненно, уступает той роли, которую они сыграли в развитии периодического закона, создании фундаментальной теории химической связи и химической реакционной способности.
Общая характеристика элементов главной подгруппы VIII группы
Атомы благородных газов, как видно из табл. 16, имеют завершенную структуру внешнего электронного слоя, что затрудняет образование ими соединений. Этим объясняется и то, что в отличие от других простых газов благородные газы имеют одноатомные молекулы.

Свободных орбиталей на этом уровне нет. Возбудить атом неона — значит перевести часть его электронов на другой, более высокий уровень М, что энергетически весьма невыгодно. Поэтому ковалентные связи у неона обнаружить не удается.
У атома аргона распределение электронов на внешнем-(третьем) уровне следующее
![]()
Как показывает схема, у атома аргона в невозбужденном состоянии третий энергетический уровень М имеет 5 незанятых d-орбиталей, на которые при возбуждении атома могут переходить электроны. Это орбитали одного и того же уровня, поэтому для возбуждения атома аргона требуется меньше энергии, чем для атома неона.
Еще легче возбуждаются и, следовательно, вступают в химические реакции атомы криптона, ксенона, радона. С увеличением радиуса атома уменьшается затрата энергии, необходимой для его возбуждения и, следовательно, увеличивается реакционная способность элемента. Другими словами, реакционная способность благородных газов увеличивается от гелия к радону. Устойчивость соединений этих элементов возрастает в том же направлении.
■ 1 . Чем объяснить первоначальное размещение благородных газов в нулевой группе периодической системы, а затем последующее их перенесение в VIII группу? (См. Ответ)
2. Почему атом криптона легче возбудить, чем атом неона?
3. Почему молекула хлора двухатомна, а неона — одноатомна?
4. Почему гелий и неон не образуют соединений с ковалентной связью?
5. Как зависит реакционная способность благородных газов от радиуса атома? (См. Ответ)
Читайте также:

