Атомные и ионные радиусы кратко
Обновлено: 02.07.2024
Атомные радиусы разделяют на металлические, которые мы находим в металлах, сплавах или интерметаллических (?) соединениях, и ковалентные, характерные для неметаллов и вообще для ковалентных молекул.
Ковалентные радиусы в свою очередь подразделяют на тетраэдрические, октаэдрические и т.д. Безусловно нужно различать радиусы при одинарной, двойной и тройной связях. Существуют ещё атомные радиусы по Брэггу–Слейтеру и орбитальные радиусы.
Ван-дер-ваальсовы радиусы следует рассматривать как радиусы несвязанных атомов. Их находят по межатомным расстояниям в твердом теле или жидкости, где атомы находятся в непосредственной близости друг от друга, но не связаны между собой ионной, ковалентной или металлической связью.
За ковалентный радиус атома при одинарной связи принимают половину расстояния между ядрами 2 х одинаковых атомов, связанных ковалентной связью.
Так, длина связи С – С в алмазе и в органических молекулах равна откуда R = 1,54:2 = 0,77 А°.
При двойных или тройных связях, как у:
т.е. укорочение связи можно наблюдать при увеличении кратности.
Измерить межъядерное расстояние в молекуле несложно, но решить какая часть этого расстояния приходится на долю катиона, а какая на долю аниона, далеко не просто.
R катиона
R аниона
Эти значения называют одновалентными радиусами. (для щелочных Ме и галогенов).
По Брэггу (1920г) межъядерное расстояние в кристалле можно рассматривать как сумму радиусов. Ионный радиус отличаются от атомных (Это определил Слейтер) на А°, определив радиус у 1200 соединений.
Атомные радиусы нужно применять в том случае, когда атомы соединены ковалентной или металлической связью. Это связывание осуществляется, если атомы приближаются друг к другу на расстояние, когда каждый атомный радиус примерно равен радиусу максимума радиальной плотности заряда.
Ионные радиусы используются в том случае, когда внешний электрон полностью удален с внешней орбитали электроотрицательного атома.
Периодичность атомных и ионных R. Для групп непероходных элементов атомные и ионные радиусы увеличиваются с увеличением порядкового номера (Z). Наибольшее увеличение имеет место для двух наиболее легких членов группы (Li и Be) и наименьшее для двух наиболее тяжелых членов группы. Но при изменении атомных и ионных радиусов по периодам они в общем уменьшаются при увеличении заряда ядра (Z). Наибольшее уменьшение наблюдается у элементов малых периодов, т.к. у них происходит заполнение внешнего электронного слоя. В больших периодах в пределах семейств d- и f- элементов наблюдается более плавное уменьшение радиусов. Это уменьшение называют соответственно d и f сжатием, (т.к. эти элементы имеют электроны, обладающие малой экранирующей способностью).
Важным для понимания особенностей строения кристаллических структур является понятие об атомных или ионных радиусах. Атомный, ионный радиус (или радиуса иона) равен минимальному расстоянию, на которое центр сферы данного атома (иона) может приблизиться к поверхности сфер соседних атомов (ионов).
Величина радиуса иона (аниона или катиона) зависит от величины и знака заряда данного иона. Это можно сформулировать в виде следующего правила: чем больше положительный заряд иона, тем меньше его радиус; чем больше отрицательный заряд иона, тем больше его радиус. Следовательно, ионные радиусы катионов, как правило, будут меньше радиусов анионов, а радиус одного и того же элемента в различных степенях окисления будет также различным. Эти закономерности отчетливо прослеживаются на периодической таблице химических элементов Д.И. Менделеева. Размер радиуса одного и того же атома или иона может изменяться в определенных пределах в зависимости от ряда причин, главнейшей из которых является природа химической связи.
По современным представлениям, химическая связь является результатом движения электронов внешних (валентных) оболочек в пространстве между ядрами взаимодействующих атомов. Возникновение связи обуславливается тем, что электроны, которые принадлежат двум различным атомам, становятся для них общими.
Главнейшими типами связи, развитыми в кристаллах, являются металлические, ионные, ковалентные, ван-дер-ваальсовы и водородные.
Например, N а имеет единственный валентный электрон на своей внешней оболочке, который он легко отдает, оставляя атом с положительным несбалансированным зарядом. С другой стороны, С l и другие элементы VII группы периодической таблицы могут легко приобретать устойчивую благородно-газовую оболочку, захватывая электрон для заполнения единственной вакансии на внешней электронной оболочке. Так возникают ионы с отрицательными несбалансированными зарядами. Ионы с избытком положительного заряда называются катионами, с избытком отрицательного заряда — анионами. В кристалле NaCl атом N а переходит в ионное состояние ( Na + ), теряя электрон, а атом С l ионизируется (С l - ), приобретая электрон.
Для структур с ионным типом связи характерны достаточно высокие координационные числа (КЧ = 6, 8), нередки плотнейшие упаковки атомов. Симметрия ионных кристаллов обычно высокая.
Для кристаллических веществ с ионным типом связи (например, N аС l , С s С1, Са F 2 и др.) обычно характерны диэлектрические свойства, хрупкость, средние значения твердости и плотности, низкая тепло- и электропроводность.
Следует, однако, оговорить, что идеально ионных соединений в природе не существует. Поэтому такие соединения лучше называть преимущественно ионными.
Ковалентная (гомеополярная) связь возникает между одинаковыми или близкими по свойствам атомами и осуществляется с помощью обобществленных (принадлежащих одновременно двум атомам) пар электронов с противоположно направленными спинами - поделенной пары электронов - при наличии области перекрывания атомных орбиталей. При этом каждый из атомов приобретает стабильную конфигурацию благородно-газовых элементов. Например, одиночный атом С l с вакансией на своей валентной оболочке очень активен. Если его ближайшим соседом оказывается другой атом хлора, они объединяются таким образом, что один электрон выполняет двойную функцию на внешних валентных оболочках обоих атомов, формируя у них заполненные внешние электронные оболочки (рисунок). Такой способ образования ковалентной связи, когда каждый атом отдает по одному электрону, называется обменным, а сама связь - одинарной ковалентной связью.
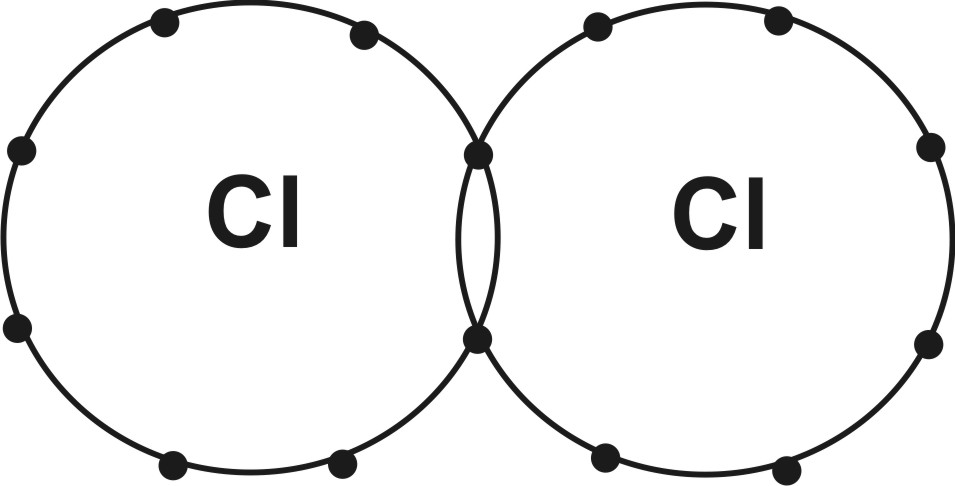
Ковалентная связь в молекуле С12
Ряд элементов (С, Si , S и др.) имеют не одну, а две, три, четыре вакансии на внешней электронной оболочке. И, следовательно, не вся энергия связи насыщается присоединением одного ближайшего атома. Поэтому такие элементы стремятся объединиться ковалентной связью с несколькими соседними атомами, образуя стабильные группы строго фиксированной формы. Количество общих электронных пар в ковалентной связи называется кратностью связи. Например, атомы С в структуре алмаза имеют четыре вакансии, которые заполняются обобществлением электронов с четырьмя соседними атомами С, вследствие чего образуется стабильная конфигурация в форме тетраэдра (КЧ = 4).
Ван-дер-ваальсова связь. Структуры с этим типом связи состоят из нейтральных изолированных или связанных в группы атомов - молекул. В качестве примера можно привести молекулярную структуру С l 2, в которой нейтральные молекулы С l 2 могут иметь незначительный избыток положительного заряда на одном конце с соответствующим недостатком на другом ее конце. Такие молекулы взаимодействуют как слабо заряженные диполи с разным зарядом на противоположных концах. Ориентировка соседних диполей все время изменяется. Однако во всех случаях диполи притягиваются, так как на их ближних участках всегда будет избыток отрицательного заряда с одной стороны и недостаток с другой. В результате диполь-дипольных взаимодействий возникают слабые связи, называемые ван-дер-ваальсовыми, остаточными или молекулярными.
Ван-дер-ваальсова связь характерна для кристаллов инертно-газовых элементов, широко распространена в качестве одной из основных составляющих в органических соединениях между молекулами. Если она реализуется в структурах минералов, то их кристаллы обладают хорошей спайностью, низкой твердостью. Например, в слоистой структуре графита в слое преобладают ковалентные связи, а между слоями — только ван-дер-ваальсовы, что объясняет совершенную спайность, параллельную графитовым слоям. Ван-дер-ваальсовы связи на полтора порядка слабее ковалентных и ионных. Они быстро ослабевают с увеличением межатомных расстояний, но тем не менее в кристалле любого типа всегда присутствуют в качестве добавочных. Для кристаллов с чисто ван-дер-ваальсовыми связями характерны летучесть, легкоплавкость (точка плавления не больше 300° С), отсутствие электро- и теплопроводности и др.
Водородная связь. Помимо четырех основных типов выделяют специфическую разновидность химической связи — водородную связь, хотя она и не является пятым типом связи. Энергия ее невелика: примерно в десять раз превышает ван-дер-ваальсову, но на порядок слабее ковалентной.
Водородная связь — это связь, которую атом водорода образует с двумя электроотрицательными атомами, такими как О, F , N, С l . Механизм связи состоит в том, что атом Н, отдав свой единственный электрон одному из электроотрицательных атомов (например, О1) и, следовательно, лишившись электронной оболочки, по размерам оказывается исчезающе малым и может быть втянут в электронную оболочку другого ближайшего атома (например, О2) до тех пор, пока силы отталкивания между протоном Н + и ядром атома кислорода О2 не придут в состояние равновесия. В результате между атомами О1 и О2 возникает связь, передатчиком которой служит атом водорода, — водородная связь: О1-Н-О2. С химической точки зрения она близка к одной из разновидностей ионной связи. Однако в отличие от нее водородная связь является направленной, т. е. сохраняет черты ковалентной связи.
В итоге можно отметить, что ионная, металлическая и ван-дер-ваальсова связи не являются направленными. Это указывает на то, что электронная плотность вокруг атомов приблизительно сферически симметрична. Ковалентная и водородная связи, напротив, являются направленными, и максимум электронной плотности лежит на линии, соединяющей взаимодействующие атомы.

Разница между атомным радиусом и ионным радиусом - Разница Между
Содержание:
Основное отличие - атомный радиус от ионного радиуса
Атомы являются строительными блоками материи. Вся материя состоит из атомов. Эти атомы могут быть преобразованы в ионы путем добавления одного или нескольких электронов извне. Поскольку атомы и ионы являются круговыми трехмерными структурами, мы можем измерить радиус атома или иона. Но это не простая задача. Потому что атом или ион состоит из электронов, которые находятся в движении. Радиус атома - это расстояние между ядром атома и границей его электронного облака. Ионный радиус - это радиус иона атома. Радиус иона может быть больше или меньше радиуса атома, в зависимости от электрического заряда иона. Основное различие между атомным радиусом и ионным радиусом этот атомный радиус является радиусом нейтрального атома, тогда как ионный радиус является радиусом электрически заряженного атома.
Ключевые области покрыты
1. Что такое атомный радиус
- Определение, тренды в периодической таблице
2. Что такое ионный радиус
- Определение, тренды в периодической таблице
3. В чем разница между атомным радиусом и ионным радиусом
- Сравнение основных различий
Ключевые слова: атомный радиус, атомы, электронная оболочка, ионный радиус, ионы

Что такое атомный радиус
Радиус атома - это расстояние от ядра атома до его границы электронного облака. Другими словами, это расстояние от ядра до самого дальнего электрона, который принадлежит этому атому. Атомный радиус может быть определен только для изолированных и нейтральных атомов.
При рассмотрении периодической таблицы элементов существует структура атомного радиуса элементов. В период периодической таблицы, атомный номер постепенно уменьшается. Элементы в один и тот же период имеют одинаковое количество электронных оболочек. Если число присутствующих электронов выше, притяжение между электронами и ядром также велико. В начале периода на внешней орбите присутствует меньше электронов. Тогда притяжение со стороны ядра меньше. Следовательно, атом велик, и радиус атома также велик. Но при движении по периоду число протонов в ядре увеличивается вместе с количеством электронов, присутствующих в атоме. Поэтому сила притяжения между электронами и ядром велика. Это приводит к уменьшению размера атома; тогда атомный радиус уменьшается. Аналогично, при движении по периоду размер атома постепенно уменьшается, равно как и атомный радиус.

Рисунок 1: Сравнение атомных размеров
При движении вниз по группе периодической таблицы элементов атомный радиус увеличивается. После каждого периода к атому добавляется еще одна электронная оболочка. Поэтому при движении вниз по группе размер атома увеличивается. Атомный радиус также увеличен.
Но в элементах d-блока нет большей разницы между атомными радиусами атомов двух соседних элементов в одном и том же периоде. Это потому, что электроны здесь добавляются к той же орбитали, которая находится в качестве внутренней орбитали. Поскольку внешняя оболочка остается постоянной, атомные радиусы этих элементов не имеют существенных различий.
Что такое ионный радиус
Ионный радиус - это радиус иона атома. Ионы не могут существовать одни. Если это положительно заряженный ион, он будет реагировать с отрицательно заряженным ионом (или наоборот) и станет стабильным нейтральным соединением. Это соединение называется ионным соединением, потому что оно состоит из ионных компонентов. Ионное соединение состоит из катионов и анионов. Катион меньше по размеру, потому что катион образуется путем удаления одного или нескольких электронов из атома. Анион большой, потому что у него есть дополнительные электроны, которые отталкиваются ядром, что приводит к увеличению расстояния между ядром и самым дальним электроном электронного облака.
Самый точный способ найти ионный радиус - это разделить расстояние между двумя ядрами двух ионов в соответствии с их размерами. Например, если ионное соединение состоит из катиона и аниона с атомным размером, который в три раза больше, расстояние между двумя ядрами должно быть разделено на 4, чтобы получить радиус катиона.

Рисунок 2: Атомный и ионный радиусы некоторых элементов
Ионы одного и того же химического элемента могут быть разных размеров в зависимости от их электрических зарядов. Наиболее распространенным методом определения ионного радиуса является рентгеновская кристаллография. Как и в атомном радиусе, ионный радиус также имеет тренды в периодической таблице. По мере того, как мы движемся вниз по группе в периодической таблице, ионный радиус увеличивается. Это потому, что новая электронная оболочка добавляется за каждый период, когда мы идем вниз группой. В течение периода ионный радиус уменьшается, поскольку эффективное положительное притяжение со стороны ядра постепенно увеличивается.
Разница между атомным радиусом и ионным радиусом
Определение
Радиус атома: Радиус атома - это радиус нейтрального атома.
Ионный Радиус: Ионный радиус - это радиус иона атома.
расчет
Радиус атома: Радиус атома можно рассчитать как расстояние от ядра атома до его границы электронного облака.
Ионный Радиус: Ионный радиус можно рассчитать путем деления расстояния между двумя ядрами двух ионов в соответствии с их размерами.
Размеры
Радиус атома: Нейтральные атомы одного и того же элемента имеют одинаковый размер, поэтому атомный радиус равен друг другу.
Ионный Радиус: Катионы имеют меньший атомный радиус, чем у анионов.
определение
Радиус атома: Атомный радиус определяется с учетом нейтральных газообразных атомов химических элементов.
Ионный Радиус: Ионный радиус определяется с учетом катионов и анионов, находящихся в ионной связи (в ионных соединениях).
Заключение
Атомный радиус и ионный радиус химических элементов имеют тренды в периодической таблице элементов. Увеличение или уменьшение атомных или ионных размеров по периоду или по группе периодической таблицы может быть объяснено с использованием электронных конфигураций элементов. Однако существуют значительные различия между атомным радиусом и ионным радиусом. Основное различие между атомным радиусом и ионным радиусом состоит в том, что атомный радиус - это радиус нейтрального атома, тогда как ионный радиус - это радиус электрически заряженного атома.
Рекомендации:
Атомные радиусы-числа, получаемые при измерении растояния между центрами атомов в кристаллической структуре. Атомные радиусы элементов, у которых заполняются s и p уровни, закономерно возрастают в каждой группе в направлении сверху вниз, при увеличении числа слоев в атоме. В пределах каждого периода слева на право, при увеличении числа элементов в слое, атомные радиусы уменьшаются. Наращивающие d уровни в начале ряда уменьшаются, затем возрастают.
Ионные радиусы-радиусы ионов, а точнее атомов в состоянии, когда у них проявляется ионная связь. Размер иона изменяется в зависимости от внешних условий и влияния окружающих соседей в структуре минерала. Радиус иона зависит от его валентности. При возрастании положительной валентности радиус уменьшается по сравнению с атомами, а при отрицательной валентности возрастает. У s, p, d уровнях в первых периодах радиус чуть сокращается, далее возрастает, для f уменьшается во всем ряду. В вертикальных группах радиусы возрастают сверху вниз
Все свойства элементов, которые определяются электронной оболочкой атома, закономерно изменяются в периодах и группах периодической системы. Но поскольку у ряда элементов-аналогов электронные структуры не тождественны, а только подобны, то при переходе от одного элемента к другому в подгруппах наблюдается не простое повторение свойств, а их более или менее четко выраженное закономерное изменение, которое мы называем периодичностью свойств элементов.
Химическая природа элемента обусловлена способностью его атома отдавать или присоединять электроны, которая количественно характеризуется энергией ионизации, сродством к электрону и электроотрицательностью и зависит от радиуса атома.
Атомные и ионные радиусы
Вследствие волнового характера движения электрона атом не имеет четко очерченных границ, поэтому измерить абсолютное значение размера атома невозможно.
В последнее время распространилось понятие об орбитальных радиусах. Орбитальный радиус — это расстояние от ядра до наиболее удаленного от него максимума распределения электронной плотности. Поэтому атом в основном состоянии может иметь только один орбитальный радиус, а в возбужденном — множество значений rорб. Практически имеют дело с радиусами атомов, которые соединены друг с другом тем или иным типом химической связи. Такой радиус рассматривают как эффективный радиус атома, то есть, который проявляет себя в действии. Эффективные радиусы определяют при изучении строения молекул и кристаллов.
По этой причине значение атомных радиусов, приводимые в различных справочных изданиях, иногда существенно отличаются. Однако несмотря на различия в величинах атомных радиусов для одного и того же элемента, сохраняется общая закономерность, отражающая зависимость атомных радиусов от заряда ядра атома Z, которая имеет периодический характер.
Зависимость орбитальных радиусов r (1Å = 10 -10 м) элементов от порядкового номера Z:
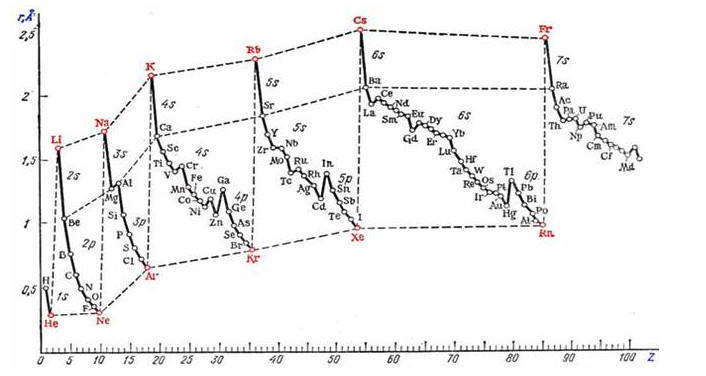
В пределах одного периода с повышением Z наблюдается тенденция к уменьшению размеров атомов. Это объясняется растущим притяжением электронов внешнего слоя к ядру по мере увеличения его заряда.
При переходе от предыдущего к следующему периоду атомные радиусы увеличиваются, поскольку начинается застройка нового энергетического уровня, более удаленного от ядра. В результате в пределах главных подгрупп размеры атомов увеличиваются с ростом зарядов ядер. В побочных подгруппах размеры атомов изменяются в меньшей степени, особенно для переходных d-металлов пятого и шестого периодов, для которых радиусы атомов примерно одинаковы. Это объясняется тем, что увеличение радиусов за счет увеличения количества квантовых уровней при переходе от пятого к шестому периода компенсируется лантаноидным сжатием (уменьшением атомных радиусов элементов от 57La до 71Lu), которое вызвано заполнением 4f-подуровня. Благодаря этому d-элементы-аналоги пятого и шестого периодов имеют особенно близкие свойства. Так, в IIIB-подгруппе (Ti-Zr-Hf) у последних двух элементов радиусы одинаковы (0,145 нм), поэтому они очень похожи между собой по физическим и химическим свойствам и значительно отличаются от Титана, радиус которого равен 0,132нм.
Потеря атомом электронов приводит к уменьшению его эффективных размеров, а присоединение избыточных электронов — к увеличению. Поэтому радиус положительно заряженного иона (катиона) всегда меньше, а радиус отрицательно заряженного иона (аниона) всегда больше радиуса соответствующего электронейтрального атома. Так, радиус атома калия равна 0,236нм, а радиус иона калия К + — 0,133нм, радиусы атома хлора и иона хлора Сl — соответственно равны 0,099 и 0,181нм.
При этом радиус иона тем сильнее отличается от радиуса электронейтрального атома, чем больше заряд иона. Например, радиусы атома хрома и ионов Cr 2+ и Cr 3+ равны соответственно 0,127, 0,083 и 0,064нм.
В пределах одной подгруппы радиусы ионов одинакового заряда растут с увеличением заряда ядра. Такая закономерность объясняется увеличением количества электронных слоев и увеличением удаления внешних электронов от ядра.
Энергия ионизации
Удаление электрона из невозбуждённого атома при преобразовании его в положительно заряженный ион — это процесс всегда эндоэнергетический (то есть, проходит при поглощении энергии), поэтому для его осуществления необходимо приложить определенную энергию.
Минимальная энергия, необходимая для отрыва электрона от невозбужденного атома, называется энергией ионизации I :
где символами Е и E + обозначены соответственно нейтральный атом и положительно заряженный ион (катион) некоторого элемента, I — энергия ионизации, ē — электрон.
Энергия ионизации измеряется в [кДж / моль] или [эВ / атом]. 1 эВ (электрон-вольт) — это энергия, которую приобретает электрон в ускоряющем электрическом поле с разностью потенциалов 1В; (1эВ = 1,6 · 10 -19 Дж), в пересчете на 1 моль это соответствует энергии 96,5кДж / моль. Энергию ионизации можно определить путем бомбардировки атомов электронами, ускоренными в электрическом поле.
От многоэлектронного атома можно оторвать один, два и более электронов. Отрыву каждого электрона соответствует определенное значение энергии ионизации i 1 , i 2 , …, i n , при этом всегда i 1 2 , p 6 , d 10 ) и ровно наполовину (р 3 , d 5 ) застроенными подуровнями.
Энергия ионизации в рядах d-элементов меняется мало. Это объясняется тем, что увеличение заряда ядра компенсируется экранирующих действием электронов, размещенных на внутренних энергетических уровнях.
В рамках подгрупп периодической системы увеличение порядкового номера элемента сопровождается увеличением размера атома. Увеличение заряда ядра в подгруппах меньше влияет на связь внешнего электрона с ядром, чем увеличение размера атома и числа экранирующих электронов. Поэтому в пределах подгрупп s- и р-элементов связь внешнего электрона с ядром уменьшается, что приводит к уменьшению энергии ионизации и усилению металлических свойств. Исключение составляют подгруппы d-элементов, в пределах которых при переходе от 3d- к 5d-элементам энергия ионизации увеличивается.
Величина энергии ионизации может характеризовать металлические свойства элемента: они тем выше, чем меньше значение I.
Сродство к электрону
Сродство к электрону F — это энергетический эффект процесса присоединения электрона к нейтральному атому с превращением его в отрицательно заряженный ион:
где символами Е и E — обозначены соответственно нейтральный атом и отрицательно заряженный ион (анион) некоторого элемента, F — сродство к электрону, ē — электрон. Измеряется сродство к электрону в [кДж / моль] или [эВ / атом].
Величина энергии сродства к электрону F для атомов элементов имеет периодическую зависимость от заряда ядра атома.
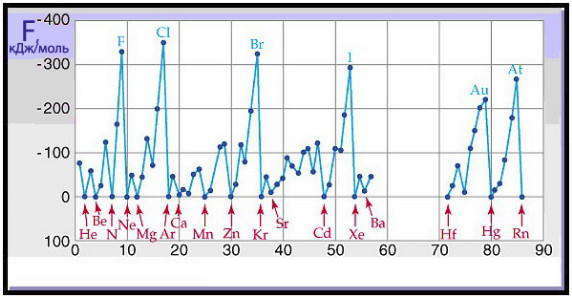
Зависимость энергии сродства к электрону F от порядкового номера элемента Z
Сродство к электрону зависит от электронной конфигурации атома и его химических свойств. Наибольшее сродство к электрону имеют р-элементы седьмой группы (F, Cl, Br, I), а маленькие и даже отрицательные значения — атомы с конфигурациями s 2 (Be, Mg), s 2 p 6 (Ne, Ar) или p 3 (N, P).
Сродство к электрону атомов металлов близка к нулю, то есть присоединения электронов к их атомам энергетически невыгодно. Сродство к электрону атомов неметаллов имеет положительное значение, поскольку этот процесс энергетически выгоден.
Присоединение одного электрона к атомам О, S, C и некоторым другим сопровождается выделением энергии. Таким образом, для этих элементов силы притяжения к ядру дополнительного электрона преобладают над силами отталкивания между дополнительным электроном и электронной оболочкой атома. Присоединение дальнейших электронов (двух, трех и более) к атому согласно квантово-механическими расчетами невозможно. Поэтому одноатомные многозарядные анионы (О 2 , S 2 , N 3 ) в свободном состоянии существовать не могут.
Электроотрицательность
Один и тот же атом в зависимости от условий может присоединять электроны, проявляя родство с ними, или отдавать электроны атома другого элемента, у которого сродство к электрону больше.
Электроотрицательность (ЕН или χ) — это обобщенная функция, характеризующая способность атома данного элемента оттягивать на себя электронную плотность по сравнению с атомами других элементов того же соединения.
Следует отметить, что электроотрицательность определенного элемента не является постоянной. На нее влияют различные факторы: валентное состояние элемента, тип соединений, содержания которой он входит и тому подобное. Но это понятие полезное для качественного объяснения свойств элементов и их соединений.
В пределах одного периода с ростом порядкового номера элемента наблюдается тенденция повышения электроотрицательности, а в подгруппах — ее снижение. Наименьшими значениями электроотрицательности характеризуются s-элементы первой группы, а крупнейшими — р-элементы седьмой группы.
Читайте также:

