Атомная теория 1808 кратко
Обновлено: 02.07.2024
Само слово "атом" имеет греческое происхождение и в буквальном переводе означает – неделимый. Считается, что саму идею о том, что гладкая и на беглый взгляд непрерывная материя в реальности состоит из огромного количества микроскопических (а поэтому и невидимых) частиц, предложил древнегреческий философ Демокрит, который блистал своим умом в V веке до нашей эры.
К сожалению, труды самого философа-мыслителя до наших дней не дошли, и о его работах мы судим в основном на основании авторов других работ, которые цитировали выдержки его трудов. И в основном ориентируемся на Аристотеля.
Простая логика Демокрита
Если попытаться адаптировать логику философа к современным реалиям, то получится вот такая цепочка рассуждений:
Возьмем абсолютно любой объект (который попадется вам под руку) и начнем его разрезать самым острым в мире ножом. Затем берем одну из получившихся половинок и ее так же разрезаем пополам. И продолжаем этот процесс снова и снова.
Так вот, продолжая такой процесс деления, мы с вами обязательно дойдем до того момента, что получим столь малую частицу материи, которую будет уже невозможно поделить на две половинки. Это и будет искомый и неделимый атом материи.
По рассуждениям Демокрита, атомы являлись вечными, неделимыми и оставались неизменными постоянно. А все изменения во Вселенной происходили исключительно за счет изменений связей между атомами.
Вот так зародилась теория Атома.
Современные представления об атоме
Но для того, чтобы все это понять, современным ученым пришлось провести огромное количество опытов. А древний философ мог положиться только на силу своего разума и в ходе рассуждений делал заключения относительно мироустройства.
И сама идея атомарного устройства мира была лишь философской вплоть до 19 века. Именно в это время началось формирование такой науки как химия. Именно химики первые установили, что в ходе реакций очень многие вещества разлагаются на более простые составные компоненты.
Например, вода (H2O) распадается на кислород и водород, а вот уже сам кислород и водород дальнейшему разложению (при химических реакциях) не подвергается.
Вещества, которые никак не изменялись в ходе химических реакций, получили название "химические элементы".
Помимо этого было установлено крайне важное обстоятельство. Оказывается, что во время протекания химической реакции количественное соотношение веществ в одной реакции остается неизменной.
Объяснил все эти моменты ученый Джон Дальтон. Так в 1808 году он опубликовал двухтомник "Новая система химической философии".
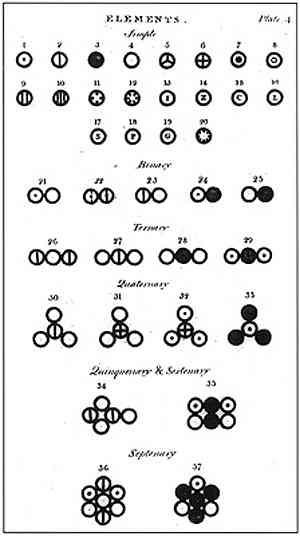
Если кратко, то в своих трудах он предложил принять тот факт, что каждому химическому элементу принадлежит уникальный атом. И в результате смешения именно этих уникальных атомов образуются все химические вещества в мире.
Возьмем ту же воду. По Дальтону вода состоит из единственного атома кислорода и пары атомов водорода.
Причем неважно, где бы вы ни взяли воду, она всегда будет состоять из одних и тех же элементов.
Так вот, как и для Демокрита, для Дальтона атомы - это абсолютно неделимые кирпичики мироздания. Но главная мысль трудов ученого 19 века в том, что каждому химическому элементу присущ особый атом, до сих пор является основополагающей для современной химии.
И это несмотря на то, что мы прекрасно знаем, что атом — это сложная конструкция из множества более мелких элементов.
Получается, что несмотря на прошедшие тысячелетия сама концепция атома не исчерпана и в начале 21 столетия.
Понравился материал? Тогда оцените его лайком, репостом и комментарием. Спасибо, что прочитали до конца.

На этом уроке вы познакомитесь со становлением в науке представлений о строении атома. Вы узнаете историю открытия строения атома, повторите, как он устроен. Рассмотрите опыты, которые ставились учеными в прошлом с целью получить все эти знания, таким образом, помогали им получить представление о строении атома.
Атомная модель Далтона или Атомная теория Далтона, Это было предложение, представленное между 1803 и 1807 годами английским химиком и математиком Джоном Далтоном. Это было первое предложение концептуальной организации относительно структуры и функционирования атомов..
Модель Далтона также известна как сферическая модель, поскольку она предполагает тот факт, что атом является неделимой, твердой и компактной сферой. Благодаря этой модели стало намного проще дать объяснение химии остальному миру, и это стало основой для многих инновационных исследовательских проектов, которые последовали. Могли бы объяснить, почему вещества реагировали в определенных состояниях.
Согласно Далтону, материя состояла из минимальной единицы, называемой атомом, которую нельзя было ни разрушить, ни разделить. Эта единица, ранее предложенная Демокритом и его наставником Леучипо, была основой исследований Далтона и создания его атомной модели..
Используя эту атомную теорию, Джон Далтон попытался поднять идеи греческих философов о существовании атома (атомная теория вселенной), но используя в качестве платформы различные лабораторные эксперименты, которые позволили ему продемонстрировать свои идеи..
- 1 Постулаты атомной модели Далтона
- 1.1 Постулат 1
- 1.2 Постулат 2
- 1.3 Постулат 3
- 1.4 Постулат 4
- 1.5 Постулат 5
- 1.6 Постулат 6
- 2.1 Формула воды
- 2.2 Состав атомов
- 4.1 Предшественник атомных теорий
- 4.2 Он заложил основы современной химии
- 4.3 Сначала опубликовать таблицу химических весов
- 4.4 Дайте имя дальтонику
Постулаты атомной модели Далтона
![]()
Далтон сформулировал свою атомную модель с 6 постулатами, в которых он объясняет, как он основывал свои исследования и как он их проводил..
Постулат 1
![]()
На изображении выше представлено краткое изложение модели Далтона: атомы будут крошечными сферами, неразделимыми, неразрушимыми и однородными.
Первый постулат Дальтона гласил, что элементы состоят из крошечных частиц, называемых атомами, которые не могут быть разделены и не могут быть уничтожены.
Кроме того, Далтон заметил, что эти частицы не могут измениться ни в одной химической реакции..
Постулат 2
![]()
Второй постулат Дальтона установил, что все атомы, присутствующие в одном и том же элементе, имеют одинаковый вес, как и в других характеристиках..
С другой стороны, также установлено, что атомы разных элементов имеют разную массу. Из этого предложения возникло знание об относительных атомных весах, которые были продемонстрированы при сравнении различных элементов с водородом.
Постулат 3
![]()
Третий постулат Дальтона установил, что атомы неделимы, даже когда они объединены в химических реакциях. Также они не могут быть созданы или уничтожены.
Комбинация атомов, как равных, так и разных, будет генерировать более сложные соединения, но этот процесс не изменит тот факт, что атом является минимальной единицей вещества.
Постулат 4
![]()
Четвертый постулат Дальтона установил, что даже когда атомы объединяются в соединения, они всегда будут иметь отношение, которое может быть выражено в простых и полных числах. Это выражение не будет отображаться во фракциях, так как атомы неделимы.
Постулат 5
Пятый постулат Дальтона гласил, что существует возможная комбинация разных атомов в разных пропорциях для образования более чем одного соединения.
Таким образом, можно объяснить, что из конечного количества атомов произошла вся существующая материя во вселенной..
Постулат 6
Шестой и последний постулат Дальтона гласил, что каждое химическое соединение было создано из комбинации атомов двух или более различных элементов..
Ошибки атомной модели Далтона
Как и вся теория в мире науки, было много опровержений в отношении модели, предложенной Далтоном, которые были продемонстрированы на протяжении многих лет, оставляя позади инновационные идеи Далтона..
Формула воды
Примером этого является аргумент, приведенный Далтоном в отношении формулы воды, которая, по его словам, состоит из водорода и кислорода..
Из-за этого утверждения было много ошибок в расчете массы и веса некоторых основных соединений, которые были основаны на этой информации.
Несколько лет спустя европейские ученые Гай-Люссак и Александр фон Гумбодт опровергли эту информацию и доказали, что вода на самом деле состоит из двух атомов водорода и одного кислорода. Спустя 6 лет Амадео Авогадро указал точный состав воды и из-за этого существует Закон Авогадро.
Состав атомов
С другой стороны, в двадцатом веке был выявлен истинный состав атомов. В этом случае было показано, что существует меньшая единица, такая как протоны, электроны и нейтроны.
Точно так же возникло существование различных атомных весов, установленных в периодической таблице Менделеева и Мейера, существование изотопов и более специфические химические свойства..
выводы
Несмотря на его ошибки, вклад Джона Далтона имел большое значение в мире науки и вызвал сенсацию в его время из-за большого количества информации, которую он предоставил.
Ваш научный вклад все еще действителен и все еще изучается.
Атомная модель Дальтона десятилетиями не подвергалась сомнению из-за ее актуальности в мире науки и ее правильного объяснения исследованиям и гипотезам, которые были представлены в тот момент в истории науки..
Основной вклад Далтона
Его вклад в мир науки состоял главным образом в разъяснении и формулировании гипотез о природе с помощью количественных тестов..
Ученый умер от сердечного приступа 27 июля 1884 года в Манчестере и вскоре после этого получил почести от монархии..
Предшественник атомных теорий
Джон Далтон был английским химиком, математиком и химиком. Он родился 6 сентября 1766 года в Камберленде, Великобритания, и известен как один из предшественников атомных теорий с момента, когда он представил свою атомную модель..
Он заложил основы современной химии
Далтон известен как один из предшественников в создании таблицы относительных весов для химических элементов. Этот факт помог заложить основы того, что мы знаем сегодня как современная химия.
Сначала опубликовать таблицу химических весов
Далтон был первым ученым, который имел честь опубликовать таблицу атомных весов, включающую такие элементы, как водород, кислород, фосфор, углерод и сера. Благодаря этой публикации Далтон начал работать и формировать то, что будет его атомной моделью.
Дайте имя дальтонику
Следует отметить, что Далтон был одним из первых людей, у которых были проблемы со зрением, и у которых возникли проблемы с отображением цветов, и из-за него это состояние называется дальтонизмом..
Атомной теорией является такая теория, которая основана на гипотезе о том, что абсолютно все в природе и космосе состоит из очень мелких частиц, которые называются атомы. Они соединяются между собой под воздействием ядерных и электрических сила.
![]()
Появление атомной теории
В начале XIX века начали появляться первые теории химии, до этих пор теория о строении всего вокруг из атомов оставалась лишь философским предположением. Химики первыми обнаружили, что вещество во время химической реакции может распадаться на другие компоненты. Вода, к примеру, распадается на кислород и водород, которые в свою очередь уже не распадутся на более простые частицы, так как они являются элементарными. Такие вещества были названы химическими элементами.
В начале XIX века были открыты примерно тридцать химических элементов. Ученые еще в то время установили, что во время химической реакции количество элементов не меняется. К примеру, для получения воды нужны одна массовая часть водорода и восемь массовых частей кислорода.
Теория атома Бора
Бор выдвинул постулаты, позволяющие рассчитывать спектр атомов водорода и систем, подобных ему, то есть систем, которые состоят из ядра з зарядом Ze и одного электрона (к примеру, ионы He+, Li+). Согласно теории Бора, можно определить несколько физических величин:
- радиус стационарных орбит: \(r_n = < \over >∙n^2, \) \(r_1=52,8 пм;\)
- энергия электрона на стационарной орбите: \(E_n =-13,6< Z^2 \over n^2>; \)
- скорость электрона на орбите: \(v =< Ze^2 \over 4πε_0 t_1 n>. \) .
На вращающийся по орбите электрон действует кулоновская сила взаимодействия с ядром и центробежная сила.
Не нашли что искали?
Просто напиши и мы поможем
Теория атома Дальтона
Английский химик Д. Дальтон был первым, кто добился существенных результатов в атомистическом развитии химии. В начале XIX века он открывает и формулирует ряд законов: парциальных давлений, о растворимости газов в жидкостях, кратных отношений.
Основные тезисы теории Дальтона звучат таким образом:
- все вещества состоят из огромного количества атомов, которые являются мельчайшими неделимыми и неразрушимыми частицами;
- все атомы одного вещества идентичны по весу и по химическим свойствам. Отличаются лишь атомы различных веществ;
- атомы различных элементов могут соединяться между собой в определенных соотношениях;
- во время химических реакций атомы не могут исчезнуть или измениться, одним из самых важных их свойств есть атомный вес.
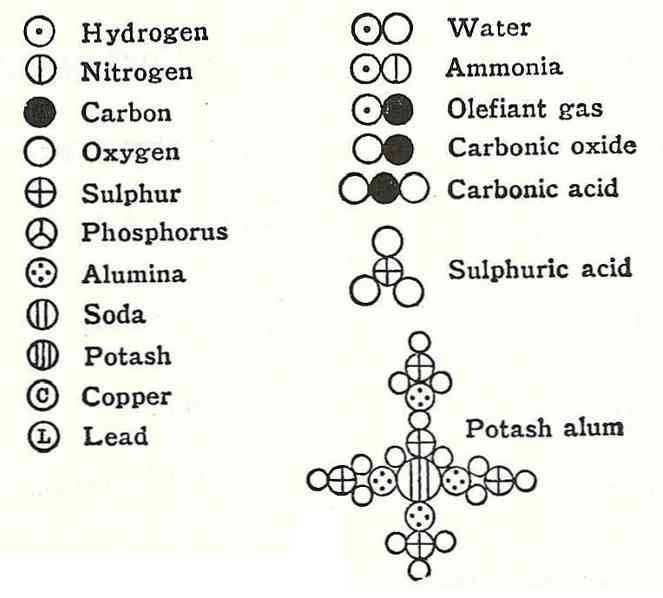
В 1803 году Дальтон создал таблицу, которая содержала относительные веса атомов некоторых элементов и соединений, при этом за основу было принято равенство атомного веса водорода единице. Подобного рода таблица была первой. Для того, чтобы обозначить атомы элементов, Дальтон впервые применил условное обозначение в виде круга с изображением различных фигур внутри него. Позже ученый многократно корректировал атомные веса многих элементов, ведь по началу он неверно определял их веса.
Дальтон допустил, что атомы химических элементов во время образования различных сложных атомов соединяются по принципу наибольшей простоты, а именно:
- если есть лишь одно бинарное соединение двух элементов, то его молекула (сложный атом) будет образовываться при помощи одного атома одного элемента и одного атома другого элемента. В соответствии с терминологией Дальтона сложный атом называется двойной;
- если есть два и более соединений, состоящих из двух элементов, то образовавшиеся сложные атомы будут тройные или более.
Соответственно, Дальтон определил, что молекула воды состоит из одного атома кислорода и двух атомов водорода. Исходя из этого, он занизил важность атомного веса кислорода, и впоследствии ложно определил атомные веса металлов, входящих в оксиды.
Вследствие этого принцип максимальной простоты, который применил Дальтон, оказался ложным и отрицательно воздействовал на дальнейшее развитие теории атомных весов. Но, невзирая на это, его теория атома послужила основой для дальнейшего развития химии.
Сложно разобраться самому?
Попробуй обратиться за помощью к преподавателям
Планетарная модель атома Резерфорда
Исследования в области изучения атомов продолжил ученый Э. Резерфорд в 1911 году. В ходе своих экспериментов, исследуя поведение альфа-частиц, он обнаружил, что в атоме присутствуют определенные положительно заряженные частицы. Резерфорд определил, что при прохождении лучей сквозь газ, некоторое число частиц отклоняется от общего направления движения (они практически разворачивались на 180 градусов).
Ученый сделал вывод, что подобное поведение объясняется фактом столкновения этих частиц с положительно заряженными. Эти исследования привели к появлению модели строения атома Резерфорда.
Благодаря своим опытам, Резерфорд создал существенно новую теорию в области изучения атомов. Открытия этого ученого имели огромное значение в последующем развитии важнейшей науки - физики. Модель Резерфорда представляет собой атом в форме ядра, которое расположено в центре, и вращающихся вокруг него электронов. Ядро положительно заряжено, а электроны - отрицательно. Эта модель подобна планетной системе, в которой планеты движутся по орбитам вокруг Солнца, здесь же вокруг ядра по орбитам движутся электроны. Поэтому данная модель получила название планетарной.
Это открытие объяснило причину отклонения альфа-частиц и послужило серьёзным подспорьем в области дальнейшего развития ядерной физики.
Читайте также: