Апоптоз это в биологии 10 класс кратко
Обновлено: 05.07.2024
Ответ. Митоз - универсальное деление соматических клеток, в результате которого из исходной (материнской) клетки образуются 2 дочерние клетки, генетически тождественные материнской.
Мейоз - особый способ деления, в результате которого образуется 4 клетки с набором хромосом уменьшенным вдвое по сравнению с материнской (обычно образуются клетки с гаплоидным набором хромосом) , причем все образовавшиеся клетки генетически отличаются друг от друга.
В мейозе происходит не одно деление (как в митозе) , а два последовательных деления - редукционное и эквационное.
В мейозе (в профазе первого деления) происходит конъюгация гомологичных хромосом и кроссинговер, а в митозе - не происходит.
В анафазе первого деления мейоза к полюсам расходятся не хроматиды, а целые хромосомы
2. Какие фазы митоза вы знаете?
Ответ. Различают следующие четыре фазы митоза: профаза, метафаза, анафаза и телофаза. В профазе хорошо видны центриоли — образования, находящиеся в клеточном центре и играющие роль в делении дочерних хромосом животных. Центриоли делятся и расходятся к разным полюсам клетки. От центриолей протягиваются микротрубочки, образующие нити веретена деления, которое регулирует расхождение хромосом к полюсам делящейся клетки.
В конце профазы ядерная оболочка распадается, ядрышко постепенно исчезает, хромосомы спирализуются и в результате этого укорачиваются и утолщаются, и их уже можно наблюдать в световой микроскоп. Еще лучше они видны на следующей стадии митоза — метафазе.
В метафазе хромосомы располагаются в экваториальной плоскости клетки. При этом хорошо видно, что каждая хромосома, состоящая из двух хроматид, имеет перетяжку — центромеру. Хромосомы своими центромерами прикрепляются у нити веретена деления. После деления центромеры каждая хроматида становится самостоятельной дочерней хромосомой.
Затем наступает следующая стадия митоза — анафаза, во время которой дочерние хромосомы (хроматиды одной хромосомы) расходятся к разным полюсам клетки.
Следующая стадия деления клетки — телофаза. Она начинается после того, как дочерние хромосомы, состоящие из одной хроматиды, достигли полюсов клетки. На этой стадии хромосомы вновь деспирализуются и приобретают такой же вид, какой они имели до начала деления клетки в интерфазе (длинные тонкие нити). Вокруг них возникает ядерная оболочка, а в ядре формируется ядрышко, в котором синтезируются рибосомы. В процессе деления цитоплазмы все органоиды (митохондрии, комплекс Гольджи, рибосомы и др.) распределяются между дочерними клетками более или менее равномерно.
Вопросы после §28
1. Что такое апоптоз?
2. Какой цикл называют митотическим?
Ответ. Обязательным компонентом каждого клеточного цикла является митотический цикл, который включает в себя подготовку клетки к процессу деления и само деление. Кроме того, в жизненный цикл входят длинные или короткие периоды покоя, когда клетка выполняет свои функции в организме. После каждого из таких периодов клетка должна перейти либо к митотическому циклу, либо к апоптозу
3. Какие процессы происходят в клетке в интерфазу?
Ответ. Подготовка клетки к делению получила название интерфазы. Она состоит из трех периодов.
Пресинтетический период (G1) – наиболее продолжительная часть интерфазы. Он может продолжаться у различных видов клеток от 2–3 ч до нескольких суток. Этот период следует сразу же за предшествующим делением, во время него клетка растет, накапливая энергию и вещества для последующего удвоения ДНК.
Синтетический период (S), который обычно длится 6–10 ч, включает в себя удвоение ДНК, синтез белков, необходимых для формирования хромосом, а также увеличение количества РНК. К концу этого периода каждая хромосома уже состоит из двух идентичных хроматид, соединенных друг с другом в области центромеры. В этот же период удваиваются центриоли.
Постсинтетический период (G2) наступает после удвоения хромосом. Он длится 2–5 ч; за это время накапливается энергия для предстоящего митоза и синтезируются белки микротрубочек, которые впоследствии образуют веретено деления. Теперь клетка может приступать к митозу.
Прежде чем перейти к описанию способов деления клетки, рассмотрим процесс удвоения ДНК, в результате которого в синтетическом периоде образуются сестринские хроматиды.
4. В какой период интерфазы происходит репликация ДНК?
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
РАЗРАБОТКА УРОКА ПО БИОЛОГИИ С ИСПОЛЬЗОВАНИЕМ ЭЛЕМЕНТОВ
КЕЙ-ТЕХНОЛОГИИ НА ТЕМУ:
Преподаватель биологии государственного бюджетного нетипового общеобразовательного учреждение «Республиканский лицей-интернат
Министерства образования и науки
Донецкой Народной Республики
Бездверная Любовь Владимировна
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
В современных условиях использования различных инновационных технологий, стало необходимым условием познавательного обучения и формирования у учащихся навыков работы с информацией, а также воспитание личности, способной найти правильный путь решения любой проблемы.
Использование на этом уроке кейс-технологии относится к одной из методик развивающих познавательную активность. Особенностью кейс-метода обучения является его образовательная открытость с одной стороны, а с другой, закрытость и жесткость в результативности обучения.
Новизна разработки заключается в том, что данный кейс дает возможность получить навыки решения реальных проблем, возможность работы группы на едином проблемном поле, он более адекватен в жизненной ситуации, чем заучивание терминов с последующим пересказом. Большую часть урока учащиеся работают в малых группах, что дает максимум возможности для формирования образовательных компетенций.
Урок рассчитан на 90 минут. Данный кейс обучающий, основной задачей которого является обучение (классификация кейсов по степени воздействия их основных источников).
Для решения кейса использован метод дискуссия: обмен взглядами по поводу проблемы и путей ее решения.
Урок с использованием рейтинговой системы и с опережающим домашним заданием.
Тема: Апоптоз и некроз клетки
Цель: сформировать знания учащихся о механизмах апоптоза и некроза;
сформировать умения выявлять причины некроза и апоптоза; факторы, вызывающие некроз и апоптоз;
помочь усвоить им основные понятия и научные факторы, которые качаются апоптоза и некроза.
Задачи: Обучающиеся:
дать представления о апоптозе и некрозе клетки;
научиться анализировать информацию, используя кейс-технологии;
активизровать познавательную активность.
Развивающая:
продолжить развивать умение анализировать, сопоставлять, сравнивать, выделять главное;
устанавливать причинно-следственные связи;
продолжить развивать навыки умения работы в группе;
продолжить развивать умения вести дискуссию;
продолжить развивать умение работать с различными источниками информации.
Воспитательные:
формировать у учащихся познавательный интерес к предмету через использование нестандартных форм обучения, которые способствует ситуации успеха;
формировать у учащихся умение планировать сотрудничество со сверстниками и учителем;
воспитывать чувство взаимопомощи;
умение работать в команде.
Тип урока: изучение и первоначальное закрепление знаний с применением кейс-технологий (обучающий кейс) с использованием дискуссии, как приема для решения кейса.
Методы обучения: проблемно-ситуативного анализа.
Основные понятия: апопноз, некроз.
Раздаточный материал:
обучающий кейс с вопросами;
жетон для распределения по группам;
примерный перечень правил;
работы участников дискуссии;
Оборудование: компьютер, мультимедийный проектор.
Организационная деятельность (4-5 минут):
а) жеребьевка групп;
б) ознакомление с рейтингом.
2. Вступительное слово учителя по теме и цели урока (5 минут).
3. Работа с кейсом (65 минут):
а) отчеты спикеров;
в) составление кластера и таблицы.
4. Домашнее задание (4-5 минут).
5. Рефлексия (10 минут).
Учащиеся входят в кабинет и рассаживаются по группам за столы, на которых лежит жетон.
Учитель предлагает спикерам подойти на жеребьевку.
1 группа (красный жетон) – утверждающая.
2 группа (синий жетон) – отрицающая.
3 группа – модераторы, которые выслушав мнения, озвучат окончательный вывод по теме дебатов.
Далее учитель знакомит учащихся с рейтингом урока (см. Приложение 1).
Слово преподавателя
Сегодня тема урока: Апоптоз и некроз клетки. Цели нашего урока подробнее изучить сущность и механизм апоптоза и некроза клетки.
Слово преподавателя
У Вас на столах лежит кейс, с которым вы должны работать. Ознакомьтесь с описанием ситуации, поработайте в группах над вопросами (см. Приложение 2 и Доп.Приложение 2).
Далее проводится дискуссия между группами. На столах у учащихся правила работы для участников дискуссии (см. Приложение 3).
Слово преподавателя
Некроз – является смертью клетки и тканей в результате положительных воздействий, он происходит массово, поражая соседние клетки. Некроз (-): массовая гибель клеток, секвестрация; некроз (+): выраженная симптоматика, повышение защитных сил организма (см. Презентация).
Предлагаю 1-й и 2-й группе составить кластер механизм апоптоза и некроза (см. Приложение 4).
Группа модераторов составляет таблицу сравнение апоптоза и некроза (см. Приложение 5).
Заключительная часть урока
Слово преподавателя
Итак, мы сегодня с Вами нашли ответ на самый главный вопрос кейса: Каким образом с помощью знаний о механизмах апоптоза можно помочь раковому больному?
Научиться активировать апоптоз в раковых клетках, таким образом уничтожая их и не давая им размножаться.
Для запуска апоптоза нужно вскрыть мембраны митохондрий в раковых клетках и доставлять препарат, способный активировать апоптоз, путем инициации доменов смерти.)
Подведение итогов (рейтинг)
Домашнее задание:
Подберите из литературы, интернета, случаи из жизни, связанные с использованием знаний о апоптозе в лечение онкологических больных.
Минус (что не понравилось на уроке)
Интересно (все любопытные факты)
Анисимов В. Н. Молекулярные и физиологические механизмы старения. — 2-ое, переработанное и дополненное. — СПб.: Наука, 2008. — Т. 1. — 481 с.
Гордеева А. В., Лабас Ю. А., Звягильская Р. А. Апоптоз одноклеточных организмов: механизмы и эволюция // Биохимия, 2004, том 69, вып. 10, с. 1301—1313
Галицкий В. А. Возникновение эукариотических клеток и происхождение апоптоза // Цитология, 2005, том 47, вып. 2, с. 103—120
Работа в группах
Приложение 2
Задача к кейсу: Самурайский закон биологии
Вопросы к обсуждению
2. Всегда ли апоптоз является благом для организма?
3. Апоптоз это патология или физиология?
4. Какая связь между механизмом программированной клеточной гибелью и ритуальным самоубийством японцев?
5. Когда и при каких обстоятельствах в клетке включается программа апоптоза?
7. Какое место в жизни клетки занимает некроз ?
8. Существует ли связь между апоптозом и некрозом ?
9. Влияет ли апоптоз на продолжительность жизни ?
10. Каким образом с помощью знаний о механизмах апоптоза можно помочь раковому больному?
11. Составьте кластер: Механизм апоптоза и некроза
12.Составьте таблицу: Сравнение апоптоза и некроза
ИНФОРМАЦИОННЫЙ МАТЕРИАЛ
В организме здорового человека клеточный гомеостаз определяется балансом между гибелью и пролиферацией клеток (размножение).
Апоптоз - программированная клеточная гибель, энергетически зависимый, генетически контролируемый процесс, который запускается специфическими сигналами и избавляет организм от ослабленных, ненужных или повреждённых клеток. Ежедневно, примерно около 5% клеток организма подвергаются апоптозу, а их место занимают новые клетки. В процессе апоптоза клетка исчезает бесследно в течение 15-120 минут.
Апоптоз - это биохимически специфический тип гибели клетки, который характеризуется активацией нелизосомных эндогенных эндонуклеаз, которые расщепляют ядерную ДНК на маленькие фрагменты.
Морфологически апоптоз проявляется гибелью единичных, беспорядочно расположенных клеток, что сопровождается формированием округлых, окруженных мембраной телец (“апоптотические тельца”), которые тут же фагоцитируются окружающими клетками.
Это энергозависимый процесс, посредством которого удаляются нежелательные и дефектные клетки организма. Он играет большую роль в морфогенезе (возникновение и развитие органов, систем и частей тела организмов) и является механизмом постоянного контроля размеров органов. При снижении апоптоза происходит накопление клеток, пример - опухолевый рост. При увеличении апоптоза наблюдается прогрессивное уменьшение количества клеток в ткани, пример - атрофия.
Морфологические проявления апоптоза
Апоптоз имеет свои отличительные морфологические признаки, как на светооптическом, так и на ультраструктурном уровне. При окраске гематоксилином и эозином апоптоз определяется в единичных клетках или небольших группах клеток. Апоптотические клетки выглядят как округлые или овальные скопления интенсивно эозинофильной цитоплазмы с плотными фрагментами ядерного хроматина.
Механизм апоптоза
TNF-α и Fas-лиганд (CD178) запускают каскад биохимических реакций, финальным этапом которых является дефрагментация хромосом и гибель клетки. На поверхности клеток организма имеются специальные рецепторы для TNF-α, это TNF-RI и TNF-RII, а для Fas-лиганда рецептор Fas / APO-1 (CD95).
TNF-R и Fas / APO-1(CD95) имеют гомологию в экстрацеллюлярных доменах, представленную в виде цистеин богатых доменов и гомологичную последовательность в интрацеллюлярной части рецептора.
Связывание TNF-α и Fas-лигандов с рецепторами апоптоза активирует интрацеллюлярные "домены смерти" (DED - death effector domain) этих рецепторов: DED, DED1 и DED2 и ряд посредников, включая церамиды, ras, SAPK / JNK, протеиновые тирозинкиназы, катепсин D и протеазы ICE / CED-3 семейства, которые каскадно проводят смертельный сигнал. Цистеиновые протеазы ICE / CED-3 семейства находятся в составе интрацеллюлярной части рецептора апоптоза в неактивной форме, они относятся к интерлейкин-lβ расщепляющим ферментам (ICE). Это семейство включает ряд различных типов протеаз, многие протеазы имеют несколько обозначений. Семейство цистеин-аспартат протеаз ещё называют каспазами.

Кроме семейства каспаз, в регуляции апоптоза принимает участие семейство Bcl-2 белков, в котором Bcl-2, Bcl-XL, Ced-9, Bcl-w, и Mcl-1 белки ингибируют апоптоз, а Bcl-2 гомологи (BH) 1-3, Bax подобный белок, Bak, Bok, и состоящие только из BH3 региона, Bad подобный белок, Bid, Bik, Bim, и Hrk выполняют проапоптозную функцию.
Активация DED, DED1 и DED2 вызывает каскадную перестройку и активацию протеаз ICE / CED-3 семейства. Первым этапом является превращение не активной про-каспазы-8 в активную каспазу-8. Каспаза-8 активирует каспазу-3 и Bid. Bid взаимодействуя с Bax способствует выходу из митохондрий цитохрома C, который активизирует каспазу-9. В свою очередь активная каспаза-9 приводит к появлению активных каспаз-3, - 6, - 7. В свою очередь активные ICE начинают взаимодействовать с рядом внутриклеточных субстратов: поли-(АДФ-рибозо) полимеразой (PARP), участвующей в репарации ДНК и модификации активности некоторых ядерных белков, ламином В1, топоизомеразой I и Р-актином. Все члены семейства ICE / CED-3 протеаз содержат каталитический остаток цистеина и расщепляют субстраты после аспарагиновой кислоты. Специфическое расщепление PARP, ламина В1, топоизомеразы I и Р-актина под действием ICE-подобных протеаз на большие и малые фрагменты приводит клетку к гибели, так как большие фрагменты этих субстратов и являются активными нуклеазами, которые разрезают хромосомы на фрагменты. Например, PARP расщепляется CPP32 / Yama на два фрагмента 85 и 24 кДа, из которых апоптоз-специфическим является фрагмент 85 кДа. Активация протеаз ICE / CED-3 семейства может происходить и под действием фосфолипидов, например, церамидов, которые способны активировать CPP32 / Yama.
Свободный сфингозин образуемый из церамидов в результате его гидролиза церамидазой так же активирует ICE-подобные протеазы и ускоряет апоптоз.
Важная роль в осуществлении апоптоза принадлежит тироксину (Т4).
Он регулирует функционирование протеиновой тирозинкиназы, важного элемента реализации сигнала смерти. При недостатке этого гормона щитовидной железы происходит подавление апоптоза.
IL-lβ блокирует апоптоз. ICE-подобные протеазы взаимодействуют с IL-lβ, а не с PARP, ламином В1, топоизомеразой I и Р-актином. В результате чего не происходит образования активных нуклеаз, и клетка избегает апоптоза.
На взаимодействие TNF-α и Fas-лигандов с TNF-R и Fas / APO-1(CD95) и проведение апоптотического сигнала оказывают влияние Bcl и Bax белки. Так белки Bcl семейства: Bcl-2, Bcl-xL и Bcl-xS блокируют выход цитохрома С из митохондрий и таким образом предотвращают превращение про-каспазы-9 в активную форму, отменяют атоптотический сигнал. В свою очередь Bax белки способствуют выходу цитохрома С из митохондрий и образованию активной каспазы-9, которая инициирует продолжение и активацию апоптотическог каскада, начавшегося с присоединения TNF-α или Fas-лигандов к TNF-R и Fas / APO-1(CD95). Быть или не быть апоптозу зависит от соотношения Bcl и Bax белков в митохондриях. Преобладание экспрессии белков Bcl семейства блокирует запуск апоптоза, а преобладание экспрессии Bax белков способствует реализации сигнала смерти.
Снижение апоптоза
Продукт р53 гена следит за целостностью генома при митозе. При нарушении целостности генома клетка переключается на апоптоз. Наоборот, белок bcl-2 ингибирует апоптоз. Таким образом, недостаток р53 или избыток bcl-2 приводит к накоплению клеток: эти нарушения наблюдаются в различных опухолях. Изучение факторов регулирующих апоптоз имеет важное значение в разработке лекарственных препаратов, усиливающих гибель клеток злокачественных новообразований.
Аутоиммунные заболевания могут отражать нарушения в индукции апоптоза лимфоидных клеток, способных реагировать с собственными антигенами. Например, при системной красной волчанке наблюдается нарушение Fas-рецепторов на клеточной поверхности лимфоцитов, что ведет к активации апоптоза. Некоторые вирусы повышают свою выживаемость путем ингибирования апоптоза инфицированных клеток, например, вирус Эпштейна-Барра может воздействовать на обмен bcl-2.
Ускорение апоптоза
Ускорение апоптоза доказано при синдроме приобретенного иммунодефицита (СПИД), нейротрофических заболеваниях и некоторых заболеваниях крови, при которых наблюдается дефицит каких-либо форменных элементов. При СПИДе вирус иммунодефицита может активировать CD4 рецептор на неинфицированных Т-лимфоцитах, ускоряя, таким образом, апоптоз, что приводит к истощению клеток данного типа.
Некроз – омертвление, гибель клеток и тканей в живом организме, при этом жизнедеятельность их полностью прекращается.
Стадии некроза:
паранекроз – обратимые изменения, подобные некротическим;
некробиоз – необратимые дистрофические изменения (при этом катаболические реакции преобладают над анаболическими);
апоптоз – вариант некроза, при котором происходит гибель клетки;
аутолиз – разложение мертвого субстрата под действием гидролитических ферментов и макрофагов.
Термин некроз применяется после того, как изменения при повреждении достигнут значительной степени выраженности. Их условно разделяют на две группы:
1) колликвационный некроз – в основе лежит растворение ядра (кариолиз) и цитоплазмы (цитолиз);
2) коагуляционный некроз – происходит конденсация хроматина с последующим распадом ядра и одновременной коагуляцией цитоплазмы.
В начальном периоде некроза (некробиоза) клетка морфологически не изменена. Должно пройти 1—3 часа, прежде чем появятся изменения, распознаваемые при электронной микроскопии или гистохимически.
Приложение 3
Правила дискуссии
4. Правило поддержки. Важно быть внимательным к высказываниям другого, стараться понять смысл его мнения, поддерживать тех, кому сложно говорить публично.
5. Правило цели. Говори кратко, ясно и четко. Говори по теме, старайся отражать суть разбираемой проблемы.
Апоптоз - функции, механизмы
Апоптозом называется запрограммированная клеточная гибель. Этот процесс играет важную роль в росте и развитии организма, т. к. по мере созревания тканей некоторые клетки должны погибнуть, чтобы уступить место более дифференцированным и специализированным.
Если клетка не умирает и становится бессмертной, может развиться злокачественная опухоль. Впервые апоптоз был описан в 1970-е годы, но только в последнее время исследователи осознали его важную роль для развития организма, дифференцировки тканей и малигнизации.
Интерес к апоптозу возрос, когда выяснилось, что этот процесс находится под контролем генов, вовлеченных в злокачественную трансформацию, т. е. онкогенов, протоонкогенов и генов-супрессоров. Очевидно, что многие из этих генов активны во время развития организма.
Полагают, что изучение апоптоза и путей его регуляции позволит понять механизмы развития организма и старения. Утрата клеточного контроля над программированной клеточной гибелью ведет к развитию опухолей.
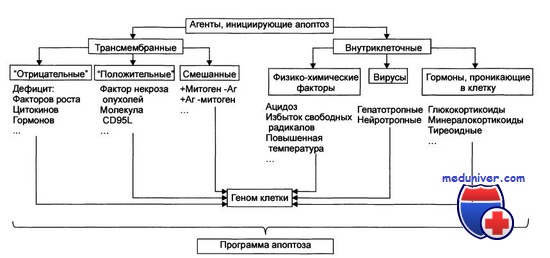
Стадия инициации апоптоза
Апоптоз — особый вид клеточной гибели, ответственный за устранение клеток в нормальных тканях. Тем не менее этот процесс наблюдается и при патологических процессах. Гистологически проявляется уменьшением клетки, буллезным разрушением клеточной мембраны и конденсацией клеточного ядра.
В итоге образуются апоптотические тельца, содержащие неповрежденные органеллы; окружающие клетки фагоцитируют эти тельца. Апоптоз не сопровождается воспалением, что отличает его от некроза. Последний сопровождается набуханием клетки, разрушением всех ее структур и развитием воспалительного ответа.
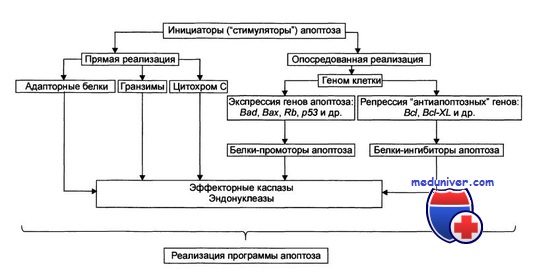
Стадия программирования апоптоза
Апоптоз играет важную роль в нормальном росте организма, а также в развитии и прогрессировании злокачественных опухолей. Спонтанный апоптоз встречается в злокачественных клетках и даже замедляет их рост.
Интенсивность этого процесса возрастает при облучении опухоли, проведении гормоно- и химиотерапии, при нагревании опухоли. В злокачественных опухолях апоптоз представляет механизм уничтожения клеток, в которых произошли канцерогенные изменения ДНК.
Однако если он заблокирован или подавлен мутациями контролирующих его генов, например BCL2 или ТР53, то эти клетки получают возможность свободно делиться и неограниченно накапливать мутации. Такая генетическая нестабильность — ранний этап развития злокачественных опухолей.
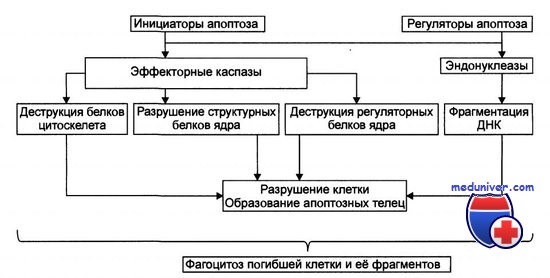
Стадия реализации апоптоза
Многие из современных методов лечения, например лучевая и химиотерапия, направлены на уничтожение клеток за счет повреждения их ДНК. Мутации гена BCL2 или ТР53 ухудшают эффективность лечения, т. к. подавляют клеточную гибель.
Более глубокое понимание процессов запрограммированной клеточной гибели может привести к разработке новых, более эффективных методов лечения. Ингибиторы апоптоза (например, протоонкоген BCL2) могут быть ответственны за развитие резистентности к противоопухолевым препаратам, позволяя выживать клеткам с патологической ДНК.
Вероятно, в дальнейшем будут выявлены и другие механизмы подавления апоптоза. Не следует думать, что этот процесс отражает нечто иллюзорное в биологической литературе, а термин принят только для описания отличной от некроза клеточной гибели. Апоптоз — фундаментальный процесс, контролируемый на молекулярном уровне, и можно надеяться, что его удастся расшифровать и использовать для медицинских нужд. Возможные механизмы апоптоза представлены на рисунке.
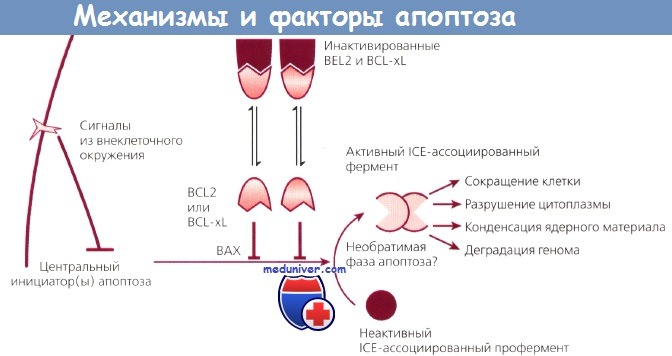
Возможные механизмы апоптоза и факторы, его контролирующие.
Внеклеточный сигнал запускает каскад событий, вовлекающий молекулы BCL2, BCL-xL и ВАХ.
Это ведет к наступлению программированной гибели клетки.
Этот механизм может быть заблокирован на любом из множества этапов, в результате чего клетка становится бессмертной.
ICE - интерлейкин-1b-превращающий фермент.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Каждый день в организме погибает большое количество клеток, а на смену им образуется равное количество новых: таково условие для поддержания клеточного гомеостаза. Удалить необходимо ненужные, старые и потенциально опасные. Одним из известных механизмов клеточной гибели является апоптоз, представляющий собой программируемый процесс.
Когда активируется апоптоз?
Физиологические ситуации:
- Разрушение клеток в процессе эмбриогенеза. Начальный этап развития организма сопровождается образованием избыточного клеточного материала, уничтожение которого происходит путем апоптоза в строго определённых местах и времени. Иначе говоря, гистогенез и органогенез тесно связаны с активацией апоптоза. Пример: удаление перепонок между зачатками пальцев.
- Инволюция гормонозависимых тканей после прекращения гормональной стимуляции. Пример: разрушение эндометрия во время менструального цикла, атрофия яичников в период менопаузы, постлактационное уменьшение молочной железы и атрофия простаты после кастрации.
- Ликвидация потенциально опасных лимфоцитов, которые могут реагировать на собственные ткани.
- Смерть клеток, которые уже послужили во благо организму. Например, гибель нейтрофилов при остром воспалительном ответе и лимфоцитов в конце иммунного ответа.
Патологические ситуации:
Внутриклеточный протеолитический каскад
Существует два класса каспаз: инициаторные (каспазы-2, -8, -9 и -10) и эффекторные (каспазы-3, -6 и -7). Первые отвечают за начало апоптоза, вторые же регулируют расщепление клеточных компонентов. Процесс развивается, как каскад, то есть состоит из нескольких ферментативных реакций. Субстратом на каждой стадии является белок, который в результате реакции превращается в активный фермент. Этот фермент в свою очередь использует другой белок в качестве субстрата, превращая его в активный фермент. И так повторяется несколько раз.
Каспазами разрушается множество белков, среди которых белки ядерной пластинки и белок-ингибитор активности эндонуклеазы. Расщепление последнего ведет к тому, что эндонуклеаза начинает разрезать ДНК. Разрушаются белки цитоскелета и клеточной адгезии, которые соединяют клетки друг с другом. Такой каспазный каскад необратим.

Рисунок 1 | Разрушение каспазой ингибитора эндонуклеазы и последствия. Апоптоз может протекать по двум различным путям — по внешнему и внутреннему (митохондриальному)
Внешний путь апоптоза
Этот путь запускается при связывании лиганда с рецептором смерти, находящимся на плазматической мембране различных клеток. Рецепторы смерти (death receptors — DR) бывают нескольких видов: TNF-R1, FAS (CD95), DR3, TRAIL-R1, TRAIL-R2 и др. Все они трансмембранные белки, содержащие внеклеточную часть — лиганд-связывающий домен — и внутриклеточную часть — домен смерти.
Иллюстрация такого пути — взаимодействие Fas рецептора на поверхности многих типов клеток с Fas-лигандом на цитотоксическом лимфоците. Домен смерти активированного рецептора объединяется с внутриклеточными белками FADD (Fas-associated death domain). Они в свою очередь объединяются с инициаторными каспазами, образуя сигнальный комплекс, вызывающий смерть (death-inducing signaling complex — DISC). Этот комплекс активирует инициаторные каспазы, которые затем включают в работу эффекторные каспазы, что дает начало апоптозу.
Существует ингибиторный белок, ограничивающий внешний путь. Этот белок называется FLIP. Он похож на инициаторную каспазу, но не обладает ее функцией. FLIP с каспазой-8 образует DISC, однако каспаза-8 не становится активной и апоптотический сигнал блокируется. Этот тормозный механизм помогает предотвратить нежелательную активацию внешнего пути.

Рисунок 2 | Внешний путь апоптоза
Внутренний путь апоптоза зависит от митохондрий
Этот путь может быть запущен в ответ на повреждение ДНК, активацию онкогенов, избыток Ca 2+ в клетке, отсутствие факторов роста (пептидный или стероидный гормон, стимулирующий рост и дифференцировку клетки), неправильно сложенные белки.
Активация пути ведет к повышению проницаемости наружной мембраны митохондрий. Из-за этого в цитоплазму выходят цитохром c и другие митохондриальные белки, которые инициируют апоптоз.
В норме они находятся в межмембранном пространстве этих органелл. Ключевой белок во внутреннем пути — цитохром с (компонент электрон-транспортной цепи). Выйдя в цитоплазму, он приобретает новые функции и присоединяется к фактору апоптотической протеазы 1 (apoptotic protease activating factor-1 — Apaf1).
Так образуется колесоподобная структура — апоптосома. Апоптосома активирует инициаторные каспазы-9, в свою очередь активирующие эффекторные каспазы, что дает начало апоптозу.

Рисунок 3 | Внутренний путь апоптоза
Апоптоз-регулируемый процесс
За внутренний путь апоптоза отвечают белки семейства Bcl2. Они контролируют выход проапоптотических белков из митохондрий (например, цитохром c). Название дано в честь гена белка Bcl2, который сверхэкспрессирован в некоторых лимфомах В-клеток (B cell lymphoma). В это семейство входят более 20 белков, которые могут быть разделены в три группы на основании их функций и количестве гомологичных доменов (Bcl2 Homology).
Первая группа — проапоптотические белки, которые увеличивают выход митохондриальных белков и запуск апоптоза.
Вторая группа — антиапоптотические белки, которые подавляют апоптоз, блокируя выход митохондриальных белков. Оба вида могут связываться друг с другом в различных комбинациях, подавляя свои функции. Баланс между активностью двух видов белков определяет, выживет ли клетка или погибнет по внутреннему пути апоптоза.
Антиапоптотическая группа представлена белками Bcl2 и BclXL, которые имеют четыре BH домена (BH1-4). Эти белки находятся на наружной мембране митохондрий и сохраняют ее непроницаемость. Таким образом это предотвращает утечку цитохрома c и других белков.
Проапоптотические белки — Bax и Bak. У них есть три BH домена (BH1-3). После своей активации Bax и Bak повышают проницаемость внешней мембраны митохондрий. Возможно, это происходит путем образования канала, что позволяет белкам выходить из межмембранного пространства в цитоплазму. Bak даже в отсуствие апоптотического сигнала связан с наружной мембраной митохондрий, а Bах локализован в цитозоле и транспортируется к митохондрии только после апоптотического сигнала.
Третья группа содержит (тоже проапототические) белки Bad, Bim, Bid, Puma и Noxa. Они имеют один BH домен (BH3), третий из четырех доменов BH, поэтому и получили название BH3 only proteins. Белки BH3-only играют ключевую роль в регулировании и стимулировании апоптоза и, таким образом, служат привлекательной целью терапевтического вмешательства. Следует отметить, что BH3 домен является единственным общим доменом для всех членов семейства Bcl2. Он опосредует взаимодействия между проапоптотическими и антиапоптотические белками.
Как происходит регуляция?
Факторы роста и другие сигналы выживания стимулируют выработку антиапоптотических белков. Они ингибируют апоптоз путем связывания проапоптотических белков на митохондриальной мембране. BH3-only белки, напротив, нейтрализуют активность антиапоптотических белков, таким образом способствуя собиранию проапоптотических белков Вах и Вак на поверхности митохондрии. Это приводит к выходу митохондриальных белков наружу.
Белок ВН3-only Bid связует оба пути апоптоза. В норме он неактивен. Но при активации внешнего пути каспаза-8 переводит белок Bid в активную форму. Bid перемещается к наружной мембране митохондрии и ингибирует антиапоптотические белки, тем самым увеличивая сигнал смерти.

Рисунок 4 | Схема регуляции внутреннего пути апоптоза
Другие способы регуляции
Клетка использует надежные механизмы от ненужной активации каспаз. Например, защитником служит семейство белков-ингибиторов апоптоза (inhibitors of apoptosis — IAPs). У человека они представлены следующими видами: cIAP1 (BIRC2), cIAP2 (BIRC3), X-связанный IAP (XIAP) и др.
Одни из этих белков связывают и ингибируют активированные каспазы. Другие - помечают каспазы для разрушения протеосомами. Функция ингибиторов заключается в установлении порога, который каспазы должны преодолеть для активации апоптоза. Активность IAP может быть подавлена белками из межмембранного пространства митохондрий, такими как Omi/HtrA2 и Smac/DIABLO, высвобождающимися во время апоптоза.
И еще о факторах выживания
Межклеточные сигналы регулируют деятельность клеток, в том числе и апоптоз. Необходим контроль, гарантирующий, что отдельные клетки ведут себя во благо всего организма, в противном случае их нужно удалить. Например, сигнальные белки, такие как Fas-лиганд, активируют рецепторы смерти и тем самым инициируют внешний путь апоптоза. Напротив, существуют факторы выживания — внеклеточные сигнальные молекулы, которые ингибируют апоптоз. Некоторые клетки требуют непрерывной сигнализации от других клеток, чтобы выживать. И это, по-видимому, помогает обеспечить жизнь только нужных клеток.

Рисунок 5 | (А) — Некоторые факторы выживания подавляют апоптоз, стимулируя выработку антиапоптотических белков, таких как Bcl2 или BclXL. (В) — Другие факторы активируют серин/треонин-протеинкиназу Akt (протеинкиназа B), которая путем фосфорилирования аминокислот серина и треонина приводит к инактивации проапоптотического белка Bad (он способствует апоптозу, так как он связывает и ингибирует Bcl2). После фосфорилирования Bad высвобождает Bcl2, который подавляет апоптоз. Активация этой протеинкиназы связана со многими злокачественными новообразованиями
Гибель нервной ткани
Нервные клетки вырабатываются избыточно в развивающейся нервной системе, а затем конкурируют за ограниченное количество факторов выживания. Эти факторы секретируются клетками-мишенями, к которым подходят нейроны. Нервные клетки, получающие достаточно сигналов выживания, живут, в то время как другие, не получающие нужного количества, умирают. Таким образом, число выживших нейронов соответствует количеству клеток-мишеней, с которыми они соединяются.
Жизнь и смерть у нервных клеток.

Рисунок 6 | Роль факторов выживания в гибели лишних нервных клеток
Каскады жизни и смерти
Каскад жизни
Факторы выживания для нейронов называются нейротрофическими факторами. Активация рецепторов нейротрофических факторов на пресинаптической мембране аксона приводит к увеличению факторов транскрипции, которые отвечают за образование антиапоптотических белков (Bcl-2, Bcl-xL), супероксиддисмутазы (подавляет повреждение клетки в результате окисления) и белков-ингибиторов апоптоза (IAP).
Каскад смерти
Апоптоз наблюдается в ходе процесса, который называется эксайтотоксичность. Этот процесс происходит при чрезмерной активации глутаматных рецепторов, в результате чего повышается приток Ca 2+ в постсинаптические области дендритов. Са 2+ , попадая в цитоплазму через ионные каналы на плазматической мембране и на эндоплазматическом ретикулуме, индуцирует апоптотический каскад, который активирует проапоптотическое белки Bax, Bad и p53. Эти белки действуют на митохондрии так, что повышается ее проницаемость, а в цитоплазму выделяется цитохром С. Это приводит к апоптозу.

Рисунок 7 | Каскады жизни и смерти
Как убрать апоптотическую клетку?
Апоптоз — очень аккуратный процесс клеточной смерти. Апоптотическая клетка и ее фрагменты не разрываются и не выделяют свое содержимое, а вместо этого остаются нетронутыми. Они съедаются без следов, поэтому воспалительного ответа нет. Апоптотическую клетку поглощают фагоциты. Процесс поглощения зависит от наличия химических изменений на поверхности мембраны клетки.
К таким изменениям относится наличие фосфатидилсерина, который служит сигналом для фагоцитарных клеток. Этот фосфолипид обычно расположен только на внутренней поверхности плазматической мембраны, а при апоптозе переворачивается на наружную поверхность. Макрофаги не фагоцитируют здоровые клетки, хотя у здоровых клеток на их поверхности есть некоторый фосфатидилсерин.

Рисунок 8 | Фагоциты удаляют апоптотическую клетку или ее части
Уклонение от апоптоза
Нарушение механизма клеточной смерти ключевой признак онкологического заболевания. Опухолевые клетки могут использовать различные механизмы для подавления апоптоза и приобретения устойчивости к апоптотическим агентам. Например, может наблюдается повышенная экспрессия антиапоптотических белков (Bcl-2) или мутации в генах проапоптотических белков (Вах).
Дефекты апоптоза могут позволить эпителиальным клеткам выживать во взвешенном состоянии без прикрепления к внеклеточному матриксу, что способствует метастазированию. Они также способствуют устойчивости перед цитолитическими Т-клетками и натуральными киллерами (NK), атакующими опухоли. Эти дефекты играют важную роль в устойчивости к лечению химиотерапией и лучевой терапией, увеличивая порог смерти клеток и требуя более высоких доз агентов, убивающих опухоль.
Успешное удаление раковых клеток с помощью нехирургических средств в конечном итоге достигается путем индукции апоптоза. Все цитотоксические противораковые средства, которые в настоящее время используются в клинических целях, вызывают апоптотическую гибель злокачественных клеток.

Рисунок 9 | Схематическое представление различных способов, из-за которых апоптотические пути могут быть нарушены
Терапия онкологических заболеваний и апоптоз
Ингибирование апоптоза лежит в основе развития всех опухолей. А значит, наиболее очевидной стратегией лечения является нацеленность на причины, которые подавляют гибель клеток. Для преодоления антиапоптотического эффекта белков Bcl-2 и Bcl-xL в опухолевых заболеваниях существует три стратегии:
- прекращение транскрипции их генов,
- разрушение мРНК с помощью антисмысловых олигонуклеотидов,
- атака мелкомолекулярными препаратами.
Стратегия первая
Следовательно, антиэстрогены, такие как тамоксифен, ингибируют экспрессию Bcl-2 в клеточных линиях рака молочной железы, способствуя развитию чувствительности к цитотоксическим противоопухолевым препаратам, таким как доксорубицин.
Стратегия вторая
Антисмысловые олигонуклеотиды — цель на мРНК. Антисмысловые олигонуклеотиды (Antisense oligonucleotides) представляют собой короткие последовательности одноцепочечной ДНК, которые могут связываться с мРНК, что сопровождается ее разрушением.
Один из перспективных препаратов - облимерсен натрия. Он представляет собой натриевую соль фосфоротиоатного антисмыслового олигонуклеотида. Препарат ингибирует мРНК гена Bcl-2. Он был успешно протестирован в сочетании с другими противораковыми агентами при различных типах рака, таких как множественная миелома, мелкоклеточный рак легких, меланома и неходжкинская лимфома.
Модификация искусственных нуклеотидов делает нуклеотидную цепь устойчивой к расщеплению нуклеазами и повышают период полувыведения в организме. В данном случае использовалось добавление фосфоротиоата (PS) в основную цепь (замена одного из кислородных остатков фосфатной цепи на серу)
Стратегия третья
BH3 миметики — это вещества, связывающиеся с рецепторами белков, на которые действуют сами BH3. Они необходимы для активации апоптоза. Эти белки нейтрализуют антиапоптотическое белки Bcl2 или активируют Bak и Bax. Разработаны BH3-имитирующие молекулы, выполняющие те же функции, что и BH3 белки.
Например, вещество ABT-737, которое ингибирует Bcl2-белки. BH3-белки, взаимодействуют с длинной гидрофобной канавкой в белке Bcl2, тем самым инактивируя последние. Препарат ABT-737 был спроектирован с помощью кристаллической структуры этой канавки.
Р53 в качестве лекарственной цели
Ген белка р53 отключен из-за мутаций примерно у 50% всех злокачественных опухолей. Повышение производства белка р53 в клетке может быть методом противораковой терапии. В нормальных клетках белок p53 обычно поддерживается на низком уровне, поскольку он подвержен ингибированию белком MDM2. В ответ на повреждения ДНК p53 видоизменяется.
Это позволяет ему избежать контроля MDM2 и начать накапливаться в клетке. Содержание гена MDM2 увеличено в некоторых типах опухолей, поэтому активного белка р53 становится меньше. Взаимодействие между p53 и MDM2 является мишенью в противораковой терапии. С этой целью были разработаны препараты, которые блокируют белок-белковые взаимодействия. Среди них Nutlin-3, ингибирующий взаимодействие p53/MDM2.
Большая часть того, что известно об апоптозе, стала понятна только недавно. Основная идея разработки терапевтических препаратов для лечения рака основана на том факте, что поврежденные клетки обычно встают на путь апоптоза, поддерживая нормальное для ткани количество клеток. Однако это явление сильно нарушается в раковых клетках. Обнаружение ключевых участников апоптоза и их взаимодействие с другими значимыми участниками создает условия для поиска новых методов терапии рака.
Читайте также:

