Амфотерные оксиды и гидроксиды кратко
Обновлено: 05.07.2024
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
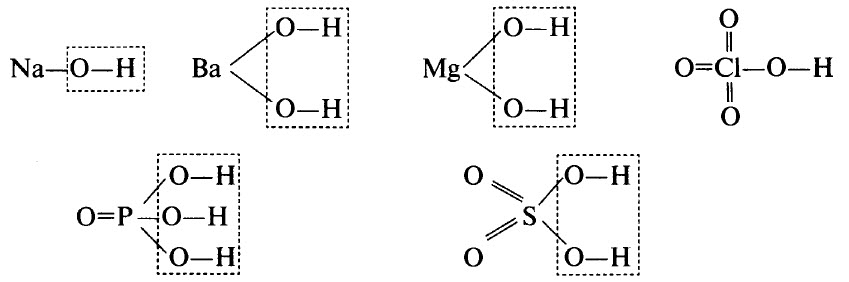
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O

Оксид и гидроксид цинка реагируют также и со щелочами:
В результате реакций со щелочами в растворах образуются комплексные ионы – тетрагидроксоцинкаты (например, Na2[Zn(OH)4]), а при сплавлении – цинкаты (например, Na2ZnO2). Чтобы составить формулы цинкатов, запишите формулу гидроксида цинка Zn(OH)2 как формулу кислоты – H2ZnO2. Кислотным остатком такой кислоты является ион ZnO2 2– .
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н + = Al 3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
Чтобы составить формулы алюминатов, запишите формулу гидроксида алюминия Al(ОН)3 как H3AlO3. Теперь представьте, что от 1 моль этого соединения отщепляется 1 моль воды. Образуется соединение НАlO2, в котором кислотным остатком будет ион AlO2 – .
В образовавшейся соли алюминий образует анион AlO2 – (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4] – :
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.

Это занятие мы посвятим изучению амфотерных оксидов и гидроксидов. На нем мы поговорим о веществах, имеющих амфотерные (двойственные) свойства, и особенностях химических реакций, которые протекают с ними. Но сначала повторим, с чем реагируют кислотные и основные оксиды. После рассмотрим примеры амфотерных оксидов и гидроксидов.
Существует три основных класса неорганических химических соединений: оксиды, гидроксиды и соли. Первые делятся на две группы: несолеобразующие (к ним относятся угарный газ, закись азота, монооксид азота и т. д.) и солеобразующие, которые, в свою очередь, бывают основными, кислотными и амфотерными. Гидроксиды делятся на кислоты, основания и амфотерные. Соли существуют основные, кислые, средние и двойные. Ниже будут более подробно описаны амфотерные оксиды и гидроксиды.

Что такое амфотерность?
Это способность неорганического химического вещества проявлять как кислотные, так и основные свойства, в зависимости от условий реакции. К веществам, которые обладают такого рода особенностью, могут относиться оксиды и гидроксиды. Среди первых можно назвать оксид и диоксид олова, бериллия, марганца, цинка, железа (ІІ), (ІІІ). Амфотерные гидроксиды представлены такими веществами: гидроксид бериллия, алюминия, железа (ІІ), метагидроксид железа, алюминия, дигидроксид-оксид титана. Самыми распространенными и часто используемыми из перечисленных выше соединений являются оксид железа и алюминия, а также гидроксиды этих металлов.
Химические свойства амфотерных оксидов
Амфотерные оксиды имеют одновременно как свойства кислотных, так и основных соединений. Как кислотные, они могут взаимодействовать со щелочами. При такого типа реакциях образуются соль и вода. Также они вступают в химическую реакцию с основными оксидами. Проявляя свои основные свойства, они вступают во взаимодействие с кислотами, вследствие чего образуются соль и вода, а также с кислотными оксидами, благодаря чему можно получить соль.
Примеры уравнений реакций, в которых участвуют амфотерные оксиды
АІ2О3 + 2КОН = 2КАІО2 + Н2О — данная реакция показывает кислотные свойства амфотерных оксидов. 2АІ2О3 + 6НСІ = 4АІСІ3 + 3Н2О; АІ2О3 + 3СО2 = АІ2(СО3)3 — эти уравнения служат примером основных химических свойств таких оксидов.
Химические свойства амфотерных гидроксидов
Они способны вступать в химическое взаимодействие как с сильными кислотами, так и со щелочами, а некоторые из них реагируют также со слабыми кислотами. Все они при воздействии высоких температур распадаются на оксид и воду. При реакции амфотерного гидроксида с кислотой образуются соль и вода. Все такие гидроксиды нерастворимы в воде, поэтому могут реагировать только с растворами определенных соединений, но не с сухими веществами.
Физические свойства амфотерных оксидов, способы их получения и применение
Оксид ферума (ІІ) — пожалуй, самый распространенный амфотерный оксид. Способов его получения существует довольно много. Он широко используется в промышленности. Другие амфотерные оксиды также применяются во многих отраслях: от металлургии до пищевой промышленности.
Внешний вид, получение и использование ферум (ІІ) оксида
Он представляет собой твердое вещество черного цвета. Его кристаллическая решетка схожа с решеткой пищевой соли. В природе его можно найти в виде минерала вюстита.
Данное химическое соединение получают четырьмя различными способами. Первый — восстановление оксида железа (ІІІ) с использованием угарного газа. При этом, смешав одинаковое количество этих двух веществ, можно получить две части оксида железа (ІІ) и одну — углекислого газа. Второй метод получения — взаимодействие железа с его оксидами, к примеру, ферум (ІІІ) оксидом, при этом не образуется никаких побочных продуктов.

Однако для такой реакции необходимо создать условия в виде высокой температуры — 900-1000 градусов по Цельсию. Третий способ — реакция между железом и кислородом, в этом случае образуется только оксид железа (ІІ). Для осуществления данного процесса также понадобится нагревание исходных веществ. Четвертым методом получения является оксалата двухвалентного железа. Для такой реакции необходима высокая температура, а также вакуум. В результате образуются ферум (ІІ) оксид, углекислый и угарный газ в соотношении 1:1:1. Из написанного выше можно сделать вывод, что самым простым и не требующим специальных условий является первый способ получения данного вещества. Применяют оксид железа (ІІ) для выплавки чугуна, также он является одной из составляющих некоторых красителей, используется в процессе чернения стали.
Оксид железа (ІІІ)
Это не менее распространенный амфотерный оксид, чем описанный выше. При нормальных условиях он представляет собой твердое вещество, имеющее красно-коричневый цвет. В природе может встретиться в виде минерала гематита, который используется в изготовлении украшений. В промышленности данное вещество получило широкое применение: его используют для окрашивания некоторых строительных материалов, таких как кирпич, тротуарная плитка и т. д., в изготовлении красок, в том числе полиграфических, и эмалей. Также рассматриваемое вещество служит пищевым красителем под названием Е172. В химической отрасли его применяют при производстве аммиака в качестве катализатора.

Оксид алюминия
Амфотерные оксиды также включают в свой список и оксид алюминия. Данное вещество при нормальных условиях имеет твердое состояние. Цвет этого оксида белый. В природе его часть можно встретить в виде глинозема, а также сапфира и рубина. Используется в основном в химической промышленности в качестве катализатора. Но также его применяют и в изготовлении керамики.

Оксид цинка
Это химическое соединение также обладает амфотерностью. Это твердое вещество, не имеющее цвета, в воде не растворяется. Получают его в основном посредством разложения различных соединений цинка. К примеру, его нитрата. При этом выделяется оксид цинка, диоксид азота и кислород. Также можно добыть данное вещество посредством разложения карбоната цинка. При такой реакции, кроме нужного соединения, выделяется еще и углекислый газ. Также возможен распад гидроксида цинка на его оксид и воду. Для того чтобы осуществить все три выше перечисленных процесса, требуется воздействие высокой температуры. Применяют оксид цинка в различных отраслях промышленности, например, в химической (в качестве катализатора) для изготовления стекла, в медицине для лечения кожных дефектов.
Оксид бериллия
Получают его в основном путем термического разложения гидроксида данного элемента. При этом также образуется вода. Он имеет вид твердого бесцветного вещества. Применение свое данный оксид находит в различных отраслях промышленности в качестве термостойкого материала.

Оксид олова
Имеет темный цвет, обладает твердым состоянием при нормальных условиях. Получить его возможно, как и многие другие амфотерные оксиды, посредством разложения его гидроксида. В результате образуется рассматриваемое вещество и вода. Для этого также нужно воздействие высокой температуры. Используется данное соединение в химической промышленности в качестве восстановителя в окислительно-восстановительных реакциях, реже применяется как катализатор.
Свойства, получение и применение амфотерных гидроксидов
Амфотерные гидроксиды используются не менее широко, нежели оксиды. Благодаря своему разностороннему химическому поведению, они в основном применяются для получения всевозможных соединений. Кроме того, гидроксид железа (бесцветное твердое вещество) используется в изготовлении аккумуляторов; гидроксид алюминия — для очистки воды; гидроксид бериллия — для получения оксида.

Некоторые элементы (почти все металлы, проявляющие степени окисления +1 и +2) образуют основные оксиды и гидроксиды. Например, калий образует оксид K2O, и гидроксид KOH. Они проявляют основные свойства, например взаимодействуют с кислотами.
K2O + HCl → KCl + H2O
Такие соединения проявляют кислотные свойства, например они реагируют с основаниями:
H2SO4 + 2KOH → K2SO4 + 2H2O
А есть элементы, образующие такие оксиды и гидроксиды, которые проявляют и кислотные, и основные свойства. Это явление называется амфотерностью. Таким оксидам и гидроксидам и будет приковано наше внимание в этой статье. Все амфотерные оксиды и гидроксиды — твердые вещества, нерастворимые в воде.
Для начала, как определить является ли оксид или гидроксид амфотерным? Есть правило, немного условное, но все-таки пользоваться им можно:
Амфотерные гидроксиды и оксиды образуются металлами, в степенях окисления +3 и +4, например (Al2O3, Al(OH)3, Fe2O3, Fe(OH)3)
И четыре исключения: металлы Zn, Be, Pb, Sn образуют следующие оксиды и гидроксиды: ZnO, Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO, Sn(OH)2, в которых проявляют степень окисления +2, но не смотря на это, эти соединения проявляют амфотерные свойства.
Свойства амфотерных соединений запомнить не сложно: они взаимодействуют с кислотами и щелочами .
Читайте также:

