Типы химических реакций 8 класс конспект урока и презентация
Обновлено: 07.07.2024
| Вложение | Размер |
|---|---|
| konspekt_na_ped_nadezhdy.docx | 56.48 КБ |
| rabochiy_list_1.docx | 37.13 КБ |
| rabochiy_list_2.docx | 35.23 КБ |
| rabochiy_list_3.docx | 35.52 КБ |
| ped_nadezhdy_4.part1_.rar | 2 МБ |
| ped_nadezhdy_4.part2_.rar | 2 МБ |
| ped_nadezhdy_4.part3_.rar | 2 МБ |
| ped_nadezhdy_4.part4_.rar | 2 МБ |
| ped_nadezhdy_4.part5_.rar | 488.58 КБ |
Предварительный просмотр:
Главный вопрос урока: Чем отличаются различные типы химических реакций? Какой признак взят за основу этой классификации?
Тип урока : урок изучения нового материала (по новой типологии открытия новых знаний).
Цель урока: обеспечить усвоение обучающимися понятия классификации химических реакций по числу и составу реагентов и продуктов реакции, деления их на типы.
- Образовательные : систематизировать знания обучающихся о типах химических реакций, продолжить формирование умений наблюдать, записывать уравнения и предвидеть продукты химических реакций.
- Развивающие : совершенствовать умения обучающихся сравнивать и обобщать; развивать память, устойчивое внимание, самостоятельное мышление, умение слушать и слышать другого человека. Развить познавательную активность обучающихся при выполнении заданий.
- Воспитательные : воспитывать чувство коллективизма и взаимопонимания при работе в парах; воспитывать отношение к химии, как прикладной науке, при изучении применения ряда химических реакций.
Планируемые результаты: урок должен помочь обучающимся восьмого класса сформировать следующие универсальные учебные действия:
1)Личностные УУД: определиться в выборе индивидуальных образовательных потребностей; научиться общаться со сверстниками, показывать свою убежденность в вопросах значения химических знаний в повседневной жизни.
2)Регулятивные УУД: организовывать свое рабочее место под руководством учителя; определять цель и составлять план выполнения задания; развивать практические навыки и умения при решении повседневных проблем связанных с химией.
3)Познавательные УУД : научиться устанавливать причинно-следственные связи ; формулировать проблемы.
4)Коммуникативные УУД: участвовать в диалоге на уроке; сотрудничать с одноклассниками в поиске и сборе информации; принимать решения и реализовывать их; точно выражать свои мысли.
1 . Организация начала урока (2 мин)
Учитель : Здравствуйте ребята, садитесь. Меня зовут Тюрина Татьяна Анатольевна.
Каждую секунду в окружающем нас мире происходит неисчислимое множество химических реакций, в результате которых одни вещества превращаются в другие. Чтобы управлять превращениями веществ, необходимо как следует разобраться в природе подобных реакций. Для этого и нужна химия.
Предлагаю вспомнить пройденный материал. Перед вами на столах лежат рабочие листы, выполните предложенные задания №1(последовательно, проверять каждое задание)

Данная презентация урока способствует усвоению обучающимися знаний о типах химических реакций и умению их определять.

Цель урока: изучение типов химических реакций , умение их определять
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
РЕАКЦИЯ СОЕДИНЕНИЯ
РЕАКЦИЯ РАЗЛОЖЕНИЯ
РЕАКЦИЯ ОБМЕНА
РЕАКЦИЯ ЗАМЕЩЕНИЯ
Типы химических реакций.
Типы реакций.
Определение.
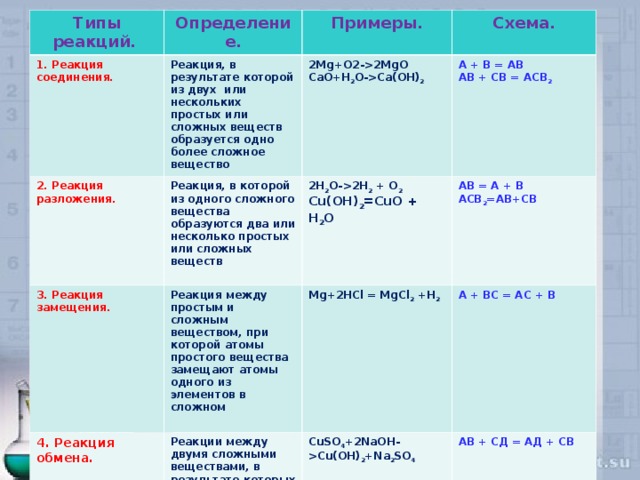
2MgO СаО+Н 2 O - Са(ОН) 2 Схема. Реакция, в которой из одного сложного вещества образуются два или несколько простых или сложных веществ 4. Реакция обмена. Реакция между простым и сложным веществом, при которой атомы простого вещества замещают атомы одного из элементов в сложном 2 Н 2 О- 2 Н 2 + О 2 Cu(OH) 2 =CuO + H 2 O А + В = АВ АВ + С B = А C В 2 Mg+2HCl = MgCl 2 +H 2 АВ = А + В ACB 2 = AB + CB Реакции между двумя сложными веществами, в результате которых происходит обмен их составными частями А + ВС = АС + В CuSO 4 +2NaOH-Cu(OH) 2 +Na 2 SO 4 АВ + СД = АД + СВ" width="640"
Типы реакций.
1. Реакция соединения.
Определение.
Реакция, в результате которой из двух или нескольких простых или сложных веществ образуется одно более сложное вещество
2 . Реакция разложения.
3. Реакция замещения.
СаО+Н 2 O - Са(ОН) 2
Реакция, в которой из одного сложного вещества образуются два или несколько простых или сложных веществ
4. Реакция обмена.
Реакция между простым и сложным веществом, при которой атомы простого вещества замещают атомы одного из элементов в сложном
2 Н 2 О- 2 Н 2 + О 2
Cu(OH) 2 =CuO + H 2 O
АВ + С B = А C В 2
Mg+2HCl = MgCl 2 +H 2
ACB 2 = AB + CB
Реакции между двумя сложными веществами, в результате которых происходит обмен их составными частями
А + ВС = АС + В
CuSO 4 +2NaOH-Cu(OH) 2 +Na 2 SO 4
Здравствуйте! Я рада всех вас видеть сегодня на уроке. Мы продолжаем изучать основы удивительной, но в тоже время и сложной науки – химии. Качественно усвоить знания невозможно без вашей активной самостоятельной работы. Для ее организации необходимо поделиться на группы. У вас на столах лежат карточки. Распределитесь на 4 команды.
По какому признаку вы объединились в группы? (вопрос каждой группе).
Настраиваются на работу.
Распределяются по 3 группам.
У нас на карточках записаны:
формулы простых веществ (1 группа), формулы сложных веществ (2 группа), химические уравнения (3 группа).
Рассаживаются по сформированным группам.
ЭТАП МОТИВАЦИИ И АКТУАЛИЗАЦИИ учебной деятельности
Сделайте глубокий вдох и выдох. Что сейчас произошло?
При вдохе вместе с воздухом в организм попал кислород и в каждой клетке начались химические реакции окисления органических веществ. При выдохе в воздух выделился углекислый газ, который затем поглотится растениями и в результате фотосинтеза превратится в углеводы. Каждую секунду в окружающем нас мире происходит неисчислимое множество химических реакций, в результате которых одни вещества превращаются в другие. (слайд 1)
Но как же не запутаться в этом огромном, разнообразном и удивительном мире химических реакций?
На основе этих признаков нужно разделить все химические реакции на группы или классы, т.е. классифицировать.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Выберите документ из архива для просмотра:
Выбранный для просмотра документ Таблица самооценки.docx
Таблица самооценки
учени____ 8 "___" класса ________________________________________
Вопросы для самооценки (Самооценка по 10-балльной шкале)
в начале этого урока
в конце этого урока
Я умею записывать схемы химической реакции
Я умею расставлять коэффициенты в схемах реакций
Я умею определять типы химических реакций
Я умею называть вещества
У меня вызывают затруднения:
Таблица самооценки
учени____ 8 "___" класса ________________________________________
Вопросы для самооценки (Самооценка по 10-балльной шкале)
в начале этого урока
в конце этого урока
Я умею записывать схемы химической реакции
Я умею расставлять коэффициенты в схемах реакций
Я умею определять типы химических реакций
Я умею называть вещества
У меня вызывают затруднения:
Таблица самооценки
учени____ 8 "___" класса ________________________________________
Вопросы для самооценки (Самооценка по 10-балльной шкале)
в начале этого урока
в конце этого урока
Я умею записывать схемы химической реакции
Я умею расставлять коэффициенты в схемах реакций
Я умею определять типы химических реакций
Я умею называть вещества
У меня вызывают затруднения:
Выбранный для просмотра документ Типы химических реакций ОТКРЫТЫЙ УРОК.docx
Тема: Типы химических реакций
Цель урока: обеспечение усвоения учащимися понятия классификации химических реакций, деления их на типы.
Образовательные - развить навыки самостоятельной работы, умения записывать уравнения реакций и расставлять коэффициенты, указывать типы реакций, делать выводы и обобщения.
Развивающие - развить речевые навыки, способности к анализу; развитие познавательных способностей, мышления, внимания, умения использовать изученный материал для познания нового.
Воспитательные - воспитание самостоятельности, сотрудничества, нравственных качеств - коллективизма, способности к взаимовыручке, адекватной самооценке.
Оборудование и реактивы:
презентация "Типы химических реакций" (Приложение1.)
на столах у учащихся инструктивная карточка для проведения исследования
набор соответствующих реактивов, пробирки, спиртовка и т.п.
карточки с тестом для проверки знаний по теме: "Типы химических реакций"
смайлики для оценки эмоционального состояния учащихся во время урока.
Парты в классе расставлены так, чтобы весь класс был разделен на 4 группы, в каждой группе есть ассистент, он отмечает в учетных карточках группы положительные ответы учеников.
Образец карточки:
Фамилия, имя ученика
Баллы за правильные ответы на уроке
Баллы за самостоятельную работу
Итоговая оценка за урок:
Тип урока: урок изучения нового материала и закрепления полученных знаний.
Методы: словесный, проблемно-поисковый, наглядный, практический, исследовательский.
I. Организационный этап (1 слайд) Приветствие Проверка присутствующих на уроке
II. Мотивационный этап (2 слайд)
Учитель:
Всё, что нас окружает, состоит из веществ. Кажется, что они живут своей жизнью, таинственной и непостижимой. Взаимодействуя, они изменяют свои свойства и состав. И задача человека, изучив этот мир, постараться использовать полученные знания во благо.
Сегодня мы продолжим знакомство с этим удивительным и волшебным миром химических реакций.
О чем же пойдет речь на сегодняшнем уроке? (3 слайд)
Чтобы ответить на этот вопрос, попробуйте отгадать загадку: " Она идет, она прошла, никто не скажет, что пришла. Она (химическая реакция).
III. Актуализация опорных знаний. (беседа)
Учитель:
Так о чем же пойдет речь на сегодняшнем уроке? (О химических реакциях)
А что такое химическая реакция? (4 слайд) (Это явление, при котором из одних веществ образуются другие)
Каковы признаки химических реакций? (5 слайд) ( Изменение цвета, выпадение осадка, выделение тепла и света, выделение газа - это признаки химических реакций)
Каковы условия возникновения химических реакций? (6 слайд) (Измельчение, нагревание, соприкосновение, растворение и смешивание веществ - это условия проведения реакций)
Как много химических реакций окружает нас в жизни? (Великое множество различных реакций окружает нас в жизни )
Что может помочь нам в изучении многообразия химических реакций? (Классификация химических реакций) (7 слайд)
Что такое классификация? (Деление на группы)
Верно. Так что же будет являться целью нашего сегодняшнего урока? (Изучение типов химических реакций и их классификация)
Запишите тему урока в тетрадь (8 слайд)
IV. Этап выявления существенных признаков для определения типов химических реакций.
На экране появляется 9 слайд , на котором представлены несколько химических реакций:
2 HgO -> 2 Hg + O 2
- можно ли выделить признак, по которому эти реакции, возможно, разделить на группы?
- различаются ли между собой реакции одной группы?
В ходе обсуждения учащиеся приходят к выводу, что одним из признаков, по которому можно классифицировать химические реакции является число и состав вступающих и образующихся в результате реакции веществ.
Введение понятия реакции соединения.
На экране появляется слайд № 10 , на котором представлены реакции:
- что объединяет все эти реакции?
- в чём их отличие?
- как одним словом мы можем назвать процесс, который протекает?
Учащиеся приходят к выводу, что идет процесс соединения веществ (реакции соединения), но в первом и втором случаях вступают в реакцию простые вещества, в третьем и четвертом - сложные вещества. Во всех реакциях образуется одно сложное вещество.
Учитель предлагает учащимся попытаться вывести определение этого типа реакций (наиболее подготовленные учащиеся делают это легко) и, используя буквы А, В, С, вывести уравнение реакции соединения в общем виде:
AB + CB -> AB 2 C
Введение понятий реакции разложения, замещения, обмена.
По такой же схеме, как и реакции соединения, изучаются реакции разложения, замещения, обмена (слайды №,11,12,13).
После изучения всех типов реакций появляется слайд № 14 и проводится обобщение материала .
Итак, мы узнали, как классифицируют химические реакции.
V. Самостоятельная работа по группам. (слайд №15)
А теперь проведем лабораторные исследования и определим, к какому типу принадлежит реакция проведенная вами.
1 группа - лабораторный опыт по реакции замещения,
2 группа - лабораторный опыт по реакции обмена,
3 группа - лабораторный опыт по реакции разложения,
4 группа - лабораторный опыт по реакции соединения.
Образец инструктивной карточки для проведения опыта:
Железный гвоздь опустите в раствор сульфата меди (II). Через 2 минуты выньте гвоздь. Что наблюдаете? Кирпично-красный цвет налета на гвозде говорит об образовании чистой меди. Спрогнозируйте, что образовалось еще? Запишите уравнения реакции. Определите тип реакции. Укажите признаки, по которым вы определили, что реакция прошла?
По одному человеку от группы отчитываются. Зачитывают уравнения реакций с комментарием. Затем на экране высвечивается правильная соответствующая запись уравнения. (слайд №16)
VI. Проверка знаний. (Рефлексия) (слайд №17)
Каждый ученик в группе получает карточку с заданием тестом и выполняет ее в течение 10 минут.
Тест состоит из 2-х частей: часть А включает 4 вопроса с выбором ответа, а часть Б - 2 вопроса на восстановление недостающих записей уравнений химических реакций.
1. (2 балла) Физическое явление – это:
а) ржавление железа
б) горение древесины
в) плавление свинца
2. (2 балла) Уравнение реакции обмена:
а) CaO + SiO 2 = CaSiO 3
б) FeS + 2 HCl = FeCl 2 + H 2 S
в) 2 KClO 3 = 2 KCl + 3O 2
3. (3 балла) По данной левой части уравнения CuO + H 2 SO 4 = … восстановите его правую часть.
4. (2 балла) Из нескольких простых или сложных веществ образуется одно более сложное вещество в реакции:
а) замещение
б) обмена
в) разложение
г) соединение
5. (6 баллов) Расставьте коэффициенты в схемах и укажите типы химических реакций:
а ) Li + O 2 Li 2 O
б ) Fe 2 O 3 + Al Al 2 O 3 + Fe
6. (7 баллов) Восстановите пропущенную запись и укажите тип химической реакции:
а ) ? + 2 HCl = FeCl 2 + H 2
б ) 2 Al + ? = 2 AlCl 3
1. (2 балла) Химическое явление – это:
а) горение свечи
б) испарение бензина
в) плавление льда.
2. (2 балла) Уравнение реакции разложения:
3.(3 балла) По данной правой части уравнения … = CuCl 2 + 2 H 2 O восстановите его левую часть.
а) Cu + 2 HCl
б) Cu(OH) 2 + 2 HCl
в) CuO + 2 HCl
4. (2 балла) Из одного сложного вещества образуется два или более новых веществ в реакции:
а) замещение
б) обмена
в) разложение
г) соединение
5. (6 баллов) Расставьте коэффициенты в схемах и укажите типы химических реакций:
а) CuO + HCl CuCl 2 + H 2 O
б) NH 3 N 2 + H 2
6. (7 баллов) Восстановите пропущенную запись, укажите тип химической реакции:
1. (2 балла) Физическое явление – это:
а) испарение воды
б) горение керосина
в) скисание молока.
2. (2 балла) Уравнение реакции замещения:
3. (3 балла) По данной левой части уравнения ZnO + 2 HCl =… восстановите его правую часть.
4. (2 балла) Из одного сложного вещества образуется два или более новых веществ в реакции:
а) замещение
б) обмена
в) разложение
г) соединение
5. (6 баллов) Расставьте коэффициенты в схемах и укажите типы химических реакций:
а ) Fe 2 O 3 + HCl FeCl 3 + H 2 O
б ) NO + O 2 NO 2
6. (7 баллов) Восстановите пропущенную запись, укажите тип химической реакции:
1. (2 балла) Химическое явление – это:
а) плавление олова
б) горение магния
в) замерзание воды..
2. (2 балла) Уравнение реакции соединения:
3. (3 балла) По данной левой части уравнения Zn(OH) 2 + 2 HCl = … восстановите его правую часть.
4. (2 балла) Из двух сложных веществ образуется два новых сложных вещества в реакции
а) замещение
б) обмена
в) разложение
г) соединение
5 (6 баллов) Расставьте коэффициенты в схемах и укажите типы химических реакций:
а ) Al 2 O 3 + H 2 SO 4 Al 2 (SO 4 ) 3 + H 2 O
б ) H 2 + Cl 2 HCl
6. (7 баллов) Восстановите пропущенную запись, укажите тип химической реакции:
а) Mg + 2 HCl = ? + H 2
б) 2 Na + ? = 2 NaCl
(При наличии времени проводится взаимопроверка и оценивание друг друга).
Затем ученикам предлагается выбрать карточки с изображением смайликов характеризующих их эмоциональное состояние на уроке.
Ассистенты делают анализ работы их групп.
VII. Домашнее задание. Итоги урока. Выставление оценок. (слайд №18.)
Оформить на альбомном листе работу, где необходимо привести примеры разных типов реакций и нарисовать рисунки, иллюстрирующие эти типы.
Примеры таких работ приведены на следующих слайдах.
Если осталось время.
Дано K 2 SO 4 + AgNO 3 = … Какова правая часть уравнения? Каков тип реакции? Почему?
Расставьте коэффициенты и укажите тип реакции. Fe + Cl 2 FeCl 3 объяснить.
Читайте также:

