Строение атома физический смысл порядкового номера элемента массовые числа атомов изотопы конспект
Обновлено: 22.07.2024
Урок "Состав атомных ядер. Изотопы. Радиоактивность" проводился на семинаре завучей в ходе продуктивно-управленческой игры. Использованы здоровьесберегающие технологии. Урок сопровождается мультимедийной презентацией.
| Вложение | Размер |
|---|---|
| konspekt_uroka_sostav_atomnykh_yader_radioaktivnost.doc | 87 КБ |
| _prilozhenie_1_opornyy_konspekt_po_teme.doc | 44.5 КБ |
| prilozhenie_2_kartochka_.doc | 33.5 КБ |
| prilozhenie3_urok_sostav_atomnykh_yader.ppt | 1.45 МБ |
Предварительный просмотр:
Кузнецова Наталья Георгиевна,
высшая квалификационная категория
1*Тема урока: Состав атомных ядер. Изотопы. Радиоактивность .
Урок изучения и первичного закрепления нового материала в 8 классе,
рассмотреть физический смысл порядкового номера элемента, научить школьников описывать состав атомных ядер, разъяснить понятие изотопов, явление радиоактивности.
сформировать у учащихся личностную мотивацию, познавательный интерес к данной теме; развить интеллектуальные и творческие способности учащихся, диалектическое мышление; углубить знания о взаимосвязи строения атома и структурой ПСХЭ;
отработать навыки работы с опорным конспектом и ПСХЭ.
развить познавательный интерес к устройству окружающего мира
Использовать методические приемы, позволяющие предотвратить переутомление учащихся, повысить их внимание.
Познакомить учащихся с историей установления сложного строения атома, с частицами, составляющими атом и их характеристиками.
Отработать умение записывать массовое число, порядковый номер элемента рядом с его символом, определять число протонов, нейтронов и электронов атомов любых химических элементов.
Показать, что этимологическое начало понятия "атом" ("неделимый") не соответствует действительности - атом делим. Дать понятие о составе атома и атомного ядра. Раскрыть взаимосвязь понятий: протон, нейтрон, электрон, массовое число.
Показать биологическое влияние радиации на организм человека.
Воспитывать в учениках уверенность в своих силах.
Межпредметные связи: физика, биология
Основные понятия (впервые вводимые):
1. Заряд ядра атома. 2. Электрон, протон, нейтрон. 3.Изотопы
Планируемые результаты обучения:
Знать строение атома, значение порядкового номера (физический смысл), состав атомного ядра, определение изотопов.
Знать 3 вида излучений.
Уметь описывать химический элемент с точки зрения положения в ПСХЭ и составе ядра.
Тип урока: изучения и первичного закрепления нового материала.
ПСХЭ Д.И.Менделеева, опорный конспект (на каждый стол) (приложение 1), карточки с заданиями (приложение 2), мультимедиа проектор, экран , презентация по теме урока(приложение 3).
Девизом нашего урока могут служить слова небезызвестного Козьмы Пруткова:
Целью нашего урока является расширение ваших знаний по строению атома, полученных на уроках физики, знакомство с составом ядра, понятиями: протон, нейтрон, изотоп. Вы получите представление о явлении радиоактивности и о биологическом влиянии радиоактивности на организм человека.
Прежде чем перейти к новой теме мы напишем Х/д (Химический диктант)
- Найди элемент по адресу, укажи его порядковый номер
(использовать ПСХЭ Д.И.Менделеева),
- 2период, 5группа главная(азот)
- 2период, 3группа главная(бор)
- 3период, 2группа главная(магний)
- 5период, 2группа побочная(кадмий)
- 2период, 7группа главная(фтор)
- 4период, 3группа побочная(скандий)
- 4период, 6группа побочная(хром)
- 4 период,4группа главная(германий)
- 4период, 4группа побочная(титан)
- 7период, 1группа главная(франций)
Оценить себя по следующему эталону:
-одна ошибка – оценка 4
-две ошибки – оценка 3
-более трех ошибок – тема не усвоена, посетить дополнительное занятие.
По ходу объяснения делайте записи в опорном конспекте, или выделяйте цветом, то что необходимо запомнить.
2*В 1879 году английский ученый Уильям Крукс открыл катодные лучи – поток быстролетящих отрицательно заряженных частиц, размеры которых были меньше самого маленького атома водорода, по вызываемой ими люминесценции. В 1891 году Д.Стонэй предложил назвать открытые частицы электронами.
3*В 1895 году немецкий ученый Уильям Конрад Рентген обнаружил новый вид излучения, обладающего большой проникающей способностью, и назвал их Х-лучами. Таинственные лучи засвечивали фотопластинку, завернутую в черную бумагу. Несколько позднее было установлено, что Х-лучи представляют собой электромагнитные колебания с очень малой длиной волны. В настоящее время рентгеновские лучи широко используются в различных областях науки и техники.
В 1896 году французский ученый Анри Беккерель открыл явление естественной радиоактивности – самопроизвольного распада ядер атомов тяжелых элементов .
В 1898 году Мария и Пьер Кюри, изучавшие явление радиоактивности, открыли новый радиоактивный элемент, названный полонием.
4*Антуан Анри Беккерель, а также Мария Склодовская-Кюри и Пьер Кюри обнаружили, что при распаде атомы испускают три типа лучей, которые получили свои названия по трем первым буквам греческого алфавита : α, β, γ.
Эти три вида излучения очень сильно отличаются друг от друга по проникающей способности, т.е. по тому, насколько интенсивно они поглощаются различными веществами .
5*Главным итогом совершенных открытий было ясное осознание того, что атом не является мельчайшей частицей вещества, он имеет сложное строение. Было предложено несколько гипотез – моделей строения атома. Большинство из них основывалось на предположениях, что атом, оставаясь в целом электронейтральным, представляет собой совокупность положительно и отрицательно заряженных частиц.
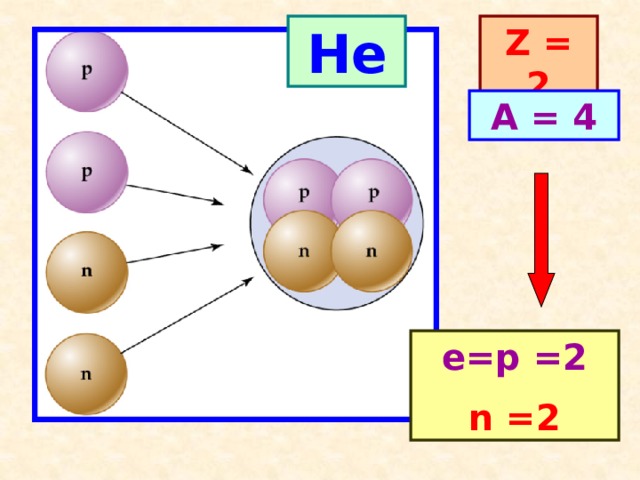
В 1911 г Э.Резерфорд на основе своих исследований (известных вам из курса физики) предложил планетарную модель атома. Исследователь привел неоспоримые доказательства того, что атомы состоят из трех типов элементарных частиц: протонов, нейтронов и электронов.
6* (планетарная модель атома) Мы видим, что протоны и нейтроны составляют ядро, которое находится в центре атома. Ядро занимает очень небольшую часть объема атома, но в нем сосредоточена практически вся масса атома. Протоны имеют положительный заряд, а нейтроны не имеют заряда, они - нейтральны.
Вокруг ядра движутся электроны - частицы с отрицательным зарядом. Их движение ограничено сферическим пространством вокруг ядра.
Английский ученый доказал, что порядковый номер элемента в ПСХЭ Д.И.Менделеева совпадает:

Дж. Дж. Томсон в 1898 году предложил модель атома в виде положительно заряженного шара радиусом 10 -10 м, в котором плавают электроны, нейтрализующие положительный заряд.
В 1895 году немецкий учёный Уильям Конрад Рентген обнаружил новый вид невидимых лучей, способных беспрепятственно проходить через твердые тела и вызывать почернение фотоплёнки. Рентген назвал их Х-лучами .

В 1898 году Пьер Кюри и Мария Склодовская – Кюри , изучавшие явление радиоактивности, открыли новые элементы – полоний и радий.

Английский физик Эрнест Резерфорд в 1909 г. открыл ядро атома
Опыт Резерфорда : поток ά-частиц, излучаемый радиоактивным источником, через узкую щель направлялся на тонкую золотую фольгу; при помощи флюоресцирующего экрана проводилась регистрация ά-частиц, которые в отсутствии фольги двигались узким пучком, вызывая на экране яркую вспышку
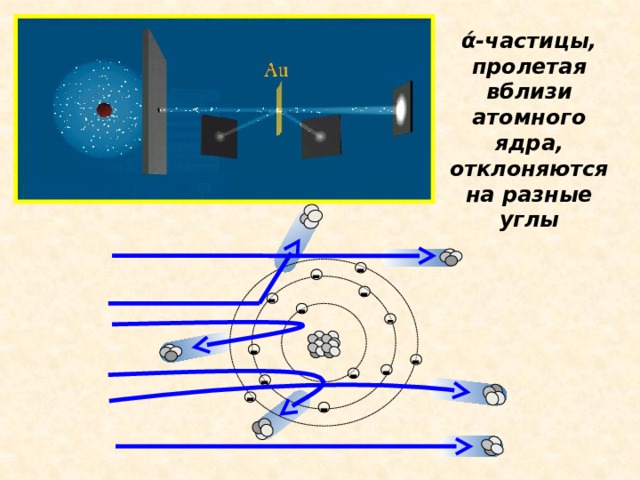
ά-частицы, пролетая вблизи атомного ядра, отклоняются на разные углы

Э. Резерфорд предложил планетарную модель атома : в центре находится положительно заряженное ядро, которое имеет достаточно малые размеры, но в нём заключена почти вся масса атома; вокруг ядра по круговым орбитам движутся отрицательно заряженные электроны, подобно движению планет вокруг солнца.
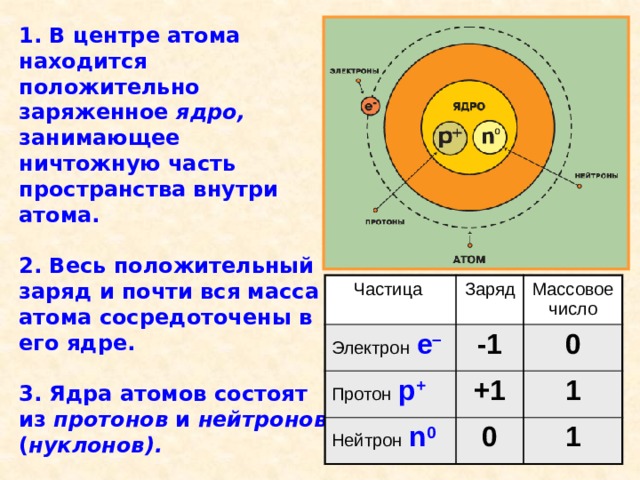
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре.
3. Ядра атомов состоят из протонов и нейтронов ( нуклонов).
4. Вокруг ядра по замкнутым орбитам вращаются электроны .
Электрон е –
Протон р +
Нейтрон n 0

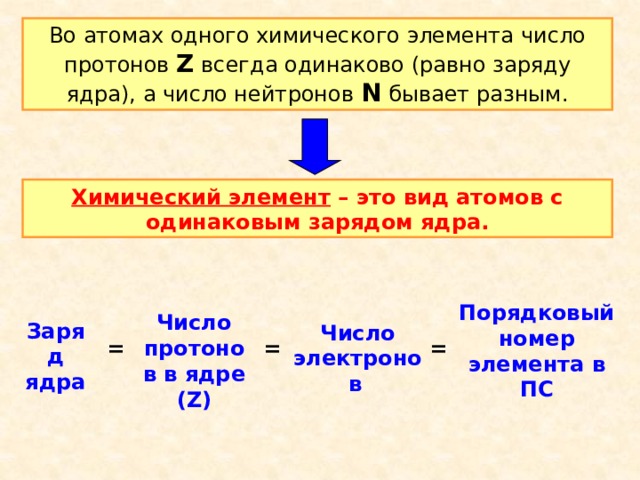
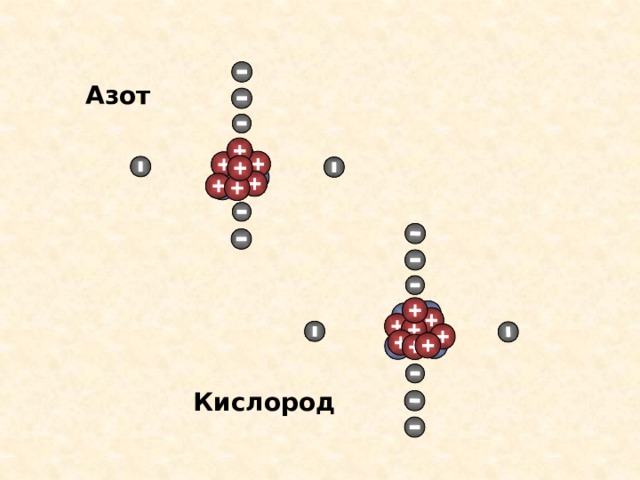
Во атомах одного химического элемента число протонов Z всегда одинаково (равно заряду ядра), а число нейтронов N бывает разным.
Химический элемент – это вид атомов с одинаковым зарядом ядра.
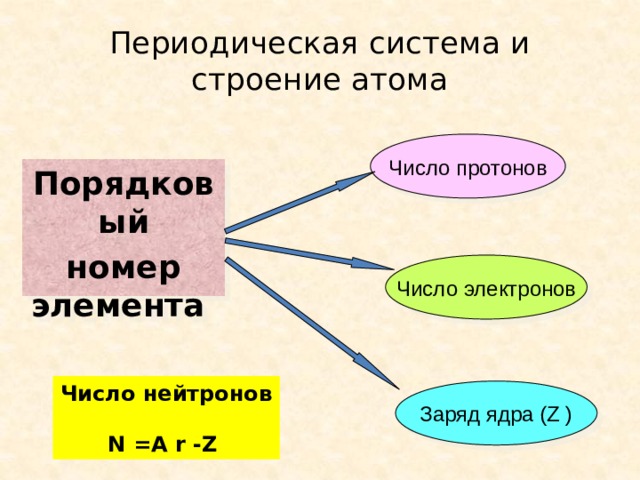
Порядковый номер элемента в ПС
Число протонов в ядре (Z)
Число электронов
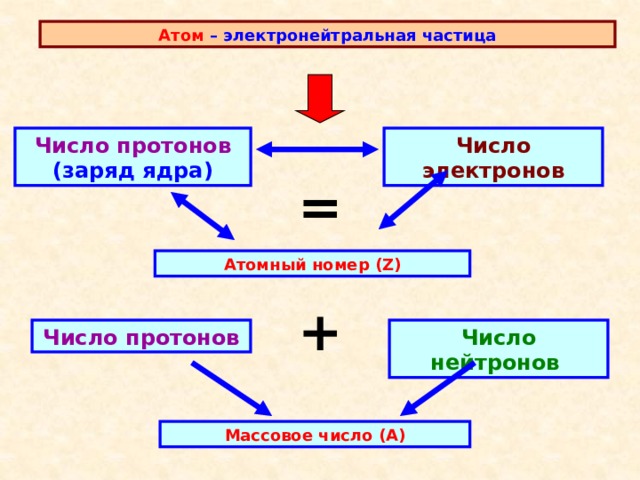
Атом – электронейтральная частица
Число протонов (заряд ядра)
Число электронов
Атомный номер (Z)
Число нейтронов
Число протонов
Массовое число (А)
Периодическая система и строение атома
номер элемента
Число нейтронов

Современная формулировка Периодического закона
Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от зарядов атомных ядер
В 1913 г. английский физик Г. Мозли установил, что положительный заряд ядра атома равен порядковому номеру элемента в периодической системе Д. И. Менделеева.
Каждый протон имеет заряд +1, поэтому заряд ядра равен числу протонов. Атом является электронейтральной частицей, поэтому число протонов равно числу электронов. Следовательно:

Например, элемент железо имеет порядковый номер 26. Следовательно, заряд ядра атома железа равен +26, т.е. ядро содержит 26 протонов, а вокруг ядра движутся 26 электронов.

Данные этой таблицы показывают, что масса протона, как и масса нейтрона, приблизительно в 1840 раз больше массы электрона. Протоны и нейтроны находятся в ядре, поэтому масса атома почти равна массе ядра. Масса ядра, как и масса атома, определяется суммой числа протонов и числа нейтронов. Эта сумма называется массовым числом атома.


Атомы изотопов одного элемента имеют одинаковое число протонов ( Z ) и отличаются друг от друга числом нейтронов ( N ).
Изотопы обозначаются символами соответствующих элементов, слева от которых вверху записывают массовое число изотопа, а внизу – порядковый номер (заряд ядра атома) элемента. Например:


Относительная атомная масса элемента Аr, которая приводится в периодической системе, - это средняя величина массовых чисел природных изотопов этого элемента с учетом процентного содержания каждого изопота.

Химические свойства всех изотопов одного элемента одинаковы. Следовательно, химические свойства элемента зависят не от атомной массы, а от заряда ядра.
Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атома, или порядкового номера элемента.

1. Каково процентное содержание изотопов 35 С1 и 37 С1 в природном хлоре, имеющем относительную молекулярную массу 70,90? Предложите способы выделения чистых веществ 35 С12 и 37 С12 из природного хлора и его соединений.
Решение : Примем за х процентное содержание изотопа 35 Сl:
35x +37(100-x) =35,45; x=77,5. Тогда 77,5% 35 Сl и 22,5% 37 Сl.
Способы разделения изотопов:
- основанные на различии в массе (центрифугирование и т. п.);
- основанные на различном отношении массы к заряду (для ионов, по типу масс-спектрометрии и т. п.);
- основанные на изотопном эффекте в химических процессах (кинетические).
2. Медь имеет два изотопа с массовыми числами 63 и 65. Массовая доля их в природной меди составляет соответственно 73% и 27%. На основании этих данных рассчитайте среднюю относительную атомную массу природной меди.




1. Чему равен заряд ядра и число электронов в атомах следующих элементов: углерод, сера, медь, барий, серебро.
6. Чему равен порядковый номер элемента, массовое число одного из изотопов которого равно 31, а число нейтронов равно 16.
7. Сколько электронов и протонов входит в состав атома элемента, который находится в 5-м периоде и в побочной подгруппе VI группы.
8. Сколько электронов и протонов входит в состав атома элемента, который находится в 4-м периоде и в главной подгруппе III группы.
9. Медь имеет два изотопа: 63 Cu и 65 Cu . Молярные доли их в природной меди составляют 73 и 27% соответственно. Определите среднюю относительную атомную массу меди.
10. Определите относительную атомную массу элемента кремния, если он состоит из трех изотопов: 28 Si (молярная доля 92,3%), 29 Si (4,7%), 30 Si (3,0%).
Ключевые слова конспекта: строение атома, элементарные частицы, протоны и электроны в атомах, атомный номер, массовой число, число нейтронов, нуклид, изотопы, ионы, катионы, заряд иона.
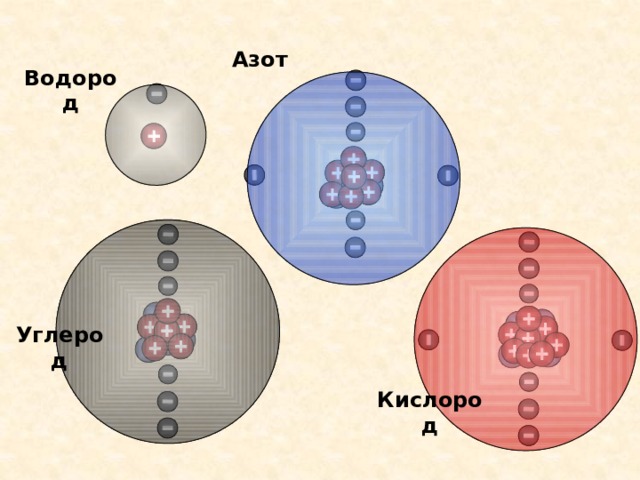
Согласно модели Резерфорда каждый атом состоит из находящегося в его центре ядра и электронной оболочки. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре. Электроны движутся вокруг ядра. Число электронов атома равно положительному заряду ядра.
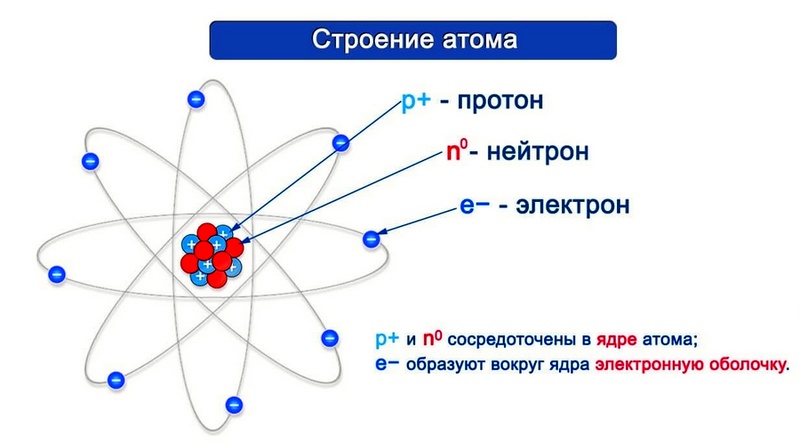
Диаметр атома 10 -10 м, диаметр ядра 10 -14 – 10 -15 м. Масса атома водорода равна 1,67 • 10 -24 г, атома углерода — 1,99 • 10 -23 г, атома железа — 9,29 • 10 -23 г.
Элементарные частицы — это протоны, электроны и нейтроны, из них состоят все атомы.
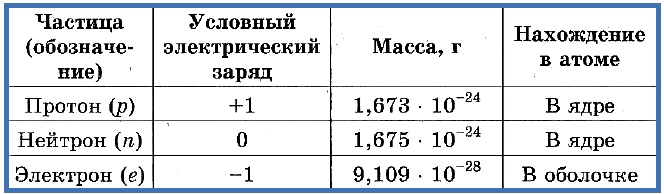
Число протонов разное у атомов различных видов, оно определяет заряд ядра атома и равно атомному номеру элемента в таблице Менделеева. Поскольку атом — электро-нейтральная частица, число электронов в нем равно числу протонов.
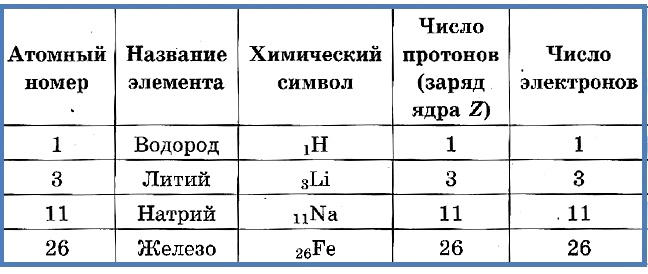
Атомный номер указывают слева внизу от символа элемента, например: 1Н, 26Fe. Обозначение атомного номера — прописная латинская буква Z.
Массовое число атома А — это сумма чисел его протонов и нейтронов в ядре. Массовое число указывают слева вверху от символа элемента или добавляют к названию элемента через дефис, например: 23 Na или натрий-23.
Массовое число кислорода, А( 16 О) = 16 = (8р + 8n).
Число нейтронов N в ядре атома определяют по формуле: N = A — Z. Например, для атома натрия с массовым числом 23, 23 Na: А = 23, Z = 11, N = А – Z = 23 — 11 = 12.
Нуклид — это вид атомов с определенным числом протонов и нейтронов в ядре. Например, в природе встречается три вида нуклидов кислорода: 16 О, 17 О и 18 О.
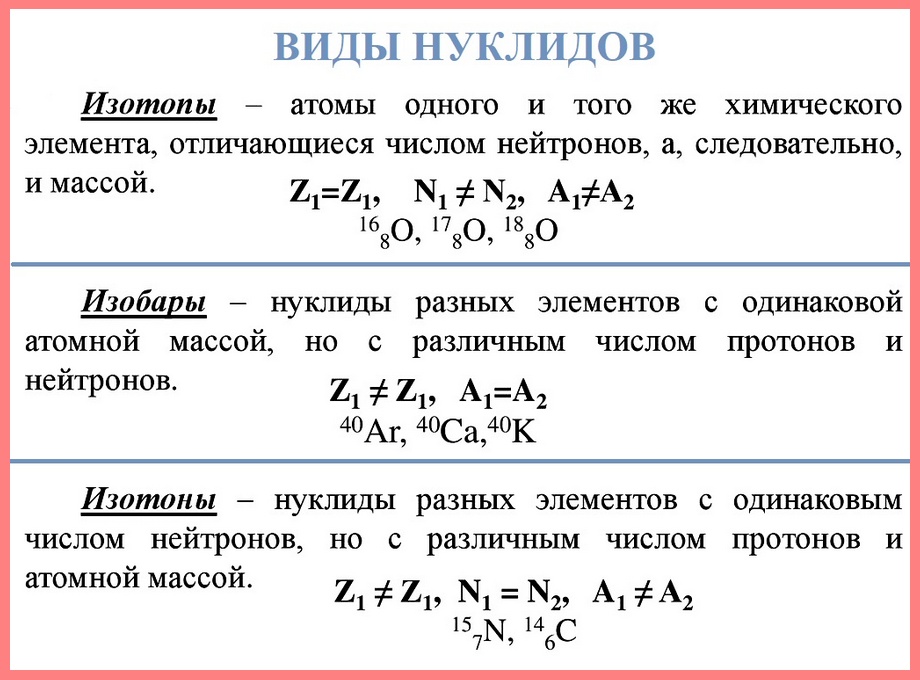
Изотопы — это атомы одного вида с одинаковым числом протонов, но разным числом нейтронов. Так, атомы 16 О, 17 О и 18 О — это изотопы. Природные изотопы урана — 234 U, 235 U и 238 U.
Ионы — заряженные частицы, образующиеся при отщеплении от нейтральных атомов или присоединении к ним электронов. Ионы образуются также из молекул в результате присоединения протона Н + (NH3 → NH4 + ) или отщепления Н + (HNO3 -> NO3 – ).

Катионы — это положительно заряженные ионы (Na + , Аl 3+ ), анионы — отрицательно заряженные ионы (Cl – , NO3 – ).
Заряд иона указывают в виде индекса справа вверху от символа химического элемента: Li + , Са 2+ . На первом месте пишут цифру, на втором — знак заряда. Цифру 1 не пишут.
Читайте также:

