Соли в свете теории электролитической диссоциации конспект
Обновлено: 06.07.2024
Цель урока: изучить свойства солей в свете теории электролитической диссоциации.
1. Образовательная: повторить и закрепить полученные знания об основаниях и химических свойствах солей в свете теории электролитической диссоциации.
2. Развивающая: развивать у учащихся интерес к химии, раскрывать практическую направленность науки химии, связь ее с другими науками, развивать наблюдательность, развитие познавательных способностей, мышления, внимания, умения использоваться изученным материалом для познания нового.
3. Воспитательная: воспитание самостоятельности, сотрудничества, способности к взаимовыручке.
Тип урока: комбинированный.
Оборудование: экран, компьютер, мультимедиа проектор, учебники, рабочие тетради, инструкция к лабораторном опытам №5, презентация (приложение 1).
Реактивы: лабораторное оборудование и растворы: соляной кислоты, гидроксида натирия и калия, хлорида железа (III), сульфата меди (II), нитрата серебра, сульфата натрия, ортофосфата натрия, хлорида натрия; металлы: медь, цинк, железо.
1. Организационный момент (сообщить тему, цель и план урока – слайд №1).
2. Фронтальный опрос
Предполагаемые ответы учащихся
Что такое основание в свете теории электролитической диссоциации?
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуютcя только гидроксид-ионы.
Задание 1: Выберите тот ряд, в котором находятся только основания и дайте им названия.
Задание 3. С какими из перечисленных веществ реагирует раствор гидроксида натрия?
1. Гидроксид калия
3. Серная кислота
7. Оксид углерода (IV)
8. Соляная кислота
10. Раствор фенолфталеина
Запишите молекулярные и ионные уравнения возможных реакций.
2Na + +2OH - +2 H + + SO4 2- → 2Na + +
3) NaOH + HCl → NaCl + H2O
Na + +OH - + H + + Cl - → Na + +Cl - + H2O
4) NaOH + фенолфталеин → окраска малиновая
1) NaOH + HCl → NaCl + H2O
Na + +OH - + H + + Cl - → Na + + Cl - + H2O
OH - + H + → H2O (фенолфталеин бесцветный)
NaOH + фенолфталеин → окраска малиновая
3) Изучение свойств солей в свете электролитической диссоциации
Что такое соли в свете электролитической диссоциации?
Солями называют электролиты, которые при диссоциации образую катионы металлов и катионы аммония и анионы кислотных остатков.
Классификация солей по составу
Многие соли применяют в быту (поваренная соль, сода), в качестве минеральных удобрений, при производстве стекла, моющих средств, взрывчатых веществ.
(в приложении 3, приложении 4 и приложении 5– инструкция к выполнению лабораторного опыта).
Химические свойства солей
Наблюдения и признаки реакций
Уравнения химических реакций
Химические свойства щелочей (растворимых оснований) (слайд №9)
Взаимодействие солей с металлами.
II образуется медь
III образуется медь
Взаимодействие солей с растворами щелочей
1 – не идет реакция до конца
2, 3 – выпадают осадки
3Na + +3OH - + Fe 3+ +3Cl - → Fe(OH)3↓ + 3 Na + +3Cl -
Взаимодействие солей с кислотами.
Выделение газообразного вещества.
2 Na + + CO3 2- + 2H + + 2Cl - →
→ 2 Na + + 2Сl - + H2O
Взаимодействие солей с солями
Выпадение различных осадков солей
Ag + + NO3 - + Na + + Cl - → AgCl ↓+
Изменяют ли соли окраску индикаторов?
Изменяют, но не все
4. Итог урока
1) солями называют электролиты, которые при диссоциации образую катионы металлов и катионы аммония и анионы кислотных остатков;
2) соли взаимодействуют с более активными металлами, чем металл, входящий в состав данной соли; с кислотами, со щелочами и с другими солями.
3) при изучении химических свойств солей мы получали новые соли (4 способа), а существует 10 получения солей.
5. Домашнее задание: § 11, задание по карточке, письменное задание на стр. 46 (по способам получения солей).
С точки зрения теории электролитической реакциисоли - это вещества, которые в водном растворе диссоциируют с образованием катионов основания и анионов кислотного остатка.
В общем виде уравнение электролитической диссоциации солей имеет следующий вид:
Соль -> Катион основания + Анион кислотного остатка
| BaCl2 Ba 2+ + 2Cl - K2CO3 K + + CO3 2- |
Рассмотрим классификацию солей.
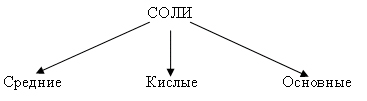
Средние соли – продукт полного замещения атомов водорода на металл
Названия кислых солей образуются из названий солей с добавлением слова “гидро”
NaHCO3 – гидрокарбонат натрия
KHSO4 – гидросульфат калия
Ca(HCO3)2 – гидрокарбонат кальция
Основные соли – продукт неполного замещения гидроксогруппы в основании на кислотный остаток. Название
солей образуется от названия соли с добавлением слова “гидроксо”.
CaOHCl – гидроксохлорид кальция
Химические свойства солей


Вычислите, сколько граммов 10% -х растворов исходных солей потребуется для получения 75 г карбоната кальция.

Данный конспект урока позволяет углубить знания учащихся по теме: "Соли" и рассмотреть их с точки зрения электролитической диссоциации.
Урок№ 49. химия 8 класс
систематизировать знания учащихся по классу солей. Получить представление о химических свойствах солей в свете теории электролитической диссоциации;
продолжить формирование навыков составления формул и названий солей, ионных уравнений реакций;
продолжить формирование познавательного интереса к предмету через использование нестандартных форм обучения и создание ситуации успеха;
продолжить работу над повышением стремления к самоактуализации;
обучать аргументировано защищать свою точку зрения;
развитие коммуникабельных способностей;
продолжить развитие учебно-интелектуальных, учебно-познавательных, поисково-информационных и учебно-организационных умений.
Набор текстов, листы учёта знаний, растворы BaCl2, H2SO4, NA2CO3, HCl, NaOH, CuSO4; коллекция минералов: малахит, бирюза, минералы группы апатитов, учебник, тетради.
Декларирую четверостишье и обращаюсь к классу с предложением определить тему урока:
Мы часто её за столом встречаем,
Названье её мы сейчас угадаем,
Рассыпать её, говорят, к несчастью,
К обеду иметь, наверное, счастье.
Далее записываем тему урока.
Определяем цели и задачи урока.
Цель: расширить и углубить наши познания о солях, ведь они так важны для человека.
Учащиеся выделяют пункты: I. 1, 4; II. 1, 2, 3; III. 1, 2, 3, 4, 5, 6, 7, 8, 9. Учитель корректирует.
I стадия - Вызов.
Прочтём ещё раз тему урока. Что вы уже знаете об этом?
Каждый ученик вспоминает и записывает в тетрадь всё, что знает о солях (строго индивидуальная работа, 1-2 мин.).
Затем происходит обмен информацией в парах. Ученики делятся друг с другом известными знаниями (групповая работа, 3 мин.).
Далее, каждая группа по цепочке называет какое-то одно сведение или факт, при этом, не повторяя ранее сказанного (составляется список идей).

Цель урока: углубление, систематизация и обобщение знаний учащихся о солях как неорганических соединений в свете теории электролитической диссоциации.
Задачи урока
- дидактические: дать понятие о солях как классе электролитов, изучить классификацию солей по составу и их номенклатуру, научить записывать уравнения диссоциации растворимых в воде солей, изучить общие химические свойства солей в свете ионных представлений;
- развивающие: продолжить развивать умения и навыки в решении проблемных ситуаций, строить гипотезы, находить пути их решения; участвовать в дискуссии и высказывать свое мнение;
- воспитательные: формировать умение выслушать своего собеседника.
Оборудование к уроку: учебник, мультимедийный проектор, ПК, растворы: Na 2 CO 3 HCl , CuSO 4, НС I , BaCl 2 , NaOH , MgSO 4, NH 4 Cl , AgNO 3, NaCl , железные опилки, медная проволока
Организационный момент.
Проверка домашнего задания.
2.1 Проверку домашнего задания проведём в виде тестирования.
1. Выберите формулу серной кислоты
2. Выберите формулу гидроксида кальция
а) Ba ( OH )2, б) NaOH в) KOH г) Ca ( OH )2
3.Выберите формулы, в которых лакмус меняет свой цвет
а) НС I б) H 2 SO 4 в) NaOH г) KOH
4.Выберите формулы, в которых лакмус меняет свой цвет на синий
а) Н2 S б) NaOH в) HNO 3 г) KOH
5. К реакции нейтрализации можно отнести взаимодействие
а)гидроксида калия с серной кислотой
б) гидроксида натрия с сульфатом магния
в ) хлорида меди с гидроксидом бария
2.2 Графический диктант:
Формула серной кислоты – H С l (нет -)
Щелочь – это растворимое в воде основание (да ^)
Кислотным основаниям соответсвует кислота (да ^)
Кислород – это сложное вещество (нет -)
Оксиды, простые вещества (нет - )
Сообщаю: я спешу!
Я живу, пока пишу.
Исчертил всю доску белым…
Исчезаю. Был я .
.
Я, конечно, очень нужен.
Без меня не сваришь ужин,
Не засолишь огурца,
Не заправишь холодца.
Но не только лишь в еде -
Я живу в морской воде.
Если льет слеза из глаза,
Вкус припомнишь мой ты сразу.
Кто догадлив, говорит:
Из предложенного списка выберите формулы солей и дайте им названия:
- А какие бывают соли? Распределите их по классам.
Посмотрите, пожалуйста, на учительский стол, что вы видите? (сода, соль, мел). Как вы думаете, почему они здесь оказались? Да, это все соли, которыми мы пользуемся в быту.
Соли проникают во все сферы человеческой деятельности. Сегодня на уроке вы убедитесь в том, что не менее важно знать химические свойства солей. Цель урока – открыть их.
С веществами каких классов могут взаимодействовать соли?
(кислотами). Давайте проведем эксперимент. Перед вами инструкция по проведению эксперимента.(приложение 1, опыт 1)
(каждому ряду разные задания)
Что вы наблюдаете? В каких случаях протекает реакция? Запишите уравнение в ионном и молекулярном виде. (приложение 1, опыт 2)
Опыт 2. Взаимодействие солей с основаниями. Записать уравнение в ионном и молекулярном виде. (приложение 1, опыт 3)
Опыт 3. Взаимодействие солей друг с другом
Соли еще обладают свойством взаимодействовать с металлами.
Уловие протекания реакций между металлами и растворами солей: Более активный металл вытесняет менее активный из раствора его соли, но должно выполниться условие: образующаяся соль должна быть растворимой. Кроме этого, в водных растворах не используют активные щелочные и щелочноземельные металлы, так как они взаимодействуют с водой раствора, а не с солью.
Предлагаю сделать предположение о том, какие из приведенных схем химических реакций практически осуществимы:
Подведем итоги.С какими классами веществ реагируют соли? Какие признаки химических реакций вы наблюдали? В каких случаях реакции ионного обмена протекают до образования конечных продуктов?
Закрепление. Из данных ионов нужно составить формулы солей так, чтобы они не повторялись.
Na + SO4 2- Na + Cl - Cl - Mg 2+ K + Br -
Из данного набора ионов получаются формулы солей: сульфата натрия, хлорида магния, бромида калия.
Так мы узнаем химический состав воды Мёртвого моря. (немного о Мертвом море, приложение 2)
Домашнее задание. §41, упр. 1-3, 5
Приложение 1
Опыт 1. Взаимодействие солей с кислотами.
В пробирку налейте раствор Na 2 CO 3 и прилейте к нему HCl . Что наблюдаете? Запишите уравнение реакции в ионном виде.
Опыт 2. Взаимодействие солей с основаниями.
В пробирку налейте раствор CuSO 4 и прилейте к нему NaOH . Что наблюдаете? Запишите уравнение реакции в ионном виде.
Опыт 3. Взаимодействие солей друг с другом.
В пробирку налейте раствор CuSO 4 и прилейте к нему NaCl . Что наблюдаете? Запишите уравнение реакции в ионном виде.
Опыт 1. Взаимодействие солей с кислотами.
В пробирку налейте раствор BaCl 2 и прилейте к нему H 2 SO 4/. Что наблюдаете? Запишите уравнение реакции в ионном виде.
Опыт 2. Взаимодействие солей с основаниями.
В пробирку налейте раствор NH 4 Cl и прилейте к нему NaOH . Что наблюдаете? Запишите уравнение реакции в ионном виде.
Опыт 3. Взаимодействие солей друг с другом.
В пробирку налейте раствор NH 4 Cl и прилейте к нему AgNO 3. Что наблюдаете? Запишите уравнение реакции в ионном виде.
Опыт 1. Взаимодействие солей с кислотами.
В пробирку налейте раствор MgSO 4 и прилейте к нему HCl . Что наблюдаете? Запишите уравнение реакции в ионном виде.
Опыт 2. Взаимодействие солей с основаниями.
В пробирку налейте раствор Na 2 SO 4 и прилейте к нему NaOH . Что наблюдаете? Запишите уравнение реакции в ионном виде.
Опыт 3. Взаимодействие солей друг с другом.
В пробирку налейте раствор Na 2 SO 4 и прилейте к нему BaCl 2. Что наблюдаете? Запишите уравнение реакции в ионном виде.
Приложение 2.
Мёртвое мо́ре бессточное солёное озеро между Израилем и Иорданией
Содержание минеральных веществ в воде в среднем составляет 260—270 ‰, иногда до 310 ‰ [8] (для сравнения: в Средиземном море — 40 ‰). Мёртвое море является одним из самых солёных в мире озёр наряду с озером. Здесь не водится рыба и членистоногие, не растут водоросли. Зато человек, оказавшийся в этой воде, не тонет. Да-да, в Мертвом море можно лежать на тихой водной глади и читать журнал, потому что плотная вода не дает погрузиться в ее толщу. Между прочим, плавать тут можно только на спине или на боку. Поплыть на животе не получится, вода будет упорно переворачивать пловца на спину.

Химические свойства
солей в свете ТЭД

1. Выберите формулу серной кислоты
а) H 2 SiO 3 б) H 2 SO 4 в) H 2 SO 3 г) H 2 S
2. Выберите формулу гидроксида кальция
а) Ba(OH) 2 , б) NaOH в) KOH г) Ca(OH) 2
3.Выберите формулы, в которых лакмус меняет свой цвет на красный
а) НСI б) H 2 SO 4 в) NaOH г) KOH
4.Выберите формулы, в которых лакмус меняет свой цвет на синий
а) Н 2 S б) NaOH в) HNO 3 г) KOH
5. К реакции нейтрализации можно отнести взаимодействие
а)гидроксида калия с серной кислотой
б) гидроксида натрия с сульфатом магния
в ) хлорида меди с гидроксидом бария

Из предложенного списка выберите формулы солей и дайте им названия:
CO 2, Ca(OH) 2 , CaOHNO 3, Na 2 SO 4, Na 2 SO 4 , KHSO 4 , H 2 CO 3 , Ba(NO 3 ) 2 , AlOHCl 2 , NaCl, (NH 4 ) 2 СO 3 .
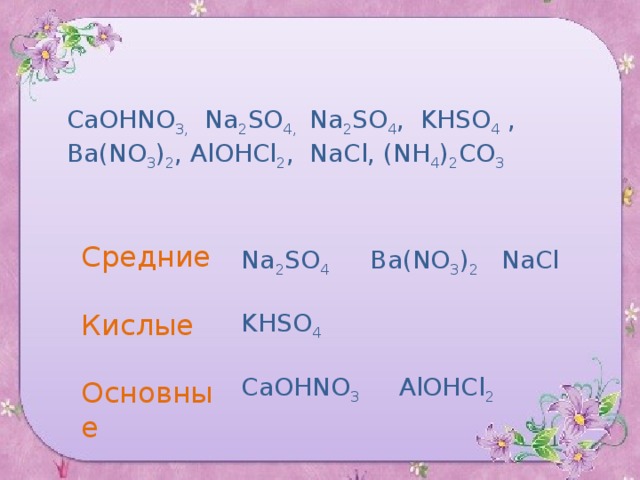
CaOHNO 3, Na 2 SO 4, Na 2 SO 4 , KHSO 4 , Ba(NO 3 ) 2 , AlOHCl 2 , NaCl, (NH 4 ) 2 СO 3
Na 2 SO 4 Ba(NO 3 ) 2 NaCl
CaOHNO 3 AlOHCl 2


Из данных ионов нужно составить формулы солей так, чтобы они не повторялись.
Na + SO4 2- Na + Cl - Mg 2+ Cl - K + Br -

Какие из приведенных схем химических реакций практически осуществимы:
Na 2 SO4 MgCl 2 KBr




-75%
Читайте также:

