Растворение как физико химический процесс конспект
Обновлено: 07.07.2024
Рассмотрим процесс растворения веществ.
Например, если мы добавляем в чай сахар, то можем наблюдать, как количество твердого вещества постепенно уменьшается. Если чай холодный, то сахар растворяется медленно. Наоборот, если чай горячий и размешивается ложечкой, то растворение происходит быстро. Попадая в воду, молекулы сахара, находящиеся на поверхности кристаллов сахарного песка, образуют связи с молекулами воды. При этом с одной молекулой сахара связывается несколько молекул воды. Тепловое движение молекул воды заставляет связанные с ними молекулы сахара отрываться от кристалла и переходить в толщу молекул растворителя. Молекулы сахара, перешедшие из кристалла в раствор, могут передвигаться по всему объему раствора вместе с молекулами воды благодаря диффузии. Если раствор нагреть или перемешивать, то диффузия происходит интенсивнее и растворение сахара проходит быстрее. Молекулы сахара распределяются равномерно и раствор становится одинаково сладким по всему объему.
Вещества при растворении не меняются, после выпаривания растворов мы можем получить растворенное вещество в твердом состоянии. При растворении разрушается кристаллическая решетка растворенного вещества и ее частицы перемещаются в растворе, следовательно, растворение - это физический процесс. Для осуществления такого процесса необходимо затратить энергию.
Но когда молекулы растворенного вещества связываются с молекулами воды, то фактически образуются новые химические соединения. Эти молекулярные ассоциаты не имеют постоянного состава. Их общее название - гидраты. Процесс связывания веществ с водой называется гидратацией. При выпаривании растворов происходит разрушение гидратов и образования кристаллического вещества. Однако некоторые вещества способны образовывать устойчивые гидраты, которые могут содержать воду даже в кристаллическом состоянии. Такие вещества называются кристаллогидратов. Их можно выделить из раствора, осторожно выпаривая воду. В формулах таких веществ кристаллизационная вода указывается после формулы соединения со знаком умножения. Например: CuSO4 ·5H2O - медный купорос, FeSO4 · 7H2O - железный купорос. Образование гидратов, т.е. новых веществ, свидетельствует, что растворение - химический процесс.
Разобраться в сущности процесса растворения помогает изучение тепловых явлений, происходящих при этом. Известно, что одним из признаков химических реакций является выделение теплоты, а для физических явлений необходимо тратить энергию. Растворения серной кислоты сопровождается сильным разогревом раствора. Это результат химического взаимодействия между молекулами воды и растворенного вещества - гидратация сопровождается выделением энергии. А растворения нитрата аммония сопровождается охлаждением раствора. В этом случае на физический процесс разрушения кристаллической решетки тратится больше энергии, чем образуется при получении гидратов.
Приведенные факты говорят о том, что растворение следует считать физико-химическим процессом.
Домашнее задание: параграф 34 , упр.2
выучить определения
Электролиты и неэлектролиты .
Электролитическая диссоциация
Электролиты – это вещества, растворы или расплавы которых проводят электрический ток.
Неэлектролиты – это вещества, растворы или расплавы которых не проводят электрический ток.
Электролитическая диссоциация – это распад электролита на свободно перемещающиеся ионы при растворении его в воде или при плавлении.
Электролиты при растворении в воде или
расплавлении распадаются(диссоциируют) на ионы – положительно (катионы) и отрицательно(анионы) заряженные частицы.

Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома - это простые ионы (Na + , Mg 2+ , Аl 3+ и т.д.) - или из нескольких атомов - это сложные ионы (NО3 - , SO 2- 4, РО З- 4 и т.д.).
В растворах и расплавах электролиты проводят электрический ток.
Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные - к аноду. Поэтому первые называются катионами, вторые - анионами. Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
| ВЕЩЕСТВА | |
| ЭЛЕКТРОЛИТЫ | НЕЭЛЕКТРОЛИТЫ |
| Электролиты – это вещества, водные растворы или расплавы которых проводят электрический ток | Неэлектролиты – это вещества, водные растворы или расплавы которых не проводят электрический ток |
| Вещества с ионной химической связью или ковалентной сильнополярной химической связью – кислоты, соли, основания | Вещества с ковалентной неполярной химической связью или ковалентной слабополярной химической связью |
| В растворах и расплавах образуются ионы | В растворах и расплавах не образуются ионы |
Диссоциация - обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической диссоциации вместознака равенства ставят знак обратимости. Например, уравнение диссоциации молекулы электролита КA на катион К + и анион А - в общем виде записывается
Домашнее задание: параграф 35, упр. 1,4,5,выучить определения
Основные положения ТЭД.
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные и отрицательные.
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные частицы движутся к катоду, отрицательно заряженные – к аноду. Поэтому положительно заряженные частицы называются катионами, а отрицательно заряженные – анионами.
3. Направленное движение происходит в результате притяжения их противоположно заряженными электродами (катод заряжен отрицательно, а анод – положительно).
4. Ионизация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов в молекулы (ассоциация).
Основываясь на теории электролитической диссоциации, можно дать следующие определения для основных классов соединений:
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода. Например,
HCl → H + + Cl - ;
CH3COOH H + + CH3COO - .
Основность кислоты определяется числом катионов водорода, которые образуются при диссоциации. Так, HCl, HNO3 – одноосновные кислоты, H2SO4, H2CO3 – двухосновные, H3PO4, H3AsO4 – трехосновные.
Основаниями называют электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. Например,
Растворимые в воде основания называются щелочами.
Кислотность основания определяется числом его гидроксильных групп. Например, KOH, NaOH – однокислотные основания, Ca(OH)2 – двухкислотное, Sn(OH)4– четырехкислотное и т.д.
Солями называют электролиты, при диссоциации которых образуются катионы металлов (а также ион NH4 + ) и анионы кислотных остатков. Например,
CaCl2→ Ca 2+ + 2Cl - ,
NaF → Na + + F - .
Электролиты, при диссоциации которых одновременно, в зависимости от условий, могут образовываться и катионы водорода, и анионы – гидроксид-ионы называются амфотерными. Например,
Домашнее задание: параграф 36,упр. 2-5, выучить определения
Растворение – это процесс равномерного распределения одного вещества в другом, при котором растворяемое вещество переходит в агрегатное состояние растворителя
Раствор – это химическая система, образованная несколькими веществами, между которыми нет поверхностей раздела.
Физическая теория растворов:
Растворение – это процесс диффузии, растворы – это однородные смеси
Химическая теория растворов:
Растворение – это процесс химического взаимодействия растворяемого вещества с водой – гидратация, растворы – соединения гидраты
Рассмотрим процесс растворения веществ.
Например, если мы добавляем в чай сахар, то можем наблюдать, как количество твердого вещества постепенно уменьшается. Если чай холодный, то сахар растворяется медленно. Наоборот, если чай горячий и размешивается ложечкой, то растворение происходит быстро. Попадая в воду, молекулы сахара, находящиеся на поверхности кристаллов сахарного песка, образуют связи с молекулами воды. При этом с одной молекулой сахара связывается несколько молекул воды. Тепловое движение молекул воды заставляет связанные с ними молекулы сахара отрываться от кристалла и переходить в толщу молекул растворителя. Молекулы сахара, перешедшие из кристалла в раствор, могут передвигаться по всему объему раствора вместе с молекулами воды благодаря диффузии. Если раствор нагреть или перемешивать, то диффузия происходит интенсивнее и растворение сахара проходит быстрее. Молекулы сахара распределяются равномерно и раствор становится одинаково сладким по всему объему.
Вещества при растворении не меняются, после выпаривания растворов мы можем получить растворенное вещество в твердом состоянии. При растворении разрушается кристаллическая решетка растворенного вещества и ее частицы перемещаются в растворе, следовательно, растворение - это физический процесс. Для осуществления такого процесса необходимо затратить энергию.
Но когда молекулы растворенного вещества связываются с молекулами воды, то фактически образуются новые химические соединения. Эти молекулярные ассоциаты не имеют постоянного состава. Их общее название - гидраты. Процесс связывания веществ с водой называется гидратацией. При выпаривании растворов происходит разрушение гидратов и образования кристаллического вещества. Однако некоторые вещества способны образовывать устойчивые гидраты, которые могут содержать воду даже в кристаллическом состоянии. Такие вещества называются кристаллогидратов. Их можно выделить из раствора, осторожно выпаривая воду. В формулах таких веществ кристаллизационная вода указывается после формулы соединения со знаком умножения. Например: CuSO4 ·5H2O - медный купорос, FeSO4 · 7H2O - железный купорос. Образование гидратов, т.е. новых веществ, свидетельствует, что растворение - химический процесс.
Разобраться в сущности процесса растворения помогает изучение тепловых явлений, происходящих при этом. Известно, что одним из признаков химических реакций является выделение теплоты, а для физических явлений необходимо тратить энергию. Растворения серной кислоты сопровождается сильным разогревом раствора. Это результат химического взаимодействия между молекулами воды и растворенного вещества - гидратация сопровождается выделением энергии. А растворения нитрата аммония сопровождается охлаждением раствора. В этом случае на физический процесс разрушения кристаллической решетки тратится больше энергии, чем образуется при получении гидратов.
Приведенные факты говорят о том, что растворение следует считать физико-химическим процессом.
Домашнее задание: параграф 34 , упр.2
выучить определения
Электролиты и неэлектролиты .
Электролитическая диссоциация
Электролиты – это вещества, растворы или расплавы которых проводят электрический ток.
Неэлектролиты – это вещества, растворы или расплавы которых не проводят электрический ток.
Электролитическая диссоциация – это распад электролита на свободно перемещающиеся ионы при растворении его в воде или при плавлении.
Электролиты при растворении в воде или
расплавлении распадаются(диссоциируют) на ионы – положительно (катионы) и отрицательно(анионы) заряженные частицы.
Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома - это простые ионы (Na + , Mg 2+ , Аl 3+ и т.д.) - или из нескольких атомов - это сложные ионы (NО3 - , SO 2- 4, РО З- 4 и т.д.).
В растворах и расплавах электролиты проводят электрический ток.
Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные - к аноду. Поэтому первые называются катионами, вторые - анионами. Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
| ВЕЩЕСТВА | |
| ЭЛЕКТРОЛИТЫ | НЕЭЛЕКТРОЛИТЫ |
| Электролиты – это вещества, водные растворы или расплавы которых проводят электрический ток | Неэлектролиты – это вещества, водные растворы или расплавы которых не проводят электрический ток |
| Вещества с ионной химической связью или ковалентной сильнополярной химической связью – кислоты, соли, основания | Вещества с ковалентной неполярной химической связью или ковалентной слабополярной химической связью |
| В растворах и расплавах образуются ионы | В растворах и расплавах не образуются ионы |
Диссоциация - обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической диссоциации вместознака равенства ставят знак обратимости. Например, уравнение диссоциации молекулы электролита КA на катион К + и анион А - в общем виде записывается
Домашнее задание: параграф 35, упр. 1,4,5,выучить определения
Основные положения ТЭД.
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные и отрицательные.
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные частицы движутся к катоду, отрицательно заряженные – к аноду. Поэтому положительно заряженные частицы называются катионами, а отрицательно заряженные – анионами.
3. Направленное движение происходит в результате притяжения их противоположно заряженными электродами (катод заряжен отрицательно, а анод – положительно).
4. Ионизация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов в молекулы (ассоциация).
Основываясь на теории электролитической диссоциации, можно дать следующие определения для основных классов соединений:
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода. Например,
HCl → H + + Cl - ;
CH3COOH H + + CH3COO - .
Основность кислоты определяется числом катионов водорода, которые образуются при диссоциации. Так, HCl, HNO3 – одноосновные кислоты, H2SO4, H2CO3 – двухосновные, H3PO4, H3AsO4 – трехосновные.
Основаниями называют электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. Например,
Растворимые в воде основания называются щелочами.
Кислотность основания определяется числом его гидроксильных групп. Например, KOH, NaOH – однокислотные основания, Ca(OH)2 – двухкислотное, Sn(OH)4– четырехкислотное и т.д.
Солями называют электролиты, при диссоциации которых образуются катионы металлов (а также ион NH4 + ) и анионы кислотных остатков. Например,
CaCl2→ Ca 2+ + 2Cl - ,
NaF → Na + + F - .
Электролиты, при диссоциации которых одновременно, в зависимости от условий, могут образовываться и катионы водорода, и анионы – гидроксид-ионы называются амфотерными. Например,


В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Растворение как физико-химический процесс. Растворимость. Типы растворов"
В каждой нашей клеточке напоминание о зарождении жизни. По нашим сосудам: артериям, венам и капиллярам тоже течет раствор, где содержание солей около 0,9%. Плазма крови, желудочный сок тоже являются растворами. Все физико-химические процессы, происходящие в живых организмах, протекают тоже в растворах. Природные водные растворы участвуют в почвообразовании и снабжают растения питательными веществами. Многие технологические процессы также протекают в растворах (получение бумаги, красок, металлов, удобрений, продуктов питания).
Растворы в организме человека
Растворы в промышленности

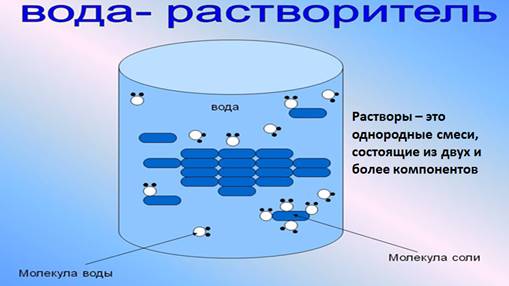
Растворы – это однородные смеси, состоящие из двух и более компонентов.
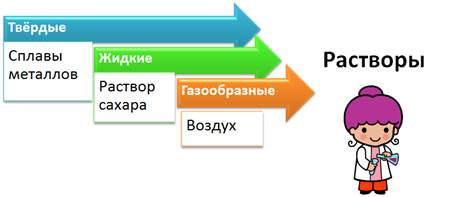
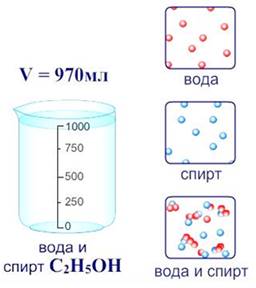
По агрегатному состоянию растворы делят на: твердые (например, сплавы металлов), жидкие (раствор сахара), газообразные (смесь газов – воздух). Наиболее распространены жидкие растворы.
Растворы состоят из растворителя и растворенного вещества (твердого, жидкого или газообразного). Растворителем может быть вода, тогда раствор является водным, а также бензин, эфир, спирт.

Как происходит растворение веществ?
Сторонники физической теории растворов, как Вант-Гофф, Аррениус, Оствальд, считали, что процесс растворения является результатом диффузии, т.е. проникновения молекул растворенного вещества между молекулами воды.
Сторонники химической теории растворов, одним из которых был Д. И. Менделеев, считали, что растворение является химическим взаимодействием растворенного вещества и воды.
В настоящее время принята физико-химическая теория растворов, которую ещё в 1906 г. предсказывал Д. И. Менделеев. Поэтому растворение является физико-химическим процессом.
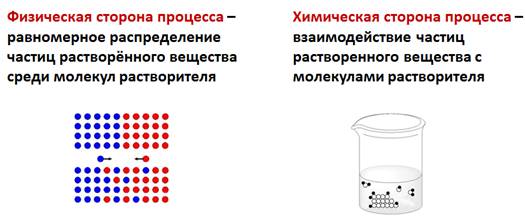
Физическая сторона процесса заключается в разрушении кристаллической решетки вещества и равномерном распределении, по принципу диффузии, частиц растворенного вещества среди молекул растворителя. Химическая сторона процесса проявляется во взаимодействии частиц растворенного вещества с молекулами растворителя.
В результате взаимодействия растворенного вещества и воды образуются гидраты. Растворение сопровождается тепловыми эффектами: при растворении серной кислоты воду добавляют к кислоте, из-за сильного разогревания раствора, т.е. теплота выделяется, а при растворении нитрата аммония, хлорида натрия, теплота, наоборот, поглощается.
Кроме гидратов есть еще кристаллогидраты, т.е. это кристаллические вещества, содержащие молекулы воды. Вода, входящая в их состав – кристаллизационная. Примером кристаллогидратов служит медный купорос – CuSO4 · 5H2O. Медный купорос является веществом голубого цвета, а безводный сульфат меди (II) – белый, при растворении в воде, раствор становится голубого цвета.

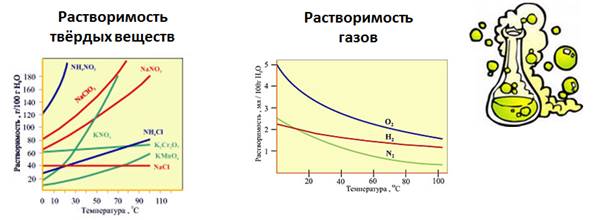
Растворимость веществ в воде зависит от температуры. Растворимость в воде твердых веществ при повышении температуры увеличивается, а газов, наоборот, уменьшается.
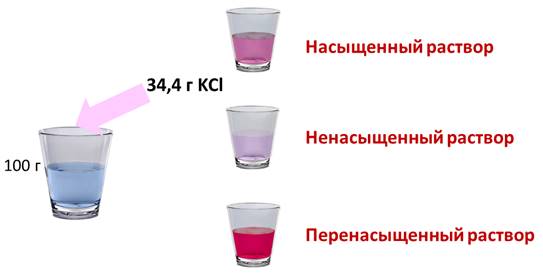
Если растворить в воде хлорид калия, то при комнатной температуре может раствориться только 34,4 г в 100 г воды. Если добавить больше соли, то сколько бы мы не перемешивали, соль не раствориться в воде, т.е. этот раствор уже насыщенный. Раствор, в котором при данной температуре вещество больше не растворяется является насыщенным. Если растворить не 34,4 г соли, а меньше, то раствор будет ненасыщенным. Т.е. раствор, в котором при данной температуре вещество ещё может раствориться, называют ненасыщенным.
При охлаждении насыщенного раствора возникает избыток растворенного вещества, если оно не выпадает в осадок, то образуется перенасыщенный раствор. Перенасыщенным называют такой раствор, в котором при данной температуре находится в растворенном состоянии больше вещества, чем в его насыщенном растворе при тех же условиях.
Перенасыщенный раствор можно легко приготовить. Для этого нужно приготовить насыщенный раствор соли при высокой температуре, затем избыток соли отфильтровать, накрыть сосуд и охладить при комнатной температуре. Этот раствор может храниться довольно долго, но если в него внести стеклянную палочку, на которой будет несколько крупинок этой соли, то начнется ее кристаллизация из раствора. В мертвом море концентрация соли так велика, что помещенные сюда предметы, начинают покрываться кристаллами.

По растворимости вещества делятся на хорошо растворимые, если при комнатной температуре в 100 г воды растворяется более 1 г вещества, если меньше 1 г вещества, то такие вещества являются малорастворимыми, и если вещества растворяется меньше 0,01 г на 100 г воды, то такие вещества относятся к практически нерастворимым. Совершенно нерастворимых веществ нет. Даже атомы серебра чуть-чуть переходят в раствор из изделий, помещенных в воду.
Демонстрация: на демонстрационных столиках насыщенные растворы солей сульфата меди, красной и желтой кровяной солей.
Что вы видите перед собой? (Растворы.)
Почему не вся соль растворилась? (Раствор насыщенный при данной температуре.)
Ребята, подумайте, как приготовить ненасыщенный раствор? (Рассчитать необходимые массу вещества и объем воды; взвесить вещество, измерить объем воды; перенести количественно вещество в сосуд, добавить воды, растворить; добавить оставшуюся воду.)
Демонстрация растворения серной кислоты в воде
Что я делаю? (Растворяете кислоту в воде.)
Соблюдаю ли я правила техники безопасности при проведении растворения серной кислоты? (Как надо растворять кислоту: приливать кислоту в воду или воду в кислоту? Ответ мотивируйте.)
Что такое растворение? (Распределение частиц вещества между частицами растворителя.)
Какое это явление? Почему? (Физическое, т.к. не происходит превращение одних веществ в другие; нет признаков химической реакции.)
Приложите руку к стакану. Что чувствуете? (Раствор нагрелся.)
Формулировка темы урока
Так какое же это явление растворение? (При растворении произошло изменение температуры, значит это процесс химический.)
Как вы думаете, ребята, о чем будем говорить на этом уроке? (О растворах, растворении.)
2-й операционно-исполнительский этап – 18'– 20'
Вы все заметили повышение температуры раствора при растворении концентрированной серной кислоты.
Всегда ли происходит выделение тепла при растворении?
Возможно ли понижение температуры раствора при растворении?
Лабораторная работа: тепловые явления при растворении
Сейчас мы с вами проведем лабораторную работу для того, чтобы ответить на эти вопросы, приготовим растворы некоторых солей. У вас есть инструкции по проведению лабораторной работы. Прочитайте их. Кратко повторим ее. Какие вопросы возникли?
3-й этап. Рефлексивно-оценочный – 3'-5'
Какие выводы по уроку сделали? (Растворение – физико-химический процесс. Он сопровождается энергетическими эффектами. Источником энергии для растворения является энергия гидратации. На разрушение кристаллов энергия затрачивается, при гидратации выделяется. Процесс растворения солей можно записать с помощью уравнений диссоциации.
Кто успел записать 5 уравнений, 4? 3? 2? Только 1? Почему? Кто записал больше? Какие ошибки у вас были? Как вы думаете, почему? Что надо сделать дома?

Цель урока: Обеспечить развитие представлений о растворах, растворении как физико-химическом процессе, растворимости веществ в воде, зависимости растворимости от природы вещества, температуры и давления, кристаллогидратах.
Растворы. Растворение как физико-химический процесс
«Мы отнюдь не властвуем над
природой, все наше господство
состоит в том, что мы … в отличие
от всех других существ, умеем
познавать ее законы и правильно
Образовательные:
Обеспечить развитие представлений о растворах, растворении как физико-химическом процессе, растворимости веществ в воде, зависимости растворимости от природы вещества, температуры и давления, кристаллогидратах.
Развивающие:
Создать условия для:
- развития мышления (учить анализировать, выделять главное, сравнивать, обобщать и систематизировать, определять понятия);
- развития мировоззрения учащихся;
- развития навыков устной и письменной речи;
- развития критического мышления.
Воспитательные:
Создать условия для воспитания самостоятельности и коммуникативности.
Способствовать развитию творческого отношения к учебной деятельности при выполнении химических опытов.
Тип урока: урок комплексного применения знаний, умений, навыков.
Вид урока: проблемно-исследовательский.
Методы и методические приемы: фронтальная беседа, рассказ, инструктаж, работа с таблицами и учебником, демонстрация презентации, объяснение схемы.
Оборудование: кристаллы гидроксида калия, раствор сульфата меди, стаканы с водой, стеклянная палочка, безводный медный купорос, серная кислота, нитрат аммония.
Целеполагание и мотивация
Актуализация ранее пройденного материала
Изучение нового материала
-тепловые эффекты при растворении;
-растворимость веществ в воде
Закрепление материала (выполнение заданий у доски и в тетрадях учащихся)
Организационный момент (приветствие, проверка отсутствующих, организация внимания учащихся, психологический настрой учащихся)
Целеполагание и мотивация (урок начитается с эпиграфа и комментариев к нему)
«Мы отнюдь не властвуем над
природой, все наше господство
состоит в том, что мы … в отличие
от всех других существ, умеем
познавать ее законы и правильно
Актуализация опорных знаний
В жизни мы чаще встречаемся с чистыми веществами или смесями?
Какие бывают смеси? (однородные, неоднородные)
Приведите примеры однородных смесей (растворы).
Слайд 1
С каким веществом мы чаще всего связываем понятие раствор? (вода)
Слайд 2 Однако есть и спиртовые растворы. ДЕМ.: йод, лекарство
Это жидкие растворы. Но есть р-ры твердые и газообразные. ДЕМ.: сплавы, газообразные (воздух)
Мы более подробно будем изучать водные растворы. Почему?
Какова роль воды в природе?
Слайд 3 В первичном океане 1% солей, в нем появились первые организмы, вышли на сушу, но сохранили в своих организмах водный раствор;
Слайд 4 В крови человека – 90 %. Пищеварение – гидролиз белков, жиров, углеводов
Слайд 5 Почвообразование. Снабжение растений питательными веществами.
Какова роль воды в технике? Получение соды, удобрений, кислот, металлов, бумаги. Каким же образом получаются растворы? Что же такое растворение? К какому явлению можно отнести растворение?
- Вспомните какими свойствами обладает вода?
- Что происходит при растворении веществ в воде?
- Вспомните как необходимо проводить растворение серной кислоты в воде? Почему? (дем. опыта)
- Что происходит при растворении нитрата аммония в воде? (дем. опыта)
-Чем отличаются эти опыты?
4.Изучение нового материала
1. Запишите свою гипотезу (научное предположение) в тетрадь.
Физическое явление: диффузия
Химическое явление: изменение цвета, выпадение осадка, растворение осадка, выделение газа, поглощение или выделение тепла
Слайд 6 Итак, наши мнения разделились. Класс разделился на 2 лагеря – сторонников физической теории растворов Вант-Гоффа, Аррениуса и Оствальда и их оппонентов – последователей химической теории растворов Д. И. Менделеева.
2. Сущность теорий растворов (Работа с учебником)
Слайд 7 Физическая теория растворов:
Растворение – это процесс диффузии, растворы – это однородные смеси
Химическая теория растворов:
Растворение – это процесс химического взаимодействия растворяемого вещества с водой – гидратация, растворы – соединения гидраты
В настоящее время считается, что растворение это физико-химический процесс. Физическая сторона процесса заключается в разрушении кристаллической решетки вещества и равномерном распределении, по принципу диффузии, частиц растворенного вещества среди молекул растворителя.
Химическая сторона процесса проявляется во взаимодействии частиц растворенного вещества с молекулами растворителя.
- Какие аргументы химической теории растворов вы сможете привести?
- изменение цвета
- выделение или поглощение тепла
- многие вещества после растворения приобретают новые свойства – электропроводность
Растворимость веществ в воде зависит от температуры. Растворимость в воде твердых веществ при повышении температуры увеличивается, а газов, наоборот, уменьшается.
-Какими бывают растворы?
- Если растворить в воде хлорид калия, то при комнатной температуре может раствориться только 34,4 г в 100 г воды. Если добавить больше соли, то сколько бы мы не перемешивали, соль не раствориться в воде, т.е. этот раствор уже насыщенный.
Раствор, в котором при данной температуре вещество больше не растворяется является насыщенным.
Если растворить не 34,4 г соли, а меньше, то раствор будет ненасыщенным.
Т.е. раствор, в котором при данной температуре вещество ещё может раствориться, называют ненасыщенным.
- Как приготовить перенасыщенный раствор?
Перенасыщенный раствор можно легко приготовить. Для этого нужно приготовить насыщенный раствор соли при высокой температуре, затем избыток соли отфильтровать, накрыть сосуд и охладить при комнатной температуре. Этот раствор может храниться довольно долго, но если в него внести стеклянную палочку, на которой будет несколько крупинок этой соли, то начнется ее кристаллизация из раствора. В мертвом море концентрация соли так велика, что помещенные сюда предметы, начинают покрываться кристаллами.
По растворимости вещества делятся на хорошо растворимые, если при комнатной температуре в 100 г воды растворяется более 1 г вещества, если меньше 1 г вещества, то такие вещества являются малорастворимыми, и если вещества растворяется меньше 0,01 г на 100 г воды, то такие вещества относятся к практически нерастворимым. Совершенно нерастворимых веществ нет.
- С помощью чего мы можем определить растворимость вещества в воде?
- Что мы должны помнить при написании уравнений в ионном виде?
- Как в уравнении такой реакции мы показываем нерастворимое в воде вещество?
5.Закрепление материала
Составьте уравнения реакций в молекулярном и ионном виде:
KOH (р) + HCl (р) = KCl (р) + H 2 O (ж)
Полное ионное уравнение реакции:
K + + OH – + H + + Cl – = K + + Cl – + H 2 O
Cокращенное ионное уравнение реакции:
CaO ( тв ) + 2HNO 3 ( р ) = Ca(NO 3 ) 2 ( р ) + H 2 O ( ж )
Полное ионное уравнение реакции:
CaO + 2H + + 2NO 3 - = Ca 2+ + 2NO 3 - + H 2 O
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca 2+ + H2O
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
CuCl 2 (р) + 2 KOH (р) = 2 KCl (р) + Cu ( OH )2↓
Полное ионное уравнение реакции:
Cu 2+ + 2Cl – + 2K + + 2OH – = 2K + + 2Cl – + Cu(OH)2↓.
Cокращенное ионное уравнение реакции:
Полное ионное уравнение реакции:
2 Al 3+ + 3 SO 4 2- + 3 Ba 2+ + 6 Cl - = 3 BaSO 4↓ + 2 Al 3+ + 6 Cl -
C окращенное ионное уравнение реакции:
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
Полное ионное уравнение реакции:
2K + + S 2– + 2H + + 2Cl – = 2K + + 2Cl – + H 2 S↑.
Cокращенное ионное уравнение реакции:
Полное ионное уравнение реакции:
2 Na + + CO 3 2- + 2 H + + 2 NO 3 - = 2 Na + + CO 2↑ + H 2 O + 2 NO 3 -
Cокращенное ионное уравнение реакции:
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода(IV).
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
6.Д/З §30, задание 2
Растворы. Растворение как физико-химический процесс
«Мы отнюдь не властвуем над
природой, все наше господство
состоит в том, что мы … в отличие
от всех других существ, умеем
познавать ее законы и правильно
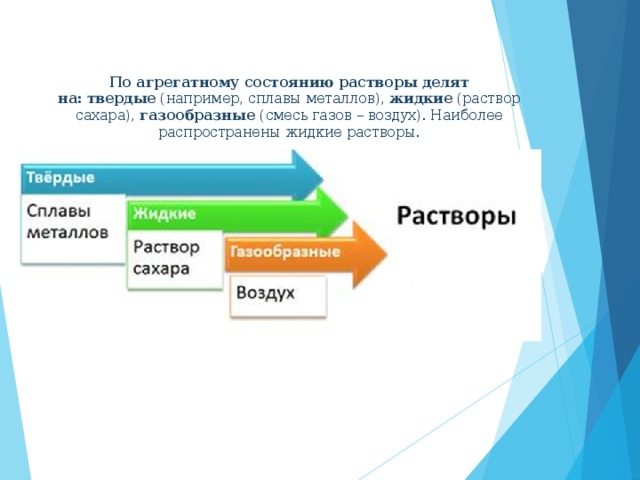
По агрегатному состоянию растворы делят на: твердые (например, сплавы металлов), жидкие (раствор сахара), газообразные (смесь газов – воздух). Наиболее распространены жидкие растворы.
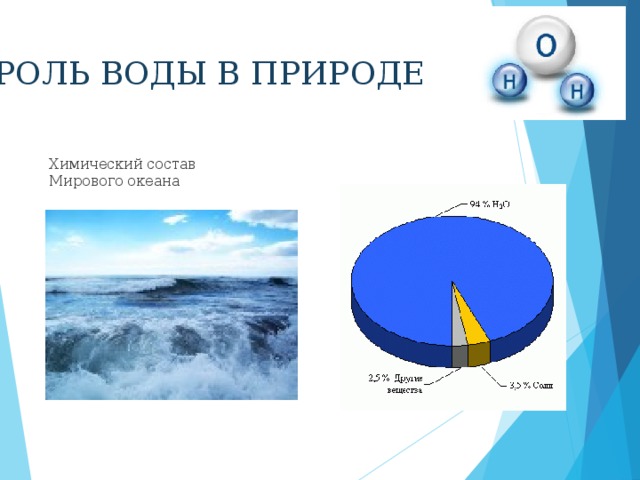
РОЛЬ ВОДЫ В ПРИРОДЕ
Химический состав Мирового океана
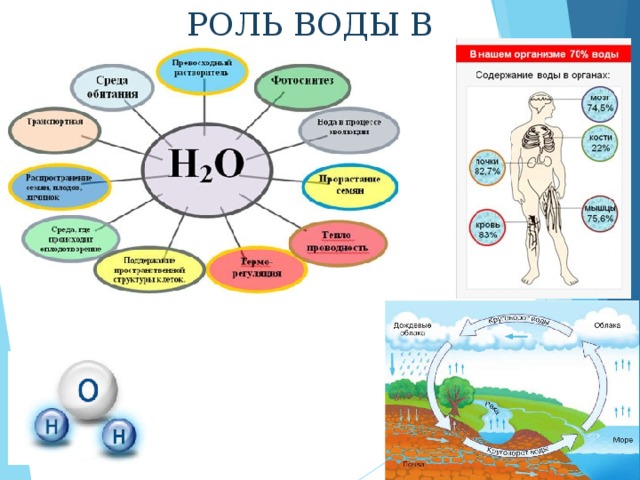
РОЛЬ ВОДЫ В ПРИРОДЕ

РОЛЬ ВОДЫ В ТЕХНИКЕ И ЖИЗНИ ЧЕЛОВЕКА
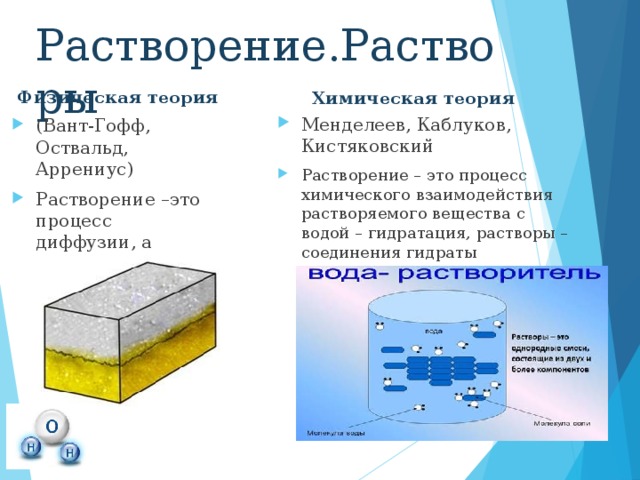
Физическая теория
Химическая теория
Современная теория
В настоящее время принята физико-химическая теория растворов , которую ещё в 1906 г. предсказывал Д. И. Менделеев . Поэтому растворение является физико-химическим процессом .
Физическая сторона процесса заключается в разрушении кристаллической решетки вещества и равномерном распределении, по принципу диффузии, частиц растворенного вещества среди молекул растворителя.
Химическая сторона процесса проявляется во взаимодействии частиц растворенного вещества с молекулами растворителя.
Признаки химического взаимодействия при растворении
H2 SO4, NaOH) NH4NO3)
Белые кристаллы дальнейшее Синие кристаллы
CuSO 4 выпаривание CuSO 4 *5H 2 O,
(безводного) (раствор голубого цвета)
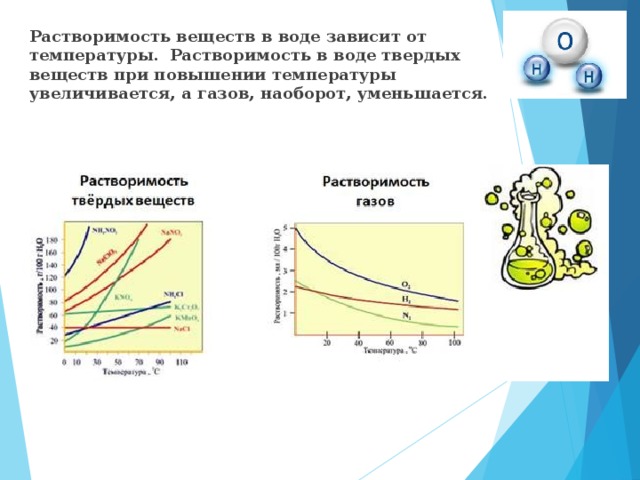
Растворимость веществ в воде зависит от температуры. Растворимость в воде твердых веществ при повышении температуры увеличивается, а газов, наоборот, уменьшается.

Если растворить в воде хлорид калия, то при комнатной температуре может раствориться только 34,4 г в 100 г воды.
Если добавить больше соли, то сколько бы мы не перемешивали, соль не раствориться в воде, т.е. этот раствор уже насыщенный.
Раствор, в котором при данной температуре вещество больше не растворяется является насыщенным.
Если растворить не 34,4 г соли, а меньше, то раствор будет ненасыщенным. Т.е. раствор, в котором при данной температуре вещество ещё может раствориться, называют ненасыщенным.

Перенасыщенный раствор можно легко приготовить. Для этого нужно приготовить насыщенный раствор соли при высокой температуре, затем избыток соли отфильтровать, накрыть сосуд и охладить при комнатной температуре. Этот раствор может храниться довольно долго, но если в него внести стеклянную палочку, на которой будет несколько крупинок этой соли, то начнется ее кристаллизация из раствора . В мертвом море концентрация соли так велика, что помещенные сюда предметы, начинают покрываться кристаллами.
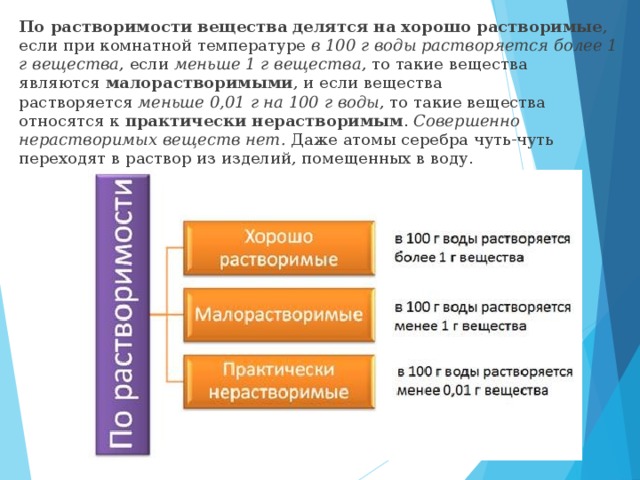
По растворимости вещества делятся на хорошо растворимые , если при комнатной температуре в 100 г воды растворяется более 1 г вещества , если меньше 1 г вещества , то такие вещества являются малорастворимыми , и если вещества растворяется меньше 0,01 г на 100 г воды , то такие вещества относятся к практически нерастворимым . Совершенно нерастворимых веществ нет. Даже атомы серебра чуть-чуть переходят в раствор из изделий, помещенных в воду.
Читайте также:

