Получение металлов химия 9 класс конспект кратко
Обновлено: 07.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Конспект урока будет удобен на уроке химии для 9 класса, здесь есть цель и задачи, все этапы урока соблюдены, организационный момент, приветствие, мотивация к учебной деятельности, приветствие, актуализация опорных знаний, открытие нового. Познакомить учащихся с получение металлов. Развивать внимание, память, речь, аналитическое мышление, способность делать выводы. дать понятие о сплавах, их классификации и свойствах. Дать понятие о научных принципах производства металлов и сплавов. Рассмотреть такие разновидности металлургии, как пиро–, гидро–, электрометаллургия, термическое разложение соединений металлов.
Углубить знания учащихся, полученные из курсов химии, географии и экологии о защите окружающей среды от отходов предприятий металлургической промышленности. Закрепить умение подбирать коэффициенты для ОВР методом электронного баланса.
Конспект урока по химии для 9 класса на тему: Получение металлов
Цель – Познакомить учащихся с получение металлов
Задачи урока: Познакомить учащихся с получение металлов. Развивать внимание, память, речь, аналитическое мышление, способность делать выводы. дать понятие о сплавах, их классификации и свойствах. Дать понятие о научных принципах производства металлов и сплавов. Рассмотреть такие разновидности металлургии, как пиро–, гидро–, электрометаллургия, термическое разложение соединений металлов.
Углубить знания учащихся, полученные из курсов химии, географии и экологии о защите окружающей среды от отходов предприятий металлургической промышленности. Закрепить умение подбирать коэффициенты для ОВР методом электронного баланса.
I.Организационный этап. Мотивация к учебной деятельности .
Учитель: - Учебник на столе у вас?
А ручки и тетрадки?
Тогда урок начнём сейчас,
Раз всё у вас в порядке.
Чтобы литературные тайны познавать,
Нужно всё серьёзно изучать.
- проверка готовности класса к уроку:
Я рада новой встрече с вами,
Приятно ваше общество, друзья!
Ответы ваши вы готовьте сами,
Их с интересом буду слушать я.
Мы сегодня снова будем читать,
Выводы делать и рассуждать.
А чтобы урок пошёл каждому впрок
Активно включайся в работу, дружок!
Вот книжки на столе,
Не хочется играть
Сегодня в прятки
Сегодня в классе у ребят
Урок очень важный
А почему он важный –
Добрый день, мои друзья,
Встрече с вами рада я.
Сели ровно, все достали,
Вспоминаем все, что знали,
Оставляем все заботы
И включаемся в работу.
II. Актуализация знаний учащихся.
На этапе закрепления обучающимся предлагается выполнение лабораторной работы по изучению химических свойств металлов.
- Взаимодействие меди с кислородом;
- Взаимодействие цинка с соляной кислотой;
- Взаимодействие железа с раствором сульфата меди(II)
Работа выполняется в парах, результаты комментируются и оформляются в тетради.
III. Работа по новой теме.
Металлы в природе встречаются в трех формах:
1) В самородном виде встречаются золото и платина.
Слайд 5. Золото известно человечеству с древних времен. В земной коре его содержится примерно 100-150 млрд. тонн, в 1 куб. м морской воды его 5,5 кг.
Золото бывает в распыленном состоянии, а иногда собирается в большие массы – самородки. Так в Австралии в 1869 году нашли глыбу золота массой 100 кг. Наши русские самородки много меньше, и самый знаменитый, найденный в 1837 году на Южном Урале, весил всего около 36 кг.
За всю историю человечества было добыто около 90 тысяч т золота. Древние племена майя, ацтеков, древние египтяне и многие другие народы изготавливали из золота украшения, предметы быта.
В 20 и 21 веке золото – это не только ювелирные украшения или валюта, но и очень нужный металл для космической аппаратуры и радиотехники, для медицинских приборов и атомных электростанций.
По запасам золота Россия занимает третье место в мире (по добыче Россия занимает шестое место в мире).
В середине XVII века в Колумбии испанцы, промывая золото, находили вместе с ним тяжелый серебристый металл. Хотя он и напоминал серебро (по-испански plata), но был почти нерастворим и упорно не поддавался выплавке; его считали случайной вредной примесью. Поэтому испанское правительство приказывало в начале XVIII столетия выбрасывать этот вредный металл при свидетелях обратно в реку.
Сегодня основная часть месторождений платины (более 90 %) заключена в пяти странах: ЮАР, США, Россия, Зимбабве, Китае. Она применяется в качестве легирующей добавки для производства высокопрочных сталей, как катализатор, в ювелирном и зубоврачебном деле, в медицине, для покрытия элементов СВЧ-техники.
2) в самородном виде и в форме соединений могут находиться в природе серебро, медь, ртуть и олово.
Слайд 6. Медь человек начал использовать тоже очень давно, еще с доисторических времен. 7000 лет назад в Древнем Египте были известны медные рудники. Сначала человек научился изготавливать орудия труда и оружие из медных самородков, а за несколько тысяч лет до нашей эры люди научились получать медь из медной руды.
В мире встречаются очень крупные самородки меди, но не часто. Так, в США был найден один из крупнейших самородков, массой 420 тонн, а в России, обнаруженный в районе Печеры, самородок, весил 6 тонн.
Поскольку потребность человечества в железе постоянно возрастала, а метеоритного железа было недостаточно, огромное значение имело открытие способа получения железа из железных руд. Сейчас мы не можем представить себе нашей жизни без железа и его сплавов, насколько прочно они вошли в нашу жизнь.
3) все металлы, которые в ряду напряжений находятся до олова, встречаются только в виде соединений.
Слайд 9, 10 Это, например, щелочные и щелочноземельные металлы.
Чаще всего металлы в природе встречаются в виде солей неорганических кислот:
Слайд 12. Сульфидов.
Слайд 13. Хлоридов.
Слайд 14. Сульфатов, фосфатов, карбонатов, нитратов.
Слайд 11. И оксидов.
Слайд 15. Оксиды – магнитный железняк Fe 3 O 4 , красный железняк Fe 2 O 3 , бурый железняк 2Fe 2 O 3 •3H 2 O.
Слайд 16. Минералы и горные породы, содержащие металлы и их соединения и пригодные для промышленного получения металлов, называются рудами, а отрасль промышленности, занимающаяся получением металлов из руд – металлургией.
Слайд 17. Металлургия включает два основных направления:
- Черная – это получение железа и его сплавов (сталь и чугун). Черная металлургия включает весь процесс производства металлов: добычу и подготовку руд, топлива, выпуск металла, производство вспомогательных материалов (огнеупоров, кислорода и т.п.). По выплавке черных металлов в докризисные времена наша страна занимала ведущие места в мире. Российская Федерация обладает значительными запасами железных руд: Центрально-черноземный, Северный, Восточно-Сибирский районы. Незначительное количество руды добывается в Западной Сибири. Общие запасы оцениваются в 55 млрд. тонн. Самый крупный производитель черных металлов Уральский экономический район, он дает 40% стали и проката страны. Важнейшие задачи дальнейшего развития черной металлургии в РФ – обновление производственных мощностей, освоение новых технологических процессов и оборудования для выплавки стали.
- Цветная металлургия – это производство всех остальных металлов и их сплавов.
Большинство металлов встречаются в природе в составе соединений, в которых металлы находятся в положительной степени окисления, значит для того, чтобы их получить, в виде простого вещества, необходимо провести процесс восстановления. Но прежде чем восстановить природное соединение металла, необходимо перевести его в форму, доступную для переработки, например, оксидную форму с последующим восстановлением металла. На этом основан пирометаллургический способ.
Раз – два – руки в горизонтали,
Обе руки в горизонтальной плоскости одновременно вправо – влево;
Три – четыре – руки по вертикали.
Обе руки одновременно резким движением поднимаются вверх и опускаются вниз.
Помни, период – это горизонталь,
Руки на пояс, наклоны туловища вправо и влево;
Ну а группа – это вертикаль!
Руки на пояс, прыжки на месте.
IV. Закреплени е
Слайд 18. Пирометаллургия – это восстановление металлов из их руд при высоких температурах с помощью восстановителей: кокса, оксида углерода (II), водорода, или активных металлов.
Если металл в природе встречается в виде солей кислородсодержащих кислот, то соль сначала подвергают термическому разложению:
А если в виде солей бескислородных кислот, то обжигу:
Слайд 19. Затем металлы восстанавливают из оксидов одним из способов:
- Восстановление углем или угарным газом:
CuO + C → Cu + CO
CuO + CO → Cu + CO 2 - Водородотермия
Cr 2 O 3 + H 2 → Cr + H 2 O - Металлотермия
Fe 2 O 3 + Al → Fe + Al 2 O 3
Для каждого из этих уравнений подберите коэффициенты методом электронного баланса.
Слайд 20. Гидрометаллургический способ основан на растворении природного соединения с целью получения раствора соли этого металла с последующим вытеснением данного металла более активным. Например:
CuO + H2SO4 = CuSO4 + H2O, затем проводят реакцию замещения
Этим способом получают в основном цветные металлы: медь, молибден, вольфрам.
Слайд 21. Еще один способ получения металлов – электрометаллургия. Это способы получения металлов с помощью электрического тока (электролиза). Этим способом получают в основном легкие металлы: Al, Na и др. щелочные металлы, Ca и т.д. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов:
В последнее время большого внимания заслуживают микробиологические методы получения металлов, в которых используется жизнедеятельность некоторых видов бактерий. Например, тионовые бактерии способны переводить нерастворимые сульфиды в растворимые сульфаты. А затем раствор, обогащенный этим сульфатом подают на гидрометаллургическую переработку.
Металлургия – крупный загрязнитель окружающей среды. На ее долю приходится 20% всех промышленных выбросов в атмосферу и сточных вод. Ежегодно металлургические предприятия выбрасывают в атмосферу более 10 млн. тонн вредных веществ, среди которых гигантское количество разнообразных металлов, только один медеплавильный завод, производящий в год 125 тыс. тонн меди, выбрасывает в атмосферу 2 млрд. м 3 газов и 43 тыс. тонн пыли. При этом теряются 6 тыс. тонн меди и сера, которой хватило бы для приготовления 650 тыс. тонн серной кислоты. При открытой добыче руд из хозяйственного оборота изымаются десятки тысяч гектаров земли. Суммарный ущерб, наносимый металлургическим комплексом природе, оценивается 500 млрд. рублей в год. Огромные средства расходуются на строительство очистных сооружений и рекультивацию нарушенных земель. Металлургические центры составляют 30% всех российских городов с загрязненной атмосферой. Можно добывать руду, не нарушая ландшафт, с помощью био- или геотехнологий. С помощью биометодов в США добывают в год 300 тыс. тонн меди, в России около 2,5 тыс. тонн.
Какой метод получения меди с помощью серной кислоты или бактериальный экологически более безопасен?
Бактериальный метод более безопасен с экологической точки зрения, чем если применять кислоты, так как при этом в процессе получения меди не используются агрессивные, вредные вещества и поэтому образуется меньше отходов, вредных для окружающей среды.
Рассмотреть решение задач, цепочек превращений, метод электронного баланса на примере уравнений реакций получения металлов различными способами; познакомиться со следующими способами поучения металлов: гидрометаллургия, пирометаллургия, электрометаллургия и микробиологический метод.
Способствовать развитию памяти, мышления, внимания. Создавать условия для формирования у учащихся бережного отношения к природным ресурсам Хабаровского края и РФ
Личностные : развитие мотивов учебной деятельности, умение управлять своей познавательной деятельностью
Регулятивные : целеполагание, планирование, контроль, оценка
Познавательные : умение строить высказывания, рефлексия деятельности
Коммуникативные : постановка вопросов, умение выражать свои мысли, умение организовывать учебное сотрудничество
Руды, металлургия черная и цветная, пирометаллургия, гидрометаллургия и электрометаллургия, микробиологический метод
Оборудование: фарфоровая пластинка, компас или магнит
Вещества: магнитный, красный и бурый железняк
Материалы для учащихся, использование которых приведет к достижению запланированных результатов
I. Самоопределение к деятельности
Включение детей в деятельность на личностно-значимом уровне.
Учащиеся поприветствовали учителей, сели и внимательно слушают учителя.
Личностные : развитие навыков сотрудничества с учителем и сверстниками в разных учебных ситуациях
II. Актуализация знаний
- Вычислите количество вещества меди, которое нужно взять для получения 12кг мельхиора.
- Определите объём водорода, который образуется при растворении 35г латуни, содержащей 13% цинка, в соляной кислоте.
- Расставьте коэффициенты методом электронного баланса:
Zn + H 2 SO 4 = ZnSO 4 + H 2 S + H 2 O
Ребята называют пройденные темы: строение атомов металлов, химические свойства металлов, коррозия и сплавы
Учащиеся по очереди выходят к доске и решают 2 задачи и одно уравнение реакции
Личностные : умение управлять своей познавательной деятельностью
III. Постановка учебной задачи
Формулирование темы урока
Посмотрите отрывок фильма. Как вы считаете, о чем будет наш сегодняшний урок?
Учащиеся приходят к выводу о теме занятия
Коммуникативные : умение выражать свои мысли в соответствии с заданными задачами.
Человек с древних времен использовал металлы. Вспомните из уроков географии, в каком виде металл может находиться в земной коре?
Как называются природные соединения металлов?
Предлагаю вам с помощью практической работы познакомиться с тремя основными рудами, содержащими железо.
Опыт 1. Описание цвета и блеска предложенных образцов
Опыт 2. Куском руды нанесите аккуратно линию на фарфоровую пластину
Опыт 3. Поднесите кусок руды к компасу или магниту
Выполнив практическую работу, сделайте вывод о сходствах и различиях данных руд, свяжите это с их молекулярными формулами
Вы познакомились с отдельными представителями руд, содержащих железо. Скажите, как называется наука, которая занимается добычей и переработкой металлов?
Какие виды металлургии по цвету обрабатываемых металлов вам известны?
Кроме данной классификации металлургия делится еще по способам получения металлов.
Первым методом получения металлов является пирометаллургия, основанная на химических реакциях при высоких температурах.
Вторым методом получения металлов является гидрометаллургия, которая основывается на получении металлов из растворов их солей. Учитель обращает внимание на то, что таким методом невозможно получить щелочные и щелочноземельные металлы. И уточняют у учащихся, почему?
Следующим методом, пригодным для получения активных металлов, является электрометаллургия. Сформулируйте определение данного способа получения металлов с помощью его названия.
Как вы считаете, возможно ли получение чистого металла из руды с помощью живых организмов?
Таким образом, мы с вами назвали 4 способа получения металлов из природных соединений.
Учащиеся отвечают, что металлы встречаются в самородном виде и в соединениях
Учащиеся называют соединения – минералы.
Учащиеся вместе с учителем формируют понятие руды как природные образования, в которых металл находится в количестве, пригодном для промышленного получения металла. Записывают определение в тетрадь
Ученики рассматривают образцы и делают выводы, магнитный железняк имеет серый цвет и металлический блеск; красный железняк имеет красный цвет и бурый железняк – бурый цвет.
Ребята выполняют работу и наблюдают цвет линий; могут охарактеризовать плотность руд. Делают вывод об уменьшение плотности от магнитного к бурому железняку.
Выполняют задание и делают вывод о хороших магнитных свойствах у магнитного железняка, средних магнитных свойствах у красного; отсутствии магнитных свойств у бурого железняка.
Учащиеся называют свойства каждой руды и отмечают в каждой из них различное количество атомов кислорода и различной степени окисления железа
Ученики называют науку – металлургия (из курса географии)
Называют черную и цветную металлургию. Приводят примеры, записывают определения
Ученики записывают определение и уравнения реакций
Ребята вспоминают прошлый материал и называют способность активных металлов взаимодействовать с водой. Записывают определение и примеры уравнений реакций
Ученики по названию формулируют определение и записывают его в тетрадь.
Учащиеся называют бактерий и записываю определение микробиологического метода
Инструкции по выполнению практической работы и наборы для практической работы (руды, фарфоровая пластинка, магнит или компас)
Самородные металлы, минералы
Магнитный, красный и бурый железняк
Пирометаллургия, электрометаллургия , гидрометаллургия, микробиологический метод
Познавательные : поиск информации с помощью предложенных ресурсов; установление причинно-следственных связей
Коммуникативные: умение организовывать совместную деятельность с партнерами
V. Первичное закрепление
Закрепить знания в названии методов получения металлов
Ответьте на следующие вопросы:
1) В самородном виде в природе находится:
2) Для получения щелочных металлов используют:
3 ) Какого метода металлургии не существует:
Ученики отвечают на вопросы
Личностные: умение управлять своей познавательной деятельностью
Коммуникативные: умение вступать в диалог и участвовать в коллективном обсуждении проблемы, аргументировать свою позицию
VI.Самостоятельная работа и работа у доски
Проверить умения расставлять коэффициенты в уравнениях методом электронного баланса, различать способы получения металлов, решать задачи по уравнению реакции
С методами металлургии мы разобрались. Теперь решим несколько заданий с использованием уравнений получения чистых металлов.
Расставьте коэффициенты методом электронного баланса:
РЬО + Н 2 = Pb + Н 2 О
WO 3 + ЗН 2 = W + ЗН 2 О
TiCl 4 + 2Mg = Ti + 2MgCl 2
Ученики по желанию выходят к доске и выполняют задание
Осознание учащимися своей учебной деятельности, самооценка результатов деятельности своей и всего класса.
Поднимите руки те, у кого состояние после урока приподнятое и позитивное.
Спасибо всем за работу!
Регулятивные: умение соотносить свои действия с планируемыми результатами; владения основами самоанализа и самооценки
Предварительный просмотр:
Подписи к слайдам:
. Металлы в природе Самородные металлы (золото, серебро, медь, платина ) Минералы (красный железняк, цинковая обманка, галенит, киноварь и т.д.)
. Самородные металлы: золото медь серебро
Минералы – природные соединения красный бурый железняк железняк магнитный железняк
. Минералы – природные соединения свинцовый кварц блеск киноварь
. Минералы входят в состав руд Рудами называют содержащие минералы природные образования, в которых металлы находятся в количествах, пригодных в технологическом и экономическом отношении для получения металлов в промышленности.
. Металлургия - это наука о методах и процессах производства металлов из руд и других металлосодержащих продуктов, о получении сплавов и обработке металлов.
Металлургия Черная Цветная Производство железа и его сплавов Производство меди, олова, алюминия и др .
Восстановление металлов при высокой температуре Восстановители: С, СО, Н 2 , СН 4 Cu 2 O + C = 2Cu + CO Cu 2 O + CO = 2Cu + CO 2 Пирометаллургия
Восстановление металлов из растворов их солей CuO + H 2 SO 4 = CuSO 4 + H 2 O CuSO 4 + Fe = Cu + FeSO 4 Гидрометаллургия
Восстановление металлов электрическим током Активные металлы (от Li до Al ) получают из расплавов соединений, остальные металлы – из растворов 2NaCl → 2Na + Cl 2 Электрометаллургия
. Микробиологический метод - в этом методе используется жизнедеятельность некоторых видов бактерий. Например, тионовые бактерии способны переводить нерастворимые сульфиды в растворимые сульфаты. тионовые бактерии
Домашнее задание: § 9, упр. 5, 6
По теме: методические разработки, презентации и конспекты

Технологические карты уроков 9 класс тема "Металлы"
Технология Монахова позволяет решить противоречия между требованиями, предъявляемые стандартом, и гарантированным достижением результата. Большим плюсом технологии является четкость при формировании ц.

Технологическая карта урока по химии 9 класс Общая характеристика металлов
Технологическая карта урока по химии 9 класс Общая характеристика металлов в соответствии требованиями ФГОС.

Технологическая карта урока по теме "Щелочные металлы – простые вещества, их физические и химические свойства".
Технологическая карта урока с использованием приемов технологии развития критического мышления.

Технологическая карта урока по химии "Химия - часть естествознания. Предмет химии. Вещества"
Теннологическая карта урока по химии в 8 классе "Химия - часть естествознания. Предмет химии. Вещества", УМК Габриелян О.С.

Технологическая карта урока "Контрольная работа №1 Металлы""
Дифференцированный подход стал основой при разработке данной контрольной работы, что позволяет учащимся самостоятельно определить степень освоения раздела "Металлы" уже на первом этапе.

Продолжить формирование умений прогнозировать свойства простого на основе положения химического элемента в Периодической системе химических элементов. Познакомить учащихся с практическим пр.

ТЕХНОЛОГИЧЕСКАЯ КАРТА УРОКА ПО ХИМИИ В 9 КЛАССЕ ПОЛОЖЕНИЕ МЕТАЛЛОВ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Д. И. МЕНДЕЛЕЕВА.
Тип урокаУрок усвоения новых знанийЦели деятельности учителяСформировать представление о металлах; способствовать усвоению материала о положении металлов в Периодической системе Д. И. Менделеева, особ.
Металлургия — это наука о промышленных способах получения металлов. Различают черную и цветную металлургию.
Черная металлургия — это производство железа и его сплавов (сталь, чугун и др.).
Цветная металлургия — производство остальных металлов и их сплавов.
Широкое применение находят сплавы металлов. Наиболее распространенные сплавы железа — чугун и сталь.
Чугун — это сплав железа, в котором содержится 2-4 масс. % углерода, а также кремний, марганец и небольшие количества серы и фосфора.
Сталь — это сплав железа, в котором содержится 0,3-2 масс. % углерода и небольшие примеси других элементов.
Легированные стали — это сплавы железа с хромом, никелем, марганцем, кобальтом, ванадием, титаном и другими металлами. Добавление металлов придает стали дополнительные свойства. Так, добавление хрома придает сплаву прочность, а добавление никеля придает стали пластичность.
Основные стадии металлургических процессов:
- Обогащение природной руды (очистка, удаление примесей)
- Получение металла или его сплава.
- Механическая обработка металла
Большинство металлов встречаются в природе в виде соединений. Наиболее распространенный металл в земной коре — алюминий. Затем железо, кальций, натрий и другие металлы.
Получить такие металлы можно, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях.
Натрий в промышленности получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl = 2Na + Cl2
Калий получают пропусканием паров натрия через расплав хлорида калия при 800°С:
KCl + Na = K↑ + NaCl
Литий можно получить электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl = 2Cs + CaCl2
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
Барий получают из оксида восстановлением алюминием в вакууме при 1200 °C:
4BaO+ 2Al = 3Ba + Ba(AlO2)2
Алюминий получают электролизом раствора оксида алюминия Al2O3 в криолите Na3AlF6:
Металлы малоактивные и неактивные восстанавливают из оксидов углем, оксидом углерода (II) СО или более активным металлом. Сульфиды металлов сначала обжигают.
3.1. Обжиг сульфидов
При обжиге сульфидов металлов образуются оксиды:
2ZnS + 3O2 → 2ZnO + 2SO2
Металлы получают дальнейшим восстановлением оксидов.
3.2. Восстановление металлов углем
Чистые металлы можно получить восстановлением из оксидов углем. При этом до металлов восстанавливаются только оксиды металлов, расположенных в ряду электрохимической активности после алюминия.
Например , железо получают восстановлением из оксида углем:
2Fe2O3 + 6C → 2Fe + 6CO
ZnO + C → Zn + CO
Оксиды металлов, расположенных в ряду электрохимической активности до алюминия, реагируют с углем с образованием карбидов металлов:
CaO + 3C → CaC2 + CO
3.3. Восстановление металлов угарным газом
Оксид углерода (II) реагирует с оксидами металлов, расположенных в ряду электрохимической активности после алюминия.
Например , железо можно получить восстановлением из оксида с помощью угарного газа:
3.4. Восстановление металлов более активными металлами
Более активные металлы вытесняют из оксидов менее активные. Активность металлов можно примерно оценить по электрохимическому ряду металлов:
Восстановление металлов из оксидов другими металлами — распространенный способ получения металлов. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например : алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO
Железо можно вытеснить из оксида с помощью алюминия:
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
Активные металлы вытесняют менее активные из растворов их солей.
Например , при добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
Медь покроется белыми кристаллами серебра.
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
3.5. Восстановление металлов из оксидов водородом
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Как правило, взаимодействие оксидов металлов с водородом протекает в жестких условиях – под давлением или при нагревании.
CuO + H2 = Cu + H2O
Чугун получают из железной руды в доменных печах.
Печь последовательно загружают сверху шихтой, флюсами, коксом, затем снова рудой, коксом и т.д.

1- загрузочное устройство, 2 — колошник, 3 — шахта, 4 — распар, 5 — горн, 6 — регенератор
Доменная печь имеет форму двух усеченных конусов, соединенных основаниями. Верхняя часть доменной печи — колошник, средняя — шахта, а нижняя часть — распар.
В нижней части печи находится горн. Внизу горна скапливается чугун и шлак и отверстия, через которые чугун и шлак покидают горн: чугун через нижнее, а шлак через верхнее.
Наверху печи расположено автоматическое загрузочное устройство. Оно состоит из двух воронок, соединенных друг с другом. Руда и кокс сначала поступают в верхнюю воронку, а затем в нижнюю.
Из нижней воронки руда и кокс поступают в печь. во время загрузки руды и кокса печь остается закрытой, поэтому газы не попадают в атмосферу, а попадают в регенераторы. В регенераторах печной газ сгорает.
Шихта — это железная руда, смешанная с флюсами.
Снизу в печь вдувают нагретый воздух, обогащенный кислородом, кокс сгорает:
Образующийся углекислый газ поднимается вверх и окисляет кокс до оксида углерода (II):
CO2 + С = 2CO
Оксид углерода (II) (угарный газ) — это основной восстановитель железа из оксидов в данных процессах. Последовательность восстановления железа из оксида железа (III):
Последовательность восстановления оксида железа (III):
FeO + CO → Fe + CO2
Суммарное уравнение протекающих процессов:
При этом протекает также частичное восстановление примесей оксидов других элементов (кремния, марганца и др.). Эти вещества растворяются в жидком железе.
Чтобы удалить из железной руды тугоплавкие примеси (оксид кремния (IV) и др.). Для их удаления используют флюсы и плавни (как правило, известняк CaCO3 или доломит CaCO3·MgCO3). Флюсы разлагаются при нагревании:
и образуют с тугоплавкими примесями легкоплавкие вещества (шлаки), которые легко можно удалить из реакционной смеси:
CaO + SiO2 → CaSiO3
Добавить комментарий
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.

Этот видеофрагмент даёт возможность учащимся вместе с путешественником побывать в местах, где были найдены самые большие самородки металлов, он расскажет о распространённости металлов в земной коре, о некоторых исторических фактах, касающихся металлов, а также о рудах и минералах. Вместе с ним ребята побывают на дне водоёма и увидят отложения металлов, смогут представить себя в роли геолога и сравнить такие минералы, как красный, бурый и магнитный железняк. Путешественник расскажет им об основных методах получения металлов и затронет некоторые вопросы охраны окружающей среды, связанные с получением металлов.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Получение металлов. Нахождение их в природе"
Получение металлов. Нахождение их в природе
Ребята, сегодня мы побываем с вами в местах, где получают металлы, а также узнаем, где же встречаются металлы.
Ну что ж, начинаем путешествие. Металлы встречаются в природе в свободном состоянии, их называют самородными металлами, так и в виде соединений.

А вот распространённость химических элементов металлов в земной коре различна. К наиболее распространённым металлам относятся алюминий (7,45%), железо (4,20%), кальций (3,25%), натрий (2,40%), калий (2,35%) и магний (2,35%). Содержание других металлов в земной коре может составлять тысячные доли процента и ниже.

Некоторые историки считают, что упадок Римской империи был обусловлен массовым отравлением свинцом. Известно, что водопроводы Древнего Рима были из свинца. В свинцовых чанах хранили воду и вино. Попадая в человеческий организм, свинец вызывает поражение центральной нервной системы, приводит к изменению состава крови.
Многие металлы являются элементами, необходимыми для функционирования живых организмов. На долю ионов Na + , K + , Mg 2+ , Ca 2+ в организме человека приходится 99% всех ионов металлов.

К биологически наиболее значимым металлам относятся: K, Na, Mg, Ca, Fe, Cu, Co, Mn, Zn, Mo.
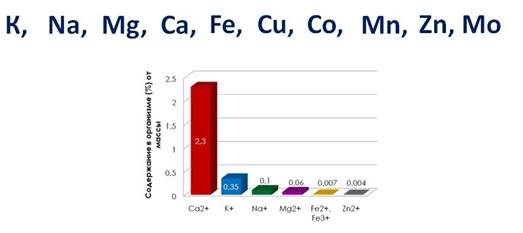
В земной коре металлы чаще всего встречаются в виде соединений: таких, как оксиды, силикаты, карбонаты, сульфиды и хлориды. Эти соединения входят в состав руд и минералов.
Рудой называют горную породу, получение из которой чистого металла экономически выгодно. В состав руды входят минералы и примеси в виде пустой породы. А минералы – это природные тела, имеющие определённый химический состав. Давайте с вами посмотрим названия и химический состав некоторых минералов.
Химический состав
Красный железняк (гематит)
Магнитный железняк (магнетит)
Железный колчедан (пирит)
Медный колчедан (халькопирит)
Свинцовый блеск (галенит)













К наиболее известным минералам относится пирит, или железный колчедан (FeS2), киноварь (HgS), малахит ((CuOH)2CO3). Пирит и киноварь используют в промышленности для получения соответствующих металлов, то есть железа и ртути, а малахит, как поделочный камень.

Представьте себя геологом или минералогом, как же это увлекательно. Для этого сравним такие минералы, как красный, бурый и магнитный железняк.
Цвет красного железняка коричнево-красный, сам он прочный, плотный, если провести образцом руды по поверхности фарфоровой ступки, то он оставляет красно-коричневый след, не притягивается магнитом.

Бурый железяк имеет жёлто-коричневую окраску, сам прочный и плотный, не притягивается магнитом, оставляет на фарфоровой ступки жёлто-бурую полосу.

Магнитный железняк чёрного цвета, сам прочный и плотный, притягивается магнитом, оставляет чёрный цвет черты на поверхности фарфоровой ступки, имеет металлический блеск.

Здорово, получается, что минералы отличаются между собой окраской, магнитными свойствами, цветом черты и некоторыми другими показателями.
В современной технике широко используют более 75 металлов и многочисленные сплавы на их основе. Поэтому большое значение придаётся промышленным способам получения металлов из руд. Обычно перед получением металлов из руды её измельчают, потом предварительно обогащают – отделяют пустую породу, примеси. В результате образуется концентрат, служащий сырьём для металлургического производства. Затем обогащённую руду превращают в оксид и только после этого восстанавливают металл.

Металлургия – это наука о методах и процессах производства металлов из руд и других металлосодержащих продуктов, о получении сплавов и обработке металлов. В зависимости от метода получения металла из руды (концентрата) существует несколько видов металлургических производств.
Представьте, что из одной т медной руды можно получить шестнадцать кг концентрата и только четыре кг чистой меди.

Такая отрасль металлургии, как пирометаллургия занимается переработкой руд, она основана на химических реакциях, при чём они проходят при высоких температурах, ведь от греч. пирос, означает огонь.
Пирометаллургические процессы включают обжиг и плавку.
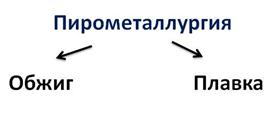
При обжиге сульфиды переводят в оксиды, а сера удаляется в виде оксида серы (IV). А затем из оксида восстанавливают металл. Полученный металл или сплав подвергают механической обработке, придают ему соответствующую форму. В процессе выделения металлов (плавке) из оксидов в качестве восстановителей используют углерод, оксид углерода (II), водород, кремний или более активные металлы.
Например, ещё древние металлурги для получения железа из его руд использовали в качестве восстановителя углерод. Но этот способ неудобен тем, что реакция между твёрдыми веществами идёт только в местах их соприкосновения.
В промышленных масштабах для получения железа, цинка и других цветных металлов из оксидов используют в качестве восстановителя оксид углерода (II).
Сейчас мы посмотрим, как получают чугун и сталь. Восстановление железа проводят в специальных вертикальных печах, называемых доменными, высотой до нескольких десятков метров и внутренним объёмом до 5000 м 3 . Они имеют стальной корпус, а изнутри выложены огнеупорным кирпичом. По характеру своей работы доменная печь – аппарат непрерывного действия. Сверху в печь подаётся твёрдое сырьё – шихта, представляющая собой смесь железной руды, кокса (переработанного угля), известняка и других добавок, а снизу вдувается подогретый или обогащённый кислородом воздух. В нижней части печи кокс сгорает в горячем воздухе, образуя углекислый газ.

Углекислый газ поднимается вверх в печи и взаимодействует с новыми порциями раскалённого кокса
с образованием оксида углерода (II).
В результате реакций СО с оксидом железа (III) образуется железо.
В доменном процессе получается железо с относительно большим (более 2%) содержанием углерода – чугун.
Чугун превращают в сталь, удаляя избыточный углерод путём окисления кислородом воздуха в специальных установках – мартеновский печах, конвертерах или электропечах.

Для получения некоторых металлов в качестве восстановителя используют водород.

В роли восстановителей можно также использовать более активные металлы, способные вытеснять другие металлы из их оксидов и солей. Этот способ получения металлов называется металлотермией. Если используют алюминий, то говорят об алюминотермии:

Восстановление железа методом алюминотермии до сих пор применяется при сварке рельсов.

Этот метод получения металлов был предложен русским учёным
Н.Н. Бекетовым.

Гидрометаллургия – это методы получения металлов, основанные на химических реакциях, происходящих в растворе. Гидрометаллургические процессы включают стадию перевода нерастворимых соединений металлов из руд в растворы, с последующим восстановительным выделением металлов из полученных растворов с помощью других металлов или электрического тока.
Электрометаллургия – методы получения металлов, основанные на электролизе, т.е. выделение металлов из растворов или расплавов их соединений с помощью постоянного электрического тока. Этот метод применяют для получения активных металлов – щелочных и щелочноземельных, алюминия, также для получения легированных сталей. С помощью этого метода, английский химик Г. Дэви впервые получил калий, натрий, барий и кальций.


Таким образом, металлы встречаются в природе в виде соединений или в самородном состоянии. В земной коре металлы чаще всего встречаются в виде соединений: оксидов, силикатов, карбонатов, сульфидов, хлоридов. Эти соединения входят в состав руд и минералов. Для получения металлов из руд руду сначала измельчают, обогащают, переводят в оксид и только после этого восстанавливают металл. В качестве восстановителей используют C, CO, H2, Si или более активные металлы. Металлургия занимается получением металлов и их сплавов из руд. В зависимости от метода получения металла из руды существует несколько видов металлургических производств: пирометаллургия, гидрометаллургия и электрометаллургия.
Читайте также:

