Почему протекают химические реакции 11 класс конспект урока
Обновлено: 06.07.2024
2. Научить учащихся рассчитывать тепловой эффект химических реакций по стандартным теплотам образования, определять возможность протекания химических процессов.
| Вложение | Размер |
|---|---|
| pochemu_protekayut_himicheskie_reakcii.ppt | 115 КБ |
| teplovoy_effekt_reakcii.doc | 57 КБ |
| test.doc | 28.5 КБ |
Предварительный просмотр:
Подписи к слайдам:
Предварительный просмотр:
Тепловой эффект реакции не обязательно находить экспериментально, его можно рассчитать, используя стандартные теплоты образования и сгорания веществ, следуя закону Гесса,
Закон Г. И. Гесса (1840 г.) заключается в следующем: Тепловой эффект химической реакции не зависит от пути процесса, а только от вида (например, аллотропной модификации) и агрегатного состояния исходных веществ и конечных продуктов реакции .
Пример. Сгорание углерода может идти двумя путями:
С + O 2 → СO 2 +394 кДж(Q = 394 кДж);
С+1/2О 2 → СO +111 кДж;
СО + 1/2 O 2 →СO 2 +283 кДж;
(Q 1 = 111 кДж, Q 2 = 283 кДж, сумма тепловых эффектов обеих стадий 394 кДж.)
С другой стороны, сравнение тепловых эффектов сгорания двух аллотропных модификаций углерода – графита (+394 кДж) и алмаза (+392 кДж), разложения водяного пара (–241,8 кДж) и воды (–285,8 кДж) доказывает, что тепловой эффект химической реакции зависит от вида и состояния исходных и конечных веществ.
Для расчета теплового эффекта реакции Q используют стандартные теплоты образования Q обр и сгорания Q сгор веществ, которые определяются в стандартных условиях: t = 25°С, Р = 1 атм на 1 моль вещества, вычисляются в кДж/моль.
Стандартная теплота образования показывает, сколько кДж энергии выделилось или поглотилось при образовании 1 моль сложного вещества из простых.
Теплоты образования простых веществ равны 0.
Стандартная теплота сгорания показывает, сколько кДж энергии выделилось при сгорании 1 моль вещества до высших оксидов.
Теплоты сгорания негорючих веществ равны 0.
Стандартные теплоты сгорания и образования можно найти в справочных таблицах.
Расчеты теплового эффекта реакции проводятся согласно следствию из закона Гесса: тепловой эффект химической реакции равен сумме стандартных теплот образования продуктов реакции за вычетом суммы стандартных теплот образования исходных веществ.
Q = ∑Q обр (продуктов) – ∑Q обр (исходных веществ).
Если даны стандартные теплоты сгорания, то можно использовать следующую форму для вычисления теплового эффекта реакции:
Q = ∑Q сгор (исходных веществ) –∑Q сгор (продуктов). При вычислениях учитываются стехиометрические коэффициенты.
Примеры решения задач.
Нахождение теплового эффекта химической реакции по стандартам теплотам образования (сгорания) исходных и конечных веществ.
Пример. Найдите тепловой эффект реакции горения метана СH 4 .
Первый способ - через стандартные теплоты образования.
1. Запишем уравнение реакции: СH 4 + 2O 2 = СO 2 + 2H 2 O + Q
2. Выразим в общем виде Q через Q обр учитывая коэффициенты:
Q = [Q обр (СO 2 ) + 2Q обр (H 2 O)] – [Q обр (СH 4 ) + 2Q обр (O 2 )].
3. Подставим значения в полученную формулу: Q = 393,5 + 2 ∙ 285,8 – 74,8 = 890,3 кДж.
Второй способ – через стандартные теплоты сгорания.
Гораздо проще решить эту задачу через Q сгор. Так как из всех веществ в данной системе только метан – горючий, то Q сгор воды, углекислого газа и кислорода равна нулю. По таблице стандартных теплот сгорания Q сгор (CH 4 ) = 890,3 кДж/моль, значит Q = 890,3 кДж.
Кроме такой характеристики системы, как энтальпия H , существует энтропия S. С одной стороны, каждая система стремится к более устойчивому, упорядоченному состоянию, соответствующему минимуму внутренней энергии, с другой – система состоит из огромного числа частиц, которые находятся в беспорядочном и непрерывном движении. Мерой упорядоченности состояния системы является ∆ Н , мерой неупорядоченности – энтропия S . Чем выше температура, чем больше объем системы, тем сильнее неупорядоченность и больше энтропия, и наоборот. Состояние веществ вблизи абсолютного нуля можно считать максимально упорядоченным – S → 0 . В отличие от Н абсолютное значение S можно найти. Значение стандартных энтропий приводится в таблицах. Например, S 0 298 (H 2 ) = 130,5 Дж/моль ∙ К, a S 0 298 (Z n O) = 43,6 Дж/моль ∙ К .
В ходе химических реакций энтропия системы меняется, ее изменение ∆ S можно рассчитать.
Вследствие стремления системы к состоянию с минимальной энергией частицы проявляют тенденцию к сближению, взаимодействию друг с другом, образованию прочных агрегатов, уменьшению объема. Тепловое движение, напротив, вызывает разброс частиц, увеличивая объем системы. Каждая из этих противоположных тенденций зависит от природы веществ и условий протекания процесса (t 0 , давления, концентрации веществ и т.д.). Сравнение этих тенденций позволяет определить направление процесса. ∆Н – энтальпийный фактор, ∆S ∙ T – энтропийный фактор, при ∆Н = T∆S система находится в состоянии равновесия.
Разница ∆Н и T∆S называется энергией Гиббса. ∆G = ∆Н – T∆S [кДж/моль]. Стандартная энергия Гиббса – табличная величина.
Таким образом, используя данные таблиц, можно определить ∆Н , ∆S и AG любого процесса и сделать вывод о возможности его протекания по таблице:
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Воспитательная: формировать умение работать самостоятельно и в коллективе – в парах или в командах
на примерах обратимых реакций закрепить умения учащихся в использовании принципа Ле Шателье для смещения химического равновесия реакции.
закрепить умения учащихся определять степени окисления элементов в соединении и составление уравнений реакций при помощи электронного баланса.
закрепить умения учащихся составлять уравнения диссоциации веществ и уравнений реакций в ионно - молекулярном виде.
Тип урока: обобщение полученных знаний.
I. Организации класса.
II . Актуализация знаний уч-ся:
Мы закончили изучение ещё одной темы. Напомните, что это за тема?
А какой вывод из этого можно сделать?
Ответ: значит, мы должны всё по этой теме повторить, систематизировать и обобщить, чтобы подготовиться к контрольной работе.
Вы совершенно точно сформулировали цель сегодняшнего урока. Именно этим мы и займёмся.
Назовите известные вам типы химических реакций.
- По числу и составу исходных веществ и продуктов реакции
- По направлению протекания реакций
- По наличию поверхности раздела среды
-. По тепловому эффекту
- . По изменению степени окисления
- Реакции ионного обмена
Выполнение заданий по раздаточному материалу.
Определить типы химических реакций: (Работа в группах) Заполнить дорожную карту.
по изменению числа и состава реагентов и продуктов реакции;
по тепловому эффекту химической реакции;
по участию катализатора;
по обратимости реакции;
по изменению степеней окисления элементов соединений в реакции:
в ) ZnO + 2HCl = ZnCl 2 + H 2 O + Q
г ) CuCl 2 + Fe = FeCl 2 + Cu
Решить задачу . Термохимическое уравнение реакции сгорания ацетилена
Сколько теплоты выделится, если будет израсходовано: а) 13 г ацетилена; б) 1,12л ацетилена; в) 1 моль ацетилена.
В каком направлении сместится равновесие химической реакции:
а) понизить ( ) температуру (Вправо)
б) повысить ( ) давление Р
в) повысить ( ) концентрацию кислорода | O 2 |
г) понизить ( ) концентрацию хлороводорода | HCl |
д) повысить ( ) концентрацию воды | H 2 O |
Расставить степени окисления элементов в соединениях:
Составить уравнение химической реакции при помощи электронного баланса, указать окислитель и восстановитель :
7 Практическая работа по группам. Составить уравнения реакций в ионно – молекулярном виде между. Указать признаки реакции.
а) карбонатом натрия и соляная кислота
б) серной кислотой и нитратом бария;
в) гидроксид натрия и сульфатом меди (II)
Уравнения записать на доске.
Приборы и материалы: растворы веществ, пробирки
Домашнее задание : повт. пар. 12-19, задания индивидуальные по раздаточному материалу
Определить типы химических реакций:
1) изменению числа и состава реагентов и продуктов реакции;
2) по тепловому эффекту химической реакции;
3) по участию катализатора;
4) по обратимости реакции;
5)по изменению степеней окисления элементов соединений в реакции:
а ) 3H 2 + N 2 – Fe, t 0C, P 2NH 3 + Q
2.Решить задачу. При сжигании серы получено 64 г оксида серы (IV), при этом выделилось теплоты 292, 6 кДж. Составьте термохимическое уравнение этой реакции.
3. В каком направлении сместится равновесие химической реакции:
3H 2 + N 2 – Fe, t 0C, P 2NH 3 + Q, если
а) понизить ( ) температуру
б) повысить ( ) давление Р
в) повысить ( ) концентрацию кислорода | Н 2 |
г) понизить ( ) концентрацию хлороводорода | NH 3 |
д) повысить ( ) концентрацию воды | N 2 |
4. Расставить степени окисления элементов в соединениях:
5 .Составить уравнение химической реакции при помощи электронного баланса, указать окислитель и восстановитель :
а ) MnS + HNO 3 конц . = MnSO 4 + NO 2 + H 2 O
Составить уравнения диссоциации электролитов:
7 Составить уравнения реакций в ионно – молекулярном виде между:
а) карбонатом натрия и серной кислотой;
Определить типы химических реакций:
1) изменению числа и состава реагентов и продуктов реакции;
2) по тепловому эффекту химической реакции;
3) по участию катализатора;
4) по обратимости реакции;
5)по изменению степеней окисления элементов соединений в реакции:
г ) 3H 2 + N 2 – Fe, t 0C, P 2NH 3 + Q
г) CuCl 2 + Fe = FeCl 2 + Cu
2.Решить задачу . Термохимическое уравнение реакции сгорания ацетилена
Сколько теплоты выделится, если будет израсходовано: а) 13 г ацетилена; б) 1,12л ацетилена; в) 1 моль ацетилена.
3.Решить задачу. При сжигании серы получено 64 г оксида серы (IV), при этом выделилось теплоты 292, 6 кДж. Составьте термохимическое уравнение этой реакции.
4.В каком направлении сместится равновесие химической реакции:
а) понизить ( ) температуру
б) повысить ( ) давление Р
в) повысить ( ) концентрацию кислорода | O 2 |
г) понизить ( ) концентрацию хлороводорода | HCl |
д) повысить ( ) концентрацию воды | H 2 O |
5. Расставить степени окисления элементов в соединениях:
6.Составить уравнение химической реакции при помощи электронного баланса, указать окислитель и восстановитель :
б ) MnS + HNO 3 конц . = MnSO 4 + NO 2 + H 2 O
Составить уравнения диссоциации электролитов:
Составить уравнения реакций в ионно – молекулярном виде между:
а) карбонатом натрия и хлоридом кальция;
б) серной кислотой и нитратом бария;
в) хлоридом бария и сульфатом меди (II) .
III .По направлению протекания реакций
Обратимые(Принцип Ле Шателье)
IV . По наличию поверхности раздела
Гомогенные(Нет раздела фаз г-г, ж-ж)
Гетерогенные (есть граница раздела фаз г-т, ж-т)
V . По тепловому эффекту
VI .По изменению степени окисления
VII Реакции ионного обмена
2Na + +CO 3 2- +2H + +2Cl - -----2Na + +2Cl - +CO 2 +H 2 O
Образование М вещества (Н 2 О)
в ) 3H 2 + N 2 – Fe, t 0C, P 2NH 3 + Q
д ) CuCl 2 + Fe = FeCl 2 + Cu
г) ZnO + 2 HCl = ZnCl 2 + H 2 O + Q
II .Присутствие катализатора
в ) 3H 2 + N 2 – Fe, t 0C, P 2NH 3 + Q
III .По направлению протекания реакций
Обратимые(Принцип Ле Шателье)
в ) 3H 2 + N 2 – Fe, t 0C, P 2NH 3 + Q
г ) ZnO + 2HCl = ZnCl 2 + H 2 O + Q
IV . По наличию поверхности раздела
Гомогенные(Нет раздела фаз г-г, ж-ж)
в ) 3H 2 + N 2 – Fe, t 0C, P 2NH 3 + Q
Гетерогенные (есть граница раздела фаз г-т, ж-т)
г ) ZnO + 2HCl = ZnCl 2 + H 2 O + Q
д ) CuCl 2 + Fe = FeCl 2 + Cu
V . По тепловому эффекту
в ) 3H 2 + N 2 – Fe, t 0C, P 2NH 3 + Q
г ) ZnO + 2HCl = ZnCl 2 + H 2 O + Q
VI .По изменению степени окисления
в ) 3H 2 + N 2 – Fe, t 0C, P 2NH 3 + Q
д ) CuCl 2 + Fe = FeCl 2 + Cu
г ) ZnO + 2HCl = ZnCl 2 + H 2 O + Q
VII Реакции ионного обмена
Образование М вещества (Н 2 О)
IV . По наличию поверхности раздела
Гомогенные(Нет раздела фаз г-г, ж-ж)
Гетерогенные (есть граница раздела фаз г-т, ж-т)
V . По тепловому эффекту
VI .По изменению степени окисления
VII Реакции ионного обмена
Образование М вещества (Н 2 О)
- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 933 человека из 80 регионов

Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 24 человека из 17 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- ЗП до 91 000 руб.
- Гибкий график
- Удаленная работа
Дистанционные курсы для педагогов
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 611 043 материала в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
Свидетельство и скидка на обучение каждому участнику
Другие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
- 13.06.2019 434
- DOCX 44.7 кбайт
- 10 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Мелькова Валентина Михайловна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
40%
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
В приграничных пунктах Брянской области на день приостановили занятия в школах
Время чтения: 0 минут
Курские власти перевели на дистант школьников в районах на границе с Украиной
Время чтения: 1 минута
В Россию приехали 10 тысяч детей из Луганской и Донецкой Народных республик
Время чтения: 2 минуты
Отчисленные за рубежом студенты смогут бесплатно учиться в России
Время чтения: 1 минута
Время чтения: 2 минуты
Рособрнадзор предложил дать возможность детям из ДНР и ЛНР поступать в вузы без сдачи ЕГЭ
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.

Занятие позволит повторить знания о химических реакциях, правилах их составления, законе сохранения массы веществ.
Описание разработки
Задачи урока:
Образовательные: повторить знания о химических реакциях, правилах их составления, законе сохранения массы веществ, продолжить изучение классификации химических реакций, научиться определять их тип; закрепить формирование умений записывать уравнения.
Развивающие: продолжить работу по развитию интеллекта и мыслительных умений (умение анализировать, сравнивать и обобщать); развивать познавательный интерес посредством выполнении лабораторных опытов.
Ход урока.
1 этап. Организационный момент.
Ребята, давайте вспомним над какой темой мы сейчас работаем?
Что такое химическая реакция?
Как мы определяем, что прошла химическая реакция?
Какими сведениями о химической реакции вы владеете?
Как вы считаете, зная определение, признаки реакций мы можем поставить точку на этой теме, или у нас есть задачи, которые мы не решили? Какие?
- поработать над определение м типов реакций
- расставлять коэффициенты в уравнениях
- вспомнить как записываются реакции ионного обмена
- уравнивать реакции разными способами
2 этап. Целеполагание и мотивация.
Тогда открываем тетради. Записываем число и тему урока и начинаем…химический диктант.
1 тур. Химический диктант
1. К реакциям обмена относится

г. СrС13 + 3NaOH = Cr(OH)3 + 3NaCl
2. Реакцией нейтрализации можно назвать взаимодействие:
а. Уксусной кислоты с хлором в присутствии катализатора;
б. Муравьиной кислоты с аммиачным раствором оксида серебра;
в. Уксусной кислоты с цинком;
г. Уксусной кислоты с гидроксидом калия.
3. Реакциями замещения и присоединения соответственно являются
4. Реакция, уравнение которой СаСО3(к) → CaO(K) + CО2(г )-Q, относится к реакциям
а. соединения, экзотермическим;
б. разложения, эндотермическим;
в. соединения, эндотермическим;
г. разложения, экзотермическим.
5. Реакция, уравнение которой MgO(K) + CО2(Г) → MgCО3(K)+Q, относится к реакциям
а. соединения, экзотермическим;
б. разложения, эндотермическим;
в. соединения, эндотермическим;
г. разложения, экзотермическим.
Весь материал - в документе.
Содержимое разработки
Урок. Реакции, идущие с изменением состава вещества.
Задачи урока:
Образовательные: повторить знания о химических реакциях, правилах их составления, законе сохранения массы веществ, продолжить изучение классификации химических реакций, научиться определять их тип; закрепить формирование умений записывать уравнения.
Развивающие: продолжить работу по развитию интеллекта и мыслительных умений (умение анализировать, сравнивать и обобщать); развивать познавательный интерес посредством выполнении лабораторных опытов.
Тип урока: урок комплексного применения знаний.
методы организации и осуществления учебно-познавательной деятельности: словесные, репродуктивные, практические методы;
методы самостоятельной работы учащихся по осмыслению и усвоению нового материала: работа с алгоритмами;
методы учебной работы по применению знаний на практике и выработке умений и навыков: упражнения, лабораторная работа;
методы контроля (фронтальный опрос) и самоконтроля
Оборудование: индивидуальные листы, распечатки домашнего задания, инструкция к лабораторному опыту, листы формата А3, маркер.
Штатив, пробирки, растворы: уксусной кислоты, нитрата серебра, фосфата калия; карбонат кальция
2., серная кислота, свежеосажденный гидроксид меди (II), сульфат меди (II), железо, уксусная кислота, пробиркодержатель, стакан, пробирки,
1 этап. Организационный момент
Ребята, давайте вспомним над какой темой мы сейчас работаем?
Что такое химическая реакция?
Как мы определяем, что прошла химическая реакция?
Какими сведениями о химической реакции вы владеете?
Как вы считаете, зная определение, признаки реакций мы можем поставить точку на этой теме, или у нас есть задачи, которые мы не решили? Какие?
- поработать над определение м типов реакций
- расставлять коэффициенты в уравнениях
- вспомнить как записываются реакции ионного обмена
- уравнивать реакции разными способами
2 этап. Целеполагание и мотивация
Тогда открываем тетради. Записываем число и тему урока и начинаем…химический диктант.
1тур. Химический диктант
1. К реакциям обмена относится
2. Реакцией нейтрализации можно назвать взаимодействие:
Уксусной кислоты с хлором в присутствии катализатора;
Муравьиной кислоты с аммиачным раствором оксида серебра;
Уксусной кислоты с цинком;
Уксусной кислоты с гидроксидом калия
3. Реакциями замещения и присоединения соответственно являются

СН4 + С12 и С2Н2 + С12 →

CH3COONa + HC1→ и С6Н6 + Вr2
г. C8H16 + H2 и C2H6 + Cl2
4. Реакция, уравнение которой СаСО3(к) → CaO(K) + CО2(г )-Q, относится к реакциям
5. Реакция, уравнение которой MgO(K) + CО2(Г) → MgCО3(K)+Q, относится к реакциям
Когда вы выполняли задания разминки, какие знания вам помогли?
Если химики изучают классификацию химических реакций, то перефразируя слова известного поэта значит , это кому-нибудь нужно.
Итак вы можете видеть, на сколько правильно вы выполнили задания , обратите внимание на ошибки.
- Есть те ,кто выполнил задания без ошибок?
Я предлагаю вам познакомиться с именными реакциями названными в память о химиках – первооткрывателях новых методов синтеза веществ. Всего известно более 1000 именных органических, неорганических реакций. Их число продолжает увеличиваться. Вот некоторые из них (именные реакции) – (выступают Бабко Новрузов Новорок с презентацией)
В живой природе и химической лаборатории постоянно протекают химические реакции вот некоторые из них ( слайд с фотосинтезом и зеленым картофелем)
Очень химию мы любим!
Шеей вправо-влево крутим.
К знаниям найдем дорожку,
И попрыгаем немножко.
Есть в оксидах кислород –
Делай вправо поворот.
А в кислотах – водород!
Делай влево поворот.
Лакмус в щелочи синеет,
Шагом марш! Быстрей! Бодрее!
Есть гидроксогруппа в ней,
Сжали кулачки сильней!
Много разных есть солей,
Вы учиться не ленитесь,
Стоп, закончена зарядка,
Вдох и выдох для порядка.
И готовы вы опять
На вопросы отвечать.
Учитель выдает отрывок из произведения Г.Р.Хаггарда “Клеопатра”:
“… Она вынула из уха одну их тех жемчужин … и … опустила жемчужину в уксус. Наступило молчание, потрясенные гости, замерев наблюдали, как несравненная жемчужина медленно растворяется в крепком уксусе. Вот от ней осталось и следа, и тогда Клеопатра подняла кубок, покрутила его, взбалтывая уксус, и выпила весь до последней капли…”
(Учащийся демонстрирует эксперимент)
2.ищет информацию в интеренете формулу уксусной кислоты и жемчужины
3.записывает уравнение реакции
руководитель отчитывается(Почему Клеопатра не погибла, выпив уксус? Произошла реакция между кислотой и солью ( реакция обмена) в результате образовались новая кислота и новая соль…в кубке уже содержится не кислота , а соль. Демонстрирует уравнение реакции написанное на формате А3)
- А вот учитель литературы … скачала стих, да не тот…Зато ее мучает вопрос..А как можно разбогатеть на на фосфате серебра?
2группа – ученики класса выполняют лабораторный опыт соблюдая инструкцию по ТБ
«Царь зовет к себе Стрельца – удалого молодца,
И дает ему поручение государственного значения:
-Чтоб я стал опять богат, нужен мне серебра фосфат
Ночь даю тебе подумать, утром буду ждать доклад.
Не смогешь – кого винить? Должен я тебя казнить.
На раствор фосфата калия подействуем раствором нитрата серебра. Что наблюдаем? Напишите уравнение реакции в полном и сокращенном ионном виде. Соблюдаем правила техники безопасности при работе в химической лаборатории.
K3PO4 + AgNO3=KNO3 + Ag3PO4
Посмотрите, что я принесла? ( экспонаты с музея ржавые детали, пожелтевшие газеты)
- Вообще все экспонаты - это вещи из прошлого. И мы видим что внешний вид не новый.
- А какие изменения произошли с этими вещами по вашему мнению
А следовательно прошли химические реакции?
- А какие процессы лежат в основе этих изменений?
Чтобы решить, кто из нас был прав, выполним следующее задание
Какая из реакций является окислительно – восстановительной?
1.Определите степени окисления элементов;
2. Покажите переход электронов;
1)2Na + Cl2 = 2NaCl 2) 2NaCl + H2 SO4 = Na2 SO4 + 2HCl↑
3) Zn O+2HCl= Zn Cl2 + H2 O 4) H2SO4 + Ag2O= Ag2 SO4 + H2O
Zn + H2SO4 (разб.) → ZnSO4 + H2
- работаем с алгоритмом
- Проверяем по этанолу
Слайд с ответами:
Ну кто из нас был прав?
К какому выводу мы пришли?
- О чем мы говорили на уроке?
- А теперь каждый из вас обдумает и напишет…
Что вы теперь умеете делать?
Где вам могут пригодиться эти знания?
Чтобы каждый из вас смог устранить ошибки, устранить неясности в понимании темы, закрепить знания - я предлагаю задания. Уровень сложности каждый выбирает сам.
Информация о домашнем задании
Уравнение реакции Тип химической реакции
а) Al + O2→ Al2O3 Реакция……………..
б) MnO2 + H2→Mn + H2O Реакция……………..
в) H2O2→ H2 + O2 Реакция……………..
г) HNO3 + Fe(OH)3→ Fe(NO3)3 + H2O Реакция……………..
Уравнение реакции Тип химической реакции
б) MgO + H2SO4→……….. Реакция……………..
Уравнение реакции Тип химической реакции
а) HNO3 + Mg (OH) 2→………. Реакция……………..
б) FeCl3 + Zn→……….. Реакция……………..
г) KOH + Ca (OH) 2→ ………. Реакция……………..

-75%
Вспомните, чем отличаются химические явления или химические реакции от физических (Конспект).

Химические реакции, протекающие
без изменения состава веществ.
Одно из положений теории химического строения утверждает, что свойства веществ зависят не только от их качественного и количественного состава, но и от строения. Следовательно, можно сделать вывод, что некоторые химические реакции могут сопровождаться изменением только качественного или только количественного состава исходных и образующихся веществ или же изменением их строения.
На примере кислорода и озона можно проиллюстрировать философский закон о переходе количественных отношений в качественные. Вспомните и сравните физические, химические и физиологические свойства кислорода и озона.
Влияние строения простых веществ, образованных одним химическим элементом на их свойства, иллюстрируют аллотропные модификации углерода.
Процесс получения искусственных алмазов моделирует природные экстремальные явления: проводится при очень высоких давлениях и температурах.
Первые сведения об аллотропии и аллотропных модификациях связаны с фосфором. В 1669 г. алхимик Хеннинг Брант, прокаливая сухой остаток мочи в попытке получить философский камень, получил белый фосфор (от греч. phos — свет и phoros — несущий), который затем превратился в красный.
Химические реакции, протекающие
с изменением состава веществ
(по признаку числа и состава реагентов и продуктов реакции).
Из курса химии основной школы вы знаете четыре типа реакций по этому признаку: соединения, разложения, замещения и обмена.
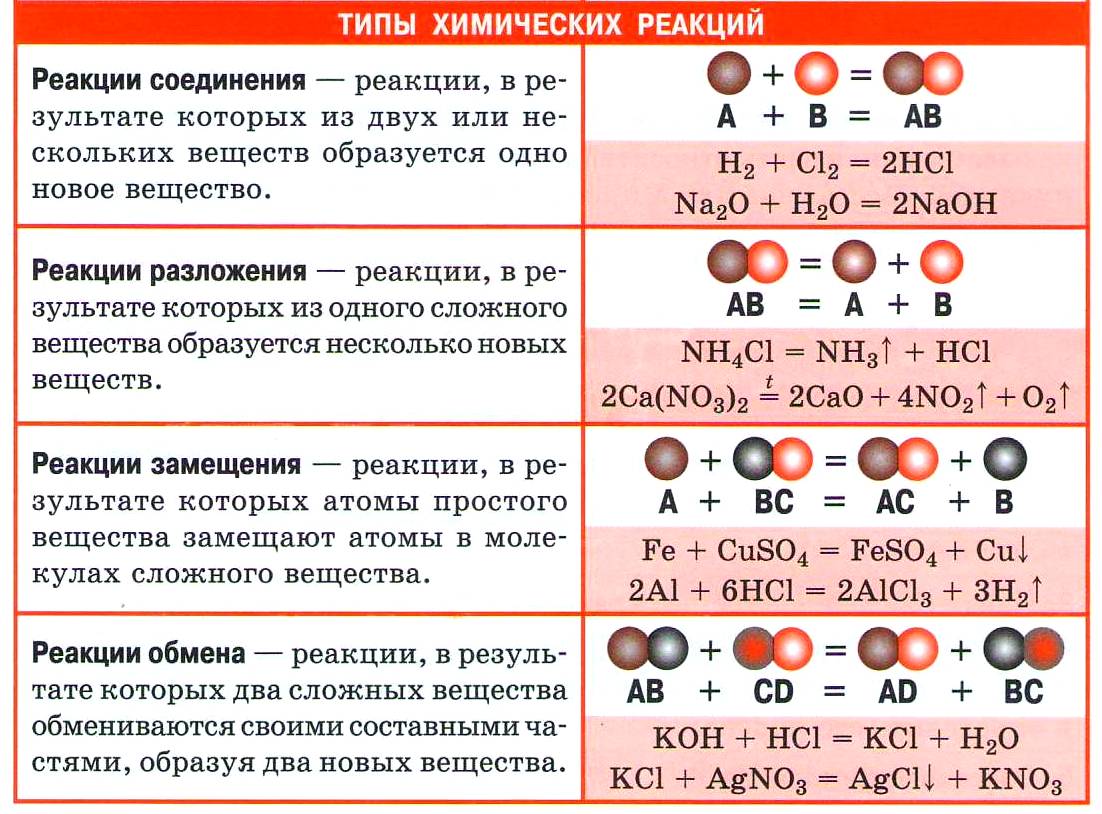
1. Реакции соединения (присоединения)
В неорганической химии весь спектр разнообразных реакций можно проиллюстрировать примерами промышленных процессов:
- Реакция горения фосфора — первая стадия получения чистой фосфорной кислоты: 4Р + 5O2 = 2Р2O5
В этом процессе участвуют два простых вещества и получается одно сложное.
- Заключительная стадия получения фосфорной кислоты описывается уравнением Р2O5 + 3Н2O = 2Н3РO4(сложное вещество образуется в результате взаимодействия двух сложных веществ).
- На заключительной стадии получения азотной кислоты в реакцию вступают три вещества (одно простое и два сложных): 4NO2 +O2 + 2Н2O = 4HNO3
В органической химии реакции соединения называются реакциями присоединения, так как к основному веществу (субстрату) присоединяется дополнительное вещество (реагент). Такие реакции характерны для непредельных углеводородов и в зависимости от реагента носят видовые названия:
- гидрирование — присоединение водорода;
- галогенирование — присоединение галогенов;
- гидрогалогенирование — присоединение галогеноводородов;
- гидратация — присоединение воды.
Частным случаем реакции присоединения является реакция полимеризации — соединение множества одинаковых молекул мономера в макромолекулу полимера.
2. Реакции разложения (отщепления)
Рассмотрим реакции разложения на примере реакций получения кислорода лабораторными способами.
Последняя реакция используется не для получения кислорода, а в медицинских целях. Полученное при разложении серебро прижигает ранки или удаляет бородавки, если используется особый ляписный (от лат. lapis infernalis — адский камень) карандаш.
В органической химии реакции разложения называют реакциями отщепления. Так, для получения этилена используются реакции дегидратации этанола, деполимеризации полиэтилена, дегидрирования этана (запишите уравнения реакций).
3. Реакции замещения
Как видно из определения, эти реакции характеризуют свойства классов простых веществ. Например, такое важное свойство галогенов, как их способность вытеснять менее активные галогены из растворов галогеноводородных кислот или их солей: Сl2 > Вг2 > I2.
Аналогично, этот тип реакций характеризует химические свойства металлов:
- Щелочные и щёлочноземельные металлы активно взаимодействуют с водой: 2Na + 2Н2O = 2NaOH + Н2↑
- С растворами кислот взаимодействуют металлы, стоящие в ряду напряжений до водорода: Zn + 2НСl = ZnCl2 + H2↑
- Металлы, стоящие в ряду напряжений до металла соли, вытесняют его из раствора соли: Fe +CuSO4 = Сu +FeSO4
- Более активные металлы вытесняют менее активные из их оксидов с выделением большого количества теплоты — металлотермия: 2Аl +Fe2O3 = Аl2O3 + 2Fe
Реакции замещения характерны для предельных соединений, например галогенирование метана, согласно цепочке переходов: СН4 –> СН3Сl –> СН2Сl2 –> СНСl3 –> ССl4.
Нитрование бензола относится к реакциям замещения, но протекает между двумя сложными веществами: С6Н6 + HNO3 —> C6H5NO2 + Н2O
В органической химии продуктами реакций этого типа являются не простое и сложное вещества, а два сложных. Кроме этого, в реакцию замещения могут вступать и сложные вещества.
4. Реакции обмена
Для растворов электролитов такие реакции протекают в соответствии с правилом Бертолле (названным по имени предложившего его французского химика Клода Бертолле) и возможны в том случае, если образуется осадок, газ или малодиссоциирующее вещество (например, вода).
- Золотисто–жёлтый осадок иодида свинца выпадает при взаимодействии растворов иодида натрия и нитрата свинца:
2NH4Cl + Са(ОН)2 = СаСl2 + 2NH3↑ + 2Н2O
NH4 + + ОН – = NH3↑ + Н2O
- Частным случаем реакции обмена является реакция нейтрализации — она протекает между растворами кислот и щелочей:
NaOH + НСl = NaCl + Н2O
OH – + H + = H2O
Химические реакции, протекающие
с тепловым эффектом.
Важный классификационный признак реакций — выделение или поглощение теплоты. Как правило, реакции соединения сопровождаются выделением теплоты. Такие реакции называются экзотермическими.
Если экзотермическая реакция сопровождается выделением света, то она называется реакцией горения: 2Mg + О2 = 2MgO + Q
Важным источником теплоты и энергии является горение углеводородов: СН4 + 2О2 –> СО2↑ + 2Н2О + Q
Но нет правил без исключения: реакция взаимодействия азота с кислородом сопровождается поглощением теплоты: N2 + О2 2NO – Q
Схематично экзо- и эндотермические реакции отражает рисунок.
Если в уравнении реакции указывается тепловой эффект, то уравнение называется термохимическим.
Например:
СН4 + 2О2 —> СO2 + 2Н2O + 800 кДж — реакция экзотермическая;
СаСO3 = СаО + СO2 – 187 кДж — реакция эндотермическая.
Классификация реакций по другим критериям
Классификация реакций — многоплановый процесс. Их можно классифицировать также:
- по направлению (обратимые и необратимые реакции);
- по использованию катализатора (каталитические и некаталитические реакции);
- по агрегатному состоянию реагентов и продуктов реакции (гомогенные и гетерогенные реакции);
- по изменению степеней окисления элементов, образующих реагенты и продукты реакции (окислительно–восстановительные и реакции, протекающие без изменения степеней окисления).

Читайте также:
- Конспект урока по русскому языку 5 класс повторение по теме имя прилагательное
- Э шим весело или грустно конспект урока
- Конспект урока 9 класс жуковский море
- Конспект нод по физкультуре в подготовительной группе на тему ходьба и бег между предметами
- Конспект урока чиновничество и его пороки страх чиновников перед ревизором

