Окислительно восстановительные реакции 11 класс конспект урока
Обновлено: 07.07.2024
Ключевые слова конспекта по химии для 9 класса: степень окисления, окислительно-восстановительные реакции, метод электронного баланса, окисление, восстановление.
В ходе огромного множества химических реакций происходит переход электронов от одних веществ к другим. Такие реакции называют окислительно-восстановительными. Формальным признаком таких реакций является изменение степеней окисления элементов.
Степень окисления соответствует заряду, который возник бы на атоме данного элемента в химическом соединении, если предположить, что все электронные пары, за счёт которых этот атом связан с другими атомами, полностью сместились к атомам элементов с большей электроотрицательностью.
Таким образом, при вычислении степени окисления мы представляем себе, что все ковалентные полярные связи превратились в ионные. Степень окисления – это формальная характеристика элемента в химическом соединении, используемая при составлении уравнений окислительно-восстановительных реакций методом электронного баланса.
Степень окисления элемента в простом веществе равна нулю. В сложном соединении алгебраическая сумма степеней окисления каждого из атомов равна нулю, в случае сложного иона – заряду иона.
Постоянные степени окисления в сложных веществах у следующих элементов:
- +1 — все элементы IA группы (Li, Na, К, Rb, Cs), в большинстве соединений Ag;
- +2 — все элементы IIA и IIВ групп (кроме ртути);
- +3 — алюминий Аl;
- –1 — фтор F;
- –2 — кислород (за исключением фторидов кислорода OF2 и O2F2, в которых его степень окисления положительна; пероксидов, в которых она равна –1 (например, Н2O2, Na2O2); супероксидов КO2 и т. п.).
Водород в соединениях с неметаллами имеет степень окисления +1, в бинарных соединениях с металлами (в гидридах) –1.
Высшая положительная степень окисления элементов II–VII групп (кроме фтора и кислорода) равна номеру группы.
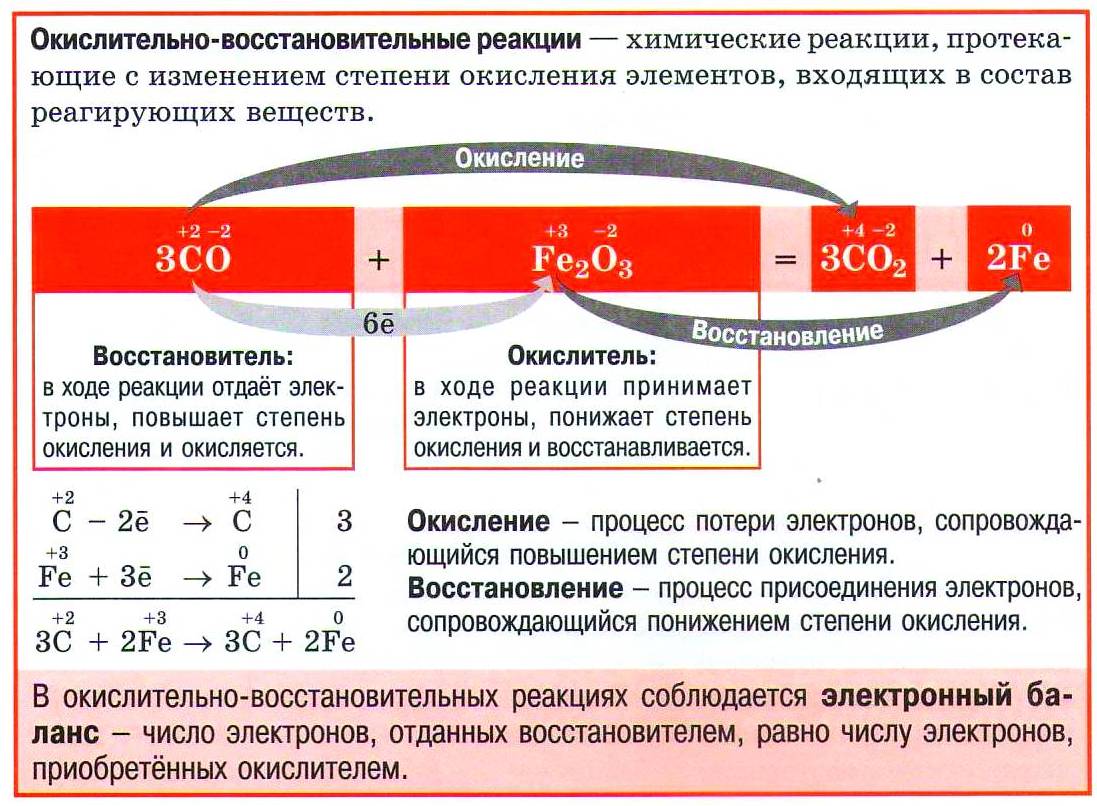
Окислительно-восстановительные реакции (ОВР) – реакции, в ходе которых изменяются степени окисления элементов вследствие перехода электронов от восстановителя к окислителю.
Окислитель – вещество, атомы, молекулы или ионы которого принимают электроны. Восстановитель – вещество, атомы, молекулы или ионы которого отдают электроны.
Окисление – процесс отдачи электронов атомом, молекулой или ионом, степень окисления элемента повышается. Восстановление – процесс приёма электронов атомом, молекулой или ионом, степень окисления элемента понижается.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Конспект урока по химии подготовила: учитель высшее категории Икренникова Г.В.
Цель: углубить и расширить знания учащихся о составлении окислительно-восстановительных реакций методом электронного баланса, показать возможность образования кислоты или щелочи в ходе реакции
Закрепить умение определять степени окисления элементов, окислитель и восстановитель, расставлять коэффициенты методом электронного баланса.
Совершенствовать умение определять окислительно-восстановительные свойства веществ, прогнозировать продукты реакций в зависимости от активности металлов, концентрации кислот и реакции среды раствора.
Выработать умение составлять уравнения химических реакций, протекающих в различных средах на примере соединений марганца.
Продолжить подготовку к ЕГЭ по химии.
Оборудование: 3-химических стакана,(50мл) промывалка с дистиллированной водой,растворы перманганата калия ,иодида калия, сульфита натрия,сульфата марганца, гидроксида натрия ,серной кислоты,Лбаратория Архимед,датчики: температурный,рН растворов
ХОД УРОКА : Окислительно-восстановительные реакции принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Важнейшие процессы на планете связаны с этим типом химических реакций. Человечество давно пользовалось ОВР, вначале не понимая их сущности. Лишь к началу XX века была создана электронная теория окислительно – восстановительных процессов. На уроке предстоит вспомнить основные положения этой теории, метод электронного баланса, научиться составлять уравнения химических реакций, протекающих в растворах, и выяснить от чего зависит механизм таких реакций.
Для вас тема ОВР не нова, она проходит красной нитью через весь курс химии. Поэтому предлагаю повторить некоторые понятия и умения по данной теме.
/ Степень окисления – это условный заряд атома химического элемента в соединении, вычисленный на основе предположения, что все соединения состоят только из ионов. Степень окисления может быть положительной, отрицательной или равняться нулю, что зависит от природы соответствующих соединений./ Следует помнить, что в целом молекула электронейтральна, поэтому в любой молекуле алгебраическая сумма степеней окисления равна нулю, а в сложном ионе – заряду иона.
. Окислительно – восстановительные реакции – это такие реакции, в которых одновременно протекают процессы окисления и восстановления и, как правило, изменяются степени окисления элементов./
Окислительно - восстановительные реакции – это такие реакции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим.
Окисление – это процесс отдачи электронов, степень окисления при этом повышается.
Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.
Атомы, молекулы или ионы, отдающие электроны, окисляются; являются восстановителями.
Атомы, ионы или молекулы, принимающие электроны, восстанавливаются; являются окислителями.
Окисление всегда сопровождается восстановлением, восстановление связано с окислением.
Окислительно – восстановительные реакции – единство двух противоположных процессов: окисления и восстановления.
Лабораторный опыт: (правила ТБ)
В четыре пронумерованные пробирки налито по 1-2 мл разбавленного раствора перманганата калия. В первую пробирку добавьте несколько капель раствора серной кислоты, во вторую – воду, в третью – гидроксид калия, четвертую пробирку оставьте в качестве контрольной. Затем в первые три пробирки прилейте, осторожно взбалтывая, раствор сульфита натрия. Отметьте. Как изменяется окраска раствора в каждой пробирке. (слайды 7, 8)
Результаты лабораторного опыта:
Продукты восстановления KMnO 4 (MnO 4 - ):
в кислой среде – Mn +2 (соль), бесцветный раствор;
в нейтральной среде – MnO 2 , бурый осадок;
в щелочной среде - MnO 4 2- , раствор зеленого цвета.
в кислой восстанавливается до Mn+2 , в нейтральной – до MnO2, в щелочной – до K2MnO4
Подберите коэффициенты методом электронного баланса.
а ) KI + К MnO4 + . . . —>MnSO4+ I2 + K 2SO4 + H2O
Ответ: т.к в результате реакции получается Mn+2 , следовательно процесс протекает в кислой среде с участием серной кислоты и образуется сульфат калия.
10KI + 2 К MnO4 + 8H2SO4 = 2MnSO4+ 5 I2 + 6K 2SO4 +8 H2O
2I-1 -2e —> I20 5 - окисление, восстановитель
Цель: Развить представление школьников о гидролизе солей, ввести количественную характеристику данного процесса
Образовательные – сформировать представление о гидролизе солей, рассмотреть факторы, влияющие на смещение химического равновесия гидролитических реакций, установить взаимосвязи между строением и свойствами солей;
Развивающие – развивать умения писать уравнения гидролиза, определять среду растворов, устанавливать образование кислых или основных солей в реакциях, экспериментальным путем определять рН среды, анализировать, сравнивать, объяснять полученные результаты.
Воспитательные – формировать умения работать в группе.
Тип урока: изучение нового материала.
Методы обучения: эвристический, экспериментально-исследовательский.
Оборудование и реактивы: таблицы “Окраска индикаторов”, “Степень диссоциации кислот и щелочей”, “Растворимость солей, кислот и оснований в воде”;Температурный датчик,датчик рН, 5стаканов(50мл),промывалка,лаборатория Архимеда,растворы:карбоната натрия,хлорида железа(ш),хлорида железа(ц),фосфата натрия,гидрофосфата натрия,дигидрофосфата натрия, на столах учащихся: растворы солей NaCl, Al(NO 3 ) 3 , Nа 2 СО 3, NaHSO 4 , NaHCO 3, Na 3 PO 4 , Na 2 HPO 4 , NaH 2 PO 4 , универсальная индикаторная бумага
Планируемые результаты обучения: на изученных примерах уметь объяснять сущность гидролиза солей, записывать краткие и полные ионные уравнения реакций гидролиза, объяснять изменение кислотности среды и образование кислых или основных солей в этом процессе; объяснять процессы, протекающие в растворах, применять принцип Ле-Шателье для объяснения процессов гидролиза.
Ход урока: Как и любой вопрос, имеющий большое практическое значение и применение, основан на теории, а именно теории протекания химических явлений, теории растворов . Разминка.
Назовите формулы сильных оснований.
Назовите формулы слабых оснований.
Назовите формулы сильных кислот.
Назовите формулы слабых кислот.
По какому признаку эти вещества классифицируют на сильные и слабые?
Какие ионы образуются при диссоциации оснований?
Какова среда раствора в данном случае?
Какие ионы образуются при диссоциации кислот?
Какова среда раствора?
Сделайте вывод, присутствие каких ионов обуславливает щелочную и кислотную реакцию среды.
Как изменится цвет лакмуса в щелочной и кислотной среде?
Химический эксперимент (работа в парах)
Перед вами четыре пробирки, в которых растворы кислоты, щелочи, дистиллированная вода, водопроводная вода. Подтвердим ваши ответы экспериментом. При работе не забывайте о правилах ТБ при обращении с химическими веществами.
1. Возьмите пробирку № 1 с раствором воды опустите в неё универсальную индикаторную бумагу.
2. Отметьте цвет индикаторной бумаги, сделайте вывод.
3. Возьмите пробирку № 2 с раствором кислоты опустите в неё универсальную индикаторную бумагу.
4. Отметьте цвет индикаторной бумаги, сделайте вывод.
5. Возьмите пробирку № 3 с раствором щёлочи опустите в неё универсальную индикаторную бумагу.
6. Возьмите пробирку № 4 с раствором дистиллированной воды опустите в неё универсальную индикаторную бумагу.
7. Отметьте цвет индикаторной бумаги, сделайте вывод.
Какова окраска универсальной индикаторной бумаги в пробирках? Результаты реакций в 1-3 пробирках мы легко можем объяснить. А как объяснить слабощелочную реакцию среды в пробирке с водопроводной водой? Вспомним, в чем различие дистиллированной воды и воды водопроводной. (присутствие растворенных солей). Значит, окраску лакмуса обуславливает наличие в воде растворенных солей. Можем ли мы, основываясь на имеющихся знаниях, объяснить результаты 4 опыта? Действительно, вы столкнулись с неизвестным пока для вас явлением, которое не можете грамотно истолковать на основании имеющегося у вас опыта и знаний. Это явление – гидролиз солей в водных растворах, и ему мы посвятим сегодняшний урок. Всегда ли нейтральны водные растворы солей? Вода – нейтральна, потому что содержит ионы водорода и ионы гидроксила в равных количествах.
H 2 O = H + + OH –
Смещается ли равновесие при растворении в воде солей? Напомним, что при избытке ионов водорода H + среда получается кислой, при избытке ионов гидроксила OH – щелочной. Соли состоят из двух ионов: катиона – положительно заряженного иона и аниона – отрицательно зараженного иона. Кислоты и основания бывают слабыми, малорастворимыми, и сильными растворимыми. Если соль образована равными по силе кислотой и основанием, раствор такой соли нейтрален. Когда силы не равны - кислотность определяет сильнейший. При растворении в воде многие соли способны смещать равновесие: H 2 O → H + + OH -
В ту или другую сторону вследствие взаимодействия между ионами соли и молекулами воды. Этот процесс называется гидролизом. Гидролиз соли- этообратимая обменная реакция, в которой изменяется концентрация ионов H +
раствора.Ее важной характеристикой является степень гидролиза- отношение количества гидрализованной соли к общему количеству соли, введенной в раствор. Мы знаем, что соли – производные кислот и оснований. Растворимая соль в воде диссоциирует на составляющие ее ионы.Нитрат алюминия – соль, образованная слабым основанием и сильной кислотой, диссоциирует следующим образом
Очевидно, что в растворе данной соли противоположно заряженные ионы объединятся.
Al 3+ + 3NO 3 - + 3H + + 3OH - . →Al (OH) 3 +3 H + + 3 NO 3 -
Катионы алюминия прочно связывают гидроксид-ионы, так как гидроксид алюминия слабое основание и не подвергается диссоциации. Нитрат-ионы не могут быть связаны катионами водорода, так как азотная кислота – сильная и диссоциирует полностью. В результате – в растворе избыток катионов водорода, вследствии этого – среда раствора кислотная. Al(NO 3 ) 3 →Al(OH) 3 + HNO 3 слабое основание сильная кислота [OH - ] + ] Кислотная среда .
Для того, чтобы записать уравнение гидролиза, воспользуемся памяткой. 1. Определим состав соли: Al(NO 3 ) 3 сл. осн, с. к-та
2. Возьмем ион слабого электролита и напишем уравнение его взаимодействия с составными частями воды:
Al 3+ +3 HOH → Al (OH) 3 +3 H +.
На основании краткого ионного уравнения напишем молекулярное уравнение. Исходные вещества известны – соль и вода, продукты гидролиза составим, связывая образовавшиеся ионы с теми ионами соли, которые не участвуют в гидролизе:
Al (NO 3 ) 3 + H 2 O →AlOH(NO 3 ) 2 + HNO 3. Одним из продуктов данной обменной реакции является основная соль.
Сформулируем вывод: Раствор соли, образованной слабым основанием и сильной кислотой, имеет кислотную реакцию, так как в растворе избыток катионов водорода.
Карбонат натрия – соль, образованная сильным основанием и слабой кислотой, диссоциирует следующим образом
Карбонат-ионы прочно связывают катионы водорода, так как угольная кислота слабая. Катионы натрия не могут быть связаны гидроксид-ионами, так как гидроксид натрия – сильное основание и диссоциирует полностью.
2Na + + CO 3 2- + H + + OH - . →HCO 3 - + 2Na + + OH -
В результате в растворе избыток гидроксид-ионов, вследствие чего среда щелочная.
сильное основание слабая кислота [OH-] > [H + ] Щелочная среда Воспользовавшись памяткой, самостоятельно составьте молекулярное уравнение гидролиза карбоната натрия.
CO 3 2- + H + + ОН - →HCO 3 - + OH -
Одним из продуктов данной обменной реакции является кислая соль. Сформулируем вывод: Раствор соли, образованной сильным основанием и слабой кислотой, имеет щелочную реакцию, так как в растворе избыток гидроксид-ионов.
Хлорид натрия – соль, образованная сильным основанием и сильной кислотой.
Хлорид натрия гидролизу не подвергается, так как в составе соли нет иона, который мог бы при взаимодействии с водой образовывать слабый электролит.
сильное основание сильная кислота [OH - ] ═ [H + ] Среда нейтральная Сформулируем вывод: Раствор соли, образованной сильным основанием и сильной кислотой, имеет нейтральную реакцию, так как в растворе равное количество катионов водорода и гидроксид-ионов.
Случай, когда соль образована слабым основанием и слабой кислотой более сложный и будет рассмотрен. Продукты гидролиза зависят от соотношения констант диссоциации основания и кислоты. Отмечу лишь, что зачастую гидролиз в данном случае идет необратимо, соль полностью разлагается водой. В этом случае в таблице растворимости в ячейке соответствующей соли стоит прочерк.
объяснение гидролиза сульфида алюминия.
Итак, гидролиз – это реакция обмена между некоторыми солями и водой приводящая к образованию слабого электролита.
III. ЗАКРЕПЛЕНИЕ
Можно ли по составу соли сделать заключение о возможности ее гидролиза? Это возможно с помощью таблицы растворимости. Нерастворимые соли гидролизу практически не подвергаются. Если соль в воде растворима, то следует выяснить, входит ли в ее состав катион, отвечающий слабому основанию, или анион, отвечающий слабой кислоте. Так отчего же водопроводная вода имеет слабощелочную среду? Из-за гидролиза солей, которые в качестве примесей имеются в водопроводной воде. Можем предположить, что это соли, образованные слабым основанием и сильной кислотой. Предлагаю в качестве домашнего задания следующее: выяснить из дополнительных источников , какие соли находятся в нашей воде и составить уравнения их гидролиза.
Этапы урока
Деятельность учителя
Деятельность учащихся
1. Актуализация знаний
Организует работу с текстом (мотивирует на изучение темы “Гидролиз солей”.
определяют тему урока и задачи.
2. Изучение нового материала
Организует выполнение лабораторной работы №1: Испытайте предложенные растворы солей NaCl, АlCl 3 , Nа 2 СО 3 универсальной индикаторной бумагой. Определите характер среды. Объясните полученные результаты. Предоставляет инструкцию, напоминает учащимся о правилах ТБ.
Выполняют лабораторный опыт №1. Определяют характер среды. Приходят к выводу о недостаточности имеющихся знаний для объяснения полученных результатов.
Организует беседу для решения возникших у учеников затруднений в объяснении полученных результатов:
- Что происходит с солями в растворе? (диссоциация)
- Какие частицы находятся в растворе? (катионы и анионы)
- Возможно ли взаимодействие ионов соли с полярными молекулами воды? В каких случаях оно возможно? (образование малодиссоциирующих частиц)
Приходят к выводу о взаимодействии ионов солей с молекулами воды, в результате чего в растворе накапливаются ионы водорода или гидроксид-ионы.
Организует работу учащихся с текстом “Гидролиз солей” , консультирует учащихся.
Изучают процессы гидролиза солей, записывают уравнения гидролиза. Работают в группах, при необходимости обращаются к учителю за консультацией.
Организует выполнение лабораторного опыта №2. Определите характер среды водных растворов гидросульфата натрия NaHSO 4 и гидрокарбоната натрия NaHCO 3 . Объясните полученные результаты. Запишите уравнения протекающих реакций.
Выполняют лабораторный опыт №2. Анализируют состав солей, процессы гидролиза, записывают уравнение гидролиза:
Организует беседу по вопросам:
- Угольная кислота нестойкая. Почему же не наблюдается выделение углекислого газа? (обратимый процесс)
- Какому принципу подчиняется состояние обратимых систем? (принцип Ле-Шателье)
- Как усилить гидролиз? (разбавление, повышение температуры)
Отвечают на вопросы.
Применяют принцип Ле-Шателье для гидролитических процессов.
Организует выполнение опыта лаборатория Архимеда рН датчик: Испытание раствора фосфата натрияNa 3 PO 4, гидрофосфата натрия Na 2 HPO 4 и дигидрофосфата натрия NaH 2 PO 4 ..Запишите полученные результаты.
Записывают полученные результаты.
Представляет учащимся таблицу для объяснения полученных результатов.
Приводит учащихся к выводу о том, что характер среды в растворах кислых солей зависит от соотношения констант диссоциации и гидролиза.
Анализируют таблицу и записывают процессы, происходящие в растворах солей.
3. Первичный контроль
Предоставляет учащимся тестовые задания
Работают в группах, обсуждают результаты, осуществляют взаимопроверку и самопроверку.
4. Домашнее задание
Предлагает и комментирует домашнее задание: выучить теорию и ответить на вопрос: Возможна ли реакция между цинком и хлоридом цинка?
Записывают домашнее задание.
1. Габриелян О.С. Настольная книга для учителя химии. 11 класс. – М.: Блик плюс, 2000.
3. Сгибнева Е.П., Скачков А.В. Современные открытые уроки химии (Серия “Школа радости”) – Ростов н/Д: изд-во “Феникс”, 2002.
Цель урока: Обобщить, систематизировать и расширить знания учащихся об окислительно-восстановительных реакциях, важнейших окислителях и продуктах их восстановления.
1. Организационный момент
Учитель: Добрый день! Хорошего вам настроения!
Окислительно-восстановительные реакции принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Важнейшие процессы на планете связаны с этим типом химических реакций. Человечество давно пользовалось ОВР, вначале не понимая их сущности. Лишь к началу XX века была создана электронная теория окислительно – восстановительных процессов. На уроке предстоит вспомнить основные положения этой теории, метод электронного баланса, научиться составлять уравнения химических реакций, протекающих в растворах, и выяснить от чего зависит механизм таких реакций.
2. Повторение и обощение изученного ранее материала
Учитель: Для вас тема ОВР не нова, она проходит красной нитью через весь курс химии. Поэтому предлагаю повторить некоторые понятия и умения по данной теме.
Ученик: Степень окисления – это условный заряд атома химического элемента в соединении, вычисленный на основе предположения, что все соединения состоят только из ионов. Степень окисления может быть положительной, отрицательной или равняться нулю, что зависит от природы соответствующих соединений.
Одни элементы имеют постоянные степени окисления, другие — переменные.
Например, к элементам с постоянной положительной степенью окисления относят щелочные металлы: Li +1 , Na +1 , K +1 , Rb +1 , Cs +1 , Fr +1 , следующие элементы II группы периодической системы: Ве +2 , Mg +2 , Ca +2 , Sr +2 , Ва +2 , Ra +2 , Zn +2 , а также элемент III А группы - А1 +3 и некоторые другие. Металлы в соединениях всегда имеют положительную степень окисления.
Из неметаллов постоянную отрицательную степень окисления (-1) имеет F.
В простых веществах, образованных атомами металлов или неметаллов, степени окисления элементов равны нулю, например: Na°, Al°, Fe°, Н2, О2, F2, Cl2, Br2.
Для водорода характерны степени окисления: +1 (Н20), -1 (NaH).
Для кислорода характерны степени окисления: -2 (Н20), -1 (Н2О2), +2 (OF2).
Следует помнить, что в целом молекула электронейтральна, поэтому в любой молекуле алгебраическая сумма степеней окисления равна нулю, а в сложном ионе – заряду иона.
Например, рассчитаем степень окисления хрома в дихромате калия K2Cr2O7.
Проверка: алгебраическая сумма положительных и отрицательных степеней окисления элементов равна нулю, молекула электронейтральна.
Учитель: Самостоятельная работа № 1 по инструктивной карте: пользуясь приведенными сведениями, рассчитайте степени окисления элементов в соединениях: MnO2, H2SO4, K2SO3, H2S, KMnO4. (Приложение 2).
Ученик: Окислительно – восстановительные реакции – это такие реакции, в которых одновременно протекают процессы окисления и восстановления и, как правило, изменяются степени окисления элементов.
Рассмотрим процесс на примере взаимодействия цинка с разбавленной серной кислотой:

При составлении этого уравнения используется метод электронного баланса. Метод основан на сравнении степеней окисления атомов в исходных веществах и продуктах реакции. Основное требование при составлении уравнений этим методом: число отданных электронов должно быть равно числу принятых электронов.
Учитель: Самостоятельная работа № 2 по инструктивной карте: методом электронного баланса найдите и поставьте коэффициенты в следующей схеме окислительно –восстановительной реакции:
Учитель: Однако научиться находить коэффициенты в ОВР еще не значит уметь их составлять. Нужно знать поведение веществ в ОВР, предусматривать ход реакций, определять состав образующихся продуктов в зависимости от условий реакции.
Ученик: Для того чтобы разобраться, в каких случаях элементы ведут себя как окислители, а в каких – как восстановители, нужно обратиться к периодической системе Д.И.Менделеева. Если речь идет о простых веществах, то восстановительные свойства должны быть присущи тем элементам, которые имеют больший по сравнению с остальными атомный радиус и небольшое (1 - 3) число электронов на внешнем энергетическом уровне. Поэтому они могут сравнительно легко их отдавать. Это в основном металлы. Наиболее сильными восстановительными свойствами из них обладают щелочные и щелочноземельные металлы, расположенные в главных подгруппах I и II групп (например, натрий, калий, кальций и др.).
Наиболее типичные неметаллы, имеющие близкую к завершению структуру внешнего электронного слоя и значительно меньший по сравнению с металлами того же периода атомный радиус, довольно легко принимают электроны и ведут себя в окислительно-восстановительных реакциях как окислители. Наиболее сильными окислителями являются легкие элементы главных подгрупп VI – VII групп, например фтор, хлор, бром, кислород, сера и др.
Вместе с тем надо помнить, что деление простых веществ на окислители и восстановители так же относительно, как и деление на металлы и неметаллы. Если неметаллы попадают в среду, где присутствует более сильный окислитель, то они могут проявлять восстановительные свойства. Элементы в разных степенях окисления могут вести себя по-разному.
Если элемент имеет свою высшую степень окисления, то он может быть только окислителем. Например, в HN +5 O3 азот в состоянии + 5 может быть только окислителем и принимать электроны.
Только восстановителем может быть элемент, находящийся в низшей степени окисления. Например, в N -3 Н3 азот в состоянии -3 может отдавать электроны, т.е. является восстановителем.
Элементы в промежуточных положительных степенях окисления могут, как отдавать, так и принимать электроны и, следовательно, способны вести себя как окислители или восстановители в зависимости от условий. Например, N +3 , S +4 . Попадая в среду с сильным окислителем, ведут себя как восстановители. И, наоборот, в восстановительной среде они ведут себя как окислители.
По окислительно – восстановительным свойствам вещества можно разделить на три группы:
- окислители
- восстановители
- окислители - восстановители
Учитель: Самостоятельная работа № 3 по инструктивной карте: в какой из приведенных схем уравнений реакций MnO2 проявляет свойства окислителя, а в какой – свойства восстановителя:
3. Углубление и расширение знаний
Важнейшие окислители и продукты их восстановления
1. Серная кислота - Н2SO4 является окислителем
А) Уравнение взаимодействия цинка с разбавленной Н2SO4 (слайд 3)
Какой ион является окислителем в данной реакции? (H + )
Продуктом восстановления металлом, стоящим в ряду напряжения до водорода, является H2.
Б) Рассмотрим другую реакцию – взаимодействие цинка с концентрированной Н2SO4 (слайд 4)
Какие атомы меняют степень окисления? (цинк и сера)
Концентрированная серная кислота (98%) содержит 2% воды, и соль получается в растворе. В реакции участвуют фактически сульфат – ионы. Продуктом восстановления является сероводород.
В зависимости от активности металла продукты восстановления концентрированной Н2SO4 разные: H2S, S, SO2.
Чем выше активность металла, тем дальше (глубже) идет восстановление серы (вплоть до низшей степени окисления - 2) (слайд 5)
На схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот (Приложение 3)
2. Другая кислота – азотная – также окислитель за счет нитрат – иона NO3 - . Окислительная способность нитрат – иона значительно выше иона H + , и ион водорода не восстанавливается до атома, поэтому при взаимодействии азотной кислоты с металлами, никогда не выделяется водород, а образуются различные соединения азота. Это зависит от концентрации кислоты и активности металла. Разбавленная азотная кислота восстанавливается глубже, чем концентрированная (для одного и того же металла) (слайд 6)
На схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот (Приложение 3)
Au + 3HCI (конц.) + HNO3 (конц.) = AuCI3 + NO + 2H2O
3. Наиболее сильным окислителем из числа простых веществ является фтор. Но он слишком активен, и его трудно получить в свободном виде. Поэтому в лабораториях в качестве окислителя используют перманганат калия KMnO4. Его окислительная способность зависит от концентрации раствора, температуры и среды.
Реакции окисления – восстановления могут протекать в различных средах. В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами: среда влияет на изменение степеней окисления атомов.
Обычно для создания кислотной среды добавляют серную кислоту. Соляную и азотную применяют реже, т.к. первая способна окисляться, а вторая сама является сильным окислителем и может вызвать побочные процессы. Для создания щелочной среды применяют гидроксид калия или натрия, нейтральной – воду.
Лабораторный опыт: (правила ТБ)
В четыре пронумерованные пробирки налито по 1-2 мл разбавленного раствора перманганата калия. В первую пробирку добавьте несколько капель раствора серной кислоты, во вторую – воду, в третью – гидроксид калия, четвертую пробирку оставьте в качестве контрольной. Затем в первые три пробирки прилейте, осторожно взбалтывая, раствор сульфита натрия. Отметьте. Как изменяется окраска раствора в каждой пробирке. (слайды 7, 8) (Приложение 2)
Результаты лабораторного опыта:
Продукты восстановления KMnO4 (MnO4 - ):
К схемам реакций:
Подберите коэффициенты методом электронного баланса. Укажите окислитель и восстановитель (слайд 10)
(Задание разноуровневое: сильные учащиеся записывают продукты реакции самостоятельно)

Вы проделали лабораторный опыт, предложите вещество, с помощью которого можно очистить халат.
Демонстрационный опыт:
Пятна от раствора перманганата калия быстро выводятся раствором пероксида водорода, подкисленным уксусной кислотой:
Старые пятна перманганата калия содержат оксид марганца (IV), поэтому будет протекать еще одна реакция:
После выведения пятен кусок ткани необходимо промыть водой.
Значение окислительно – восстановительных реакций
В рамках одного урока невозможно рассмотреть все многообразие окислительно-восстановительных реакций. Но их значение в химии, технологии, повседневной жизни человека трудно переоценить.
Ученик: Окислительно-восстановительные реакции лежат в основе получения металлов и сплавов, водорода и галогенов, щелочей и лекарственных препаратов.
С окислительно – восстановительными реакциями связано функционирование биологических мембран, многие природные процессы: обмен веществ, брожение, дыхание, фотосинтез. Без понимания сущности и механизмов протекания окислительно-восстановительных реакций невозможно представить работу химических источников тока (аккумуляторов и батареек), получение защитных покрытий, виртуозную обработку металлических поверхностей изделий.
Для целей отбеливания и дезинфекции пользуются окислительными свойствами таких наиболее известных средств, как пероксид водорода, перманганат калия, хлор и хлорная, или белильная, известь.
Хлор как сильный окислитель используют для стерилизации чистой воды и обеззараживания сточных вод.

Закрепить умение определять степени окисления элементов, окислитель и восстановитель, расставлять коэффициенты методом электронного баланса.
Совершенствовать умение определять окислительно-восстановительные свойства веществ, прогнозировать продукты реакций в зависимости от активности металлов, концентрации кислот и реакции среды раствора.
Выработать умение составлять уравнения химических реакций, протекающих в различных средах на примере соединений марганца
Показать разнообразие и значение ОВР в природе и повседневной жизни.
Продолжить подготовку к ЕГЭ по химии.
1. Организационный момент
Учитель: Добрый день! Хорошего вам настроения!
Окислительно-восстановительные реакции принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Важнейшие процессы на планете связаны с этим типом химических реакций. Человечество давно пользовалось ОВР, вначале не понимая их сущности. Лишь к началу XX века была создана электронная теория окислительно – восстановительных процессов. На уроке предстоит вспомнить основные положения этой теории, метод электронного баланса, научиться составлять уравнения химических реакций, протекающих в растворах, и выяснить от чего зависит механизм таких реакций.
2. Повторение и обощение изученного ранее материала
Учитель: Для вас тема ОВР не нова, она проходит красной нитью через весь курс химии. Поэтому предлагаю повторить некоторые понятия и умения по данной теме.
Ученик: Степень окисления – это условный заряд атома химического элемента в соединении, вычисленный на основе предположения, что все соединения состоят только из ионов. Степень окисления может быть положительной, отрицательной или равняться нулю, что зависит от природы соответствующих соединений.
Одни элементы имеют постоянные степени окисления, другие — переменные.
Например, к элементам с постоянной положительной степенью окисления относят щелочные металлы: Li+1, Na+1, K+1, Rb+1, Cs+1, Fr+1, следующие элементы II группы периодической системы: Ве+2, Mg+2, Ca+2, Sr+2, Ва+2, Ra+2, Zn+2, а также элемент III А группы - А1+3 и некоторые другие. Металлы в соединениях всегда имеют положительную степень окисления.
Из неметаллов постоянную отрицательную степень окисления (-1) имеет F.
В простых веществах, образованных атомами металлов или неметаллов, степени окисления элементов равны нулю, например: Na°, Al°, Fe°, Н2, О2, F2, Cl2, Br2.
Для водорода характерны степени окисления: +1 (Н20), -1 (NaH).
Для кислорода характерны степени окисления: -2 (Н20), -1 (Н2О2), +2 (OF2).
Следует помнить, что в целом молекула электронейтральна, поэтому в любой молекуле алгебраическая сумма степеней окисления равна нулю, а в сложном ионе – заряду иона.
Например, рассчитаем степень окисления хрома в дихромате калия K2Cr2O7.
Степень окисления калия +1, кислорода -2.
Подсчитаем число отрицательных зарядов: 7 • (-2) = -14
Число положительных зарядов должно быть + 14. На калий приходится два положительных заряда, следовательно, на хром – 12.
Так как в формуле два атома хрома, 12 делим на два: 12 : 2 = 6.
+ 6 – это степень окисления хрома.
Проверка: алгебраическая сумма положительных и отрицательных степеней окисления элементов равна нулю, молекула электронейтральна.
Учитель: Самостоятельная работа № 1 по инструктивной карте: пользуясь приведенными сведениями, рассчитайте степени окисления элементов в соединениях: MnO2, H2SO4, K2SO3, H2S, KMnO4. (Приложение 2).
Ученик: Окислительно – восстановительные реакции – это такие реакции, в которых одновременно протекают процессы окисления и восстановления и, как правило, изменяются степени окисления элементов.
Рассмотрим процесс на примере взаимодействия цинка с разбавленной серной кислотой:
При составлении этого уравнения используется метод электронного баланса. Метод основан на сравнении степеней окисления атомов в исходных веществах и продуктах реакции. Основное требование при составлении уравнений этим методом: число отданных электронов должно быть равно числу принятых электронов.
Окислительно - восстановительные реакции – это такие реакции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим.
Окисление – это процесс отдачи электронов, степень окисления при этом повышается.
Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.
Атомы, молекулы или ионы, отдающие электроны, окисляются; являются восстановителями.
Атомы, ионы или молекулы, принимающие электроны, восстанавливаются; являются окислителями.
Окисление всегда сопровождается восстановлением, восстановление связано с окислением.
Окислительно – восстановительные реакции – единство двух противоположных процессов: окисления и восстановления.
Учитель: Самостоятельная работа № 2 по инструктивной карте: методом электронного баланса найдите и поставьте коэффициенты в следующей схеме окислительно –восстановительной реакции:
MnO2 + H2SO4 → MnSO4 + O2 + H2O (2MnO2 + 2H2SO4 → 2MnSO4 + O2 +2H2O
Учитель: Однако научиться находить коэффициенты в ОВР еще не значит уметь их составлять. Нужно знать поведение веществ в ОВР, предусматривать ход реакций, определять состав образующихся продуктов в зависимости от условий реакции.
Ученик: Для того чтобы разобраться, в каких случаях элементы ведут себя как окислители, а в каких – как восстановители, нужно обратиться к периодической системе Д.И.Менделеева. Если речь идет о простых веществах, то восстановительные свойства должны быть присущи тем элементам, которые имеют больший по сравнению с остальными атомный радиус и небольшое (1 - 3) число электронов на внешнем энергетическом уровне. Поэтому они могут сравнительно легко их отдавать. Это в основном металлы. Наиболее сильными восстановительными свойствами из них обладают щелочные и щелочноземельные металлы, расположенные в главных подгруппах I и II групп (например, натрий, калий, кальций и др.).
Наиболее типичные неметаллы, имеющие близкую к завершению структуру внешнего электронного слоя и значительно меньший по сравнению с металлами того же периода атомный радиус, довольно легко принимают электроны и ведут себя в окислительно-восстановительных реакциях как окислители. Наиболее сильными окислителями являются легкие элементы главных подгрупп VI – VII групп, например фтор, хлор, бром, кислород, сера и др.
Вместе с тем надо помнить, что деление простых веществ на окислители и восстановители так же относительно, как и деление на металлы и неметаллы. Если неметаллы попадают в среду, где присутствует более сильный окислитель, то они могут проявлять восстановительные свойства. Элементы в разных степенях окисления могут вести себя по-разному.
Если элемент имеет свою высшую степень окисления, то он может быть только окислителем. Например, в HN+5O3 азот в состоянии + 5 может быть только окислителем и принимать электроны.
Только восстановителем может быть элемент, находящийся в низшей степени окисления. Например, в N-3Н3 азот в состоянии -3 может отдавать электроны, т.е. является восстановителем.
Элементы в промежуточных положительных степенях окисления могут, как отдавать, так и принимать электроны и, следовательно, способны вести себя как окислители или восстановители в зависимости от условий. Например, N+3, S+4 . Попадая в среду с сильным окислителем, ведут себя как восстановители. И, наоборот, в восстановительной среде они ведут себя как окислители.
По окислительно – восстановительным свойствам вещества можно разделить на три группы:
Учитель: Самостоятельная работа № 3 по инструктивной карте: в какой из приведенных схем уравнений реакций MnO2 проявляет свойства окислителя, а в какой – свойства восстановителя:
2MnO2 + O2 + 4KOH = 2K2MnO4 + 2H2O (MnO2 – восстановитель)
MnO2 + 4HCI = MnCI2 + CI2 + 2H2O (MnO2 – окислитель) (Приложение 2).
3. Углубление и расширение знаний
Важнейшие окислители и продукты их восстановления
1. Серная кислота - Н2SO4 является окислителем
А) Уравнение взаимодействия цинка с разбавленной Н2SO4 (слайд 3)
Какой ион является окислителем в данной реакции? (H+)
Продуктом восстановления металлом, стоящим в ряду напряжения до водорода, является H2.
Б) Рассмотрим другую реакцию – взаимодействие цинка с концентрированной Н2SO4 (слайд 4)
Какие атомы меняют степень окисления? (цинк и сера)
Концентрированная серная кислота (98%) содержит 2% воды, и соль получается в растворе. В реакции участвуют фактически сульфат – ионы. Продуктом восстановления является сероводород.
В зависимости от активности металла продукты восстановления концентрированной Н2SO4 разные: H2S, S, SO2.
Чем выше активность металла, тем дальше (глубже) идет восстановление серы (вплоть до низшей степени окисления - 2) (слайд 5)
На схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот (Приложение 3)
2. Другая кислота – азотная – также окислитель за счет нитрат – иона NO3-. Окислительная способность нитрат – иона значительно выше иона H+, и ион водорода не восстанавливается до атома, поэтому при взаимодействии азотной кислоты с металлами, никогда не выделяется водород, а образуются различные соединения азота. Это зависит от концентрации кислоты и активности металла. Разбавленная азотная кислота восстанавливается глубже, чем концентрированная (для одного и того же металла) (слайд 6)
На схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот (Приложение 3)
Au + 3HCI (конц.) + HNO3 (конц.) = AuCI3 + NO + 2H2O
3. Наиболее сильным окислителем из числа простых веществ является фтор. Но он слишком активен, и его трудно получить в свободном виде. Поэтому в лабораториях в качестве окислителя используют перманганат калия KMnO4. Его окислительная способность зависит от концентрации раствора, температуры и среды.
Реакции окисления – восстановления могут протекать в различных средах. В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами: среда влияет на изменение степеней окисления атомов.
Обычно для создания кислотной среды добавляют серную кислоту. Соляную и азотную применяют реже, т.к. первая способна окисляться, а вторая сама является сильным окислителем и может вызвать побочные процессы. Для создания щелочной среды применяют гидроксид калия или натрия, нейтральной – воду.
Лабораторный опыт: (правила ТБ)
В четыре пронумерованные пробирки налито по 1-2 мл разбавленного раствора перманганата калия. В первую пробирку добавьте несколько капель раствора серной кислоты, во вторую – воду, в третью – гидроксид калия, четвертую пробирку оставьте в качестве контрольной. Затем в первые три пробирки прилейте, осторожно взбалтывая, раствор сульфита натрия. Отметьте. Как изменяется окраска раствора в каждой пробирке. (слайды 7, 8) (Приложение 2)
Результаты лабораторного опыта:
Продукты восстановления KMnO4 (MnO4-):
в кислой среде – Mn+2 (соль), бесцветный раствор;
в нейтральной среде – MnO2, бурый осадок;
в щелочной среде - MnO42- , раствор зеленого цвета. (слайд 9, Приложение 3)
К схемам реакций:
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O
KMnO4 + Na 2SO 3 + H2O → MnO2↓ + Na2SO4 + KOH
KMnO4 + Na 2SO3 + КOH → Na2SO4 + K2MnO4 + H2O
Подберите коэффициенты методом электронного баланса. Укажите окислитель и восстановитель (слайд 10)
(Задание разноуровневое: сильные учащиеся записывают продукты реакции самостоятельно)
Вы проделали лабораторный опыт, предложите вещество, с помощью которого можно очистить халат.
Пятна от раствора перманганата калия быстро выводятся раствором пероксида водорода, подкисленным уксусной кислотой:
2KMnO4 + 9H2O2 + 6CH3COOH = 2Mn(CH3COO)2 +2CH3COOK + 7O2 + 12H2O
Старые пятна перманганата калия содержат оксид марганца (IV), поэтому будет протекать еще одна реакция:
MnO2 + 3H2O2 + 2CH3COOH = Mn(CH3COO)2 + 2O2 + 4H2O (слайд 12)
После выведения пятен кусок ткани необходимо промыть водой.
Значение окислительно – восстановительных реакций
В рамках одного урока невозможно рассмотреть все многообразие окислительно-восстановительных реакций. Но их значение в химии, технологии, повседневной жизни человека трудно переоценить.
Ученик: Окислительно-восстановительные реакции лежат в основе получения металлов и сплавов, водорода и галогенов, щелочей и лекарственных препаратов.
С окислительно – восстановительными реакциями связано функционирование биологических мембран, многие природные процессы: обмен веществ, брожение, дыхание, фотосинтез. Без понимания сущности и механизмов протекания окислительно-восстановительных реакций невозможно представить работу химических источников тока (аккумуляторов и батареек), получение защитных покрытий, виртуозную обработку металлических поверхностей изделий.
Для целей отбеливания и дезинфекции пользуются окислительными свойствами таких наиболее известных средств, как пероксид водорода, перманганат калия, хлор и хлорная, или белильная, известь.
Хлор как сильный окислитель используют для стерилизации чистой воды и обеззараживания сточных вод.
Читайте также:

