Ковалентная полярная химическая связь конспект
Обновлено: 29.04.2024
Химическая связь - это взаимодействие атомов, осуществляемое путем обмена электронами .
Атомы стремятся завершить свой внешний уровень (до 8 электронов, исключение водород, гелий до 2 электронов)
Классификация химических связей
1. По способу достижения завершенной электронной оболочки
2. По механизму образования химической связи
3. По способу перекрывания электронных орбиталей
I. По способу достижения завершенной электронной оболочки
КОВАЛЕНТНАЯ СВЯЗЬ
КОВАЛЕНТНАЯ СВЯЗЬ - это связь, возникающая между атомами за счет образования общих электронных пар: H 2 , HCl, H 2 O, O 2
ИОННАЯ СВЯЗЬ
ИОННАЯ СВЯЗЬ – образуется между атомами металлов и неметаллов, т.е. между атомами, резко отличающимися друг от друга по значениям электроотрицательности: NaCl, K 2 O, LiF.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ - связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке.
II. По механизму образования химической связи (только для ковалентной связи)
III. По способу перекрывания электронных орбиталей (только для ковалентной связи)
КОВАЛЕНТНАЯ СВЯЗЬ - это связь, возникающая между атомами за счет образования общих электронных пар (Например, H 2 , HCl, H 2 O, O 2 ).
По степени смещения общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
А) КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ (КНС) - образуют атомы одного и того же химического элемента - неметалла (Например, H 2 , O 2 , О 3 ).
Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Б) КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ (КПС) - образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (Например, HCl, H 2 O) .
Образующиеся общие электронные пары смещены в сторону более электроотрицательного элемента согласно ряду электроотрицательности элементов, предложенному американским химиком Л. Полингом.
В результате на более электроотрицательном элементе образуется избыток электронной плотности ( частичный отрицательный заряд δ- ), а на менее электроотрицательном элементе образуется недостаток электронной плотности ( частичный положительный заряд δ+ ).
Электроотрицательность (ЭО) - это свойство атомов одного элемента притягивать к себе электроны от атомов других элементов.
Самый электроотрицательный элемент – фтор F.
Встречаются исключения, когда ковалентную связь образуют атом неметалла и металла!
AlCl 3 , разница в электроотрицательности ∆ Э.О.
Рассмотрим механизм образования молекул с ковалентной полярной и неполярной связями: Cl 2 , O 2 , HCl.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Ковалентная химическая связь.
( возникает между атомами неметаллов в результате образования
общих электронных пар )
Неполярная Полярная
(одинаковые атомы неметаллов) ( разные атомы неметаллов)
Атомы, между которыми Атомы, между которыми
происходит образование связи, происходит образование связи,
обладают равной обладают разной электроотрицательностью электроотрицательностью
разность ЭО = 0 разность ЭО
В образовании ковалентной связи принимают только неспаренные е-
Н▪ + ▪Н → Н ▪▪ Н Н▪ + ▪ CI •• → Н •• CI ••
Общая электронная пара Общая электронная пара
расположена симметрично смещена в сторону более
относительно ядер атомов, электротрицательного
образующих химическую элемента. Молекула
связь представляет собой
•• CI •• CI •• - электронная формула молекулы хлора,
CI – CI - структурная формула молекула хлора .
CI 2 - молекулярная формула хлора .
H •• O •• - электронная формула молекулы воды,
Н →О - структурная формула молекулы воды.
H 2 O - молекулярная формула воды .
Электронная формула – показывает механизм образования
химической связи внутри молекулы.
Структурная формула – показывает порядок соединения атомов
внутри молекулы и число связей, которые
образует каждый атом.
Молекулярная формула – показывает количественный и
качественный состав молекулы
Составьте схему строения атома кислорода.
Выпишите молекулы с ковалентной полярной связью, напишите их электронные и структурные формулы: Н 2 О, S 2 , Н 2 , Н 2 S .
Опишите качественный и количественный состав аммиака NH 3
Краткое описание документа:
В опорной конспекте дана классификация видов ковалентной химической связи. Конспект содержит всю необходимую информацию - определение, механизм образования. Даны определения молекулярной, электронной и структурной формул.
Данный опорный конспект удобно использовать при изучении и закреплении темы, а также при подготовки к ГИА
- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания

Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 24 человека из 17 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- ЗП до 91 000 руб.
- Гибкий график
- Удаленная работа
Дистанционные курсы для педагогов
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 606 255 материалов в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
Свидетельство и скидка на обучение каждому участнику
Другие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
- 16.12.2018 1029
- DOCX 22.7 кбайт
- 6 скачиваний
- Рейтинг: 5 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Гусева Татьяна Ивановна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
40%
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Минтруд предложил упростить направление маткапитала на образование
Время чтения: 1 минута
Новые курсы: функциональная грамотность, ФГОС НОО, инклюзивное обучение и другие
Время чтения: 15 минут
В Россию приехали 10 тысяч детей из Луганской и Донецкой Народных республик
Время чтения: 2 минуты
Отчисленные за рубежом студенты смогут бесплатно учиться в России
Время чтения: 1 минута
В приграничных пунктах Брянской области на день приостановили занятия в школах
Время чтения: 0 минут
Академическая стипендия для вузов в 2023 году вырастет до 1 825 рублей
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.

В данном уроке рассматривается ковалентная полярная связь, образование молекул с данным типом связи. Вводится понятие электроотрицательности и валентности. Подробно показан принцип определения валентности по известной формуле и составление формулы по валентности. Этот видеофрагмент просто необходим для каждого учащегося, так как он связывает несколько тем в единое целое.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Ковалентная полярная связь. Электроотрицательность"
Основной особенностью ковалентной полярной связи является то, что она образуется между атомами различных неметаллов. Как, например, в молекуле HCl. У атома водорода в нашем случае один неспаренный электрон, ему до завершения внешнего энергетического уровня не хватает одного электрона. У атома хлора семь электронов на внешнем уровне, один из которых неспаренный, ему тоже не хватает одного электрона до завершения уровня. Тогда атом водорода и атом хлора объединяют свои неспаренные электроны и между ними образуется химическая связь. Эту связь тоже можно изобразить в виде чёрточки.
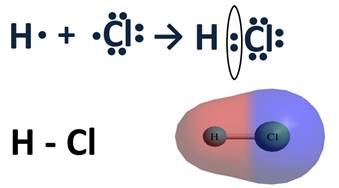
Образовавшаяся общая электронная пара не в равной степени будет принадлежать этим атомам. Для этой оценки используют понятие электроотрицательности. Электроотрицательность (ЭО) – способность атомов химического элемента притягивать к себе общие электронные пары, участвующие в образовании химической связи.
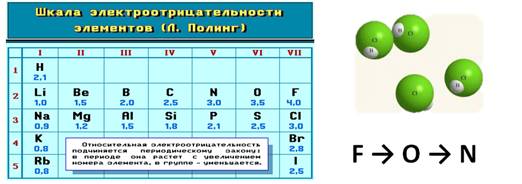
Электроотрицательность служит характеристикой металличности и неметалличности химических элементов. Первое место по электроотрицательности занимает фтор, он же самый неметаллический, второе место занимает кислород и третье – азот.
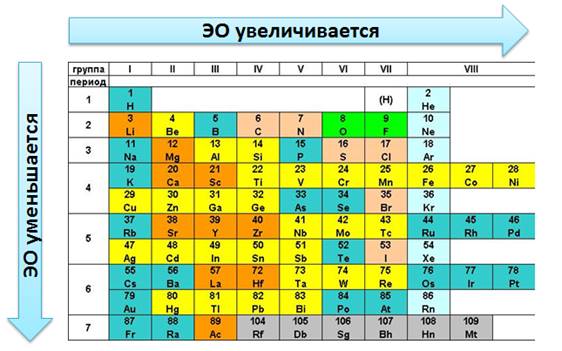
Т.к. электроотрицательность – мера металличности, то она, как правило, по периодам и группам изменяется в той же последовательности, т.е. в периодах слева направо увеличивается, а в группах сверху вниз уменьшается.
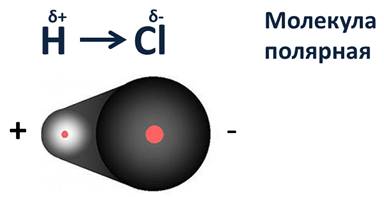
Посмотрев на молекулу HCl, можно с уверенностью определить, что в данной молекуле более электроотрицательный атом хлора, поэтому общая электронная пара будет смещена больше к нему. В результате этого, на атомах появляются частичные заряды. Смещение электронной плотности показывается стрелкой, а частичные заряды буквой дельта. В молекуле появляется два полюса: положительный и отрицательный, поэтому такую связь называют полярной.
Механизм образования связей в молекуле воды (Н2О)
Водород – элемент IA группы, значит, у него один электрон, который участвует в образовании химической связи. У второго атома водорода тоже один электрон, который участвует в образовании химической связи. Атом кислорода находится в VIA группе, поэтому у него на внешнем уровне 6 электронов, а число неспаренных находим по формуле 8 – 6 = 2. Эти два электрона и будут участвовать в образовании химической связи. Неспаренные электроны объединяются и образуется две общие электронные пары. Из этих атомов более электроотрицательный кислород, поэтому именно к нему будут смещены общие пары электронов и молекула будет полярной, связь – ковалентной полярной.
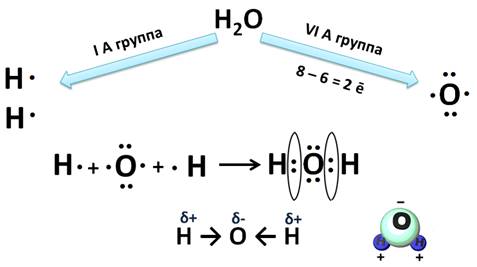
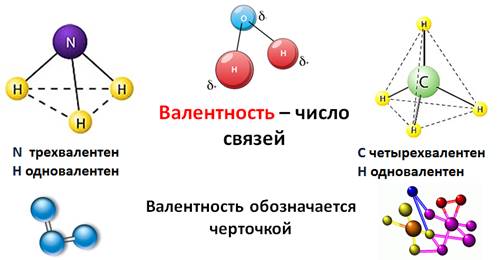
Доказано, что молекула воды на самом деле имеет не линейное строение, а угловое. В этой молекуле атом водорода связан только одной связью с кислородом, а кислород двумя связями с атомами водорода. Это число ковалентных связей, которыми атом одного химического элемента связан с атомами этого же или других элементов, называется валентностью.
Условно валентность обозначается черточкой, когда необходимо записать структурные формулы. Например, в молекуле NH3, атом азота связан с тремя атомами водорода. Поэтому говорят, азот трехвалентен. В молекуле СН4 четырехвалентный углерод связан с одновалентными атомами водорода.
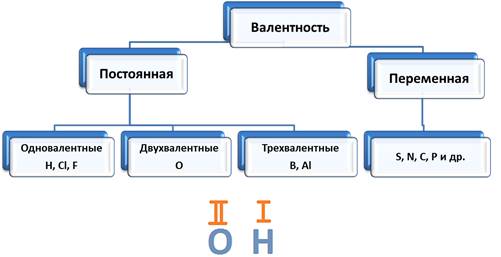
Следует различать элементы с постоянной и переменной валентностью. Элементами с постоянной валентность являются:
· H, Cl, F – одновалентные,
· B, Al – трехвалентные.
Элементы с переменной валентностью: S, N, C, P и др.
Для вывода формулы соединения азота с кислородом, где азот четырехвалентен, нужно сделать так: записываем знаки NO. Над знаками элементов ставим валентности римскими цифрами. У азота она дана по условию – четыре, у кислорода она постоянная и равна двум. Найдем наименьшее общее кратное между валентностями. Наименьшее общее кратное равно четырем. Разделим наименьшее общее кратное на валентности и получим индексы. Четыре делим на четыре будет единица, помните, индекс единица не ставится, затем четыре делим на два, будет два, следовательно, индекс у кислорода будет два.

Аналогично поступают, когда по формуле, необходимо найти валентности элементов. Определим валентность фосфора в соединении Р2О3. У кислорода, как нам известно, валентность постоянная и равна двум. Определим число валентностей всех атомов кислорода, для этого 2 умножим на три, будет шесть. Разделим шесть на число атомов фосфора, т.е. на два, в результате будет три, значит, валентность фосфора в нашем случае равна трем.
Рефераты и конспекты лекций по географии, физике, химии, истории, биологии. Универсальная подготовка к ЕГЭ, ГИА, ЗНО и ДПА!
Химическая связь между атомами, который осуществляется за счет общих электронных пар, называется ковалентной. Ковалентная связь осуществляется между атомами как в молекулах, так и в кристаллах. Он возникает как между одинаковыми атомами (H2, C12, кристалл алмаза), так и между различными атомами (H2O, NH3, SiC, CC, CH, ^ ^ орган.)).
Насыщенность. Обусловлена тем, что в химических взаимодействиях участвуют электроны только внешних энергетических уровней, точнее ограниченное число электронов.
Направленность. Электронные облака атомов имеют определенную пространственную ориентацию и область перекрывания электронных облаков находится в определенном направлении относительно взаимодействующих атомов.
Полярность связи. Если атомы одного и того же элемента сочетаются (H2, C12, J2 . ), то каждое ядро атома с одинаковой силой притягивает пару электронов. Такая связь называется неполярной ковалентная (гомеополярний). Если взаимодействующие атомы характеризуются разной электроотрицательностью, то общая пара электронов смещается к ядру с большим электроотрицательностью атома, например: HF: F = 4.0; H = 2.1. Пара в этом случае смещается к Фтора. Такая связь называется полярным.
где РСВ - электрический момент диполя; ô - эффективный заряд образованных полей;
l - расстояние между центрами тяжести положительных и отрицательных зарядов.
Прочность ковалентной связи. Ее степени служит энергия разрыва связи. Прочность связана со степенью перекрывания электронных орбиталей. Ковалентная связь - самый прочный из всех. Порядок прочности его видов.
Кратность ковалентной связи. Два атома могут быть связаны одной или двумя, или более парами электронов. Ковалентная связь является одинарным (H2, Cl2), двойным (C2H4), тройным (N2 ^ N = N) и т. д.
Читайте также:

