Конспект урока вероятность протекания химических реакций
Обновлено: 06.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам

Описание презентации по отдельным слайдам:

Вероятность протекания химических реакций. Скорость химических реакций. Казань 2017г.

Скорость химических реакций Химическая кинетика изучает скорость и механизмы химических реакций

Гомогенные и гетерогенные системы Гетерогенные системы Фаза – совокупность всех гомогенных частей системы, одинаковых по составу и по всем физическим и химическим свойствам и отграниченных от других частей системы поверхностью раздела. Гомогенные системы состоят из одной фазы.

Сущность химических реакций сводится к разрыву связей в исходных веществах и возникновению новых связей в продуктах реакции. При этом общее число атомов каждого элемента до и после реакции остается постоянным. Поскольку образование связей происходит с выделением, а разрыв связей — с поглощением энергии, то химические реакции сопровождаются энергетическими эффектами. Очевидно, если разрушаемые связи в исходных веществах менее прочны, чем образующиеся в продуктах реакции, то энергия выделяется, и наоборот. Обычно энергия выделяется и поглощается в форме теплоты. Со скоростью химических реакций связаны представления о превращении веществ, а также экономическая эффективность их получения в промышленных масштабах. Учение о скоростях и механизмах химических реакций называется химической кинетикой. Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени при неизменном объеме системы.

По мере расходования вещества А скорость реакции уменьшается (как это показано на рис. 4.1). Отсюда следует, что скорость реакции может быть определена лишь для некоторого промежутка времени. Так как концентрация вещества А в момент времени Т1 измеряется величиной c1, а в момент Т2 — величиной С2, то за промежуток времени изменение концентрации вещества составит ∆С = с2 — с1, откуда определится средняя скорость реакции (и): Рассмотрим в общем виде скорость реакции, протекающей по уравнению:

Скорость химических реакций (для гомогенных систем) A + B = D + G C0 = 0,5 моль/л C1 = 5 моль/л t = 10 c

Скорость химических реакций (для гомогенных систем) A + B = D + G C0 = 2 моль/л C1 = 0,5 моль/л t = 10 c (для гетерогенных систем)

Факторы, от которых зависит скорость реакции Природа реагирующих веществ Концентрация веществ в системе Площадь поверхности (для гетерогенных систем) Температура Наличие катализаторов

1. Влияние концентраций реагирующих веществ. Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. Для реакции (I) этот закон выразится уравнением v = ксА- св, где СА и Св — концентрации веществ А и В, моль/л; к — коэффициент пропорциональности, называемый константой скорости реакции. Основной закон химической кинетики часто называют законом действующих масс.

2.Влияние температуры Правило Вант-Гоффа При нагревании системы на 10 ˚С скорость реакции возрастает в 2-4 раза - температурный коэффициент Вант-Гоффа. Якоб Вант-Гофф (1852-1911)

Энергия, которую надо сообщить молекулам (частицам) реагирующих веществ, чтобы превратить их в активные, называется энергией активации Еа – кдж /моль

На примере реакции в общем виде: А2+ В2 = 2АВ. Ось ординат характеризует потенциальную энергию системы, ось абсцисс — ход реакции: исходное состояние —* переходное состояние —* конечное состояние. Чтобы реагирующие вещества А2 и В2 образовали продукт реакции АВ, они должны преодолеть энергетический барьер С (рис. 4.2). На это затрачивается энергия активации Ed, на значение которой возрастает энергия системы. При этом в ходе реакции из частиц реагирующих веществ образуется промежуточная неустойчивая группировка, называемая переходным состоянием или активированным комплексом (в точке С), последующий распад которого приводит к образованию конечного продукта АВ.

Механизм реакции можно изобразить схемой Если при распаде активированного комплекса выделяется больше энергии, чем это необходимо для активации частиц, то реакция экзотермическая.

Как видно из рис. 4.2, разность энергий конечного состояния системы и начального равна тепловому эффекту реакции. Скорость реакции непосредственно зависит от значения энергии активации: если оно мало, то за определенное время протекания реакции энергетический барьер преодолеет большое число частиц и скорость реакции будет высокой, но если энергия активации велика, то реакция идет медленно. При взаимодействии ионов энергия активации очень мала и ионные реакции протекают с очень большой скоростью (практически мгновенно).

Механизм разложения пероксида водорода 2H2O2 = 2H2O + O2 (1)H2O2 = H+ + HO2- (2)HO2- + H2O2 = H2O + O2 + OH- (3)OH- + H+ = H2O

Разложение H2O2 в присутствии Fe3+ H2O2 = H+ + HO2- HO2- + Fe3+ = Fe2+ + HO2 HO2 + Fe3+ = Fe2+ + O2 + H+ Fe2+ + H2O2 = Fe3+ + OH + OH- OH + H2O2 = H2O + HO2 Fe2+ + HO2 = Fe3+ + HO2- OH- + H+ = H2O . . . . . . Сравните с механизмом без участия катализатора

Благодарю за внимание.
Краткое описание документа:
Данная презентация состоит из 18 слайдов.
Сущность химических реакций сводится к разрыву связей в исходных веществах и возникновению новых связей в продуктах реакции. При этом общее число атомов каждого элемента до и после реакции остается постоянным.
Поскольку образование связей происходит с выделением, а разрыв связей — с поглощением энергии, то химические реакции сопровождаются энергетическими эффектами. Очевидно, если разрушаемые связи в исходных веществах менее прочны, чем образующиеся в продуктах реакции, то энергия выделяется, и наоборот. Обычно энергия выделяется и поглощается в форме теплоты.
Со скоростью химических реакций связаны представления о превращении веществ, а также экономическая эффективность их получения в промышленных масштабах. Учение о скоростях и механизмах химических реакций называется химической кинетикой.
Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени при неизменном объеме системы.

Сущность химических реакций сводится к разрыву связей в исходных веществах и возникновению новых связей в продуктах реакции. При этом общее число атомов каждого элемента до и после реакции остается постоянным. Поскольку образование связей происходит с выделением, а разрыв связей — с поглощением энергии, то химические реакции сопровождаются энергетическими эффектами. Очевидно, если разрушаемые связи в исходных веществах менее прочны, чем образующиеся в продуктах реакции, то энергия выделяется, и наоборот. Обычно энергия выделяется и поглощается в форме теплоты. Со скоростью химических реакций связаны представления о превращении веществ, а также экономическая эффективность их получения в промышленных масштабах. Учение о скоростях и механизмах химических реакций называется химической кинетикой. Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени при неизменном объеме системы.
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Вероятность Вероятность протекания протекания химических реакций. химических реакций. Скорость химических Скорость химических реакций. реакций. Подготовила: Подготовила: преподаватель химии преподаватель химии 1 квалификационной 1 квалификационной категории категории Сагдиева М.С. Сагдиева М.С. Казань 2017г. Казань 2017г.
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Скорость химических Скорость химических реакций реакций Химическая кинетика изучает скорость и изучает скорость и Химическая кинетика механизмы химических реакций механизмы химических реакций
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Гомогенные и Гомогенные и гетерогенные системы гетерогенные системы Фаза – совокупность всех гомогенных частей системы, одинаковых по составу и по всем химическим физическим свойствам и отграниченных от других поверхностью раздела. системы и частей Гомогенные системы состоят из одной фазы. Гетерогенные системы Гетерогенные системы
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Сущность химических реакций сводится к разрыву связей в исходных веществах и возникновению новых связей в продуктах реакции. При этом общее число атомов каждого элемента до и после реакции остается постоянным. энергии, поглощением Поскольку образование связей происходит с выделением, а разрыв связей — с сопровождаются энергетическими эффектами. Очевидно, если разрушаемые связи в исходных веществах менее прочны, чем образующиеся в продуктах реакции, то энергия выделяется, и наоборот. Обычно энергия выделяется и поглощается в форме теплоты. химические то реакции Со скоростью химических реакций связаны представления о превращении веществ, в промышленных масштабах. Учение о скоростях и механизмах химических реакций называется химической кинетикой. эффективность их получения экономическая также а Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени при неизменном объеме системы.
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Рассмотрим в общем виде скорость реакции, протекающей по уравнению: По мере расходования вещества А скорость реакции уменьшается (как это показано на рис. 4.1). Отсюда следует, что скорость реакции может быть определена лишь для некоторого промежутка времени. Так как концентрация вещества А в момент времени Т1 измеряется величиной c1, а в момент Т2 — величиной С2, то за промежуток времени изменение концентрации вещества составит ∆С = с2 — с1, откуда определится средняя скорость реакции (и):
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)
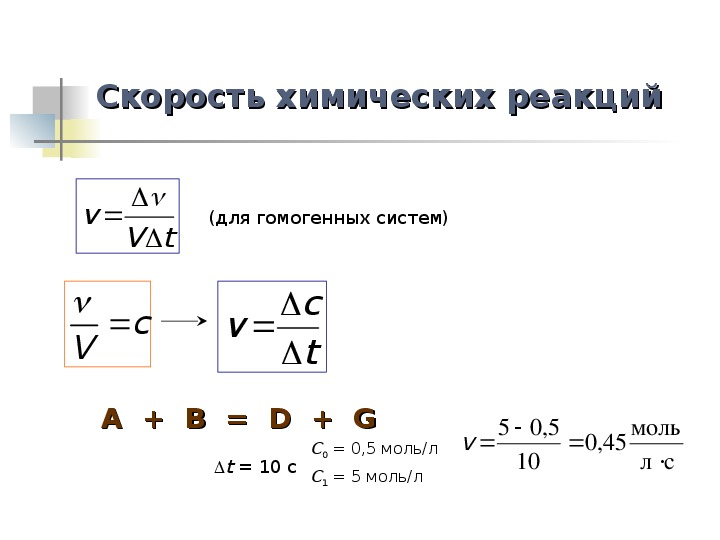
Скорость химических реакций Скорость химических реакций (для гомогенных систем) tVv cV A + B = D + G A + B = D + G cv t t = 10 c C0 = 0,5 моль/л C1 = 5 моль/л v 5,05 10 45,0 моль сл
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Скорость химических реакций A + B = D + G A + B = D + G C0 = 2 моль/л C1 = 0,5 моль/л t = 10 c v 25,0 10 15,0 моль сл cv t tSv (для гомогенных систем) v 25,0 10 15,0 моль сл (для гетерогенных систем)
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Факторы, от которых зависит скорость реакции Природа реагирующих веществ Природа реагирующих веществ Концентрация веществ в Концентрация веществ в системе системе Площадь поверхности (для Площадь поверхности (для гетерогенных систем) гетерогенных систем) Температура Температура Наличие катализаторов Наличие катализаторов
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

1. Влияние концентраций реагирующих веществ. Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. Для реакции (I) этот закон выразится уравнением v = ксА св, где СА и Св — концентрации веществ А и В, моль/л; к — коэффициент пропорциональности, называемый константой скорости реакции. Основной закон химической кинетики часто называют законом действующих масс.
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

2.Влияние температуры Якоб ВантГофф Якоб ВантГофф (18521911) (18521911) Правило Вант-Гоффа При нагревании системы на 10 ˚С скорость реакции возрастает в 2-4 раза - температурный коэффициент Вант-Гоффа. t vv 10 0 100tvv
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

сообщить молекулам сообщить молекулам Энергия, которую надо которую надо (частицам) реагирующих (частицам) реагирующих веществ, чтобы превратить веществ, чтобы превратить их в активные, , называется называется их в активные энергией активации энергией активации ЕЕа – кдж /моль а – кдж /моль
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

На примере реакции в общем виде: А2+ В2 = 2АВ. Ось ординат характеризует потенциальную энергию системы, ось абсцисс — ход реакции: исходное состояние —* переходное состояние —* конечное состояние. Чтобы реагирующие вещества А2 и В2 образовали продукт реакции АВ, они должны преодолеть энергетический барьер С (рис. 4.2). На это затрачивается энергия активации Ed, на значение которой возрастает энергия системы. При в ходе реакции из частиц реагирующих образуется промежуточная неустойчивая группировка, называемая переходным состоянием или активированным комплексом (в точке С), последующий распад которого приводит к образованию конечного продукта АВ. веществ этом
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)
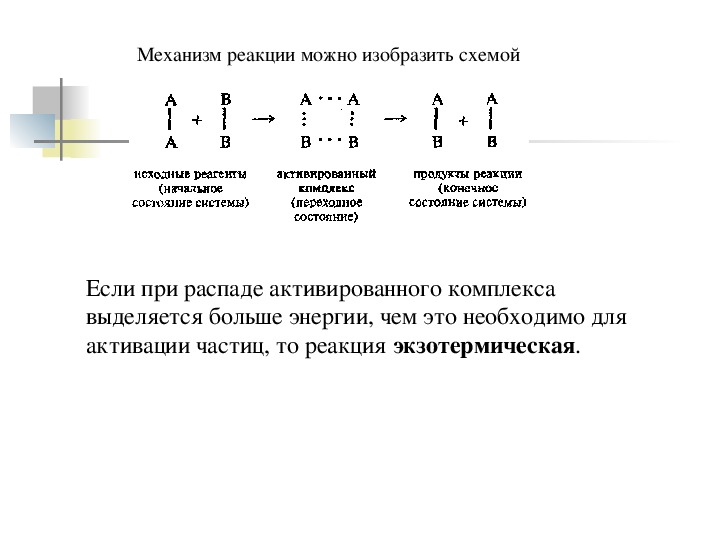
Механизм реакции можно изобразить схемой Если при распаде активированного комплекса выделяется больше энергии, чем это необходимо для активации частиц, то реакция экзотермическая.
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Как видно из рис. 4.2, разность энергий конечного и начального равна тепловому эффекту реакции. состояния системы Скорость реакции непосредственно зависит от значения энергии активации: если оно мало, то за определенное время протекания энергетический барьер преодолеет большое число частиц и скорость реакции будет высокой, но если энергия активации велика, то реакция идет медленно. реакции При взаимодействии ионов энергия активации очень мала и ионные реакции протекают с очень большой скоростью (практически мгновенно).
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Механизм разложения Механизм разложения пероксида водорода пероксида водорода 2H2O2 = 2H2O + O2 (1) H2O2 = H+ + HO2 (2) HO2 + H2O2 = H2O + O2 + OH (3) OH + H+ = H2O
Презентация по химии на тему "Вероятность протекания химических реакций. Скорость химических реакций" (1 курс)

Разложение H2O2 в присутствии Fe3+ . H2O2 = H+ + HO2- HO2- + Fe3+ = Fe2+ + HO2 HO2 + Fe3+ = Fe2+ + O2 + H+ Fe2+ + H2O2 = Fe3+ + OH + OH- OH + H2O2 = H2O + HO2 Fe2+ + HO2 = Fe3+ + HO2- OH- + H+ = H2O . . . . . Сравните с механизмом без участия катализатора

Данный урок занимает центральное место в блоке "Изменения,происходящие с веществами".Он может быть реализован как в середине изучения темы,так и при подготовке к контрольной работе в конце темы.Отдельные слайды презентации можно использовать при изучении всех ключевых вопросов этого блока,а также во внеурочной деятельности.Для проведения урока необходим компьютерный класс с интерактивной доской.
урока на тему:Химические реакции. Условия
и признаки протекания химических реакций.
Пояснительная записка
урока в 8 классе по теме «Химические реакции. Признаки и условия протекания химических реакций
Изменения, происходящие с веществами
Тема изучения
Химические реакции. Признаки и условия протекания химических реакций.
Формирование
представления о сущности химических явлений с позиций атомно-молекулярного учения;
навыков грамотного выполнения и интерпретации химического эксперимента;
Основное содержание темы
Сущность химических явлений в свете атомно-молекулярного учения.
Признаки и условия протекания химических реакций. Причины и направления протекания химических реакций.
Тепловой эффект химических реакций. Экзо- и эндотермические реакции.Составление уравнений химических реакций.
Термины и понятия
Химическая реакция; признаки и условия возникновения и течения реакций; экзо- и эндотермические реакции, тепловой эффект, термохимическое уравнение; химическое уравнение; коэффициент, индекс.
Образовательные результаты
Личностные
Метапредметные
Предметные
Понимать единство естественнонаучной картины мира и значимость естественнонаучных и математических знаний для решения практических задач в повседневной жизни.
Грамотно обращаться с веществами в химической лаборатории и в быту.
Знать и оценивать вклад российских ученых в развитие мировой химической науки
Познавательные УУД:
Давать определение понятиям, обобщать понятия; осуществлять сравнение и классификацию; строить логические рассуждения, устанавливать причинно-следственные связи, создавать обобщения, делать выводы.
Осознанно и произвольно строить речевые высказывания.
Анализировать объекты с выделением существенных и несущественных признаков, осуществлять классификацию явлений.
Проводить наблюдение и эксперимент под руководством учителя.
Описывать самостоятельно проведенные эксперименты, используя язык химии. Объяснять явления, выявленные в ходе эксперимента.
Понимать, обобщать и интерпретировать информацию, представленную в рисунках, схемах, графиках и таблицах.
Использовать знаково-символические средства для решения задач. Работать с моделями молекул химических процессов (в виде уравнений реакций).
Регулятивные УУД:
Планировать учебную деятельность в соответствии с учебным заданием, в том числе при выполнении эксперимента в рамках предложенных условий.
Преобразовывать практическую задачу в познавательную.
Выполнять учебные действия в материализованной форме, учитывать алгоритмы и правила в планировании и контроле способа решения поставленной задачи.
Уметь использовать речь для регуляции своей деятельности.
Осуществлять само- и взаимоконтроль и коррекцию своей деятельности в процессе достижения результата в соответствии образцами (алгоритмами).
Коммуникативные УУД:
Организовывать учебное сотрудничество и совместную деятельность с учителем и с одноклассниками
Устанавливать рабочие отношения в группе, планировать общие способы работы.
Строить понятные для собеседника речевые высказывания, уметь слушать собеседника, адекватно и осознанно использовать устную и письменную речь, владеть монологической контекстной речью
Описывать простейшие химические реакции с помощью химических уравнений.
Классифицировать химические реакции.
Актуализировать знания о признаках химических реакций.
Тема урока: Химические реакции. Условия и признаки протекания химических реакций.
Цель урока:способствовать формированию знаний учащихся об отличии физических явлений от химических реакций,изучить на практике условия и признаки химических реакций.
Задачи урока:
обучающая: содействовать формированию различий между физическими и химическими явлениями; повторить признаки и условия протекания химических реакций; дать первоначальное представление о классификации химических реакций по тепловому эффекту;
развивающая: развивать навыки вести сравнительный анализ, обобщать и делать выводы, формулировать определения понятий; развитие логико-смыслового мышления учащихся, памяти, химического языка, а также умения осуществлять самостоятельную деятельность на уроке;
воспитательная: воспитывать культуру умственного труда, положительную мотивацию к учению; способствовать воспитанию гуманности, дисциплинированности, эстетического восприятия мира, продолжить формирование убеждения учащихся в необходимости привлечения средств химии к пониманию и описанию процессов, происходящих в окружающем мире, воспитывать стойкий позитивный интерес к предмету, гордость за отечественную науку.
Методы, приемы работы: Метод словесной передачи информации, слухового и зрительного восприятия информации (беседа, рассказ, презентация), демонстрация опытов, самостоятельная работа.
Оборудование и реактивы. Лабораторный штатив с пробирками, пробирка с газоотводной трубкой, спиртовка, спички, тигельные щипцы, растворы хлорида железа FeCL3, роданида калия KNCS, медного купороса (сульфат меди) CuSO4, гидрооксида натрия NaOH, соляной кислоты HCL; карбоната кальция СаCO3, порошок железа, порошок серы S, магниевая лента, нитрат аммония.
Интеграция: физика
Тип урока: урок получения новых знаний, урок – практикум
О.С. Габриелян. Химия. 8 класс Учебник для общеобразовательных учреждений Москва “Дрофа”, 2014 г.
О.С.Габриелян, Н.П.Воскобойникова, А.В.Яшукова. Настольная книга учителя. Химия. 8 класс: поурочные разработки. – М.: ДРОФА, 2004
Е.В. Савинкина. Сборник задач и упражнений по химии: 8 класс. – М.: Экзамен, 2010
Организационный момент.
На прошлых уроках мы изучали основные классы неорганических веществ. Рассмотрели их классификацию, состав, строение. Но наши знания будут неполными, если мы не изучим явления происходящие с ними.Презентация
Мы приступаем к изучению новой главы “Изменения, происходящие с веществами”. При изучении новой темы:
определим – сущность физических и химических явлений;
выявим – признаки химических реакций;
отметим – условия протекания реакций;
познакомимся – с видами химических реакций.
Сегодня на уроке, используя опорный план – конспект и имеющиеся у вас знания из курса физики, отметим отличия физических явлений от химических реакций, признаки и условия протекания реакций и дадим первоначальное представление о классификации химических реакций по тепловому эффекту.
Человек, и все, что его окружает – живая и неживая природа непрерывно изменяются. Вся живая и неживая природа состоит из веществ. Изменения, происходящие с веществами, называются явлениями.
– А как классифицируются явления? (Явления делятся на физические и химические).
В чём отличие химического явления от физического? (В результате химического явления изменяется состав вещества, а в результате физического явления состав вещества остается без изменения, а меняется лишь его агрегатное состояние или форма и размеры тел).
Учащиеся выполняют задание, а затем осуществляют взаимопроверку (работа в парах)
Задание. Укажите, о каких явлениях (физических или химических) идет речь:

Данный видеоурок полностью посвящён химическим реакциям: условиям их протекания и прекращения. Более подробно рассматриваются реакции горения и управление этими реакциями.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Химические реакции. Условия протекания и прекращения химических реакций"
Химические реакции – это явления, которые сопровождаются превращением веществ.
Рассмотрим на конкретном примере, что же представляют собой химические реакции. Смешаем железные опилки и порошок серы в отношении 7 : 4. В результате получилась смесь, в которой каждое вещество сохраняет свои свойства. Как вы помните, эту смесь можно разделить, поднеся к ней магнит, при этом, железные опилки притянутся к магниту.
Если смесь железных опилок и порошка серы нагреть, то начинается химическая реакция, в результате которой образуется новое сложное вещество. Свойства этого сложного вещества отличаются от свойств железа и серы. Полученное соединение не притягивается магнитом, тонет в воде, не ржавеет, не горит.
Эту реакцию можно записать словами, а можно с помощью химических формул и знаков:
Железо + сера = сульфид железа
Для того чтобы между исходными простыми веществами прошла реакция, нужны следующие условия: во-первых – это соприкосновение веществ, а во-вторых – это нагревание.
Таким образом, соприкосновение реагирующих веществ – это обязательное условие для любой химической реакции.
Проведём небольшой эксперимент: в пробирку с кусочками мрамора добавим соляной кислоты. Происходит бурное выделение пузырьков газа. Опустим газоотводную трубку, через которую выделяется газ в пробирку с известковой водой, при этом происходит помутнение известковой воды.
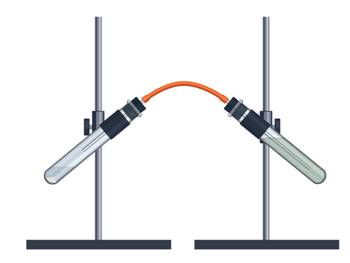
Из проведённого опыта можно сделать вывод: во-первых, прошла химическая реакция, так как в первом случае выделяется газ, а во втором происходит помутнение известковой воды.
Запишем эти химические уравнения словами:
мрамор + соляная кислота = хлорид кальция, углекислый газ и вода,
углекислый газ + известковая вода = карбонат кальция и вода.
Если записать эти уравнения с помощью формул, то получатся следующие записи:
В данных реакция нагревания не требовалось, в отличие от предыдущего опыта.
Есть такие реакции, которые протекают очень медленно, и для того, чтобы их ускорить используют вещества, которые называются катализаторами.
Таким образом, катализаторы – это вещества, которые ускоряют химические реакции, но сами при этом не расходуются.
Биологические катализаторы называют ферментами, или энзимами.
Проведём эксперимент, в котором используется катализатор. Нальём в стакан перекиси водорода. Добавим сюда диоксид марганца, при этом наблюдается бурное выделение газа. Этим газом является кислород, чтобы это доказать, достаточно поднести тлеющую лучинку, она вспыхнет. То есть диоксид марганца в нашем случае является катализатором, который ускорил химическую реакцию.

Запишем эту реакцию словами:
пероксид водорода разлагается с образованием воды и кислорода.
Если реакцию записать с помощью формул, то она имеет следующий вид:
Таким образом, для ускорения протекания этой реакции требуется катализатор.
Знание условий протекания реакций позволяет ускорять, замедлять и прекращать химические реакции. Прекращение химических реакций используют при тушении пожаров. Для того чтобы остановить процесс горения, нужно исключить доступ кислорода. Для этого горячие предметы заливают водой, пеной, засыпают песком, набрасывают плотную ткань или используют огнетушитель.
Читайте также:

