Конспект урока по химии 10 класс алкины
Обновлено: 04.07.2024
Автор: Сидельникова Ирина Михайловна
Населенный пункт: Тамбовская область, Никифоровский р-он, р.п. Дмитриевка
Цель урока: организация условий достижения учащимися образовательных результатов по заданной теме:
- приобретение учебной информации,
- контроль усвоения теории,
- применение знаний и умений,
- формирование метапредметных УУД (регулятивных, познавательных, коммуникативных).
- знание определений понятий, понимание взаимосвязей между ними,
- умение применять эти знания и умения для решения практических задач,
- контроль уровня освоения материала,
- развитие метапредметных универсальных учебных действий.
Планируемые образовательные результаты
Метапредметные
Постановка учащимися учебной задачи на основе сопоставления того, что известно и ранее усвоено, и того, что еще неизвестно. Выбор, принятие и сохранение учебной цели и задач. Составление плана достижения цели, осознанный выбор наиболее эффективных способов решения учебных и познавательных задач. Осуществление самоконтроля и самооценки, осознание качества и уровня усвоения. Саморегуляция учебной деятельности.
Сравнение, обобщение, конкретизация, анализ. Самостоятельное выделение и формулирование познавательной цели. Поиск и выделение необходимой информации. Умение определять понятия, создавать общения, устанавливать аналогии. Умение структурировать знания и устанавливать причинно-следственные связи, строить логическое рассуждение, умозаключение и делать выводы. Рефлексия способов и условий действия, контроль и оценка процесса и результатов деятельности.
Планирование учебного сотрудничества и совместной деятельности с учителем и сверстниками. Умение работать индивидуально и в группе: находить общее решение и разрешать конфликты на основе согласования позиций и учета интересов. Умение формулировать собственное мнение и позицию. Осознанное и произвольное построение речевых высказываний. Восприятие выступлений учащихся. Участие в обсуждении содержания материала. Взаимоконтроль, взаимопроверка, распределение обязанностей в группе. Формирование и развитие компетентности в области использования ИКТ.
Личностные: формирование целостного мировоззрения, соответствующего современному уровню развития науки. Формирование ответственного отношения к учению, готовности обучающихся к саморазвитию и самообразованию на основе мотивации к обучению и познанию. Осознанное осмысление обучающимися связи между целью учебной деятельности и ее мотивом. Осознание возникающих трудностей и стремление к их преодолению. Освоение новых видов деятельности. Формирование ценности безопасного образа жизни, усвоение правил индивидуального и коллективного безопасного поведения.
Организационная структура урока
1.Организационный момент. Приветствие учащихся.
2. Вхождение в тему урока и создание условий для осознанного восприятия материала. Время на выполнение 1-2 мин.
(проводится фронтальная беседа по некоторым ранее изученным вопросам с использование платформы Kahhot (Кахут)
Учитель: Ребята, вспомните, какие вещества называются углеводородами?
Ученик: Углеводороды – это органические соединения, которые состоят из двух элементов – углерода и водорода.
Учитель: Какие типы углеводородов известны?
Ученик: Углеводороды бывают предельные и непредельные.
Учитель: Чем они отличаются по строению друг от друга?
Ученик: Предельные углеводороды в своем составе содержат одинарные углерод-углеродные связи, а непредельные – кратные.
Учитель: Выберете ряд в котором находятся только классы непредельных углеводородов.
Ученик: К непредельным углеводородам относятся алкены и алкадиены.
Учитель: Особенности строения непредельных углеводородов.
Ученик: У алкенов между атомами углерода существует одна двойная связь, а у алкадиенов – две двойных связи.
- Молодцы. Почти все справились с ответами на вопросы. Давайте посмотрим рейтинг, кто сегодня оказался на пьедестале.
Учитель: Ребята, для того, что бы понять о каком классе веществ будет идти речь на сегодняшнем уроке, давайте, познакомимся с историческим фактом получения неизвестного газа.
Учитель. Решите задачу и установите молекулярную формулу этого углеводорода.
(У доски работает один человек- Деев Данила).
- Установите молекулярную формулу этого углеводорода, если в его состав входит углерод с массовой долей92, 31 %и водород7, 69 %.Известно, что относительная плотность по водороду данного вещества составляет –13.
- ( х:у=7,69:7,69=1:1, Простейшая формула: СН, М(СН)=13 г/моль, М(СхНу)=2*13=26 г/моль. 26:13=2, значит истинная формула С2Н2 ).
- Назовите полученный углеводород (этин или ацетилен)
- Исходя из молекулярной формулы, предложите структурную формулу вещества. К какому классу веществ оно относится?
Учитель. Ребята, предложите тему урока, которую мы сегодня будем изучать.
-Сформулируйте цель урока.
Цель урока: изучение непредельных углеводородов ряда ацетилена, их строения, изомерии и номенклатуры.
3. Организация и самоорганизация учащихся в ходе усвоения материала. Организация обратной связи.
Учитель. Ребята, посмотрите видеоопыт (21 с.) получения ацетилена из карбида кальция, который взят на платформе МЭО.
Учитель. Каким пламенем горит ацетилен? (ацетилен горит ярким коптящим пламенем).
- Отличается ли горение ацетилена, от горения алканов? (метан, этан — горят почти бесцветным пламенем и света дают мало).
- Правильно, в этом вы сами убедились дома, посмотрев на пламя кухонной плиты в темноте — оно почти не освещает. Ацетилен же даёт яркое пламя. Это свойство ацетилена использовали давно. Например, в фонарь, наполненный карбидом кальция, по каплям поступала вода, а получившийся газ поступал в горелку и использовался для освещения. Эти ацетиленовые или карбидные лампы долгое время использовали шахтёры, спелеологи, водители автомобилей, велосипедов.
В 1895 году Ле Шателье обнаружил, что ацетилен в смеси с кислородом даёт пламя очень высокой температуры — около 3000 ∘ C, что позволяет очень легко резать и сваривать металлы. Поэтому ацетилен нашёл широкое применение в газосварочных аппаратах. Если вас заинтересовала информация о применении ацетилена, вы можете изучить её дома используя платформу МЭО.
Учитель. Решив задачу, вы нашли молекулярную формулу ацетилена С2Н2 и предложили структурную формулу ацетилена
Точную формулу ацетилена установил французский химик Марселен Бертло в 1856 г.
Задание для группы №1 - Какие вещества можно отнести к алкинам, и чем они отличаются от алканов и алкенов? Дайте определение алкинам. Назовите общую формулу алкинов, алкенов и алканов.
- Укажите тип гибридизации, атомов углерода в молекулах ацетилена и его гомологов, сравните с типом гибридизации атомов углерода метана и этилена.
Задание для группы №2
- Укажите валентный угол в молекуле ацетилена и сравните с метаном и этиленом.
- Чему равна длина тройной, одинарной и двойной связи?
Задание для группы №3
- Укажите форму молекулы ацетилена, метана и этилена?
- Предположите, какие виды изомерии будут характерны для алкинов, алканов и алкенов?
Учитель: (2-3 мин.) И так, 1 группа даёт свои ответы. 2 группа, вам слово. И 3 группа завершает (выслушиваю ответы групп и корректирую вместе с другими группами),
- Молодцы, все справились со своими заданиями.
Ваши результаты будут зафиксированы в системе и учитываются при выставлении итоговой отметки за урок (одного человека вызываю к доске для выполнения этого задания и дальнейшей самопроверки на местах).
- Молодцы. Посмотрите на экран и сравните ваши ответы.
Учитель: Мы много сегодня говорили об ацетилене.
- А вы знаете, как можно составить формулы его гомологов? (ответы учеников)
- Возвращаемся в МЭО, открываем вкладку интернет-урока №2. Работаем в парах.
Динамическая пауза, которая пройдёт с пользой для ваших глаз (1 мин)
Круг
Представить себе большой круг. Обводить его глазами сначала по часовой стрелке, потом против часовой стрелки.
Квадрат
Предложить детям представить себе квадрат. Переводить взгляд из правого верхнего угла в левый нижний, в левый верхний, в правый нижний. Ещё раз одновременно посмотреть в углы воображаемого квадрата.
Вверх-вниз, влево-вправо
Двигать глазами вверх-вниз, влево-вправо. Зажмурившись, снять напряжение, считать до 10.
Учитель: Продолжаем работу на платформе МЭО. Ребята, теперь давайте посмотрим, как выглядит модель молекулы ацетилена и бутина-1.
Работаем в парах и собираем шаро-стержневые модели молекул алкинов по их структурным формулам и даём им названия: Этин, Пропин, Бутин-1, Бутин-2, Пентин-1, Пентин-2, Гексин-1, Гексин-2. Соблюдаем ТБ при работе с деталями шаро-стержневых моделей. Время на выполнение 1-2 мин.
- Молодцы, все справились.
(одного человека вызываю к доске для выполнения этого задания и дальнейшей самопроверки на местах).
Ребята, посмотрите внимательно на свои шаро-стержневые модели. Чем эти вещества являются по отношению друг к другу? Правильно (Гомологами и изомерами)
- Назовите формулы, которые являются по отношению друг к другу изомерами? Правильно (Пентин-1, Пентин-2, Гексин-1, Гексин-2, Гексин-3.)
- Вспомните, как называется такой вид изомерии?
Ученик: Изомерия положения кратной связи.
- Какой ещё вид изомерии характерен для алкенов?
Ученик: Для алкенов характерна изомерия углеродного скелета и межклассовая изомерия с алкадиенами и циклоалкенами.
- Продолжаем работу в рабочих тетрадях. Выполняем задание из МЭО. Составьте не менее трёх структурных формул изомеров с учётом видов изомерии, для алкина состава C6H10 и назовите эти вещества по номенклатуре ИЮПАК. (проводиться взаимопроверка в парах). Время на выполнение 2-3 мин, 1 мин на взаимопроверку.
(если осталось время)4. Проверка полученных результатов
-Работа в МЭО. Выполнение теста «Проверь себя. Готовимся к ЕГЭ)
5. Подведение итогов. Домашнее задание.
- Ребята, пришло время подвести итоги нашей работы на уроке. Как вы считаете, удалось нам достичь цели нашего урока? (Ответы учеников)
Рефлексия.
Как мы видим, на диаграмме, что большинство из вас выбрали вариант, что для вас урок был полезен. Значит, мы не зря сегодня потрудились. А результаты вашего труда вы узнаете чуть позже, после проверки ваших работ, я выставлю отметки в дневник.ру, где вы сможете их посмотреть.
Также, в дневник.ру для вас размещено домашнее задание. Вы должны определить для себя на какую оценку хотите выполнить задание:

Ацетиленовые углеводороды (алкины)
Ключевые слова конспекта: Ацетиленовые углеводороды (алкины). Межклассовая изомерия. Карбидный и метановый способы получения ацетилена. Винилхлорид. Поливинилхлорид. Реакция Кучерова.
Гомологический ряд алкинов
Как правило, любое научное открытие не только имеет теоретическую ценность, но и находит практическое применение. В химической науке есть немало примеров того, как практическое использование свойств вновь открытых веществ приводило к созданию новых материалов или технологий.
температура пламени достигала 3100 °С, что в 2 раза выше температуры плавления железа! Это свойство кислородно-ацетиленового пламени используют и сейчас при газовой резке и сварке металлов.
В XX в. было установлено строение молекулы ацетилена. Как оказалось, в ней два атома углерода связаны тройной углерод-углеродной связью:
H—C≡C—H

Ацетилен — первый представитель гомологического ряда ацетиленовых углеводородов.
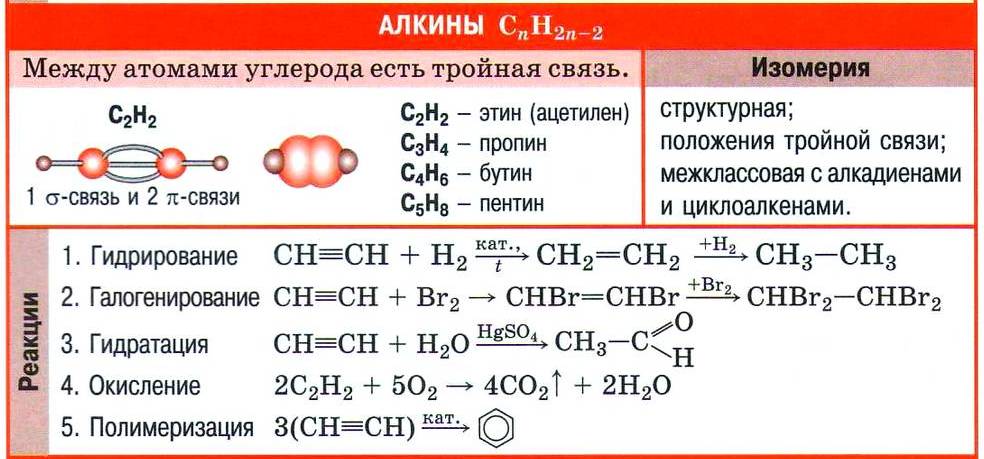
Номенклатура и изомерия алкинов
Принадлежность углеводорода к алкинам обозначают суффиксом -ин, который указывает на тройную углерод-углеродную связь в молекуле. За основу названия алкина берут корень названия соответствующего алкана. Так, ацетилен в соответствии с номенклатурой ИЮПАК называют этином.

Формулы некоторых алкинов и их названия приведены в таблице.
Для алкинов, как и для алкенов, характерна изомерия положения кратной (тройной) связи. Например, изомерны бутин-1 и бутин-2.
Кроме этого, следует учесть, что гомологический ряд алкинов имеет такую же общую формулу, как и ещё один гомологический ряд уже знакомых вам углеводородов (алкадиенов): CnH2n–2. Такой вид структурной изомерии называют межклассовой изомерией.
Способы получения ацетилена
Рассмотрим способы получения важнейшего представителя класса алкинов — ацетилена.

Карбидный способ основан на взаимодействии карбида кальция с водой:

В промышленности карбид кальция получают сплавлением оксида кальция (негашёной извести) с коксом (углеродом):

Оксид кальция получают обжигом известняка по реакции:

В промышленном масштабе ацетилен получают метановым методом — пропусканием газообразного метана в специальных реакторах через зону с высокой (1500 °С) температурой:
Химические свойства алкинов
Тройную связь в молекулах алкинов обнаруживают с помощью двух качественных реакций — обесцвечивания бромной воды и раствора перманганата калия.

Непредельный характер алкинов обусловливает и наиболее характерные реакции веществ этого класса — реакции присоединения, которые протекают в две стадии. Например, реакция бромирования ацетилена:

Реакцию присоединения галогеноводородов к алкинам мы рассмотрим на примере важной в практическом отношении реакции хлороводорода с ацетиленом:
Хлорэтен называют также винилхлоридом, потому что одновалентный радикал этилена СН2=СН— носит название винил. Хлорэтен — исходное вещество для получения ценного полимера поливинилхлорида. Уравнение реакции полимеризации хлорэтена выглядит так:


Как и этилен, ацетилен вступает в реакцию гидратации, т. е. присоединяет воду. Однако отличие тройной углерод-углеродной связи от двойной отражается на строении продукта реакции гидратации. Схематично присоединение воды к ацетилену можно изобразить так:

или
Реакция гидратации ацетилена названа в честь русского учёного-химика Михаила Григорьевича Кучерова, предложившего для проведения этого процесса использовать в качестве катализатора соли ртути(II). Продукт реакции Кучерова — органическое вещество уксусный альдегид. До середины XX в. реакция Кучерова лежала в основе промышленного получения уксусного альдегида, но в настоящее время её не используют из-за токсичности солей ртути. Получение уксусного альдегида по реакции Кучерова было вытеснено так называемым Вакер-процессом — получением ацетальдегида прямым окислением этилена в присутствии катализатора — хлорида палладия(II).
Ацетилен применяют в органическом синтезе. Он является одним из исходных веществ в производстве синтетических каучуков, поливинилхлорида и других полимеров. Из ацетилена получают органические растворители. Ацетилен до сих пор используют для газовой сварки и резки металлов.
Образовательные цели: изучить строение, гомологический ряд, изомерию и номенклатуру алкинов на примере ацетилена и его гомологов.
Развивающие цели:
- создать условия для развития логического мышления через сравнение и установление взаимосвязи строения и свойств веществ с учетом зоны ближайшего развития;
- формирование умений переносить полученные знания в новую ситуацию.
Воспитательные цели:
- формирование научного мировоззрения через познаваемость химических явлений;
- формирование умений осуществлять самоконтроль хода и результатов своего труда;
- развитие коммуникативности личности.
Тип занятия: изучение нового материала.
Формы работы: фронтальная, индивидуальная, работа в парах, работа в группах.
Методы:
- Практический: лабораторная работа.
- Словесный: эвристическая беседа
- Наглядный: презентация, таблица.
- Логический: обобщать, делать вывод.
Основные средства:
- Учебник Химия 1 класс, автор О.С. Габриеляна; ;
- Тестовая работа;
- Инструктивная карточка.
Технология: элементы ИСУД (индивидуальный стиль учебной деятельности).
Оборудование:
Учащиеся должны знать: Строение алкинов, их гомологический ряд, виды изомерии, особенности номенклатуры алкинов.
Уметь:
- Строить и записывать формулы гомологического ряда алкинов,
- Давать название алкинам по их структурным формулам,
- Вести расчеты по химическим формулам.
Этапы урока и деятельность учителя-ученика на уроке
| № | Ключевые образовательные компетенции | Формируемые компетентности на уроке | Задания, формирующие компетентности | Этап урока |
| 1. | Методологические компетентности (оргдеятельностные) | Осознание цели и учебной деятельности. Формулировка цели урока. Самоанализ и самооценка. | 1. Какие вопросы мы должны будем рассмотреть по данному классу веществ? 2. Сформулируйте цель нашего сегодняшнего урока? | Целепологание урока. |
| 2. | Познавательные (когнитивные) компетенции | Понимание или непонимание учащимися заданного вопроса. Самостоятельная работа по заданиям. | 1. Исходя из молекулярной формулы предложите структурную формулу вещества. К какому классу веществ оно относится? 2. Работая в парах ответьте на вопросы (при затруднении смотрите стр. 99-100: Какие соединения называют алкинами? Особенности строения алкинов? Тип гибридизации у простейшего алкина? Угол между гибридными облаками? Расстояние между атомами С≡С? Типы связей в молекулах алкинов? Пространственное строение простейшей молекулы алкинов. Форма молекулы у алкинов. | Актуализация знаний. |
Ход урока
I. Организационный момент 1 минута.
II. Актуализация знаний
? Классы веществ, какой группы органических соединений мы с вами изучаем?
? Что такое углеводороды?
? Где в природе содержатся углеводороды?
? На какие группы делятся УВ?
? Какие классы углеводородов вы помните?
? Какие классы УВ вы уже изучили?
? В чем особенность строения, изученных классов УВ?
Для определения темы нашего урока решите следующую задачу и ответьте на вопрос:
Задача. Установите молекулярную формулу углеводорода, если в его состав входит углерод с массовой долей 92,31 % и водород 7,69 %. Известно, что относительная плотность по водороду данного вещества составляет – 13.
Задание. Исходя из молекулярной формулы предложите структурную формулу вещества. К какому классу веществ оно относится?
? Какие вопросы мы должны будем рассмотреть по данному классу веществ?
? Сформулируйте цель нашего сегодняшнего урока?
III. Изучение нового материала
1. Строение алкинов (слайд 6).
Работая в парах ответьте на вопросы (при затруднении смотрите стр. 99-100):
? Какие соединения называют алкинами?
? Особенности строения алкинов?
? Тип гибридизации у простейшего алкина?
? Угол между гибридными облаками?
? Расстояние между атомами С≡С?
? Типы связей в молекулах алкинов?
? Пространственное строение простейшей молекулы алкинов.
? Форма молекулы у алкинов.
? По окончании работы самопроверка по ответу учащегося.
Ациклические соединения, имеющие в своем строении одну тройную связь.
Наличие тройной связи связи.
угол между облаками 180°
Расстояние С≡С составляет 0, 120 нм
Тройная связь и одинарные
2. Гомологический ряд алкинов (слайд 8)
Задание. Запишите 5 первых представителей гомологического ряда алкинов и дайте им названия.
Составьте общую формулу алкинов. (если затрудняетесь см. стр. 100)
По окончании работы самопроверка по ответу учащегося. Затем самопроверка по слайду № 8
Используя молекулярные формулы гомологического ряда алкинов, смоделируйте пространственное строение простейшего алкина.
Запишите структурные формулы данных соединений и зарисуйте их пространственное строение.
Сравните строение соединений гомологического ряда алкинов.
Сделайте вывод об особенностях строения соединений класса алкинов.
3. Изомерия и номенклатура алкинов (слайд 10)
Задание. Определите виды изомерии для алкинов (при затруднении см. стр. 100-101).
- Структурная
- Положения кратной связи
- Углеводородного скелета
- Межклассовая
Запишите все возможные структурные формулы соединений состава С5Н8 и дайте им названия.
По окончании работы самопроверка по ответу учащегося. Ответ: № 13, 14.
IV. Первичная проверка.
А сейчас закончите следующие фразы:
- Алкины - это …
- Общая формула алкинов ….
- Простейший алкин …
- Формула простейшего алкина…
- Количество π-связей у алкинов…
- Виды изомерии у алкинов …
- Тип гибридизации у алкинов ….
V. Вторичная проверка.
- Репродуктивный
- Прикладной
- Творческий
I вариант выполняет задания под нечетными номерами
II вариант выполняет задания под четными номерами
VI. Домашнее задание.
Стр. 99-101. Найдите информацию о применении алкинов
- Что изучили сегодня на уроке?
- Какие вопросы вызвали затруднения?
- Понравился ли вам урок? Чем?

Совершенствовать умения и навыки в написании формул веществ и уравнений химических реакций.
Оборудование: презентация, компьютер.
Понятия темы: алкины, гибридизация, изомерия, реакции гидрирования, галогенирования, гидрогалогенирования, гидратации, полимеризации.
Тип урока: комбинированный.
Организационный момент:
Знакомство с планом урока (на доске), объявление темы и цели урока (слайды №1,2)
Проверка знаний:
Химическая разминка (слайды №3,4) – фронтальная работа класса
Что такое углеводороды?
Какие углеводороды относятся к непредельным?
Что такое алкины?
Что такое гибридизация? Виды гибридизации?
Каково строение молекулы ацетилена?
Типы химической связи?
Что такое π-связь?
Какие виды изомерии характерны для алкинов?
Индивидуальная работа у доски:
1 учащийся. Назвать вещества по систематической номенклатуре. Какие из данных веществ являются изомерами?
а) CH₃—C ≡ C—CH₂—CH₃; б) СH ≡ C—CH—CH₃;
СН₃ СН₃
в) СН₃— СН—С ≡ С—СН—СН₃ г) СН ≡ С—С—СН₂ — СН₃
СН₃ С₂Н₅ СН₃
2 учащийся. Составить формулы веществ: а) пропин, б) бутин-2, в) 2,2-диметилгексин-3,
Изучение новой темы:
- Получение алкинов (слайды №5,6) – работа учащихся в тетради
1. Метановый способ : 2СН4 → С2Н2 + 3Н2 (при t =1500 0 С)
2. Карбидный способ: СаС2 + 2Н2О → С2Н2 + Са(ОН)2
3.*Из дигалогеналканов спиртовым раствором щелочи СН3—СН—СН—СН3 + 2КОН → СН3—С ≡ С—СН3 + 2КВr + 2Н2О
І І
Br Br
- Физические свойства алкинов (слайд №7) – работа учащихся в тетради
Ацетилен – газ легче воздуха, мало растворим в воде, в чистом виде почти без запаха. Изменения физических свойств углеводородов ряда ацетилена (так же как у алканов и алкенов) подчиняются общим закономерностям: при увеличении относительной молекулярной массы повышается температура кипения веществ.
- Химические свойства алкинов
а) Реакция галогенирования (слайд №8,9 ) – объяснение учителя, работа учащихся в тетради
Происходит в две стадии по месту расположения пи- связи (сначала разрушается одна пи-связь, образуется алкен, затем вторая – образуется алкан).
1. Галогенирование (присоединение галогенов):
1 стадия. СН ≡ СН + Br2 (р-р) → СНВr = СНВr;
1,2-дибромэтен
2 стадия. СНВr = CHBr + Br2 (р-р) → СНВr2— CHBr2
1,1,2,2-тетрабромэтан
Суммарное уравнение: CH ≡CH + 2Br₂→CHBr₂—CHBr₂
Качественная реакция на пи-связь обесцвечивание бромной воды.
б) Реакция гидрирования (слайды №10,11) – учащийся у доски
Гидрирование: Закончить уравнения реакций.
2. Присоединение водорода:
СН ≡ СН + Н2 → Y
1 стадия: СН ≡ СН + Н2 → X;
2 стадия: X + H₂ → Y.
в) Реакция гидрогалогенирования (слайды №12,13) – учащийся у доски
Составить уравнение реакции 1 стадии присоединения хлороводорода.
СН ≡ СН + НСl → X
Ответ для реакции гидрогалогенирования
СН ≡ СН + НСl → СН2= СНСl винилхлорид
Продукт первой стадии винилхлорид используется в промышленности для реакций полимеризации получают полимер-поливинилхлорид (ПВХ) имеет важное промышленное значение.
г) Реакция гидратации (слайд №14) – объяснение учителя
4.Реакция присоединения воды в присутствии солей ртути – реакция Кучерова :
СН ≡ СН + НОН → СН3—С = О ацетальдегид
! Остальные алкины образуют кетоны
д) Реакции окисления (слайд №15) – самостоятельная работа в тетради
1. Горение(закончить уравнение реакции):
С2Н2 + О2 → ?
Ацетилен горит коптящим пламенем, т.к. соотношение атомов углерода и водорода в соединении одинаково.
2.*Обесцвечивание раствора перманганата калия КМnО4 качественная реакция на пи-связь:
СН ≡ СН + КМnО4 → СООН—СООН
е) Реакции полимеризации (слайд №16) – объяснение учителя
СН ≡ СН + СН ≡ СН → СН≡ С—СН=СН2 (CuCl)
СН ≡ СН + СН ≡ СН + СН ≡ СН → С6Н6
( t=600 0 С, катализатор уголь активированный Сакт)
Закрепление:
Разминка (слайд №17);
Неоконченный текст: Вещество с формулой C₂H₂ называется ¹ _ _ _ _ .Он является первым гомологом класса ² _ _ _ _ _. По агрегатному состоянию это ³ _ _ _ _ _ . С галогенами, водородом, галогеноводородами и водой он вступает в реакции ⁴ _ _ _ _ _ , так как в его молекуле присутствует ⁵ _ _ _ _ _ связь. При взаимодействии с водой в присутствии солей ртути он образует ⁶ _ _ _ _ _. При реакции ⁷ _ _ _ _ из него получается бензол.
ацетилен тримеризации ацетальдегид
присоединения тройная алкинов газ
Письменная работа в тетради (слайд №18);
Закончить уравнения реакций:
1.C₂H₂+Cl₂→
2. C₃H₄+O₂→
3. CH ≡ C—CH₃+HBr→
4. CH ≡ C—CH₃ + H₂→
С какими из перечисленных веществ будет реагировать ацетилен: бром, метан, водород, хлороводород? Напишите уравнения возможных реакций, укажите условия их протекания.
Д/з (слайд №19)
1. Выучить конспект по теме: Алкины
2. Решить задачу: «Найти молекулярную формулу углеводорода, массовая доля углерода в котором составляет 85,7%, относительная плотность паров этого вещества 2 по оксиду углерода (IV) равна 1,593.
Осуществить превращения: O

CaCO₃→CaC₂→CH ≡ CH→ CH₃—C
Читайте также:

