Конспект урока окислительно восстановительные реакции в органической химии
Обновлено: 07.07.2024
Пособие предназначено для учеников выпускных классов для подготовки и успешной сдачи ЕГЭ, а также для учителей общеобразовательных учреждений, начинающих свою педагогическую деятельность. В данном методическом пособии включены примеры окислительно-восстановительных реакций, которые больше всего вызывают затруднения при их составлении.
Составление окислительно – восстановительных реакций в органических реакциях………………………………………………………………………. 4
Список использованной литературы…………………………………………14
Среди разнообразных процессов и явлений, протекающих в окружающем нас мире, важное место занимают окислительно-восстановительные реакции. Без изучения ОВР невозможно понять современную неорганическую и органическую химию.
Целью методического пособия является оказание помощи в изучении окислительно - восстановительных реакций. В данное пособие вошло много разобранных примеров и задач, которые помогут глубже понять изучаемый материал. Для более глубокого изучения материала необходимо использовать учебную литературу, список которой приводится в конце пособия.
Составление окислительно – восстановительных реакций в органических реакциях.
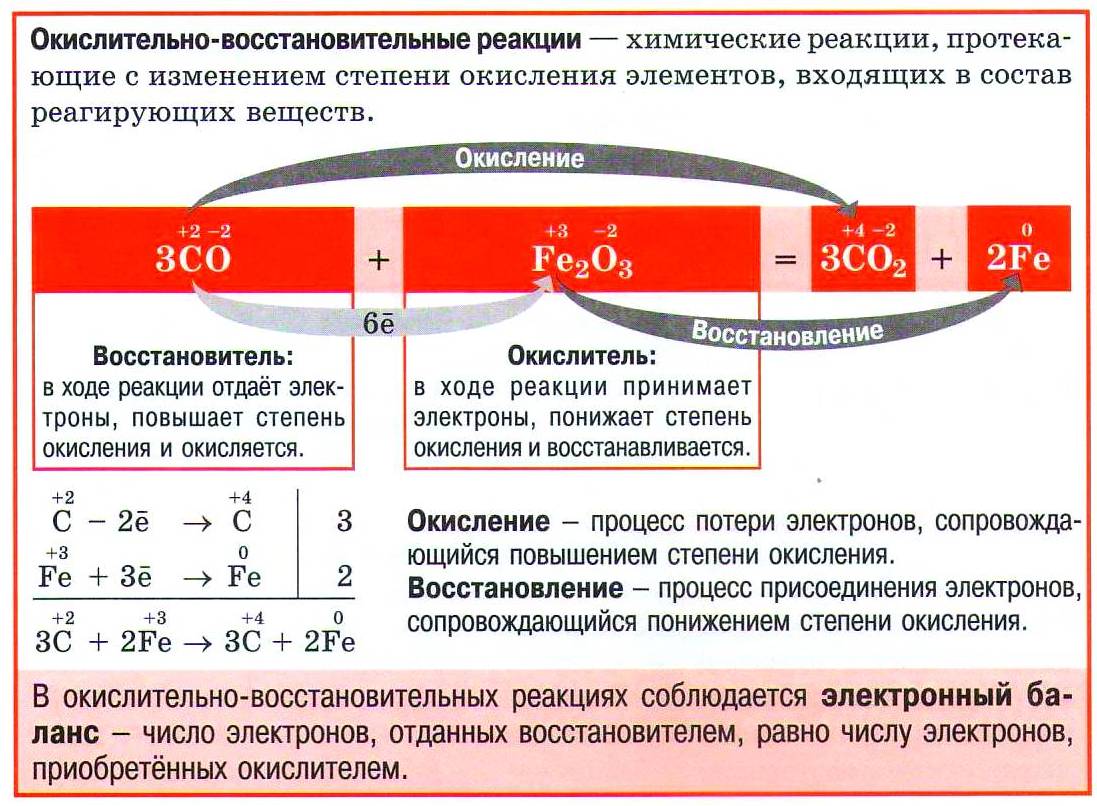
Окислительно - восстановительные реакции (ОВР) - реакции, протекающие с изменением степени окисления одного или нескольких элементов.
Окислительно-восстановительные реакции играют важную роль в природе и технике. Фотосинтез, дыхание, брожение, накопление энергии в клетках сопровождаются переносом электронов. Разделяя процессы окисления и восстановления, удается превращать энергию химических реакций в электрическую.
К числу ОВР принадлежат все реакции между простыми и сложными веществами, между двумя простыми веществами, а также некоторые случаи взаимодействия сложных веществ.
При определении степени окисления атомов углерода в органических соединениях следует помнить
1. У каждого атома углерода степень окисления определяется отдельно.
2. При этом не учитываются углерод - углеродные связи, а алгебраическая сумма степеней окисления атомов, связанных с каждым атомом углерода равна нулю. Поэтому, зная степени окисления других элементов, легко определить степень окисления атомов углерода.
3. Атомы водорода в органических соединениях проявляют степень окисления +1, атомы кислорода -2, атомы галогенов -1, атомы азота или -3 (если это производные аммиака) или +5 (если производные азотной кислоты).
Пример расстановки степеней окисления в органических соединениях:
Основные окислители, которые чаще всего в используют в школьном курсе: KMnO 4 , K 2 Cr 2 O 7 , озон, галогены и др.
Необходимо помнить, что ион MnO 4 - , имеющий фиолетово-малиновую окраску в кислой среде переходит в бесцветный ион Mn +2 .
MnO 4 - + 8H++5 → Mn +2 +4H 2 O.
в нейтральной и слабощелочной среде в МnO 2 , образуя бурый осадок
MnO 4 - +2H 2 O+3 → MnO 2 +4OH - .
а в сильнощелочной среде в Mn . При этом фиолетово-малиновая окраска переходит в зеленую:MnO 4 - + 1 → MnO 4 2- .
Ион Cr 2 O 7 2- оранжевого цвета в кислой среде переходит в ион зеленого цвета 7.
Оксид хрома CrO 3 оказывает такое же действие CrO 3 +6H + +3 → Cr 3+ +3H 2 O.
Очень легко окисляются алкены. Образование продуктов, которые получаются при этом, зависит от строения алкенов и от условия проведения реакций.
При окислении алкенов разбавленным водным раствором при обычной температуре они превращаются в двухатомные спирты.
Расстановка коэффициентов в органических реакциях.
Пример 1. Окисление этилена перманганатом калия в нейтральной среде
3C -2 H 2 = C -2 H 2 + 2K O 4 + 4H 2 O → 3C -1 H 2 - C -1 H 2 + 2 O 2 + 2KOH
2C -2 - 2 → 2C -1 | 3
Пример 2. Оксиление пропена перманганатом калия в нейтральной среде
C -1 – 1 →
C -2 – 1 → |3
При нагревании симметричного алкена перманганатом калия двойная связь разрывается.
2 C -2 - 12 → 2 C +4 |1
Аналогичная картина наблюдается, если два атома углерода, связанные двойной связью, входят в состав других классов органических соединений.
Пример 4. Окисление непредельных дикарбоновых кислот
2 C -1 -2 →2 C 0 |3
Пример 5. Окисление стирола (винилбензола)
Если в качестве окислителя используют кислый раствор KMnO 4 или хромовую смесь происходит расщепление молекулы алкена по месту двойной связи. В качестве продуктов реакции могут получиться две кислоты.
Пример 6.Окисление симметричного алкена перманганатом калия в кислой среде
2 C -1 -8 →2 C +3 |5
Окисление несимметричного алкена перманганатом калия в кислой среде, образуются органическая кислота и CO 2 .
3C 6 H 5 -C -1 H= H 2 +5 O 7 +2OH 2 SO 4 →3C +4 O 2 +3 -C +3 OOH +5 O 4 + +23H 2 O
2Cr +6 +6 →2Cr +3 5
При окислении этилена перманганатом калия в кислой среде образуется только CO 2 .
2 C -2 -12 →2 C +4 |5
Если алкен имеет разветвленное строение, то продуктами реакции могут быть кислота и кетон, кетон и СО 2 .
В щелочной среде образуются двухатомные спирты. Эта реакция является качественной, так как при этом фиолетово-розовая окраска переходит в зеленую.
При окислении этилена кислородом воздуха в присутствии металлического серебра образуется оксид этилена (350 0 С).
2CH 2 =CH 2 +O 2 2CH 2 -CH 2
Алкины легко окисляются с частичным или полным разрывом молекулы, по тройной связи.
При действии KMnO 4 на ацетилен нейтральной среде получается оксалат калия.
2 C -1 -8 →2 C +3 |3
Бензол не окисляется раствором KMnO 4 . Толуол и другие гомологи бензола легко окисляются до бензойной кислоты. При этом толуол окисляется в кислой среде до бензойной кислоты.
Если радикал содержит два и более атомов угле рола, то получается бензойная кислота и выделяется СО 2 , иногда бензойная кислота, соответствующая карбоновая кислота, и CO 2 .
5C 6 H 5 -C +3 OOH+5C +4 O 2 +6K 2 SO 4 +12Mn +2 SO 4 +28H 2 O
5C 6 H 5 -C -1 H-C -2 H 2 -C -3 H 3 +16KMnO 4 +24H 2 SO 4 →5C +4 O 2 +5C 6 H 5 -C +3 OOH + |
+5CH 3 --C +3 OOH+16Mn +2 SO 4 +8K 2 SO 4 +34H 2 0
Если в состав молекул гомологов бензола в радикале два и более атома углерода, то выделяющийся углекислый газ с образующейся щелочью может образовывать карбонаты и гидрокарбонаты.
При окислении толуола MnO 2 образуется бензальдегид.
C 6 H 5 -C -3 H 3 +2Mn +4 O 2 +2H 2 SO 4 →C 6 H 5 -C +1 OOH+2Mn +2 SO 4 +3H 2 O
При окислении спиртов образуются различные продукты. Первичные спирты чаще всего переходят в альдегиды
3CH 3 -C -1 H 2 -OH+2Cr +6 O 3 +3H 2 SO 4 →3CH 3 -C +1 HO+Cr +3 2 (SO 3 ) 3 +6H 2 O
3C 6 H 5 -C -1 H 2 -OH+2K 2 Cr +6 2 O 7 +8H 2 SO 4 →3C 6 H 5 -C +3 =O+2Cr +3 2 (SO 4 ) 3 +2K 2 SO 4 +11H 2 O
2Cr +6 +6 →2Cr +3 |2
При окислении метанола выделяется СО 2 .
В нейтральной среде образующаяся кислота дает соль при взаимодействии со щелочью.
Вторичные спирты при окислении переходят в кетоны.
У третичных спиртов под действием энергичных окислителей или при высокой температуре происходит разрушение молекулы с образованием смеси кислот.
Для окисления спиртов можно использовать и галогены, при этом на первом этапе образуется альдегид, а затем кислота.
CH 3 - C -1 H 2 - OH + Cl 0 2→ CH 3 - C +1 H 2 - OCl -1 + HCl -1
CH 3 -CH-O-Cl→CH 3 -C +1 =O+HCl -1
При окислении альдегидов образуются соответствующие карбоновые кислоты.
CH 3 -C +1 =O+2[Ag +1 (NH 3 ) 2 ]OH→CH 3 -C +3 OONH 4 +2Ag 0 ↓ +3NH 3 ↑ +H 2 O
Исключением является метаналь, так как муравьиная кислота в дальнейшем окисляется до углекислого газа, который может образовывать карбонаты и гидрокарбонаты.
При окислении соединений с двойственными функциями протекают более сложные процессы.
При окислении кетонов происходит разрыв углеродный цепи с образованием смеси различных кислот.
При окислении муравьиной кислоты KMnO 4 в нейтральной среде образуются карбонаты или гидрокарбонаты.
Таким образом, в данном методическом пособии представлены примеры основных типов окислительно-восстановительных реакций, изучаемых в школьном курсе органической химии. Подробно рассмотрен вопрос расстановки коэффициентов в уравнениях органических окислительно-восстановительных реакций методом электронного баланса. Кроме того, существуют другие методы расстановки коэффициентов, такие как метод электронно-ионного баланса, метод протонно-кислородного баланса, метод макроподстановки и др.
Список использованной литературы
Кузьменко Н.Е, Еремин В.В. 2500 задач по химии. – М: Экзамен, 2005.
Кузьменко Н.Е, Еремин В.В., Попков В.А. Начала химии. – М: Экзамен, 2007
Еремин В.В., Кузьменко Н.Е. Сборник задач и упражнений по химии: школьный курс. – М: Экзамен, 2005
Энциклопедия для детей, т.17. Химия. – М: Аванта+, 2011
Химия: формулы успеха на вступительных экзаменах. – М: Изд-во Моск. ун-та, 2006
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Формирование умения составлять уравнения окислительно-восстановительных процессов, идущих в стандартных условиях.
Сформировать систему понятий, которые будут усваиваться в процессе изучения данной темы.
На основании строения атома научить определять возможные степени окисления каждого элемента, т.е. все многообразие возможных состояний атомов.
Создать положительную мотивацию к изучению данного материала.
Использовать проблемные ситуации, решение, которых возможно с помощью действий, формирование которых намечено на данных занятиях.
Закрепить химические знания об окислительно-восстановительных реакциях.
Систематизировать сведения об окислителях.
Становить связь между строением органических веществ и их степени окисления.
Находить зависимость окислительно-восстановительной способности органического вещества от его строения.
Формировать умения устанавливать связь между классом органических веществ и окислением нужной силы, агрегатного состояния и механизма действия.
Формировать знания предсказывать условия проведения реакции и ожидаемые продукты окисления.
Задачи: обеспечить усвоение знаний в области ОВР; научить прогнозировать состав продуктов ОВР;
расширить умения решать задачи повышенной сложности
Тип урока: урок совершенствования знаний, умений и навыков
Вид урока: лекция (2 часа)
Методы приемов обучения: монологическое изложение материала (1 час), закрепление (2 час)
Среди разнообразных химических процессов, протекающих в окружающем мире, важное место занимают окислительно-восстановительные реакции. Процессы горения обеспечивают человечество энергией. Технологические процессы - органические и неорганические синтезы, получение металлов, электролиз- также связаны с ОВР. И в биологических процессах таких, как дыхание и фотосинтез, окислительно-восстановительные реакции играют существенную роль. Поэтому, прежде всего, необходимо научить учащихся выделять из всего многообразия химических реакций, протекающих в окружающем мире, окислительно-восстановительные процессы.
Степень окисления -формальный заряд, который можно прописать атому, считая, что он отдал или принял некоторое количество электронов.
Элемент в определенной степени окисления Э + n , Э - n . Для определения потенциальных степеней окисления атома сначала необходимо построить модель строения атома в виде электронных ячеек. Т.к. атомы отдают только валентные электроны, то следующий шаг - выделение в структуре атома валентных электронов. Затем определить число валентных электронов и положение в периодической системе - группу и подгруппу.
Из электронной структуры следует:
-атом элемента главной подгруппы IV группы отдает и принимает электроны. Максимально может быть отдано 4 электрона. Однако в атоме имеются 2 спаренных s - и 2 не спаренных p -электрона, а затем еще и 2 s - электрона. Максимально можно определить 4 электрона.
-углерод имеет степени окисления :-4,-2,-3,0,+1,+2,+3,+4.
Окислительно-восстановительная реакция- это процесс, в котором одновременно происходит и окисление и восстановление атомов элементов в различных степенях окисления или окислительно-восстановительные реакции- это химические реакции, в которых происходит перенос электронов от одних частиц (атомы, радикалы, ионы, молекулы) к другим частицам.
В ходе химической реакции идет перенос электронов, следовательно, возникает электрический ток, который характеризуется силой и разностью потенциалов. Раз есть переход электронов от атомов одного элемента к атомам другого, следовательно, изменяются степени окисления элементов.
В качестве упражнений для распознавания окислительно-восстановительного процесса можно задать упражнения:
При фотосинтезе электроны перемещаются от одного вещества к другому. Является ли данный процесс окислительно-восстановительным?
В различных бытовых приборах используют аккумуляторы. К какому типу процессов относятся реакции, протекающие в аккумуляторах?
Подавляющее большинство животных используют кислород воздуха для окисления органических веществ. Что можно сказать об изменении степеней окисления атомов кислорода в этих процессах?
При сжигании ископаемого топлива в атмосферу выбрасывается огромное количество углекислого газа, оксидов серы и оксидов азота. Эти вещества растворяются в атмосферных осадках и в виде кислотных дождей выпадают на землю. Какие из описанных процессов являются окислительно-восстановительными, а какие нет?
Расскажите, какие процессы, протекающие в окружающем мире, являются окислительно-восстановительными?
Можно ли отнести дыхание животных к окислительно-восстановительному процессу?
Электроны не могут исчезать в никуда и появляться ниоткуда, т.е. число электронов, принятых в процессе восстановления, должно быть равно числу электронов, отданных, в процессе окисления. Такое равновесие называется электронным балансом. Процедура уравнения числа отданных и принятых электронов называется составление электронного баланса.
Для составления электронного баланса находят наименьшее общее кратное и коэффициент, для каждой полуреакции, представляющий собой наименьшее общее кратное на число электронов, перемещенных в данной полуреакции.
Число атомов, вступивших в реакцию, должно быть равно числу атомов, получившихся в результате реакции. Такое равновесие называется материальным балансом.
Определение степени окисления атомов в органических веществах.
Определим степени окисления атомов углерода в молекулах пропана и этанола:
При определении степени окисления по электронной формуле допускаются полное смещение обобщенных электронов полярных связей к более электроотрицательному атому и делят поровну обобщенные электроны неполярных связей между атомами углерода. После этого сравнивают по числу электронов во внешнем слое каждый атом в соединении и нейтральный атом искомого элемента. Если число электронов в атоме элемента в соединении больше, чем в нейтральном, его степень окисления отрицательная, а его значение равно разности между числом электронов в данных атомах. В противном случае степень окисления положительная.
Составление уравнений окислительно-восстановительного реакций затрудняется содержанием нескольких атомов углерода в молекуле.

Генетическая связь между классами органических соединений представляется как ряд окислительно-восстановительных реакций, обеспечивающих переход от одного класса органических соединений к другому. Завершают его продукты полного окисления (горения) любого из представителей класса органических соединений.
При переходе от одного класса органических соединений к другому и увеличении степени разветвленного углеродного скелета молекул соединений внутри отдельного класса степень окисления атома углерода, ответственного за восстанавливающую способность соединения, изменяется. Органические вещества, в молекулах которых содержатся атомы углерода с максимальными положительными и отрицательными значениями степени окисления (-4,-3,+2,+3), вступают в реакцию полного окисления-горения, но устойчивы к действиям мягких окислителей и окислителей средней силы. Вещества, в молекулах которых содержатся атомы углерода в степени окисления -1,0,+1 окисляются легко, восстановительные способности их близки, поэтому их неполное описание может быть достигнуто за счет одного из известных окислителей малой и средней силы. Эти вещества могут проявлять двойственную природу, выступая и в качестве окислителя.
Окислители органических соединений.
К окислителям органических соединений относятся в первую очередь вещества неорганической природы:
По агрегатному состоянию:
II . Окислители органической природы ( Pb (С H 3 COO ) 4, HCOOH (надмуравьиная кислота), CH 3 COOH (надуксусная кислота), ( CH 3 ) 2 SO .
III .-Мягкие окислители применяют для окисления органических соединении, содержащих кратные связи С=С, С=О, где степень окисления активного углерода от -1 до +1 и +1 до +3 (окисление алкенов, алкинов, альдегидов).
-Окислители средней силы работают, окисляя вторичные спирты до кетонов (степень окисления изменяется от 0 до +2), альдегиды – до карбоновых кислот (-1 до +3), алкены – до кетонов и карбоновых кислот (-1 до +2,+3).
-Жесткие окислители разрушают органические вещества со степенью окисления +4 до -2 до продуктов со степенями окисления +3,+4 и до простого вещества углерода. В этом случае процесс называется осмолением.
-Жидкие окислители чаще используют для окисления жидких органических веществ и применяют в лаборатории.
Классификация реакций окисления.
Горение C n H 2 n +2 + O 2 при температуре равной 300-350 0 С протекает при высокой скорости. При нагревании происходит разрыв связей С-Н, С-С, О=О (Н.Н. Семенов).
Жидкофазное окисление C n H 2 n +2 C n H 2 n +1 ОН, которые под действием серной кислоты превращаются в алкилсульфаты – синтетические моющие средства (температура 200 0 C в присутствии марганцевых катализаторов (способ А.Н. Башкирова)), при этом углеродная цепь становится у спирта меньше.
Твердофазное окисление (окислительная деструкция) наблюдается при старении полиолефинов под действием атмосферного кислорода.
Все три процесса – радикально-цепные, автокаталитические.
Механизм реакции окисления органических соединений.
Радикальное расщепление при температуре 300-350 0 С реализуется при разрыве связей С-Н, С-С. Инициирование может быть осуществлено нагреванием (горением), действием пероксида водорода, окислительных реагентов (раствор перманганата калия), лучи:
ROO +RH ROOH + R
RH + ROOH R + RO + H 2 O (разветвленный автокаталитический)
Пероксидный радикал- ключевой при окислении C n H 2 n +2 кислородом. В результате образуются продукты окисления: спирты, простые эфиры, сложные эфиры, угарный или углекислый газы, вода:
Степень окисления углерода изменяется от -4,-3 до +1,+4.
Каталитическое и хемоселективное окисление органических соединений.
Каталитическое окисление или окисление в присутствии катализаторов лишь увеличивают скорость прохождения процесса окисления, снижая энергию разрыва связей С-С, Н-Н, способствуют максимальному выходу необходимого продукта окисления (1).

Под хемоселективным окислением понимают способность ряда окислителей избирательно воздействовать на определенные функциональные группы, при этом, не затрагивая другие имеющиеся в молекуле соединения, способные к окислительно-восстановительному процессу. Для окисления альдегидов применяют азотную кислоту (25 % окисляет альдегидные и первичные спиртовые группы (2)).

Особенности природы ми строения органических соединений обуславливают специфичность протекания ряда реакций с их участием (3).

Все химические реакции сопровождаются перестройкой электронных оболочек атомов реагирующих веществ.
Реакции разложения сложных неорганических соединений на менее сложные относятся электроностатическим (4).

На характер получающихся в окислительно-восстановительной реакции веществ оказывает влияние среда. При окислении алкенов перманганатом калия в нейтральной среде, в результате разрыва пи-связи и присоединения гидроксильных групп образуются двухатомные спирты (5).

Под действием перманганата калия и серной кислоты при нагревании происходит разрыв пи- и сигма-связи и образуются карбонильные соединения.

Оба атома углерода в исходном алкане выполняют роль восстановителей и в ходе реакции окисляются. Необходимо установить, на сколько единиц изменяются степени окисления атомов углерода и марганца.

Обучающая: закрепить умение определять степени окисления элементов, окислитель и восстановитель, расставлять коэффициенты методом электронного баланса. Совершенствовать умение определять окислительно-восстановительные свойства веществ, прогнозировать продукты реакций в зависимости от активности металлов, концентрации кислот и реакции среды раствора. Выработать умение составлять уравнения химических реакций, протекающих в различных средах на примере соединений марганца. Показать разнообразие и значение ОВР в природе и повседневной жизни.
Развивающая: развивать умения делать выводы на основе проведенных экспериментов
Воспитательная: воспитывать интерес к предмету, умение целенаправленно работать на уроке.
Тип урока лекция
Средства обучения: рассказ, беседа, сравнение, химический эксперимент, самостоятельная работа.
Межпредметные связи: ОДБ. 07, ОДБ.09, ОДП.03.
Самостоятельная работа:
Учебная литература: Химия. 10 класс: Учебник для общеобразовательных учреждений / О.С. Габриелян, Ф.Н. Маскаев, С.Ю. Пономарев, В.И. Теренин; под ред. В. И. Теренина – М.: Дрофа, 2002. – 304 с.
Ход урока:
1.Организационная часть: приветствие учащихся, подготовка к уроку, психологический настрой.
Добрый день! Хорошего вам настроения!
Тема нашего урока: «Окислительно – восстановительные реакции
Окислительно-восстановительные реакции принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Важнейшие процессы на планете связаны с этим типом химических реакций. Человечество давно пользовалось ОВР, вначале не понимая их сущности. Лишь к началу XX века была создана электронная теория окислительно-восстановительных процессов. На уроке предстоит вспомнить основные положения этой теории, метод электронного баланса, научиться составлять уравнения химических реакций, протекающих в растворах, и выяснить от чего зависит механизм таких реакций.
2. Опрос учащихся по домашнему заданию:
3. Изложение нового материала:
Для вас тема ОВР не нова, она проходит красной нитью через весь курс химии. Поэтому предлагаю повторить некоторые понятия и умения по данной теме.
/Степень окисления – это условный заряд атома химического элемента в соединении, вычисленный на основе предположения, что все соединения состоят только из ионов. Степень окисления может быть положительной, отрицательной или равняться нулю, что зависит от природы соответствующих соединений./
Одни элементы имеют постоянные степени окисления, другие — переменные.
Например, к элементам с постоянной положительной степенью окисления относят щелочные металлы: Li +1 , Na +1 , K +1 , Rb +1 , Cs +1 , Fr +1 , следующие элементы II группы периодической системы: Ве +2 , Mg +2 , Ca +2 , Sr +2 , Ва +2 , Ra +2 , Zn +2 , а также элемент III А группы - А1 +3 и некоторые другие. Металлы в соединениях всегда имеют положительную степень окисления.
Из неметаллов постоянную отрицательную степень окисления (-1) имеет F.
В простых веществах, образованных атомами металлов или неметаллов, степени окисления элементов равны нулю, например: Na°, Al°, Fe°, Н2 0 , О2 0 , F2 0 , Cl2 0 , Br2 0 .
Для водорода характерны степени окисления: +1 (Н20), -1 (NaH).
Для кислорода характерны степени окисления: -2 (Н20), -1 (Н2О2), +2 (OF2).
Следует помнить, что в целом молекула электронейтральна, поэтому в любой молекуле алгебраическая сумма степеней окисления равна нулю, а в сложном ионе – заряду иона.
Например, рассчитаем степень окисления хрома в дихромате калия K2Cr2O7.
Степень окисления калия +1, кислорода -2.
Подсчитаем число отрицательных зарядов: 7 • (-2) = -14
Число положительных зарядов должно быть + 14. На калий приходится два положительных заряда, следовательно, на хром – 12.
Так как в формуле два атома хрома, 12 делим на два: 12 : 2 = 6.
+ 6 – это степень окисления хрома.
Проверка: алгебраическая сумма положительных и отрицательных степеней окисления элементов равна нулю, молекула электронейтральна.
Самостоятельная работа № 1 по инструктивной карте: пользуясь приведенными сведениями, рассчитайте степени окисления элементов в соединениях: MnO2, H2SO4, K2SO3, H2S, KMnO4.
/Окислительно-восстановительные реакции – это такие реакции, в которых одновременно протекают процессы окисления и восстановления и, как правило, изменяются степени окисления элементов./
Рассмотрим процесс на примере взаимодействия цинка с разбавленной серной кислотой:
При составлении этого уравнения используется метод электронного баланса. Метод основан на сравнении степеней окисления атомов в исходных веществах и продуктах реакции. Основное требование при составлении уравнений этим методом: число отданных электронов должно быть равно числу принятых электронов.
Окислительно-восстановительные реакции – это такие реакции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим.
Окисление – это процесс отдачи электронов, степень окисления при этом повышается.
Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.
Атомы, молекулы или ионы, отдающие электроны, окисляются; являются восстановителями.
Атомы, ионы или молекулы, принимающие электроны, восстанавливаются; являются окислителями.
Окисление всегда сопровождается восстановлением, восстановление связано с окислением.
Окислительно-восстановительные реакции – единство двух противоположных процессов: окисления и восстановления.
Самостоятельная работа № 2 по инструктивной карте: методом электронного баланса найдите и поставьте коэффициенты в следующей схеме окислительно –восстановительной реакции:
Однако научиться находить коэффициенты в ОВР еще не значит уметь их составлять. Нужно знать поведение веществ в ОВР, предусматривать ход реакций, определять состав образующихся продуктов в зависимости от условий реакции.
Для того чтобы разобраться, в каких случаях элементы ведут себя как окислители, а в каких – как восстановители, нужно обратиться к периодической системе Д.И.Менделеева. Если речь идет о простых веществах, то восстановительные свойства должны быть присущи тем элементам, которые имеют больший по сравнению с остальными атомный радиус и небольшое (1-3) число электронов на внешнем энергетическом уровне. Поэтому они могут сравнительно легко их отдавать. Это в основном металлы. Наиболее сильными восстановительными свойствами из них обладают щелочные и щелочноземельные металлы, расположенные в главных подгруппах I и II групп (например, натрий, калий, кальций и др.).
Наиболее типичные неметаллы, имеющие близкую к завершению структуру внешнего электронного слоя и значительно меньший по сравнению с металлами того же периода атомный радиус, довольно легко принимают электроны и ведут себя в окислительно-восстановительных реакциях как окислители. Наиболее сильными окислителями являются легкие элементы главных подгрупп VI – VII групп, например фтор, хлор, бром, кислород, сера и др.
Вместе с тем надо помнить, что деление простых веществ на окислители и восстановители так же относительно, как и деление на металлы и неметаллы. Если неметаллы попадают в среду, где присутствует более сильный окислитель, то они могут проявлять восстановительные свойства. Элементы в разных степенях окисления могут вести себя по-разному.
Если элемент имеет свою высшую степень окисления, то он может быть только окислителем. Например, в HN +5 O3 азот в состоянии + 5 может быть только окислителем и принимать электроны.
Только восстановителем может быть элемент, находящийся в низшей степени окисления. Например, в N -3 Н3 азот в состоянии -3 может отдавать электроны, т.е. является восстановителем.
Элементы в промежуточных положительных степенях окисления могут, как отдавать, так и принимать электроны и, следовательно, способны вести себя как окислители или восстановители в зависимости от условий. Например, N +3 , S +4 . Попадая в среду с сильным окислителем, ведут себя как восстановители. И, наоборот, в восстановительной среде они ведут себя как окислители.
По окислительно-восстановительным свойствам вещества можно разделить на три группы:
Самостоятельная работа №3 по инструктивной карте: в какой из приведенных схем уравнений реакций MnO2 проявляет свойства окислителя, а в какой – свойства восстановителя:
MnO2 + 4HCI = MnCI2 + CI2 + 2H2O (MnO2 – окислитель)
3. Углубление и расширение знаний
Важнейшие окислители и продукты их восстановления
1. Серная кислота - Н2SO4 является окислителем
А) Уравнение взаимодействия цинка с разбавленной Н2SO4
Какой ион является окислителем в данной реакции? (H + )
Продуктом восстановления металлом, стоящим в ряду напряжения до водорода, является H2.
Б) Рассмотрим другую реакцию – взаимодействие цинка с концентрированной Н2SO4
Какие атомы меняют степень окисления? (цинк и сера)
Концентрированная серная кислота (98%) содержит 2% воды, и соль получается в растворе. В реакции участвуют фактически сульфат – ионы. Продуктом восстановления является сероводород.
В зависимости от активности металла продукты восстановления концентрированной Н2SO4 разные: H2S, S, SO2.
Чем выше активность металла, тем дальше (глубже) идет восстановление серы (вплоть до низшей степени окисления - 2)
На схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот
2. Другая кислота – азотная – также окислитель за счет нитрат – иона NO3 - . Окислительная способность нитрат – иона значительно выше иона H + , и ион водорода не восстанавливается до атома, поэтому при взаимодействии азотной кислоты с металлами, никогда не выделяется водород, а образуются различные соединения азота. Это зависит от концентрации кислоты и активности металла. Разбавленная азотная кислота восстанавливается глубже, чем концентрированная (для одного и того же металла)
На схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот
Au + 3HCI (конц.) + HNO3 (конц.) = AuCI3 + NO + 2H2O
3. Наиболее сильным окислителем из числа простых веществ является фтор. Но он слишком активен, и его трудно получить в свободном виде. Поэтому в лабораториях в качестве окислителя используют перманганат калия KMnO4. Его окислительная способность зависит от концентрации раствора, температуры и среды.
Реакции окисления – восстановления могут протекать в различных средах. В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами: среда влияет на изменение степеней окисления атомов.
Обычно для создания кислотной среды добавляют серную кислоту. Соляную и азотную применяют реже, т.к. первая способна окисляться, а вторая сама является сильным окислителем и может вызвать побочные процессы. Для создания щелочной среды применяют гидроксид калия или натрия, нейтральной – воду.
Лабораторный опыт: (правила ТБ)
В четыре пронумерованные пробирки налито по 1-2 мл разбавленного раствора перманганата калия. В первую пробирку добавьте несколько капель раствора серной кислоты, во вторую – воду, в третью – гидроксид калия, четвертую пробирку оставьте в качестве контрольной. Затем в первые три пробирки прилейте, осторожно взбалтывая, раствор сульфита натрия. Отметьте. Как изменяется окраска раствора в каждой пробирке.
Результаты лабораторного опыта:
Продукты восстановления KMnO4 (MnO4 - ):
в кислой среде – Mn +2 (соль), бесцветный раствор;
в нейтральной среде – MnO2, бурый осадок;
в щелочной среде - MnO4 2- , раствор зеленого цвета.
К схемам реакций:
Подберите коэффициенты методом электронного баланса. Укажите окислитель и восстановитель
(Задание разноуровневое: сильные учащиеся записывают продукты реакции самостоятельно)
Вы проделали лабораторный опыт, предложите вещество, с помощью которого можно очистить халат.
Демонстрационный опыт:
Пятна от раствора перманганата калия быстро выводятся раствором пероксида водорода, подкисленным уксусной кислотой:
Старые пятна перманганата калия содержат оксид марганца (IV), поэтому будет протекать еще одна реакция:
После выведения пятен кусок ткани необходимо промыть водой.
Значение окислительно-восстановительных реакций
В рамках одного урока невозможно рассмотреть все многообразие окислительно-восстановительных реакций. Но их значение в химии, технологии, повседневной жизни человека трудно переоценить.
Ученик: Окислительно-восстановительные реакции лежат в основе получения металлов и сплавов, водорода и галогенов, щелочей и лекарственных препаратов.
С окислительно-восстановительными реакциями связано функционирование биологических мембран, многие природные процессы: обмен веществ, брожение, дыхание, фотосинтез. Без понимания сущности и механизмов протекания окислительно-восстановительных реакций невозможно представить работу химических источников тока (аккумуляторов и батареек), получение защитных покрытий, виртуозную обработку металлических поверхностей изделий.
Для целей отбеливания и дезинфекции пользуются окислительными свойствами таких наиболее известных средств, как пероксид водорода, перманганат калия, хлор и хлорная, или белильная, известь.
Хлор как сильный окислитель используют для стерилизации чистой воды и обеззараживания сточных вод.
4. Подведение итогов по уроку, комментирование выставленных оценок.
Тест:
В кислой среде KMnO4 восстанавливается до:
Концентрированная H2SO4 при обычной температуре пассивирует:
Ключевые слова конспекта по химии для 11 класса: Окислительно-восстановительные реакции. Степень окисления. Окисление и восстановление. Окислитель и восстановитель. Метод электронного баланса.
Химия даёт множество примеров, иллюстрирующих один из основных философских законов — единства и борьбы противоположностей.
Единую структуру атома отражают его положительное ядро и отрицательно заряженные электроны оболочки. Природа амфотерных соединений заключается в единстве их кислотных и основных свойств. Обратимый гидролиз солей — это результат противоположных процессов: взаимодействия кислот и оснований с образованием соли и воды и разложение продуктов этого взаимодействия водой. Это утверждение справедливо для всех обратимых реакций: единство прямого и обратного химических процессов. Окислительно-восстановительные реакции — ещё один пример действия этого философского закона.
В пробирку налейте 4—5 мл раствора сульфата меди(II) и опустите в неё стальную канцелярскую скрепку. Оставьте пробирку в штативе на 1—2 мин. При наблюдении легко заметить, что в результате реакции стальная скрепка покрылась красноватым налётом свободной меди:
CuSO4 + Fe = FeSO4 + Сu
Для того чтобы выполнить задание, сформулированное в условии эксперимента, вам необходимо записать степени окисления элементов, образующих реагенты и продукты данной реакции.
Для дальнейшего рассмотрения окислительно-восстановительных реакций необходимо уметь быстро и безошибочно определять степени окисления атомов . Приведём основные правила, которые необходимо знать.
Рассмотрим пример расстановки степеней окисления атомов в перманганате калия КМnO4:

Следовательно,

Вернёмся к выполнению задания, указанного в лабораторном опыте:
Как видите, степени окисления в данной реакции изменили атомы железа и меди. Следовательно, эта реакция является окислительно-восстановительной.

Атомы железа в степени окисления 0 отдали два электрона, превратившись при этом в ион с зарядом +2: — процесс окисления.

Ионы меди в исходном веществе имели степень окисления +2, а в продукте реакции — степень окисления 0, т. е. каждый из них принял по два электрона: — процесс восстановления.


Итак, на схеме показано, что железо в этой реакции окисляется, являясь восстановителем; сульфат меди(II), а точнее, ионы , входящие в его состав, принимают 2 электрона, выступая в роли окислителя, т. е. восстанавливаются.

Окислительно–восстановительные реакции играют важную роль и в органической химии. Рассмотрим, например, реакцию горения метана и повторим, как рассчитываются коэффициенты и составляются уравнения окислительно–восстановительных реакций с использованием метода электронного баланса, т. е. равенства числа отданных и принятых электронов.

Убедиться, что атомы углерода в этой реакции теряют именно 8 электронов, поможет схема, где на числовом луче показаны степени окисления атомов, а также изменение этой величины в процессах окисления и восстановления.
Одно вещество в реакциях может выступать и в роли окислителя, и в роли восстановителя.
Во-первых, в состав вещества могут входить атомы элементов, один из которых проявляет свойства окислителя, а другой — восстановителя. Например, хлороводород (и его водный раствор — соляная кислота) проявляет окислительные свойства при взаимодействии с металлами за счёт катиона водорода и восстановительные благодаря наличию галогена в минимальной степени окисления :


Во-вторых, вещество может содержать атомы элемента в промежуточной степени окисления и выступать в качестве окислителя, принимая чужие электроны, или в качестве восстановителя, отдавая электроны другим атомам. Так, оксид серы(IV) в реакции с кислородом выступает в роли восстановителя, а в реакции с углеродом — окислителя:
Окислительно-восстановительные реакции используются на производстве (все металлургические процессы, синтез аммиака, производство кислот) и играют важную роль в процессах жизнедеятельности (процессы дыхания, горения и фотосинтеза).
В заключение подчеркнём единство окислительно–восстановительных процессов. Ведь если какой-то элемент или вещество окисляется (отдаёт электроны), то другое вещество обязательно восстанавливается (принимает эти электроны) с соблюдением электронного баланса. Эти процессы неразрывно связаны между собой.
Без изменения степеней окисления элементов протекают, например, реакции ионного обмена.

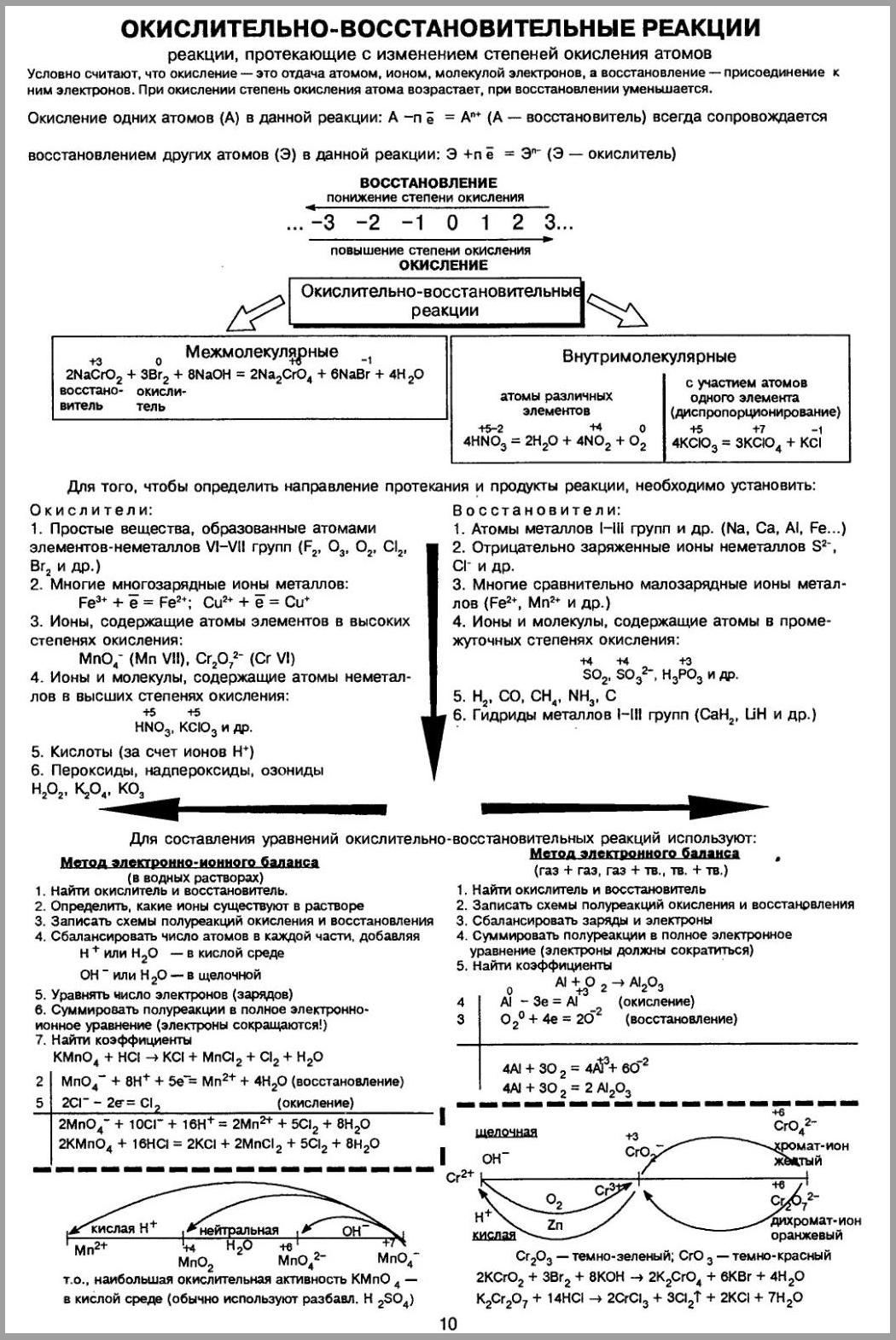
Окислительно-восстановительные реакции.
Шпаргалка по всей теме курса.
Читайте также:

